山药多糖和燕麦多糖发酵产酸及发酵产物对结肠癌细胞的增殖抑制作用
2017-09-03殷丹婷郝丽鑫赵新淮
殷丹婷,郝丽鑫,王 琦,赵新淮
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨 150030)
山药多糖和燕麦多糖发酵产酸及发酵产物对结肠癌细胞的增殖抑制作用
殷丹婷,郝丽鑫,王 琦,赵新淮*
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨 150030)
采用水提取、醇沉淀法制备山药多糖和燕麦多糖,利用健康成人粪便提取物中的肠道微生物体外发酵多糖,确定发酵产酸情况(乙酸,丙酸,丁酸,乳酸)以及发酵产物对结肠癌细胞HCT-116的增殖抑制作用。山药多糖和燕麦多糖的糖含量分别为82.63%和80.32%。发酵24 h,山药多糖和燕麦多糖产生23.28、25.14 mmol/L乙酸、2.49、1.97 mmol/L丙酸、11.04、7.99 mmol/L丁酸和0.19、0.46 mmol/L乳酸;发酵48 h,它们产生四种酸为28.14、42.53,6.48、2.45,13.76、9.64,0.08、0.09 mmol/L。发酵时间从24 h延长至48 h,产物中乙酸、丙酸和丁酸含量显著提高(p<0.05),而乳酸含量明显降低(p<0.05)。两种多糖对细胞的抑制作用小于24.5%,而两种多糖发酵产物有更强的抑制作用,分别达到46.2%~69.1%、44.6%~67.3%;48 h发酵产物抑制作用更强,处理细胞48 h产生的抑制作用更大。结果表明,两种多糖经过肠道微生物发酵后,其产物对结肠癌细胞具有更强的增殖抑制活性。
山药多糖,燕麦多糖,发酵,短链脂肪酸,结肠癌细胞
在植物性食品中,天然植物多糖被认为是一种最重要的成分[1]。植物多糖是相对复杂的碳水化合物,也是最丰富的有机化合物[2]。研究表明,一些非消化性植物多糖具有各种各样的生物活性,例如免疫调节作用[3-5]、抗肿瘤[6-7]、降血糖[8]、降血脂[9]、抗病毒[10]、抗衰老[11]、抗氧化[12]等。这些多糖备受关注,对其提取、纯化以及生物活性的研究颇多,例如山药多糖和燕麦多糖[13-14]。水提取、醇沉淀法是最常见的多糖制备方法[13]。非消化性多糖在体内不吸收,但是可以被肠道微生物发酵[15-16]。抗性淀粉、非淀粉多糖和非消化性低聚糖等被肠道微生物发酵后,产生各种短链脂肪酸主要包括乙酸、丙酸和丁酸等[17]。短链脂肪酸对机体健康有益,因为它们可以降低肠内环境pH,抑制有害菌的生长,防止肠道功能紊乱[18]。此外,短链脂肪酸还有其他方面的健康作用。例如,乙酸和丙酸可以影响血脂和胆固醇的代谢,有降低血脂和胆固醇的作用[19-20]。又如,丁酸可以抑制肿瘤细胞增殖以及促进肿瘤细胞分化和凋亡,具有抗癌作用[21-23]。
山药和燕麦是重要的食材,其组成成分包括多糖。进食山药和燕麦后,山药多糖和燕麦多糖将进入消化道、并被肠道微生物所发酵。但是,山药多糖和燕麦多糖发酵后是否会影响抗结肠癌作用,目前尚缺乏必要的体外、体内评估。因此,本研究采用水提取、醇沉淀法提取山药多糖和燕麦多糖,利用健康成人粪便的微生物菌群体外发酵两种多糖,评估发酵产物的产酸情况以及对结肠癌细胞的抑制作用。本研究以期为开发、剖析食品成分的健康作用提供必要的科学依据。
1 材料与方法
1.1 材料与仪器
新鲜山药 市售河南种植铁棍山药;燕麦粒 市售;α-淀粉酶、碱性蛋白酶 北京奥博星生物技术有限责任公司;正己烷(色谱纯) 天津市科密欧化学试剂有限公司;无水乙醇、无水乙酸钠 天津市天力化学试剂有限公司;丙酸钠 天津市巴斯夫化工有限公司;丁酸钠 上海阿拉丁化学试剂有限公司;McCoy′5A培养基 Sigma公司;胎牛血清 Wisent公司;胰蛋白酶 Amresco公司;CCK-8 日本同仁化学研究所;其他所有试剂均为分析纯。
7890N气相色谱仪 美国Agilent仪器有限公司;UV-2401PC型紫外可见分光光度计 日本岛津公司;HF-90型CO2培养箱 美国力康公司;Model 680型酶标仪 美国BIO-RAD公司;DHP-9082型电热恒温培养箱 上海一恒科学仪器有限公司;C10-2.4A型低速离心机 北京京立离心机厂;DELTA 320型精密pH计、AL204型分析天平 梅特勒-托利多仪器中国有限公司;LGJ-1冷冻干燥机 上海医分仪器制造有限公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 山药多糖及燕麦多糖的提取
1.2.1.1 原料预处理 新鲜山药洗净去皮,切成大小均一的方块,匀浆处理,备用。燕麦粒经过粉碎、过筛(100目),备用。
1.2.1.2 多糖的提取 按照料液比1∶10(w/w)将原料与蒸馏水混合,在适宜温度下浸提3 h(山药:100 ℃,燕麦:60 ℃),冷却到室温,8000 r/min离心5 min,收集上清液;残渣重复浸提2次;合并上清液。上清液用α-淀粉酶在pH7.0、45 ℃下处理4 h,沸水浴灭酶5 min;加入碱性蛋白酶,在pH9.0、55 ℃下再处理4 h,沸水浴灭酶5 min;然后,8000 r/min离心5 min。上清液浓缩4倍后,加入无水乙醇(终浓度为80%)于4 ℃过夜,离心,沉淀用乙醇洗涤后冻干,得到多糖粉末。
1.2.1.3 多糖含量测定 利用苯酚硫酸法[24]测定多糖的含量。标准曲线的绘制:取0.1 mg/mL葡萄糖标准液0、0.20、0.40、0.60、0.80、1.00、1.20、1.40、1.60、1.80 mL于25 mL具塞刻度试管中,加蒸馏水至2.00 mL,分别加5%苯酚溶液1.00 mL,摇匀,迅速加入浓硫酸溶液5 mL,振摇5 min,放置10 min后在沸水浴中加热60 min,冷却后采用分光光度计在波长490 nm下测定吸光值。以葡萄糖浓度为横坐标,吸光值为纵坐标作图。
样品多糖含量的测定:取0.1 mg/mL多糖样品溶液1.00 mL放入具塞试管中,按照上述方法测定吸光值,由标准曲线计算出葡萄糖浓度,乘以0.9即为多糖含量。
1.2.2 多糖的体外发酵
1.2.2.1 粪便提取物的制备 采集5个健康成人(2男3女,年龄为22~24岁)的新鲜粪便,所选对象在近一个月未服用抗生素、未得腹泻和肠炎。采集和处理在1 h内完成。取40 g粪便样品,于200 mL磷酸盐缓冲液(0.1 mol/L,pH6.5)中匀浆2 min,悬浮液用四层纱布粗滤除去颗粒物质,得到粪便提取物。提取物于-20 ℃保存以备用。
1.2.2.2 体外发酵培养基的制备 参考文献方法[25]稍作修改,配制体外发酵培养基。组成成分为:2.0 g NaHCO3,2.0 g蛋白胨,2.0 g酵母浸粉,0.5 g牛胆盐,0.5 gL-半胱氨酸盐酸盐,0.01 g CaCl2,0.1 g NaCl,0.04 g K2HPO4,0.04 g KH2PO4,0.01 g MgSO4·7H2O,2.0 mL吐温-80,蒸馏水定容至1 L。
1.2.2.3 粪便的体外发酵 在具塞试管中分别加入2.5 mL体外发酵培养基、2.5 mL粪便提取物和0.5 mL无菌去离子水,混匀后在37 ℃厌氧条件下分别发酵24 h和48 h。发酵结束后震荡混合,将内容物转移到10 mL离心管中,8000 r/min离心10 min得到上清液。将上清液的pH调节到7.0,并分成两部分以便用于有机酸分析和细胞实验;其中,用于细胞实验的发酵上清液(即发酵产物),使用前需要经过0.22 μm的无菌微孔滤膜进行过滤除菌。发酵产物于-20 ℃保存备用。
1.2.2.4 两种多糖的体外发酵 在具塞试管中分别加入2.5 mL含9 g/L山药多糖(或燕麦多糖)的体外发酵培养基、2.5 mL粪便提取物和0.5 mL无菌去离子水,混匀后在37 ℃厌氧条件下分别发酵24 h和48 h。其他处理同1.2.2.3。发酵产物于-20 ℃保存备用。用于细胞实验的发酵产物也经过0.22 μm的无菌微孔滤膜过滤。
1.2.3 有机酸分析
1.2.3.1 短链脂肪酸的气相色谱(GC)分析 根据参考文献[26]的方法稍作改进。取1.00 mL标准溶液或发酵上清液,加入2.40 mL无水乙醇,混匀后吸取850 μL于安瓿瓶中,加入100 μL浓硫酸和1 mL正己烷,封口后于60 ℃水浴中加热1 h;不断震荡使发酵产物中的短链脂肪酸充分酯化。反应完成后冷却至室温,剧烈震荡5 min,静置分层。上层有机相用于气相色谱(GC)分析乙酸、丙酸和丁酸的含量。
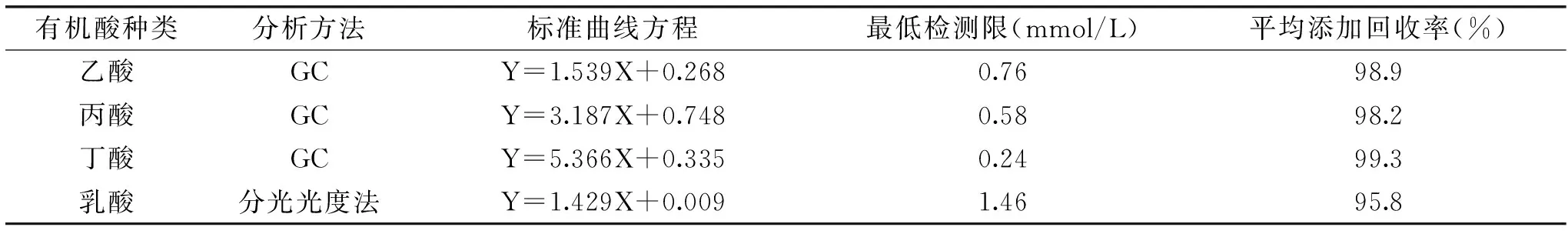
表1 乙酸、丙酸、丁酸和乳酸的标准曲线、最低检测限和平均添加回收率Table 1 Standard curves,detection limits,and average recoveries of f acetate,propionate,butyrate,and lactate
注:X,酸的浓度(mmol/L);Y,峰面积或吸光值。气相色谱条件:色谱柱型号(HP-5毛细管柱,30 m×0.32 mm×0.25 μm);进样口温度,200 ℃;FID检测器温度,220 ℃;载气:氮气,流速1 mL/min,分流比为40∶1;燃气:氢气,流速30 mL/min;助燃气:空气,流速300 mL/min;隔垫扫吹为3 mL/min;进样体积1 μL。柱箱升温程序:初始温度30 ℃,保持3.5 min,以5 ℃/min升温至40 ℃;再以15 ℃/min升温至150 ℃。
1.2.3.2 乳酸分析 根据参考文献[27]的方法稍作改进。取1.00 mL发酵上清液,分别加入0.5 mL 10.6%亚铁氰化钾溶液、0.5 mL 21.9%乙酸锌溶液,补充蒸馏水至5 mL,迅速混匀,静置30 min后8000 r/min离心20 min。所得到的上清液适当稀释。5 mL稀释液加入到预先加有50 mg Ca(OH)2粉末的试管中,混匀,加入0.8 mL 20% CuSO4溶液混匀,沸水浴加热3 min,冷却,8000 r/min离心20 min。吸取0.5 mL上清液于大试管中,置于冰水中,缓慢加入6 mL预冷的浓H2SO4,边加边振荡,混匀后沸水浴加热5 min,冰水浴中冷却,再加入0.125 mL对羟基联苯溶液,充分摇匀,放置30 min,期间每10 min摇一次;沸水浴加热1.5 min,冰水浴中冷却后。在波长565 nm处测定吸光值。
1.2.4 发酵产物对HCT-116细胞的增殖抑制作用评估
1.2.4.1 细胞培养 HCT-116细胞购自中国科学院上海生物化学与细胞生物学研究所细胞库。HCT-116细胞生长于含10%胎牛血清的McCoy′5A培养基中,于CO2培养箱中培养(37 ℃,5% CO2)。胰蛋白酶消化收集细胞,以1∶3~1∶5的比例进行传代培养。
1.2.4.2 CCK-8法测定增殖抑制作用 将HCT-116细胞接种于96孔培养板中,接种密度为8(103个细胞/孔,预培养24 h,使细胞贴壁。吸除培养基,加入含发酵产物的细胞培养基,发酵产物的比例为10%(v/v),细胞处理时间为24 h和48 h。用100 μmol/L的5-氟尿嘧啶(5-FU)处理细胞组,作为阳性对照组。用含磷酸盐缓冲溶液(0.1 mol/L,pH6.5)的细胞培养基(10%,v/v)处理细胞,作为阴性对照组。调零组不含有细胞只含有磷酸盐缓冲溶液(0.1 mol/L,pH6.5)的细胞培养基(10%,v/v)。处理后的细胞,再加入10 μL CCK-8继续培养2 h,并用酶标仪测定各孔吸光值(OD),检测波长为450 nm。每组实验设5个复孔,重复3次。按下式进行计算抑制率(%),并以此表示细胞增殖抑制作用。
1.2.5 数据分析 所有数据均为3次独立重复实验的平均值,结果以平均值±标准偏差表示。采用SPSS软件(16.0)中的单因素方差分析(One-way AVONA)和Duncan多重比较法对数据进行统计分析,当p<0.05时即认为数据间存在显著性差异。
2 结果与分析
2.1 山药多糖及燕麦多糖的糖含量
所得到的葡萄糖标准曲线方程为Y(吸光度)=0.0121X(葡萄糖浓度)+ 0.0106(R2=0.9991)。根据分析结果,所制备的山药多糖中的糖含量为82.63%,而燕麦多糖中的糖含量则为80.32%。
2.2 发酵产物中有机酸的分析
采用1.2.3.1中所述的气相色谱条件,分析各个发酵产物中乙酸、丙酸和丁酸的含量。从所得到气相色谱图(图1A~图1C)中可以看出,这3种短链脂肪酸均能被色谱柱有效分离,保留时间约为4~9 min。

图1 GC法分析标准溶液(A)和山药多糖(B)和燕麦多糖(C)Fig.1 GC profiles of acetate,propionate,and butyrate in standard solution(A)and fermented products of yam polysaccharides(B)and oat polysaccharides(c)注:1:乙酸;2:丙酸;3:丁酸。
采用不同浓度的乙酸、丙酸和丁酸标准溶液(10~60 mmol/L)或乳酸标准溶液(0.1~0.5 mmol/L),得到的标准曲线如表1。以3倍的信噪比(S/N)计算,得到这4种酸的检出限,结果也列于表1中。分别添加不同浓度的乙酸、丙酸、丁酸和乳酸至发酵产物中,所得到的添加回收率结果见表1。表1中的数据表明,所采用的GC分析法以及分光光度法可以准确地测定发酵产物中的4种有机酸含量。
2.3 不同时间两种多糖的发酵产酸情况
两种多糖被粪便提取物中的肠道微生物发酵后,发酵体系的产酸情况如表2所示。表中数据首先证明,粪便提取物自身也可以发酵,并产生少量的4种有机酸。粪便提取物发酵24 h和48 h后,乙酸、丙酸和丁酸分别增加到9.98~10.48、1.98~2.16、2.69~2.93 mmol/L;不同的是,乳酸先增加到0.16 mmol/L,再降低到0.08 mmol/L。表1中的数据也表明,山药多糖和燕麦多糖均可以被粪便提取物中的微生物发酵,并产生乙酸、丙酸、丁酸和乳酸。数据比较结果表明,添加山药多糖或燕麦多糖于发酵体系中,所得发酵产物中4种有机酸的含量大幅度提高,明显高于未发酵时各个体系中的有机酸含量(p<0.05),也高于粪便提取物自身发酵产酸。其中,发酵24 h,山药多糖和燕麦多糖分别发酵产生23.28、25.14 mmol/L乙酸,2.49、1.97 mmol/L丙酸,11.04、7.99 mmol/L丁酸和0.19、0.46 mmol/L乳酸;发酵48 h,两种多糖分别发酵产生28.14、42.53 mmol/L乙酸,6.48、2.45 mmol/L丙酸,13.76、9.64 mmol/L丁酸和0.08、0.09 mmol/L乳酸。可见,发酵时间从24 h延长至48 h,发酵产物中的乙酸、丙酸和丁酸含量得到显著提高(p<0.05),而乳酸含量明显降低(p<0.05)。进一步比较数据发现,山药多糖在发酵时的产酸情况与燕麦多糖有所不同;例如山药多糖发酵比燕麦多糖发酵能够产生更多的丙酸和丁酸、较少的乙酸和乳酸。
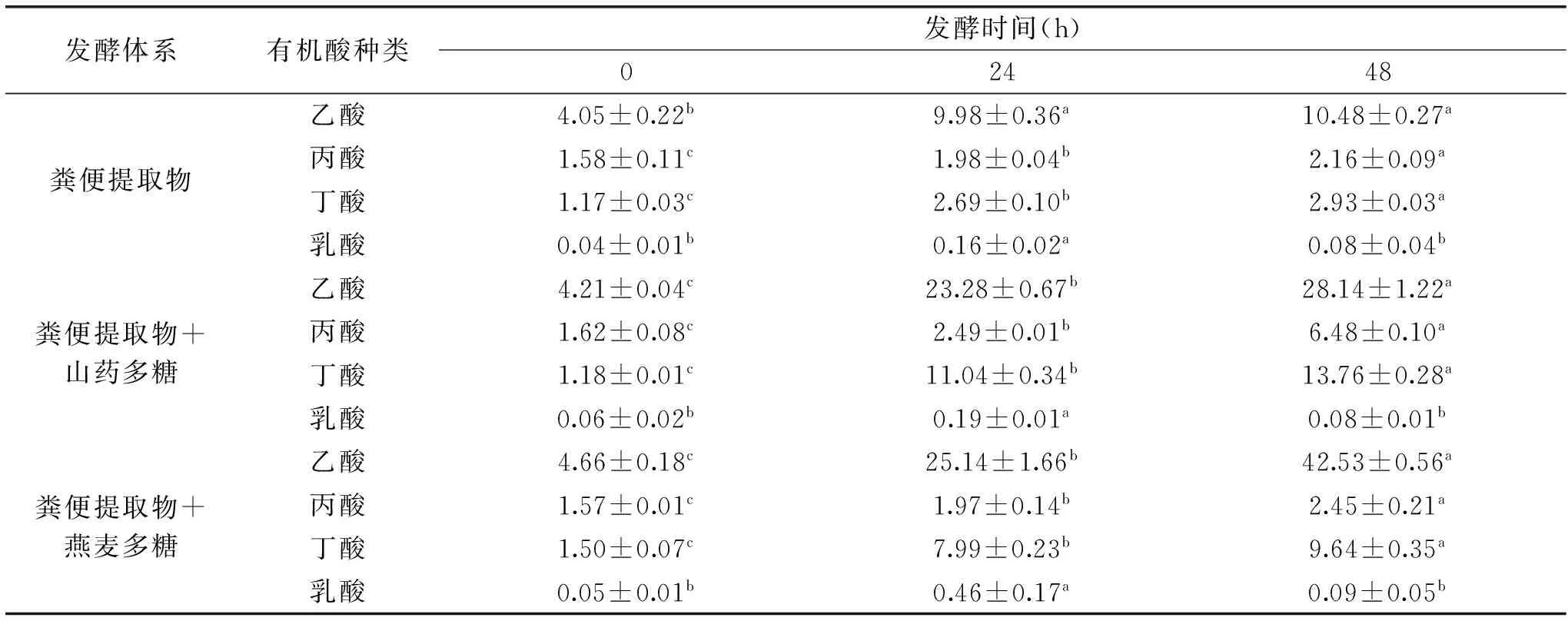
表2 山药多糖及燕麦多糖发酵体系中有机酸含量(mmol/L)Table 2 Four acids produced during in vitro fermentation of yam polysaccharides and oat polysaccharides(mmol/L)
注:数据后不同上标的小写字母表示同一行内数据差异性显著(p<0.05)。
已有研究结果表明,抗性淀粉和魔芋多糖可以被粪便提取物中的肠道微生物降解,产生短链脂肪酸和乳酸,并且随着发酵时间的延长,乙酸、丙酸和丁酸的含量增加,而乳酸呈下降趋势[28-29],这些结果与本研究两种多糖的发酵产酸情况相同。乳酸作为发酵初期产物可被某些微生物利用,合成乙酸[30]和丁酸[31],所以较长时间发酵会减少乳酸含量。本研究的乳酸含量分析结果也证明了这一点。Ying[32]等利用猪肠道微生物发酵水溶性大豆多糖,发现发酵体系中3种短链脂肪酸的生成量明显高于未加入多糖发酵体系中3种酸的生成量,并且在48 h产酸达到最大值。Drzikova等[33]研究也表明,燕麦粉体外发酵实验中丁酸的生成量与发酵时间成正比。以上的这些研究工作结果与本研究结果基本一致,证明山药多糖及燕麦多糖体外发酵可以产生短链脂肪酸(尤其是丁酸),这可能有助于提高两种多糖在体内的抗结肠癌活性,因为丁酸已被证明具有抗结肠癌作用[21-23]。
2.4 不同时间发酵产物对HCT-116细胞的增殖抑制作用
通过CCK-8法评估所得到的发酵产物对HCT-116细胞的增殖抑制作用,结果如表3所示。未发酵时(即发酵时间为0 h),粪便提取物对细胞的抑制作用仅为6.3%、7.9%,而两种多糖对细胞的抑制作用为12.2%~24.5%。粪便提取物自身发酵24 h和48 h后,发酵产物对细胞的增殖抑制作用为8.4%~25.7%。山药多糖和燕麦多糖发酵产物对细胞的增殖抑制作用明显大于粪便提取物自身发酵产物(p<0.05),达到44.6%~56.4%(发酵24 h)或63.5%~69.1%(发酵48 h)。因此,山药多糖和燕麦多糖被粪便提取物中的微生物发酵后,产生了更强的细胞增殖抑制作用;同时,山药多糖和燕麦多糖的发酵时间越长,发酵产物所具有的细胞增殖抑制作用越大。由表3数据还可以看出,任何一个发酵产物对细胞处理24 h或48 h,48 h处理所产生的增殖抑制作用更大。这意味着存在时间依赖关系,即发酵产物处理细胞的时间越长,发酵产物的增殖抑制作用越大。进一步比较两种多糖发酵产物的细胞增殖抑制作用差异性,发现山药多糖发酵产物的增殖抑制作用略高于燕麦多糖发酵产物,但发酵产物之间的抑制作用差异性并非很大。
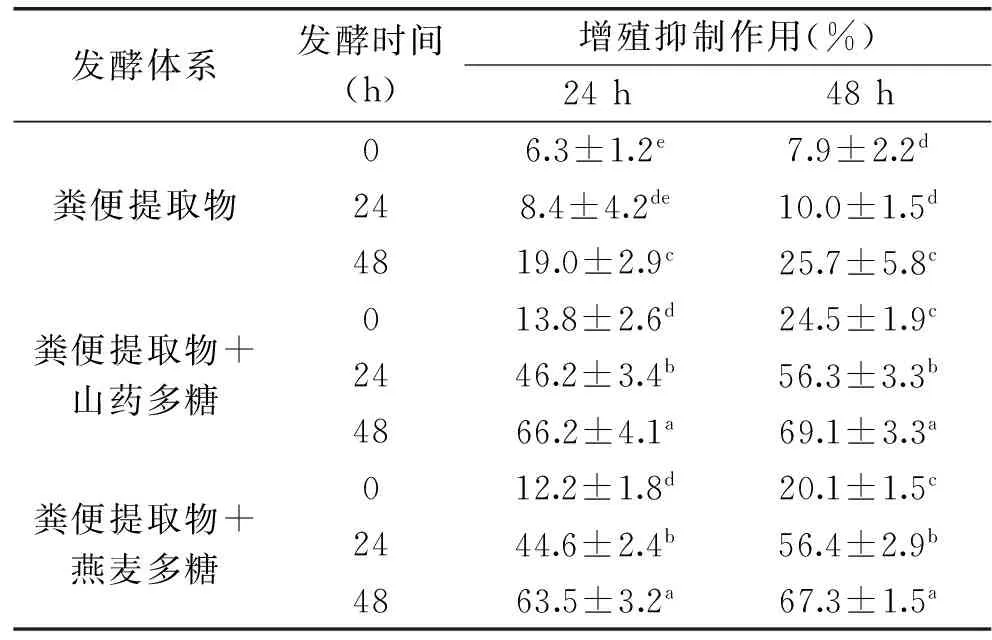
表3 各个发酵产物对HCT-116细胞处理24 h和48 h的增殖抑制作用(%)Table 3 Growth inhibition of the fermentation products on HCT-116 cells with cell treatment times of 24,48 h(%)
注:数据后不同上标的小写字母表示同一列内数据差异性显著(p<0.05)。
肠道微生物发酵山药多糖、燕麦多糖后,对细胞的增殖抑制作用明显地高于未发酵的多糖,并且48 h发酵产物具有更高的增殖抑制作用。这一现象极有可能与发酵产物中丁酸含量增加和乳酸含量降低有关。丁酸已被证明具有抑制结肠癌细胞增殖,诱导凋亡和分化的作用[34]。Kautenburger等[35]的研究结果表明,高浓度的丁酸可以减少肿瘤细胞的存活率或缓解肿瘤的发展。Borowicki等[36]的研究结果也指出,小麦糊粉体外发酵产生较高的丁酸,导致其对LT97和HT29细胞产生更强的增殖抑制作用。本研究结果也发现,两种多糖48 h发酵可以生成更多的丁酸,因此48 h发酵产物的增殖抑制作用更强。另外,肿瘤细胞可以把乳酸作为能量来源维持自身代谢[37]。乳酸也可以促进肿瘤血管生成[38],这意味着,高浓度的乳酸可能会降低发酵产物对结肠癌细胞的增殖抑制作用。反过来,低浓度的乳酸则可能会有利于发酵产物对结肠癌细胞的增殖抑制作用。因此,就本研究结果而言,两种多糖48 h的发酵可以产生更多的丁酸、但是降低乳酸的含量,因此提高了发酵产物对细胞的增殖抑制作用。
3 结论
利用健康成人粪便提取物中的肠道微生物体外发酵山药多糖和燕麦多糖,可以产生4种有机酸(乙酸、丙酸、丁酸和乳酸),并且48 h的发酵时间可以提高乙酸、丙酸和丁酸的生成,减少乳酸的生成。山药多糖和燕麦多糖的发酵,使得发酵产物对结肠癌细胞HCT-116具有更强的增殖抑制作用。初步分析结果表明,发酵时间越长,增殖抑制作用越大;细胞处理时间越长,增殖抑制作用越大;发酵产物对细胞的增殖抑制作用极有可能与丁酸含量升高、乳酸含量降低有关。整体结果证明,肠道微生物发酵山药多糖和燕麦多糖可以产生短链脂肪酸(尤其是丁酸),增强其对HCT-116细胞的增殖抑制作用。
[1]Sun W J,Meng K,Qi C H,et al. Immune-enhancing activity of polysaccharides isolated fromAtractylodismacrocephalaeKoidz[J]. Carbohydrate Polymers,2015,126:91-96.
[2]Liu J,Willfo S,Xu C L. A review of bioactive plant polysaccharides:Biological activities,functionalization,and biomedical applications[J]. Bioactive Carbohydrates and Dietary Fibre,2015,5:31-61.
[3]Cooke C L,An H J,Kim J,et al. Method for profiling mucin oligosaccharides from gastric biopsies of rhesus mon keys with and without Helicobacter pylori infection[J]. Analytical Chemistry,2007,79(21):8090-8097.
[4]Dube D H,Bertozzi C R. Glycans in cancer and inflammation-Potential for therapeutics and diagnostics[J]. Nature Reviews Drug Discovery,2005,4(6):477-488.
[5]Varki A. Biolog ical roles of oligosaccharides:All of the theories are correct[J]. Glycobiology,1993,3(2):97-130.
[6]Takahashi Y,Kitadai Y,Bucana C D,et al. Expression of VEGF and its receptor KDR.Correlates with vascularity metastasis and proliferation of human colon cancer[J]. Cancer Research,1995,55(12):3964-3968.
[7]Wu Q Y,Qu H S,Jia J Q,et al. Characterization,antioxidant and antitumor activities of polysaccharides from purple sweet potato[J]. Carbohydrate Polymers,2015,132:31-40.
[8]何凤玲,叶小利,李学刚,等. 山药中降糖活性成分的筛选与比较[J]. 食品工业科技,2011,32(6):373-375.
[9]宋莎莎,吕佳煜,冯叙桥. 大蒜多糖研究进展[J]. 食品工业科技,2017,38(1):364-374.
[10]Pujol C A,Ray S,Ray B,et al. Antiviral activity against dengue virus of diverse classes of algal sulfated polysaccharides[J]. International Journal of Biological Macromolecules,2012,51:412-416.
[11]刘帅,杨小兰,张晓云. 长山药粗多糖对果蝇抗衰老作用的研究[J]. 食品工业科技,2013,34(14):339-341.
[12]刘杭达,马千苏,王傑,等. 紫山药粗多糖提取工艺的优化及其抗氧化性的研究[J]. 食品工业科技,2015,36(23):208-212.
[13]Yang W F,Wang Y,Li X P,et al. Purification and structural characterization of Chinese yam polysaccharide and its activities[J]. Carbohydrate Polymers,2015,117:1021-1027.
[14]Virkkia L,Johanssona L,Ylinena M,et al. Structural characterization of water-insoluble nonstarchy polysaccharides of oats and barley[J]. Carbohydrate Polymers,2005:357-366.
[15]Yang W F,Wang Y,Li X P,et al. Purification and structural characterization of Chinese yam polysaccharide and its activities[J]. Carbohydrate Polymers,2015,117:1021-1027.
[16]Cummings J H,Pomare E W,Branch W J,et al. Short chain fatty acids in human large intestine,portal,hepatic and venous blood[J]. Gut,1987,28(10):1221-1227.
[17]Bergman E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species [J]. Physiological Reviews,1990,70(2):567-590.
[18]Venter C S,Vorster H H,Cummings J H. Effects of dietary propionate on carbohydrate and lipid metabolism in healthy volunteers[J]. The American Journal of Gastroenterology,1990,85(5):549-553.
[19]Perrin P,Pierre F,Patry Y,et al. Only fibres promoting a stable butyrate producing colonic ecosystem decrease the rate of aberrant crypt foci in rats[J]. Gut,2001,48(1):53-61.
[20]Rasmussen H,Dirven H,Grant D,et al. Etiology of cecal and hepatic lesions in mice after administration of gas-carrier contrast agents used in ultrasound imaging[J]. Toxicology and Applied Pharmacology,2003,188(3):176-184.
[22]De Deckere E,Kloots W J,Van Amelsvoort J. Resistant starch decreases serum total cholesterol and triacylglycerol concentrations in rats[J]. The Journal of Nutrition,1993,123(12):2142-2151.
[23]Raben A,Tagliabue A,Christensen N J,et al. Resistant starch:The effect on postprandial glycemia,hormonal response,and satiety[J]. The American Journal of Clinical Nutrition,1994,60(4):544-551.
[24]Dubosi M,Gilles K A,Hamilton J K.A. Colorimetric method for the determination of sugars[J]. Nature,1951,28:167-168.
[25]Miao M,Ma Y J,Jiang B,et al. Structural elucidation andinvitrofermentation of extracellularα-D-glucan fromLactobacillusreuteriSK24.003[J]. Bioactive Carbohydrates and Dietary Fibre,2015,6:109-116.
[26]Fenster K M,Rankin S A,Steele J L. Accumulation of short n-chain ethyl esters by esterases of lactic acid bacteria under conditions simulating ripening Parmesan cheese[J]. Journal of Dairy Science,2003,86(9):2818-2825.
[27]Barker S B,Summerson W H. The colorimetric determination of lactic acid in biological material[J]. Journal of Biological Chemistry,1941,138(2):535-554.
[28]Geng Q,Zhao X H. Influences of exogenous probiotics and tea polyphenols on the production of three acids during the simulated colonic fermentation of maize resistant starch[J]. Journal of Food Science and Technology,2014:1-8.
[29]Zhao X H,Geng Q. Acid production and conversion of konjac glucomannan duringinvitrocolonic fermentation affected by exogenous microorganisms and tea polyphenols[J]. International Journal of Food Science and Nutrition,2016,67:274-282.
[30]Lopez H W,Levrat-Verny M A,Coudray C,et al. Class 2 resistant starches lower plasma and liver lipids and improve mineral retention in rats[J]. Journal of Nutrition,2001,131:1283-1289.
[31]Duncan S H,Louis P,Flint H J. Lactate-utilizing bacteria,isolated from human feces,that produce butyrate as a major fermentation product[J]. Applied and Environmental Microbiology,2004,70(10):5810-5817.
[32]Ying X,Gong J,Goff H D,et al. Effects of pig colonic digesta and dietary fibres oninvitromicrobial fermentation profiles[J]. Bioactive Carbohydrates and Dietary Fibre,2013,1(2):120-130.
[33]Drzikova B,Dongowski G,Gebhardt E,et al. The composition of dietary fibre-rich extrudates from oat affects bile acid binding and fermentationinvitro[J]. Food Chemistry,2005,90(1):181-192.
[34]Hamer H M,Jonkers D,Venema K,et al. Review article:The role of butyrate on colonic function[J]. Alimentary Pharmacology & Therapeutics,2008,27:104-119.
[35]Kautenburger T,Beyer-Sehlmeyer G,Festag G,et al. The gut fermentation product butyrate,a chemopreventive agent,suppresses glutathione S-transferase theta(hGSTT1)and cell growth more in human colon adenoma(LT97)than tumor(HT29)cells[J]. Journal of Cancer Research and Clinical Oncology,2005,131:692-700.
[36]Borowicki A,Michelmann A,Stein K,et al. Fermented wheat aleurone enriched with probiotic strains LGG and Bb12 modulates markers of tumor progression in human colon cells[J]. Nutrition and Cancer,2011,63:151-160.
[37]Kaelin W G,Thompson C B. Cancer clues from cell metabolism[J]. Nature,2010,465:562-564.
[38]Doherty J R,Cleveland J L. Targeting lactate metabolism for cancer therapeutics[J]. Journal of Clinical Investigation,2013,123:3685-3692.
Acid production of the polysaccharides from yam and oatinvitrofermentation as well as the growth inhibition of the fermentation products on human colon cancer cells
YIN Dan-ting,HAO Li-xin,WANG Qi,ZHAO Xin-huai*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Yam polysaccharides and oat polysaccharides were both prepared using water extraction and alcohol precipitation methods. The intestinal microflora in a fecal extract from the health adults were used to ferment the two polysaccharidesinvitro. The amount of four organic acids(acetic,propionic,butyric and lactic acids)in the generated fermentation products were measured,and growth inhibition of these fermentation products on human colon cancer cells(HCT-116 cells)were assessed. Yam polysaccharides and oat polysaccharides contained saccharide contents of 82.63% and 80.32%,respectively. Being fermented for 24 h,yam polysaccharides and oat polysaccharides generated acetic,propionic,butyric and lactic acids in levels of 23.28 and 25.14,2.49 and 1.97,11.04 and 7.99,0.19 and 0.46 mmol/L,respectively. Being fermented for 48 h,yam polysaccharides and oat polysaccharides resulted in the levels of the four acids at 28.14 and 42.53,6.48 and 2.45,13.76 and 9.64,0.08 and 0.09 mmol/L,respectively. With the increase of fermentation time(24~28 h),acetate,propionate and butyrate contents in fermentation products were enhanced clearly(p<0.05),but lactate contents was also decreased markedly(p<0.05). Yam polysaccharides and oat polysaccharides showed lower growth inhibition(less than 24.5%)on the HCT-116 cells. However,the obtained fermentation products exerted growth inhibition effect(46.2%~69.1% and 44.6%~67.3%,respectively)on the cells. And more,a fermentation time of 48 h conferred the fermentation products with higher growth inhibition while treatment of the cells for 48 h also led to higher growth inhibition. It is thus concluded thatinvitrofermentation of the two polysaccharides by the intestinal microflora could bring enhanced anti-proliferation activities to the colon cancer cells.
yam polysaccharides;oat polysaccharides;fermentation;short-chain fatty acids;colon cancer cells
2017-02-21
殷丹婷(1993-),女,在读硕士研究生,研究方向:食品科学,E-mail:yindanting@163.com。
*通讯作者:赵新淮(1963-),男,博士,教授,主要从事食品化学研究,E-mail:zhaoxh@neau.edu.cn。
高等学校博士学科点专项科研基金(20092325110012)。
TS201.4
A
1002-0306(2017)15-0296-06
10.13386/j.issn1002-0306.2017.15.055
