5所医院19 487例马来酸桂哌齐特用药人群ADR自动监测与评价
2017-09-03郭代红王啸宇张小莉雍晓兰王福利胡鹏洲解放军总医院解放军ADR监测中心北京008国家食品药品监管总局药品评价中心北京000解放军医院北京000北京军区总医院北京0000成都军区成都总医院成都008解放军0医院北京000重庆医科大学药学院重庆
郭代红,王啸宇,刘 佳,张小莉,张 梅,雍晓兰,王福利,胡鹏洲,马 亮,赵 靓(.解放军总医院解放军ADR监测中心,北京 008;.国家食品药品监管总局药品评价中心,北京 000;.解放军医院,北京 000;.北京军区总医院,北京 0000;.成都军区成都总医院,成都 008;.解放军0医院,北京 000;.重庆医科大学药学院,重庆 0)
·不良反应监测·
5所医院19 487例马来酸桂哌齐特用药人群ADR自动监测与评价
郭代红1,王啸宇1,刘 佳2,张小莉3,张 梅4,雍晓兰5,王福利6,胡鹏洲7,马 亮1,赵 靓1(1.解放军总医院解放军ADR监测中心,北京 100853;2.国家食品药品监管总局药品评价中心,北京 100045;3.解放军261医院,北京 100071;4.北京军区总医院,北京 100700;5.成都军区成都总医院,成都 610083;6.解放军304医院,北京 100037;7.重庆医科大学药学院,重庆 401331)
目的:通过实施哨点医院多中心ADR信息化重点品种主动监测研究,探讨药物监测与评价规律和相关因素,深化军队药物警戒工作。方法:经过集中培训,按照统一监测条件,利用“住院患者药品不良事件主动监测与评估警示系统”,自动监测2016年1 – 12月期间5所军队哨点医院19 487例马来酸桂哌齐特用药人群数据,系统报警案例经人工逐例分析后上报汇总并统计分析。结果:马来酸桂哌齐特注射液相关血小板减少、血红蛋白减少、白细胞减少、肝损害、肾损害发生率分别为0.20%、0.37%、0.41%、1.37%、0.82%;总发生率3.17%。未见相关性粒细胞缺乏病例。多中心监测结果能反映各医院的用药习惯和真实人群特点,但总体趋同。结论:基于大样本真实世界研究获得的药物上市后安全性再评价结果更具参考意义;基于专项软件开展多中心药物安全性再评价,数据可靠、便捷高效。桂哌齐特注射液工艺改进后,临床用药较为安全。
桂哌齐特;药品不良反应;自动监测;安全性再评价;真实世界研究
随着药品不良反应/事件(ADR/ADE)监测工作日趋完善,药物警戒的重心逐渐倾向于规范开展重点品种的大样本多中心集中监测工作,但囿于成本、时效所限,真实世界大样本量用药人群研究的实施相对较少。本团队借助信息化手段自主研发的“住院患者ADE主动监测与评估警示系统”(简称系统),已经完成了多个重点品种的多种ADR主动监测[1-2],显著提升了ADR主动监测的时效。基于多年来的实践经验,我中心于2016年组织8所军队ADR哨点医院,利用升级版系统再次实施多个重点品种的多中心集中监测。笔者对来自其中5所哨点医院19 487例马来酸桂哌齐特注射液用药人群获得的自动监测评价数据进行汇总分析,以期对上市后药品的安全性评价及其再注册审批提供科学的参考依据。
1 数据来源与实施方法
本研究为基于我中心研发的“住院患者ADE主动监测与评估警示系统”开展的多中心信息化集中监测。前期对军队8所哨点医院参加研究的人员进行了集中专项培训,由工程师现场安装系统后,进行数据提取、案例分析并提交报告;其中5所医院提交数据中涉及马来酸桂哌齐特注射液,分别是解放军总医院、解放军261医院、北京军区总医院、成都军区总医院、解放军304医院(简称301、261、北总、成总、304)。
本项目为真实世界大样本数据分析,按照培训提供的系统统一设置条件,各医院回顾性自动监测军卫一号系统中,2015年1月– 2016年12月期间,使用了马来酸桂哌齐特注射液的住院患者电子病历数据;纳入自动监测的ADE为“血小板减少”、“血红蛋白减少”、“白细胞减少”、“肝损伤”、“肾损伤”。由研究人员和临床药师针对系统报警阳性病例逐一甄别分析,依据国家药品不良反应监测中心评判标准进行分类和关联性评价[3]。采用Excel系统进行数据处理,统计描述采用例数和构成比。采用SPSS 22.0统计学软件,对计数变量采用χ2检验,检验水准α= 0.05。
2 结果
2.1 各哨点医院完成的具体监测模块和例数
详见表1。
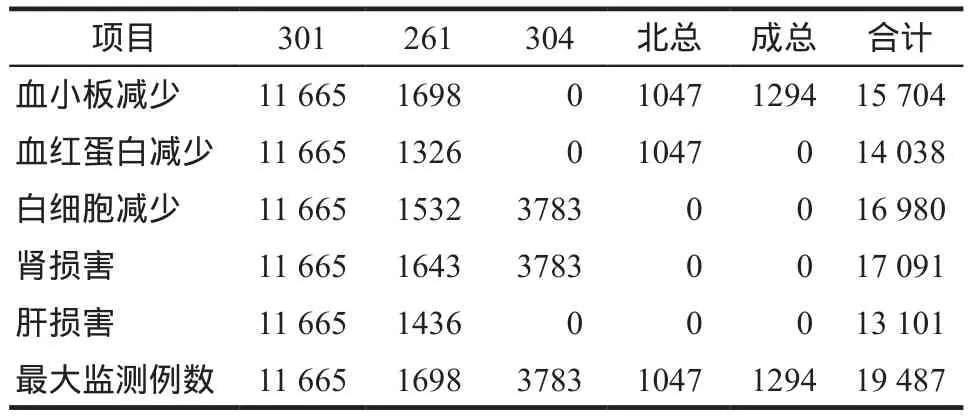
表1 各哨点医院监测模块和例数Tab 1 The monitoring module and the number of cases in sentinel surveillance hospital
2.2 血小板减少的主动监测数据
血小板减少发生率为0.20%,具体监测数据详见表2。
2.3 血红蛋白减少的主动监测数据
血红蛋白减少发生率为0.37%,具体监测数据见表3。

表2 血小板减少的主动监测数据汇总Tab 2 The summary of active monitoring data about thrombocytopenia

表3 血红蛋白减少的主动监测数据汇总Tab 3 The summary of active monitoring data about decreased hemoglobin
2.4 白细胞减少主动监测数据
白细胞减少发生率为0.41%,具体监测数据见表4。
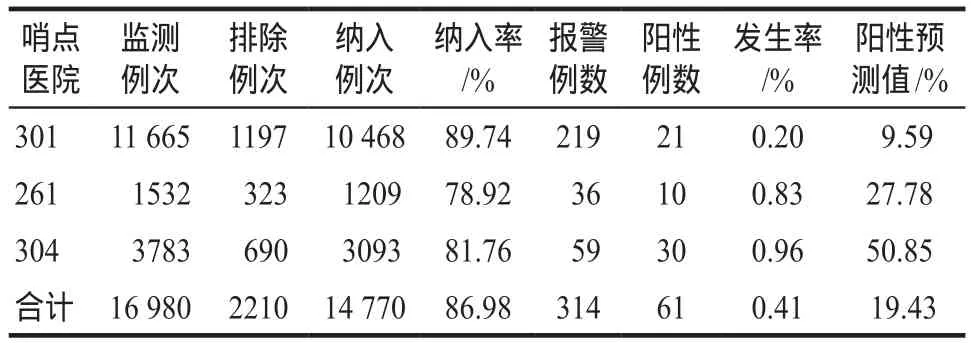
表4 白细胞减少主动监测数据汇总Tab 4 The summary of active monitoring data about leukopenia
2.5 肾损害的主动监测数据
肾损害发生率为1.37%,具体监测数据见表5。
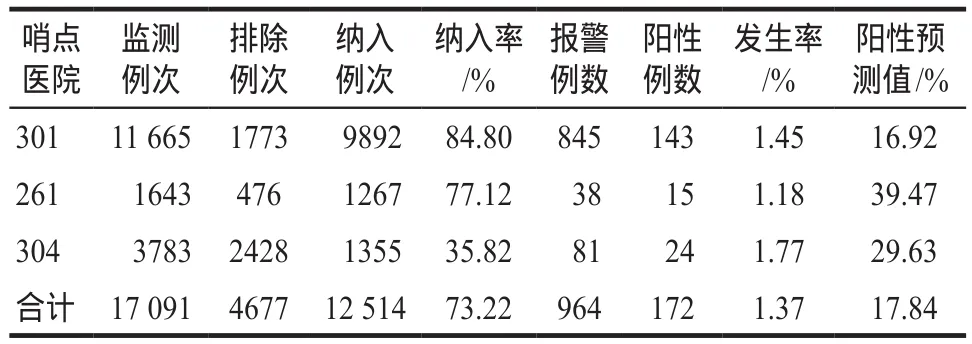
表5 肾损害的主动监测数据汇总Tab 5 The summary of active monitoring data about renal damage
2.6 肝损害的主动监测数据
肝损害发生率为0.82%,具体监测数据见表6。
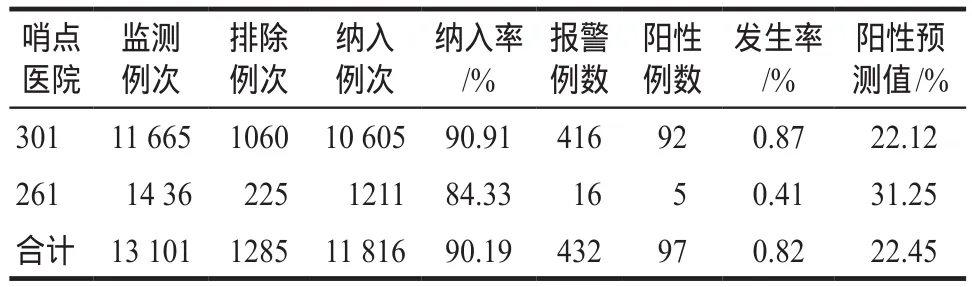
表6 肝损害的主动监测数据汇总Tab 6 The summary of active monitoring data about liver damage
2.7 粒细胞监测相关数据
解放军总医院在研究中,同步补充监测11 665例用药人群的白细胞、粒细胞计数。最终系统报警病例中确认白细胞减少20例,其中16例同时伴发中性粒细胞减少,4例中性粒细胞计数正常;另有1例仅为单纯中性粒细胞减少;没有粒细胞缺乏病例。详见表7。

表7 白细胞减少与粒细胞减少的监测结果Tab 7 The monitoring result of leukopenia and neutropenia
2.8 不同用药剂量人群ADR发生率
解放军总医院11 665例用药人群中,对两种规格桂哌齐特的不同日剂量使用人群进行亚组分析,结果表明320 mg日剂量不同规格组间,ADR发生率无显著性差异,而减量与足量用药组间有显著差异(P<0.05)。详见表8。
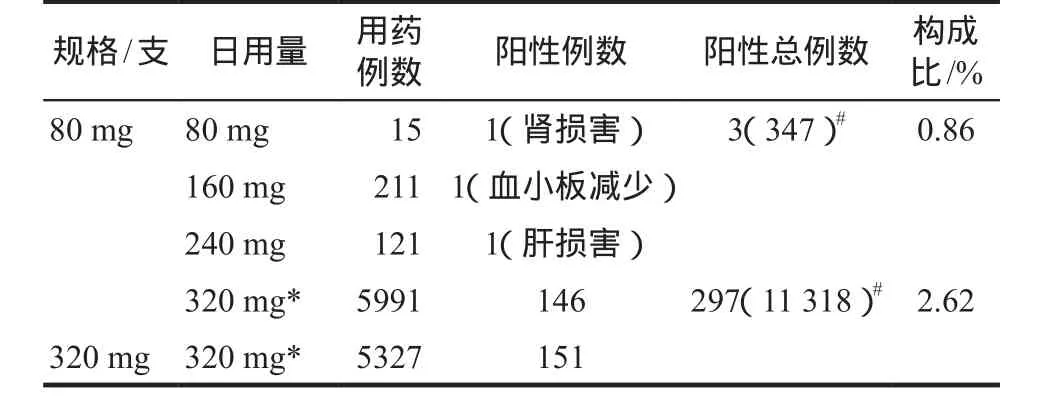
表8 11 665例用药人群中不同规格不同日剂量桂哌齐特所致ADR发生情况亚组比较Tab 8 Comparison of the ADR induced by cinepazide with different specifications and different daily doses in 11 665 patients
3 讨论
3.1 桂哌齐特的临床用药风险相对较小
对5所医院19 487例马来酸桂哌齐特注射液用药人群的多中心信息化集中监测结果表明,该药致血小板减少、血红蛋白减少、白细胞减少、肝损害、肾损害发生率分别为0.20%、0.37%、0.41%、1.37%、0.82%;总发生率3.17%。由于20世纪80年代国外该药因严重粒细胞缺乏被撤市,所以牵头单位研究后期特设中性粒细胞减少子模块,将单纯粒细胞减少而白细胞总数正常的漏报病例均纳入了监测范畴;结果未见粒细胞缺乏病例;从一个侧面验证了文献中对该药致严重粒细胞缺乏、很可能源于当时生产工艺局限致高含量氮氧化物杂质的分析[4]。而研究中个体化调整剂量人群ADR发生率显著减少,说明规范用药、个体化用药永远是不可忽视的安全用药准则。
3.2 新药上市后安全性再评价应为大样本真实世界研究结果
国家食品药品监督管理总局2017年3月《国产药品再注册管理规定(试行)》(征求意见稿)中要求,在药品批准文号有效期内,申请者应当对药品的安全性、有效性和质量控制情况等进行系统评价,并于新药上市五年到期日前6个月提交。桂哌齐特国内上市以来,与其相关的负面争议时起波澜、众议纷纷,表面上看似乎是因其市场高收益和新生产厂家的获批而起,然而细究之下,应该是源于其上市15年中,一直未见有基于大样本用药人群的安全性研究数据面世。因此,新药上市五年再注册提交资料中的安全性再评价非常重要,应该也有必要明确规定必须是大样本真实世界研究的结果。
3.3 自动监测能够精准快廉的获取临床用药风险数据
来自5所哨点医院的监测数据是在完成集中培训、实地安装系统并反复调试后得以在数月内完成的。牵头医院已具备利用系统开展主动监测与药物评价的规范操作模式[5],并针对研究目标反复进行多次前期预实验[6-7],能够提供哨点单位人员全面培训与操作指导,保证研究顺利实施。系统完成一个ADR模块的自动监测并给出报警病例的时间,视数据源和用药人群量的不同,仅需数分钟到数小时;但是研究中为纳入尽可能多的用药人群,系统设置排除条件启用最少,因此阳性报警率较低,致使人工逐例甄别的时间显著增加。获取19 478例用药人群的桂哌齐特ADR发生率用时数月,说明借助信息化技术、基于专项监测软件的药物安全性再评价模式,用于大样本真实世界药物安全性评价研究高效快捷、省时省力,较之传统的人工主动监测研究,大大缩短研究周期、降低研究成本。
3.4 开展多中心自动监测需要精细策划互相配合
作为牵头单位,解放军总医院通过成功对接HIS历史数据库,能够回顾性监测到更多的用药人群,占比达到59.86%;因而对最终统计得到的ADR发生率具有较大影响。由于军队各哨点医院存在多因素影响,不同哨点的监测进度、时间段、模块选择并不完全一致,但结果总体趋同且各有特色,真实反映了各医院的用药习惯和人群特点。以261医院监测结果与牵头单位结果对比,除白细胞减少的发生率较高、血小板减少接近,其它均明显低于后者监测结果,分析可能源于其精神病专科医院患者联合使用抗精神病药物较多、用药人群平均年龄相对较低而不似牵头医院以老年为主。囿于前期培训未要求哨点医院提供此类数据,此推测有待更多支持。因此,利用自动监测系统开展多中心信息化集中监测,牵头单位需通过反复预实验直到设置条件成熟后再进行专项培训,而哨点单位亦需配备有科研思维的资深药师积极配合跟进。
[1] 陈超,郭代红,薛万国,等.住院患者药品不良事件主动监测与评估警示系统的研发[J].中国药物警戒,2013,10(7):411-414,418.
[2] 郭代红,陈超,马亮,等.5所医院住院患者ADE警示系统主动监测数据分析与评价[J].中国药物应用与监测,2014,11(6):368-371.
[3] 国家药品不良反应监测中心.药品不良反应术语使用指南[S].监测与评价综[2016]77号.
[4] 田艳,陆景坤,董志强,等.桂哌齐特致血液系统不良反应的实验研究[J].毒理学杂志,2011,25(4):273-275.
[5] 王啸宇,郭代红,陈超,等.基于电子医疗档案的ADR自动监测规范化操作流程[J].中国药物应用与监测,2016,13(5):302-305.
[6] 郭代红,胡鹏洲,马亮,等.马来酸桂哌齐特关联性肝肾损害的自动监测研究[J].药物流行病学杂志,2017,26(1):33-36.
[7] 胡鹏洲,马亮,郭代红,等.3181例马来酸桂哌齐特注射液相关血细胞减少的自动监测研究[J].中国药物警戒,2016,13(12):745-747.
Automatic monitoring and evaluation of cinepazide maleate related ADR in 19 487 hospitalized patients of fi ve hospitals
GUO Dai-hong1, WANG Xiao-yu1, LIU Jia2, ZHANG Xiao-li3, ZHANG Mei4, YONG Xiao-lan5, WANG Fu-li6, HU Peng-zhou7, MA Liang1, ZHAO Liang1(1. PLA Center for ADR Monitoring, PLA General Hospital, Beijing 100853, China; 2. Center for Reevaluation, CFDA, Beijing 100045, China; 3. The 261th Hospital of PLA, Beijing 100071, China; 4. General Hospital of Beijing Military Command, Beijing 100700, China; 5. General Hospital of Chengdu Military Command of PLA, Chengdu 610083, China; 6. The 304th Hospital of PLA, Beijing 100037, China; 7. College of Pharmacy, Chongqing Medical University, Chongqing 401331, China)
Objective:To fi gure out the rule and relevant factors of drug safety monitoring and assessment, and improve the military pharmacovigilance practice by conducting multi-center sentinel hospital ADR informationalized active monitoring study.Methods:Under the centralized training and uniform monitoring condition, automatic monitoring were conducted by the active monitoring and assessment of adverse drug events for hospitalized patients system, which covered 19 487 cases used cinepazide in 5 hospital in January to December 2016. The warning cases that were detected by the system were manually evaluated, and then the data was submitted and analyzed statistically.Results:The incidence of cinepazide maleate related thrombocytopenia, hemoglobin decreased, leukocytopenia, liver damage and renal damage were 0.20%, 0.37%, 0.41%, 1.37% and 0.82%, respectively; the total incidence of ADR was 3.17%. No related agranulocytosis was detected. The miniature of drug utilization custom and population characteristic in different hospitals can be ref l ected by the monitoring results of multi-center, but the general trends were similar.Conclusion:The big data that came from real world studies was more meaningful in drug post-market evaluation. The special software on multi-center drug safety evaluation was reliable and efficient. With the improvement of manufacturing process, the cinepazide is safe in clinical practice.
Cinepazide; Adverse drug reaction; Automatic monitoring; Safety reevaluation; Real world study
R969.3
A
1672 – 8157(2017)04 – 0221 – 04
2017-05-26
2017-07-01)
2014年全军后勤科研重点项目(BWS14R039);国家药品评价中心委托专项(马来酸桂哌齐特注射液的安全性研究)
郭代红,女,主任药师,硕士生导师,研究方向:临床药学、药物警戒。E-mail:guodh301@163.com
