高效液相色谱法测定人血浆中伏立康唑浓度及其应用
2017-09-03郭美华高春璐哈尔滨医科大学附属第一医院黑龙江哈尔滨150001
刘 亮,郭美华,陈 岩,鲁 静,钱 钊,高春璐,海 鑫(哈尔滨医科大学附属第一医院,黑龙江 哈尔滨 150001)
·实验研究·
高效液相色谱法测定人血浆中伏立康唑浓度及其应用
刘 亮,郭美华,陈 岩,鲁 静,钱 钊,高春璐,海 鑫(哈尔滨医科大学附属第一医院,黑龙江 哈尔滨 150001)
目的:建立一种简单、准确的测定人血浆中伏立康唑浓度的方法,并应用于临床伏立康唑血药浓度监测,以促进个体化用药。方法:采用高效液相色谱法,以酮康唑为内标。色谱柱:Waters Symmetry C18柱(4.6 mm × 250 mm,5 μm),流动相为乙腈-0.01 mol·L-1醋酸铵溶液(50 : 50),流速1.0 mL·min-1,紫外检测波长255 nm,柱温40 ℃,进样量40 μL。结果:伏立康唑在0.1 ~ 20.0 μg·mL-1范围内线性良好,r= 0.999 7。定量下限为0.1 μg·mL-1。伏立康唑高、中、低三个浓度的提取回收率分别是96.24% ~ 101.61%、89.06% ~ 93.55%、83.76% ~ 108.87%。日内精密度RSD < 9.44%,日间精密度RSD < 5.56%。本方法测定患者的伏立康唑血浆药物浓度分别为6.36、4.98、0.54 μg·mL-1。结论:该方法灵敏度高,操作简便,结果准确,适用于伏立康唑血药浓度监测。
伏立康唑;血药浓度监测;高效液相色谱法
伏立康唑(voriconazole,VRC)是第二代三唑类抗真菌药物,该药在氟康唑的基础上引入甲基,并以氟代嘧啶环取代了氟康唑的三唑环,通过抑制真菌细胞膜麦角固醇的合成,从而抑制真菌的生长[1-2]。伏立康唑具有广谱抗菌作用,尤其是对急性侵袭性曲霉菌、 侵袭性念珠菌、食道球菌分支霉菌属和镰孢菌属具有较强的抗菌活性[3]。伏立康唑在人体内呈非线性药动学过程,且受基因型及药物相互作用的影响[4],不同人的血药浓度差异很大。因此,对伏立康唑的血药浓度监测十分必要[2]。目前,伏立康唑的血药浓度测定方法很多,主要有高效液相色谱法、液质联用等方法[5]。由于多数方法繁琐复杂,本研究通过改进文献中的方法,建立一种操作简便、准确、稳定的伏立康唑血药浓度监测方法,用于临床伏立康唑药物浓度监测。
1 实验材料
1.1 仪器
高效液相色谱仪20A(日本岛津公司);3-30K高速离心机(德国Sigma公司);Vortex Genius 3漩涡混合器(德国IKA公司);Branson 5800医用超声波清洗器(美国BRANSON公司);MTN-2800W氮吹仪(天津奥特赛恩斯仪器有限公司);Barnstead GenPure ProUV纯水器(美国赛默飞世尔公司);XS205十万分之一电子天平(梅特勒-托利多国际贸易有限公司);Research Plus移液器(德国Eppendorf公司)。
1.2 试剂
伏立康唑对照品(中国食品药品检定研究院,含量:99.7%,批号201402);酮康唑对照品(中国食品药品检定研究院,含量:99.4%,批号201203);乙腈和甲醇为色谱纯(赛默飞世尔科技公司),水为超纯水。
2 方法与结果
2.1 色谱条件与系统适用性实验
色谱柱为Waters Symmetry®C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-0.01 mol·L-1醋酸铵溶液(50 : 50);流速:1.0 mL·min-1;检测波长:255 nm;内标:酮康唑;柱温:40 ℃;进样量(自动进样):40 µL。系统适用性实验理论塔板数、分离度均符合相关要求。
2.2 溶液的配制
2.2.1 对照品储备液精密称取伏立康唑10.00 mg,置于10 mL的容量瓶中,用甲醇溶解并稀释至刻度,得1000 μg·mL-1伏立康唑对照品储备液,置于4 ℃冷藏。精密称量上述已配好的储备液2 mL,置于10 mL容量瓶中,用甲醇定容至刻度,配成200 μg·mL-1的伏立康唑标准对照品工作液,采用倍比稀释配成200、100、40、20、10、5、1 μg·mL-1系列浓度的伏立康唑对照品工作液,置于4 ℃冰箱中存放备用。同法配成160、80、2 μg·mL-1三个水平的伏立康唑质量控制(QC)工作液,置于4 ℃冰箱中存放备用。
2.2.2 内标溶液方法同上,配制酮康唑内标溶液100 μg·mL-1,置于4 ℃冰箱中存放备用。
2.3 血浆样品的处理
取出血浆在室温下融化后摇匀,用移液器精密移取血浆样品500 μL置于2 mL EP管中,加入内标溶液50 μL,混匀后加入1 mL乙腈,涡旋30 s后离心5 min(13 000 r·min-1),取上清液于1.5 mL EP管中,于室温条件下氮气吹干,加入200 μL流动相振荡复溶,离心5 min(13 000 r·min-1),取上清液,待分析。
2.4 方法学验证
2.4.1 特异性分别取空白血浆、空白血浆含内标、空白血浆含伏立康唑对照品、空白血浆含内标与伏立康唑对照品4种样品按“2.3”项下方法处理后进样,色谱图见图1。由图可看出内标色谱峰与目标物色谱峰完全分离,其他杂质不干扰两者的测定,峰形理想。
2.4.2 标准曲线的绘制及定量下限取离心管,分别加入空白血浆450 μL,再精密量取已经配好系列浓度的伏立康唑对照品溶液各50 μL,得到浓度分别为0.1、0.5、1.0、2.0、4.0、10.0、20.0 µg·mL-1的血浆样品,将此样品依照“2.3”项下相应步骤处理,并记录色谱图与峰面积。以伏立康唑色谱峰面积与内标酮康唑色谱峰面积之比(Y)对已知伏立康唑浓度(X)进行回归分析。回归方程为Y = 0.129 8 X + 0.009 5,r = 0.999 7。线性范围:0.1 ~ 20.0 μg·mL-1。定量下限为0.1 μg·mL-1。
2.4.3 精密度和回收率实验日内精密度:在同一天内,用空白血浆与伏立康唑对照品溶液制成浓度分别为0.20、8.00、16.00 μg·mL-1的样品各5份,按“2.3”项下方法操作,进样分析,计算均值,标准差及相对标准差。日间精密度同法配制浓度分别为0.20、8.00、16.00 μg·mL-1的血浆样品,依照上述方法测定处理,连续测定5 d,同法计算。
相对回收率:按“2.2.1”项下方法重新配置伏立康唑对照品储备液,稀释后制成浓度为0.20、8.00、16.00 μg·mL-1的样本各5份,按“2.3”项下同法操作,进样分析,将所得的伏立康唑峰面积与内标物峰面积比值带入回归方程计算出浓度值,以测得值与实际值作比计算相对回收率。结果见表1,可见准确度良好。
提取回收率用空白血浆和伏立康唑对照品溶液制成浓度为0.20、8.00、16.00 µg·mL-1的样本各5份,按“2.3”项下处理,但最后加内标,进样分析,伏立康唑与内标峰面积比为R1,空白血浆按正常方式提取,最后加入等量的伏立康唑与内标,伏立康唑与内标峰面积比为R2。按公式:提取回收率(%)=(R1/R2)×100%计算。结果见表2,符合样本分析的要求。
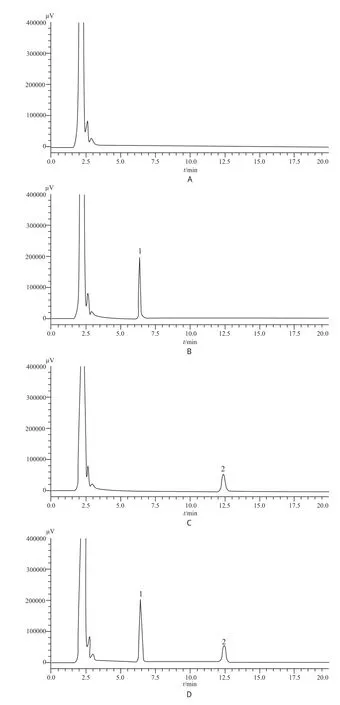
图1 HPLC色谱图A – 空白血浆,B – 空白血浆+伏立康唑,C – 空白血浆+内标,D –空白血浆+伏立康唑+内标;1 – 伏立康唑,2 –内标Fig 1 HPLC chromatogramsA – blank plasma, B – blank plasma + voriconazole, C – blank plasma + internal standard, D – blank plasma + voriconazole + internal standard; 1 – voriconazole, 2 – internal standard
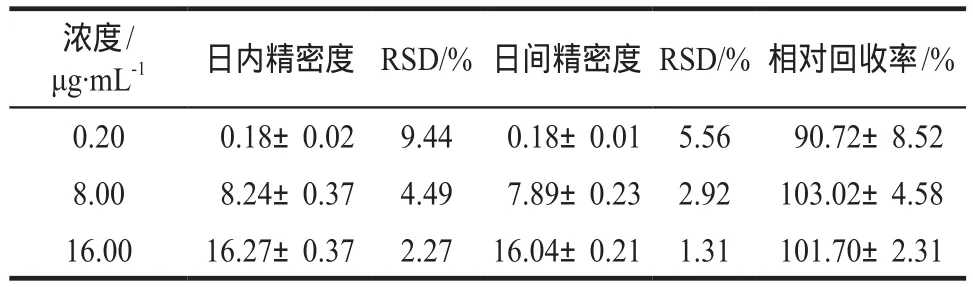
表1 伏立康唑血浆样品的精密度和相对回收率.n= 5Tab 1 Precision and relative recovery of voriconazole in plasma.n= 5
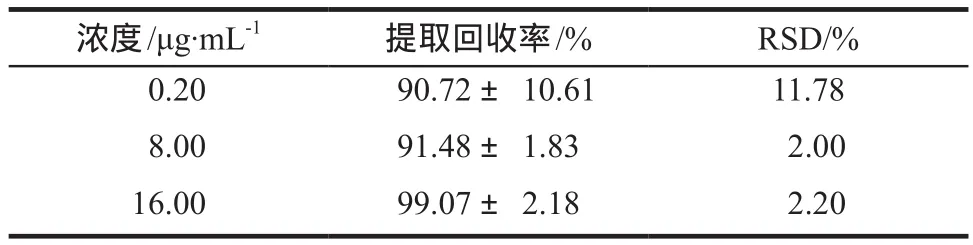
表2 伏立康唑血浆样品提取回收率.n= 5Tab 2 Extraction recovery of voriconazole in plasma.n= 5
2.4.4 稳定性实验反复冻融稳定性:同上述方法配制0.20、8.00、16.00 µg·mL-1的样品,于– 40 ℃冰箱内冷冻24 h后,取出样品,融化完全,反复冻融3次后按“2.3”项下方法操作,进样分析,每种浓度的样品3份,同法计算。
长期稳定性:同上述方法配制同样浓度样品,于冰箱– 40 ℃中放置35 d后,每种浓度测定3管样品,同法计算。结果见表3。
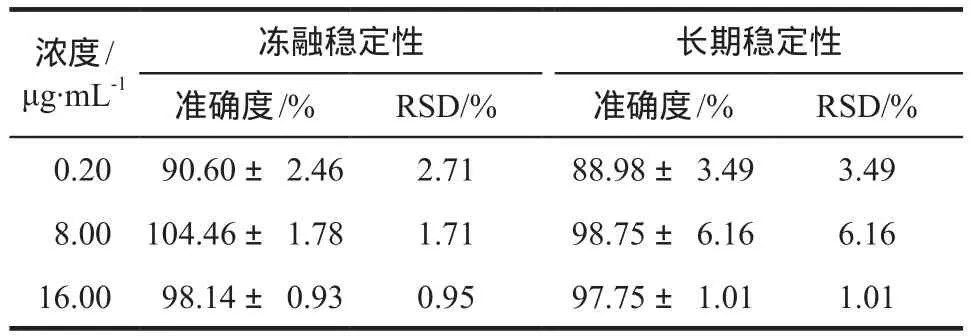
表3 伏立康唑血浆样品的冻融稳定性与长期稳定性.n= 3Tab 3 Freeze-thaw and long-term stability of voriconazole in plasma.n= 3
2.5 患者血浆测定
取待测血浆,按“2.3”项下方法进行处理,进样分析,用已建立标准曲线计算样品中伏立康唑的含量,质控样本平行测定。测定患者的伏立康唑血浆药物浓度分别为6.36、4.98、0.54 µg·mL-1。
3 讨论
三唑类抗真菌药物是临床上应用广泛的抗真菌药物,因该类药物可与体内的P-450蛋白血红素辅基Fe原子配位结合,普遍具有一定的肝、肾毒性[6]。因此,对此类药物的临床监测十分必要。伏立康唑为新型三唑类抗真菌药物,是治疗侵袭性真菌感染的常见药物之一[7]。伏立康唑的血药浓度监测方法有多种。其中质谱分析方法灵敏度高,检测范围广,但由于样品处理较复杂,成本昂贵等限制,难以在临床上推广[8]。与质谱法相比,高效液相色谱紫外检测法具有经济适用,稳定性好,被广泛应用于血药浓度监测领域中。国内关于高效液相色谱法测定伏立康唑血药浓度已有报道,多采用乙酸乙酯-环己烷或氯仿等萃取剂进行提取[8-10],血浆前处理操作繁琐、复杂。为了简化实验步骤,我们曾尝试采用外标法,血浆用乙腈沉淀后直接过滤上样,结果显示此方法杂质峰干扰太多,外标法直接沉淀未能达到检测要求,不适用于伏立康唑的检测。经过反复实验,最终通过加入内标,将样品氮吹浓缩纯化,结果峰形完好。
文献中关于伏立康唑内标的选择有多种,如卡马西平、尼群地平、劳拉西泮、酮康唑等,我们选取伏立康唑的结构类似物酮康唑作为内标。实验初期,加入50 μL浓度为20 µg·mL-1的酮康唑,结果显示内标峰面积与伏立康唑峰面积相比过小,经过反复研究,最终选择内标的浓度为100 µg·mL-1。
伏立康唑浓度个体间差异大,国内外有文献[11-12]推荐伏立康唑有效浓度为1.0 ~ 5.5 µg·mL-1,本方法结果表明伏立康唑浓度在0.1 ~ 20.0 µg·mL-1范围内线性关系良好,覆盖了伏立康唑的有效浓度范围。我们对本院3例真菌感染患者用此方法进行检测,伏立康唑的谷浓度分别是6.36、4.98、0.54 µg·mL-1,3例真菌感染患者中仅有1例患者伏立康唑浓度在此推荐范围内,可依据此结果及患者的病情进行适当调整剂量。
[1] Johnson LB, Kauffman CA. Voriconazole: a new triazole antifungal agent[J]. Clin Infect Dis, 2003, 36(5): 630-637.
[2] Lin D, Li G, Chen L. Determination of voriconazole in human plasma by HPLC-ESI-MS and application to pharmacokinetic study[J]. J Chromatogr Sci, 2013, 51(6): 485-489.
[3] 薛阳,李红磊,张薇,等.伏立康唑抗真菌作用研究进展[J].人民军医,2016,59(7):746-748.
[4] 张金杰,吕文文,魏传梅.伏立康唑临床应用个体差异影响因素的文献分析[J].中国医院药学杂志,2016,36(14):1220-1224.
[5] 李宇,张蕾,邓明影,等.反向高效液相色谱法测定人血浆中伏立康唑的浓度[J].安徽医药,2016,20(7):1276-1279.
[6] 朱曼,郭茂文,郭代红,等.三唑类抗真菌药物的药源性肝损伤主动监测研究[J].中国药物应用与监测,2017,14(1):45-47,68.
[7] 钟皎,郝琨,裴泽军.UPLC-MS/MS法测定人血浆中伏立康唑的浓度及其临床应用[J].中国药房,2016,27(29):4064-4067. [8] 史卉妍,彭亮,谭志荣,等.高效液相色谱法测定人血浆中伏立康唑浓度[J].中南药学,2007,5(4):305-308.
[9] 张华峰,戴博,宋青,等.高效液相色谱法测定人血浆中伏立康唑含量[J].解放军药学学报,2010,26(5):446-448.
[10] 程昱,丘宏强,阙万才,等.固相萃取-HPLC法测定人血浆中伏立康唑浓度及其临床应用[J].中国临床药理学杂志,2016,32(20):1894-1896,1904.
[11] Dolton MJ, Ray JE, Chen SCA,et al. Multicenter study of voriconazole pharmacokinetics and therapeutic drug monitoring[J]. Antimicrob Agents Chemother, 2012, 56(9): 4793-4799.
[12] 曲恒燕,李媛媛,高洪志,等.伏立康唑人体药代动力学的特征与差异研究[J].中国药物应用与监测,2012,9(4):187-189.
《中国药物应用与监测》开通优秀论文发表绿色通道
为了最大限度地缩短优秀论文的刊发周期,维护其首发权,同时更快捷地传播先进的新技术、新成果,本刊特开通优秀论文发表绿色通道,优先刊登下列几类论文:
(1)在国际或国内具有领先水平的创新性论文
(2)临床药师开展某类药学监护的要点总结
(3)药物临床研究与应用中的疗效和安全性评价
(4)省部级以上基金课题资助论文
对于以上四类论文,采取优先审稿、快速发表的原则,不受版面和栏目限制。欢迎广大作者踊跃投稿!
Determination of voriconazole in human plasma by HPLC and its application
LIU Liang, GUO Mei-hua, CHEN Yan, LU Jing, QIAN Zhao, GAO Chun-lu, HAI Xin(Department of Pharmacy, the First Affiliated Hospital of Harbin Medical University, Harbin 150001, China)
Objective:To establish a simple and accurate method for the determination of voriconazole in human plasma. This method was used to monitor voriconazole blood concentration and promote the individualized medication.Methods:With ketoconazole as the internal standard, the chromatographic column was the Waters Symmetry C18(4.6 mm×250 mm, 5 μm), the mobile phase was acetonitrile-0.01 mol·L-1ammonium acetate solution (50 : 50). The detection wavelength was 255 nm with the fl ow rate of 1.0 mL·min-1, and the column temperature was 40 ℃. The injection volume was 40 μL.Results:The concentration of voriconazole in the range of 0.1 – 20.0 μg·mL-1(r= 0.999 7) showed the good linearity. The lower limit of quantitation was 0.1 μg·mL-1. The recovery rates of low, middle and high concentrations were 96.24% – 101.61%, 89.06% – 93.55% and 83.76% –108.87%, respectively. The intra-day RSDs were less than 9.44% and the inter-day RSDs were less than 5.56%. The concentration of voriconazole in patient plasma were 6.36, 4.98, 0.54 μg·mL-1, respectively by the method.Conclusion:The method was sensitive, simple, accurate and applicable for voriconazole blood concentration monitoring.
Voriconazole; Blood drug concentration monitoring; HPLC
R917
A
1672 – 8157(2017)04 – 0205 – 04
2016-12-06
2017-03-26)
海鑫,女,副主任药师,主要从事药物分析,临床药学工作。E-mail:69330580@qq.com
刘亮,男,药师,主要从事治疗药物监测工作。E-mail:976719372@qq.com
