MicroRNA⁃29b调控胶质瘤发生的机制研究
2017-09-03侯文仲许远鹏毛振敏陈子阳曾敏敏李在雨
侯文仲,许远鹏,毛振敏,陈子阳,曾敏敏,李在雨
[广州医科大学第六附属医院(清远市人民医院)神经外科,广东 清远511518]
MicroRNA⁃29b调控胶质瘤发生的机制研究
侯文仲,许远鹏,毛振敏,陈子阳,曾敏敏,李在雨
[广州医科大学第六附属医院(清远市人民医院)神经外科,广东 清远511518]
目的:探讨microRNA⁃29b调控胶质瘤发生的机制.方法:利用realtime⁃PCR检测不同来源的胶质瘤组织和胶质瘤细胞中miR⁃29b的表达,MTT检测miR⁃29b对胶质瘤细胞增殖的影响;流式细胞术检测miR⁃29b对胶质瘤细胞增殖周期的影响;Western blot检测 miR⁃29b对细胞周期调控蛋白cyclin D1和cyclin E表达的影响.结果:MiR⁃29b在胶质瘤中低表达,过表达miR⁃29b能够抑制U87和U251胶质瘤细胞的增殖,miR⁃29b使得胶质瘤G1期细胞增多,S期细胞减少,并且抑制cyclin D1和cyclin E的表达.结论:MiR⁃29b能够抑制胶质瘤细胞的增殖,调控胶质瘤细胞的细胞周期,是新的胶质瘤生长抑制因子.
microRNA⁃29b;胶质瘤;增殖;细胞周期;治疗靶点
0 引言
恶性胶质瘤(malignant glioma)是严重危害人类健康的常见恶性肿瘤之一,具有发病率、复发率、死亡率高和治愈率低等“三高一低”的特点[1].手术、放化疗均不易根治,易复发,治愈率较低,患者存活期短.目前,各国科学家为了解胶质瘤的发生发展,寻找诊治手段作出了巨大努力,却始终没有取得突破性进展,恶性胶质瘤仍是医学上未被攻克的一大难题[2-4].
MicroRNA(miRNA)是一类含量丰富的非蛋白编码(non⁃protein⁃coding)小RNA,可作为负性基因调节器,能调节多种生物进程[5].近年来很多报道指出miRNAs调控胶质瘤的多种生物过程,包括胶质瘤细胞的增殖、迁移、侵袭、凋亡、干细胞维持以及应激抵抗性等[6].miRNAs表达水平的改变能够调控很多基因的表达,既包括原癌基因,也包括肿瘤抑制基因,所以miRNAs既可以作为肿瘤抑制因子,也可以作为原癌基因.研究发现,miR⁃29家族是肿瘤中重要的调控因子,miR⁃29b在多种肿瘤中低表达,对胃癌等肿瘤细胞的增殖和转移起负调控的作用,说明miR⁃29与肿瘤的发生发展密切相关.目前miR⁃29b的研究已涉及多种肿瘤,但其与胶质瘤的相关研究国内尚未见报道.本研究旨在揭示miR⁃29b对胶质瘤发生发展的调控及其作用机制.
1 材料和方法
1.1 主要试剂MTT试剂盒为日本Dojindo公司产品.碘化丙啶(propidium iodide,PI)和兔抗人cyclin D1/cyclin E多克隆抗体购自美国 Milipore公司.兔抗人β⁃actin抗体购自美国Proteintech公司.十二烷基硫酸钠、30%聚丙烯酰胺、甘氨酸、四甲基乙二胺和过硫酸铵等均购自美国Sigma公司.聚偏二氟乙烯polyvinylidene difluoride,PVDF)膜购自上海丽臣生物科技有限公司.TRIzol试剂、反转录试剂盒(天根生化).荧光定量试剂盒(北京阅微基因).miR⁃29b的引物(天根生化),U6的引物(天根生化).miR⁃29b的茎环引物:5'⁃GTCGTATCCAGTGCAGGGTCCGAG⁃GTATTCGCACTGGATACGACAA⁃3';上 游 引 物:5'⁃GCGC GCTAGCACCATTTG⁃3';下游 引 物:5'⁃CAGTGCAGGGTCCGAGGT⁃3'.U6的反转录引物:5'⁃AACGCTTCACGAATTTGCGT⁃3'; 上 游 引 物: 5'⁃CTCGCTTCGGCAGCACA⁃3';下游引物:5'⁃CTCGCT⁃TCGGCAGCACA⁃3'.
1.2 胶质瘤组织来源与细胞培养胶质瘤组织来源于广州医科大学第六附属医院2010~2015年胶质瘤手术切除胶质瘤标本.纳入标准:诊断经病理学检查证实;手术患者术前未行化疗或放疗.所有标本获取均经过伦理委员会审核批准.人神经胶质瘤细胞系U251MG和U87MG购自中国科学院细胞库,细胞系真实性均经过短串联重复序列验证.所有细胞均用高糖DMEM(Invitrogen公司,美国),添加10%的胎牛血清(GIBCO公司,美国)、100 U/mL的青霉素(NCPC公司,中国)和100 μg/mL的链霉素(NCPC公司,中国),培养环境为含5%二氧化碳的37°C细胞培养箱.
1.3 RNA提取用1 mL TRIzol的裂解50~100 mg临床组织标本;冰上用匀浆器反复研磨50次左右,待组织标本研磨至无明显结块后转移到预先标记好的1.5 mL离心管中;向组织匀浆中加入合适体积的氯仿(TRIzol∶氯仿=5∶1),混匀后室温静置5 min,12000 r/min离心20 min;离心后水相和有机相发生明显分层,小心将上层水相吸出,转移到新的1.5 mL离心管中,加入与水相等体积的异丙醇,剧烈震荡混匀,静置 10 min;然后,4℃、12000 r/min低温离心15 min.离心管底可见少量 RNA沉淀;小心移取上清,加1 mL左右的750 mL/L的乙醇,12000 r/min离心15 min;倒掉上清,将离心管倒置酒精完全挥发,用20 μL DEPC水溶解RNA,震荡混匀溶解产物;将溶解的RNA进行适当的稀释(按1∶10),并用分光光度计进行定量.
1.4 转染将细胞接种于含有 10% 胎牛血清的DMEM培养基中,5%CO2、37℃常规传代培养.细胞采用脂质体法转染,按说明书进行操作,将脂质体和mimic混合后无血清条件下孵育细胞,8 h后换成完全培养基培养.
1.5 qRT⁃PCR通过实时荧光定量 PCR(qRT⁃PCR)检测miR⁃29b在神经胶质瘤细胞、神经胶质瘤组织和创伤性脑损伤组织中的表达水平.按照试剂盒操作规程使用Trizol从冻存的组织样品和细胞中抽提总RNA.RNA用不含RNase的DNase处理(罗氏公司,瑞士).然后使用反转录试剂盒合成cDNA.荧光定量PCR使用iQ5实时PCR检测系统(Bio⁃Rad公司)检测信号.
1.6 MTT实验将1×104个细胞重悬在200 μL培养基中种到96孔板中.处理后,培养基换成200 μL含0.5 mg/mL MTT的DMEM/FBS,37°C孵育4 h.弃掉上清,细胞用200 μL DMSO 37°C裂解10 min.测量490 nm处的OD值(SpectraMax公司,美国).
1.7 细胞周期分析收集各组细胞约2×106个,PBS洗涤2次,弃上清液,缓慢向细胞沉淀中滴加1 mL预冷的70%冰乙醇,4℃固定过夜,离心,去上清液,PBS洗涤2次,0.5 mL重悬细胞,加入RNAase 200 μL,37℃ 水浴30 min,离心去上清,加入5 mg/mL的碘化丙啶1 mL,4℃ 避光染色30 min,流式细胞仪检测.
1.8 Western blotWestern blot实验步骤根据BM Chemiluminescence Western Blotting Kit操作说明进行.制好的蛋白样品,先沸水浴煮5 min,煮完后冰上快速冷却后离心5 min(12 000 r/min),然后上样.将胶上的蛋白通过电转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,400 mA、100 min于冰浴中转移.用10 g/L酪蛋白封闭液封闭1 h,一抗孵育过夜;第2天,用TBST洗涤PVDF膜2次,用封闭液稀释的二抗(HRP标记的抗兔IgG/HRP标记的抗山羊IgG)孵育PVDF膜1 h(摇床100 r/min,室温);将PVDF膜用TBST洗涤,用X光片曝光.
1.9 统计学处理采用SPSS17.0统计学软件通过单边非配对t检验对独立样本进行统计学分析.所有统计结果的定量分析均采用标准误(±SEM)进行分析,并在图中标注,P<0.05表示差异具有统计学意义.
2 结果
2.1 MiR⁃29b在胶质瘤组织中低表达研究miR⁃29b在胶质瘤中的功能,首先要检测miR⁃29b在胶质瘤中的表达水平,本研究收集了40例胶质瘤标本及对应的正常组织或癌旁组织.qRT⁃PCR检测结果发现,miR⁃29b在胶质瘤组织中的表达明显低于在正常组织和癌旁组织中的表达(图1).
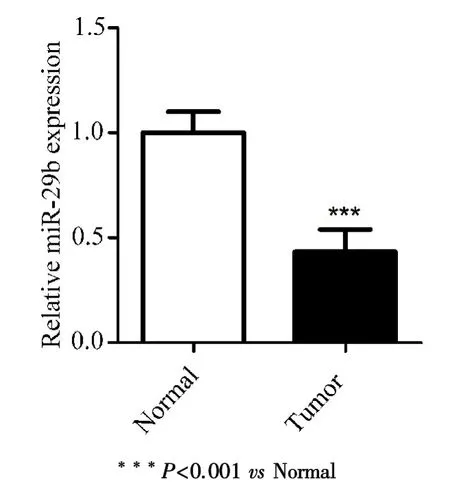
图1 MiR⁃29b在胶质瘤组织中的表达
2.2 MiR⁃29b抑制胶质瘤细胞增殖MiR⁃29b在胶质瘤组织和细胞中低表达,由此推测miR⁃29b可能在胶质瘤中起抑癌基因的功能.因此我们在 U87和U251检测了miR⁃29b对胶质瘤细胞增殖的影响(图2、3).MTT实验检测发现,miR⁃29b对U87和U251的增殖起明显的抑制作用.

图2 MiR⁃29b对U87细胞增殖的影响

图3 MiR⁃29b对U251细胞增殖的影响
2.3 MiR⁃29b对胶质瘤细胞周期的影响细胞周期实验分析发现(图4、5),在 U87和 U251细胞中,miR⁃29b组细胞在G1期所占百分率显著高于对照组,差异有统计学意义(P<0.05);同时miR⁃29b组细胞在S和G2期所占百分率显著低于对照组,差异有统计学意义(P<0.05).说明miR⁃29b具有阻滞胶质瘤细胞由G1期进入S期的功能.

图4 MiR⁃29b对U87细胞周期的影响

图5 MiR⁃29b对U251细胞周期的影响
2.4 MiR⁃29b对细胞周期蛋白表达的影响进一步检测G1/S关键调节蛋白cyclin D1和cyclin E的表达发现,在U87和U251两种胶质瘤细胞中,miR⁃29b过表达能够下调cyclin D1和cyclin E的表达(图6).

图6 MiR⁃29b对cyclin D1和cyclin E表达的影响
3 讨论
恶性胶质瘤是最常见的颅内原发性肿瘤,手术、放化疗均不易根治,易复发,治愈率较低,患者存活期短.目前,各国科学家为了解胶质瘤的发生发展,寻找诊治手段作出了巨大努力,却始终没有取得突破性进展,恶性胶质瘤仍是医学上未被攻克的一大难题.因此,寻找新的胶质瘤治疗靶标变得越来越迫切.
microRNA是一类含量丰富的非蛋白编码(non⁃protein⁃coding)小RNA,可作为负性基因调节器,能调节多种生物进程.多种人体癌症被证明与miRNA的突变或错误表达有关.microRNA可以通过靶向目标基因的3'UTR区在转录后水平抑制基因的表达[7].多种人体癌症被证明与miRNA的突变或错误表达有关.如卵巢癌、肺癌、肝癌、结肠癌和 GBM 等[8⁃14].microRNA的下调已经成为一个新的恶性肿瘤的特征,所以一些特定的microRNA具有成为肿瘤诊断和预后的生物标志物[15].
MiR⁃29家族由两个 cluster编码:miR⁃29a/miR⁃29b⁃1 cluster和miR⁃29c/miR⁃29b⁃2 cluster,分别定位于1q32.3及1q32.2.其家族的三个成员:miR⁃29a、miR⁃29b、miR⁃29c,序列高度相似,推测其功能也类似.研究证实,miR⁃29在肝癌、前列腺癌、乳腺癌等肿瘤中都不同程度地表达下调,并且参与了结肠癌由腺瘤向结肠癌发展的早期过程[16],提示其可能作为抑癌因子参与肿瘤的发生发展[17-20].本研究发现miR⁃29b在胶质瘤中低表达,并抑制胶质瘤细胞的增殖.MiR⁃29b调控胶质瘤的细胞周期,使得胶质瘤细胞停留在G1的细胞显著增多,并下调细胞周期关键调节蛋白cyclin D1和 cyclin E的表达.这些研究证明miR⁃29b可以通过细胞周期阻滞抑制胶质瘤的增殖和生长,使miR⁃29b成为未来治疗胶质瘤的潜在靶点.
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]Furnari FB,Fenton T,Bachoo RM,et al.Malignant astrocytic glioma:genetics,biology,and paths to treatment[J].Genes Dev,2007,21(21):2683-2710.
[3]Reitman ZJ,Yan H.Isocitrate dehydrogenase 1 and 2 mutations in cancer:alterations at a crossroads ofcellular metabolism[J].J Natl Cancer Inst,2010,102(13):932-941.
[4]Wolffe AP,Matzke MA.Epigenetics:regulation through repression[J].Science,1999,286(5439):481-486.
[5]Park K,Lee S,Kang E,et al.New generation of multifunctional nanoparticles for cancer imaging andtherapy[J].Adv Funct Mater,2009,19(10):1553-1566.
[6]Schroeder A,Heller DA,Winslow MM,et al.Treating metastatic cancer with nanotechnology[J].Nat Rev Cancer,2011,12(1):39-50.
[7]Ambros V.microRNAs:tiny regulators with great potential[J].Cell,2001,107(7):823-826.
[8]Nam EJ,Yoon H,Kim SW,et al.MicroRNA expression profiles in serous ovarian carcinoma[J].Clin Cancer Res,2008,14(9):2690-2695.
[9]Zhu D,Chen H,Yang X,et al.Decreased microRNA⁃224 and its clinical significance in non⁃small cell lung cancer patients[J].Diagn Pathol,2014,9:198.
[10]Yang Y,Meng H,Peng Q,et al.Downregulation of microRNA⁃21 expression restrains non⁃small cell lung cancer cell proliferation and migration through upregulation of programmed cell death 4[J].Cancer Gene Ther,2015,22(1):23-29.
[11]Yang N,Ekanem NR,Sakyi CA,et al.Hepatocellular carcinoma and microRNA:new perspectives on therapeutics and diagnostics[J].Adv Drug Deliv Rev,2015,81:62-74.
[12]Chen P,Wang BL,Pan BS,et al.MiR⁃1297 regulates the growth,migration and invasion of colorectalcancer cells by targeting cyclo⁃ox⁃ygenase⁃2[J].Asian Pac J Cancer Prev,2014,15(21):9185-9190.
[13]Zhou MK,Liu XJ,Zhao ZG,et al.MicroRNA⁃100 functions as a tumor suppressor by inhibiting Lgr5 expression in colon cancer cells[J].Mol Med Rep,2015,11(4):2947-2952.
[14]Turner JD,Williamson R,Almefty KK,et al.The many roles of mi⁃croRNAs in brain tumor biology[J].Neurosurg Focus,2010,28(1):E3.
[15]Yu SL,Chen HY,Chang GC,et al.MicroRNA signature predicts survival and relapse in lung cancer[J].Cancer Cell,2008,13(1):48-57.
[16]刘宝瑞,谢 丽.miRNA:新一代肿瘤生物标志[J].临床肿瘤学杂志,2010,15(1):1-5.
[17]Wilting SM,van Boerdonk RA,Henken FE,et al.Methylation⁃me⁃diated silencing and tumour suppressive function of hsa⁃miR⁃124 in cervical cancer[J].Mol Cancer,2010,9:167.
[18]Pang RT,Leung CO,Ye TM,et al.MicroRNA⁃34a suppresses inva⁃sion through downregulation of Notch1 and Jagged1 in cervical carci⁃noma and choriocarcinoma cells[J].Carcinogenesis,2010,31(6):1037-1044.
[19]Flavin R,Smyth P,Barrett C,et al.miR⁃29b expression is associated with disease⁃free survival in patients with ovarian serous carcinoma[J].Int J Gynecol Cancer,2009,19(4):641-647.
[20]Cortez MA,Nicoloso MS,Shimizu M,et al.miR⁃29b and miR⁃125a regulate podoplanin and suppress invasion in glioblastoma[J].Genes Chromosomes Cancer,2010,49(11):981-990.
Study on the expression and function of microRNA⁃29b in human glioma
HOU Wen⁃Zhong,XU Yuan⁃Peng,MAO Zhen⁃Min,CHEN Zi⁃Yang,ZENG Min⁃Min,LI Zai⁃Yu
Department of Neurosurgery, the Sixth Affiliated Hospital of Guangzhou Medical University(Qingyuan People's Hospital),Qingyuan 511518,China
AIM:To study the function and regulation mecha⁃nism of miRNA⁃29b in hunman glioma.METHODS:Realtime PCR was used to detect miR⁃29b expression in glioma tissues,and MTT was used to detect the influence of miR⁃29b on glioma cell proliferation.Flow cytometry was used to detect the influence of miR⁃29b on cell cycle;Western blot was used to detect the influence of miR⁃29b on the expression of cyclin D1 and cyclin E.RESULTS:MiR⁃29b was low expression in glioma tissues,and overexpression of miR⁃29b could inhibit the proliferation of U87 and U251 glioma cells.miR⁃29b can increase the number of G1 phase cells and reduce the number of S phase cells,and inhibit the expression of cyclin D1 and cyclin E.CONCLUSION:MiR⁃29b can regulate glioma cell cycle,inhibit the proliferation of gli⁃oma cells,and miR⁃29b may be a tumor suppressor gene in human glioma.
microRNA⁃29b;glioma;proliferation;cell cycle;therapy target
R739.41
A
2095⁃6894(2017)07⁃44⁃04
2017-05-15;接受日期:2017-05-30
清远市科技计划项目(2016B025)
侯文仲.博士.E⁃mail:harzard@sina.com
