硫酸乙酰肝素蛋白聚糖在胶质母细胞瘤肿瘤微环境中的作用研究进展
2017-09-03纪青,常青,2
纪 青,常 青,2
(北京大学:1医学部基础医学院病理系,2第三医院病理科,北京100191)
·专家述评·
硫酸乙酰肝素蛋白聚糖在胶质母细胞瘤肿瘤微环境中的作用研究进展
纪 青1,常 青1,2
(北京大学:1医学部基础医学院病理系,2第三医院病理科,北京100191)
胶质母细胞瘤(GBM)是一种呈弥漫性生长的高度恶性胶质细胞瘤.肿瘤微环境在GBM的生长中起重要作用.硫酸乙酰肝素蛋白聚糖(HSPG)是GBM肿瘤微环境中的重要成分之一.它通过与不同蛋白配体的相互作用,可以调控一系列配体介导的信号通路,通过对肿瘤细胞、血管内皮细胞以及免疫细胞的不同作用来促进GBM的形成和发展.HSPG的修饰酶,HPSE和SULF,也可以通过对HSPG上硫酸乙酰肝素黏多糖链的修饰作用来调节相关细胞信号通路,调节肿瘤的生长.在前神经元型和间质型GBM中,HSPG及其修饰酶的表达有明显的差异性,以其在GBM中的亚型特异性为基础,发展针对不同亚型的特异性治疗将有利于改善患者的治疗效果.正在开展的以 HSPG为治疗靶点的 PG545、OKN⁃007、M402和SST0001等药物的相关临床前研究将为GBM患者开展精准治疗提供新策略.
胶质母细胞瘤;硫酸乙酰肝素蛋白聚糖;肿瘤微环境
0 引言
胶质母细胞瘤(glioblastoma,GBM)是一种呈弥漫性生长的高度恶性胶质细胞瘤.它是成人中最常见的一种恶性脑肿瘤.在WHO 2016版中枢神经系统肿瘤分类中,GBM被分为IDH野生型、IDH突变型和NOS型.最新研究表明,以IDH1基因为靶点治疗白血病有良好的效果[1].但是IDH抑制剂AG⁃120和AG221治疗IDH突变型胶质瘤尚未得到理想的三期临床试验结果,仍需深入探索相关的分子机制,从而改善治疗方案,取得更佳治疗效果[2].
与WHO分型不同,The Cancer Genome Atlas(TCGA)的研究者基于患者年龄、预后、基因型及积极治疗的效果,将GBM进一步分为四个亚型,分别为经典型(classical)、前神经元型(proneual)、间质型(mesenchymal)和神经元型(neural)[3].不同亚型受不同信号通路的调控(图1).有研究者发现,在以PDGFR信号通路改变为特征的前神经元型GBM中,硫酸酯酶2(sulfatase 2,SULF 2)有较高表达[4].而间质型GBM中乙酰肝素酶(heparanase,HPSE)的表达最多,并且多个硫酸乙酰肝素蛋白聚糖(heparan sul⁃fate proteoglycan,HSPG)相关基因的表达也有所增加[5].而前二者(SULF2和HPSE)是后者(HSPG)的修饰酶.
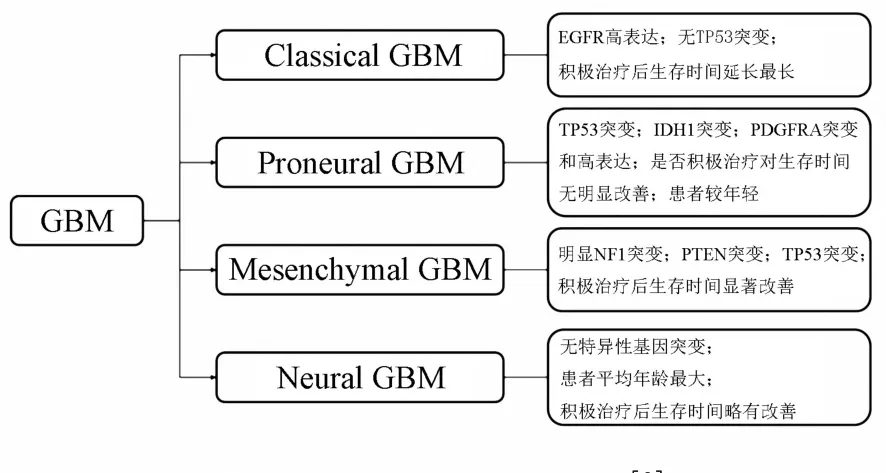
图1 GBM的TCGA分型[3]
有研究表明,GBM的发生与肿瘤微环境(tumor microenvironment,TME)关系密切[6-7].TME由肿瘤周围细胞及包括肿瘤细胞在内的所有细胞分泌的各种可溶性因子构成.TME提供了一个促肿瘤形成的环境,使肿瘤和非肿瘤细胞的各种代谢反应发生改变,从而帮助肿瘤组织与非肿瘤组织竞争营养物质及其缺乏的相关分子,使肿瘤组织即使在缺氧的环境下也能继续生长[8].此外,肿瘤微环境中的这些代谢异常还能抑制针对肿瘤细胞的免疫反应,并帮助肿瘤组织抵抗治疗[10].
HSPG是肿瘤微环境中的一种重要蛋白,与GBM的发展密切相关[6-7].HSPG及其修饰酶通过与肿瘤微环境中不同信号分子的相互作用调控相关信号通路,改变肿瘤周围的代谢反应.而HSPG修饰酶在GBM不同亚型中的差异性表达提示HSPG可能具有GBM亚型特异性.基于HSPG在肿瘤微环境中的重要作用,有望发展出针对不同亚型GBM的特异性分子诊断和治疗方法,改善GBM的治疗效果.
本文将从HSPG的功能到其与肿瘤微环境的关系展开讨论,探讨HSPG在GBM临床诊断与治疗中的应用前景.
1 HSPG在人类肿瘤中的生物学功能
HSPG是一种蛋白聚糖,由一个核心蛋白和与核心蛋白相连的HS粘多糖链组成.Protein Atlas数据库显示,HSPG广泛存在于多个人体器官和组织的细胞中,在小脑、骨髓、心肌、乳腺、前列腺等器官和脂肪组织以及软组织中均有较高表达,是正常脑组织和GBM中主要的细胞外环境成分[9-11].通过结合生长因子、趋化因子、成形素(morphogens)、基质蛋白、细胞粘附分子和蛋白酶等蛋白配体,如核转录因子κB(nuclear factor of κB,NF⁃κB)、血小板生长因子(platelet⁃derived growth factor,PDGF)、成纤维母细胞生长因子(fibroblast growth factor,FGF)等,HSPG可以阻断配体与其受体结合,防止其接触同源受体以减少信号传播,或者作为信号传播的共同受体促进信号传播,从而发挥调节细胞增殖、迁移和粘附的功能[9-14].
以分泌蛋白Wnt家族的细胞外调控为例,从细胞中释放后,Wnt配体会被HSPG等细胞外蛋白结合并隔离,只有当配体从HSPG上释放时,才可以结合并激活Frizzled受体[14],从而发挥其调节细胞增殖的作用.而另一方面,HSPG也可以作为配体介导的信号通路的共同受体来促进信号的传播,例如具有细胞增殖、存活、迁移和分化等广泛的生物学效应的FGF信号通路.在这一信号通路中,HSPG就起到了稳定FGF配体受体复合物的作用[15-18].
HSPG在调控针对肿瘤的免疫反应中也发挥着重要作用.HSPG的HS链结合L选择素后,能够稳定白细胞的滚动,使其粘附于上皮.HSPG还能将细胞因子呈递给受体,比如巨噬细胞释放的CXC细胞因子配体8(CXC⁃chemokine ligand 8,CXCL8),从而激活白细胞的整合蛋白,并促进更多稳定白细胞的粘附.此外,HSPG还能通过结合激肽原(kininogen)等蛋白协助白细胞的跨内皮运动(transendothelial migration),调控血管的渗透性[19].
HSPG相关酶在其生物学功能的发挥中也起到了重要作用.如上所述,HSPG由核心蛋白和HS链构成.HS链由以重复双糖为单位的碳水化合物链组成,经过广泛的转录后修饰才能实现调控细胞信号传导的功能.其中,葡萄糖胺6O的硫酸化是HSPG与生长因子结合以及介导组织正常发育的重要决定因素[20-21].细胞外的硫酸酯酶SULF1和SULF2,通过去除HS链6O上的硫基和调控细胞外环境HSPG的蛋白配体,可以激活众多关键的信号通路,包括Wnt、Shh及PDGF信号通路等[14,22-24].
通过采用确定基础数法来开展预算编制工作,能够防止企业财务信息不对称现象出现,引导预算体系将预算目标管理中各个问题加以处理。在企业运营发展过程中,大部分企业都会面临财务信息不对称现象,使得企业财务预算管理目标和实际状况脱节。在实际中,频频出现“讨价还价”状况,使得预算编制工作过于形式化。所以,企业需要采用确定基数法来实现预算管理,利用委托管理方式,给代理人及委托人提供对应的预算指标,并在函数加权平均法的引导下,对企业预算指标进行明确。假设企业在年末最终获取的效益小于预算标准,则可以根据有关规章体系给代理人提出相应处理,反之则给予适当激励。
另外,HPSE还是一种重要的HSPG相关酶.它是一种能够促进HS链片段生物活性的葡萄糖醛酸糖苷酶.白细胞需要HPSE的帮助来溶解内皮细胞基底膜.在溶解基底膜时,HPSE可以释放 VEGF和FGF2等一系列生长因子,这些生长因子最终会介导血管生成和组织重构,引起慢性炎症反应[19](图2).在对髓母细胞瘤(medulloblastoma)病理机制的研究中发现HPSE能够调控Shh和Wnt 3信号通路,而在GBM等多种恶性肿瘤中,HPSE的水平均有所上调,这说明HPSE的水平与肿瘤的形成和侵袭有关[25-26].
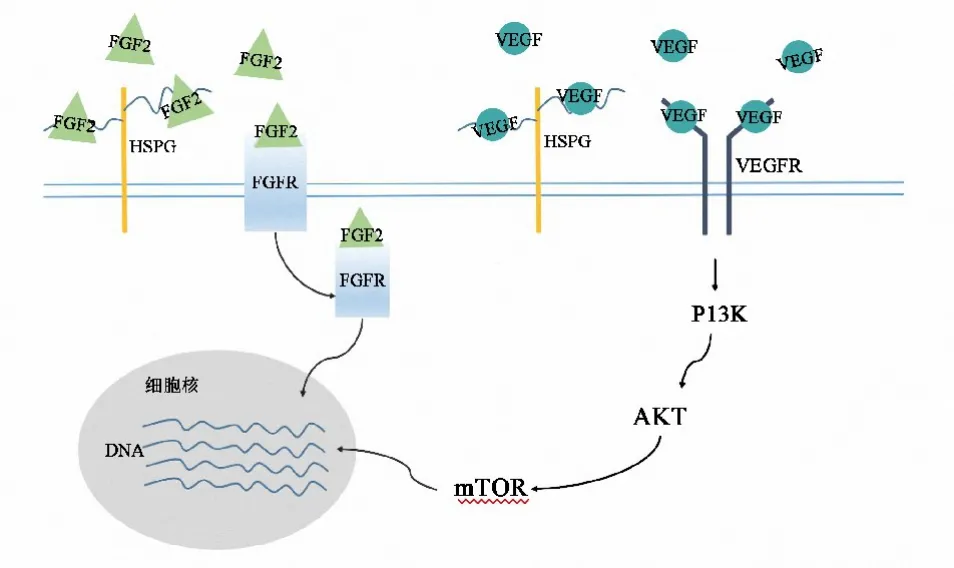
图2 FGF2被分泌到细胞表面后可以与FGFR和HSPG相连,VEGF被分泌到细胞表面后可以与VEGFR和HSPG相连,在HPSE的作用下,FGF2和VEGF从HSPG上释放,最终介导血管生成和组织重构.
除了HSPG相关酶,HSPG的核心蛋白在细胞信号传导中也起着重要作用.核心蛋白决定了蛋白聚糖的定位,从而影响细胞内外的信号传导.以粘结合蛋白聚糖(syndecans,SDCs)和磷脂酰肌醇聚糖 1(phosphatidylinositol glycan,GPC⁃1)为例:SDCs包含一个连接细胞骨架蛋白的胞浆结构域,与细胞膜相连,可以作为酶底物介导细胞信号传播[27].粘结合蛋白多糖⁃1(syndecan⁃1,SDC1)是细胞表面HSPG核心蛋白SDCs的一种,调控SDC1的表达水平能够改变HGF⁃Met和Wnt信号的传导,这说明SDCs在细胞信号传导、细胞粘附和迁移中起重要作用[28-30].而GPC⁃1则是通过GPI与细胞膜连接.在人类胰腺癌中,GPC⁃1的表达发生了减少或消失,从而减少了其对FGF2和HB⁃EGF的作用,减弱了下游MAPK信号及肿瘤增殖和血管生成因子,最终使体内肿瘤的生长和转移受到抑制[31].
2 HSPG在GBM中的研究现状
2.1 HSPG与肿瘤微环境有研究表明,在肿瘤对TME主要应激因素的适应反应中,HSPG可能起到重要的作用.由于失去控制的增殖与活性,恶性肿瘤细胞常有严重的缺氧和酸性应激,从而引起TME结构和功能的异常.GBM细胞系U87⁃MG中,缺氧和酸中毒对LDL摄取的影响可被肝素有效的逆转.LDL和VLDL能引起ERK1/2磷酸化,导致ERK/MAPK通路的激活,该激活在缺氧环境下更为显著,而在HSPG缺陷细胞中,缺氧导致的ERK1/2磷酸化则被削弱[32].该研究结果证明缺氧时肿瘤细胞对脂蛋白的摄取高度依赖完整的 HSPG表达和 HS硫化水平[33].
此外,从肿瘤细胞表面脱落的SDC1与血管内皮生长因子(vascular endothelial growth factor,VEGF)的结合能够促进内皮的侵袭和血管形成[34].对小鼠内皮细胞进行条件性敲除实验使HSPG成分减少,肿瘤中FGF2和VEGF信号的传导将随之降低,而小鼠体内肿瘤的血管形成也将减少[35].有趣的是,在这些被敲除了基因的小鼠正常发育的组织中,血管的形成并未受到影响,这提示我们可通过肿瘤组织与正常组织中蛋白聚糖的不同,特异性地抑制肿瘤的血管形成而不损伤正常组织的血管[34].
2.2 HSPG的修饰酶与肿瘤微环境HPSE、SULF1
以及SULF2已经被证明可以通过其酶修饰作用影响一系列介导肿瘤生长和进展的蛋白.这三种酶通过以下信号通路发挥其作用.
首先,HPSE和SULF通过修饰HSPG的HS链来改变HSPG相关的信号分子及其受体[7].HPSE对HS链的切除作用能够增加VEGF和FGF2等信号分子的溶解度,从而促进一系列促肿瘤生长的信号通路,如血管形成、细胞增殖和侵袭等,并可抑制肿瘤的凋亡和转移[7,34,36].而SULF1和SULF2对肿瘤的作用相反,其通过降低FGF2,VEGF,双调蛋白(amphi⁃regulin),HB⁃EGF和HGF等信号蛋白对血管内皮HS的亲和性减弱这些与HS结合的生长因子的信号传导作用[37-38].在 GBM中,敲除 SULF2会降低多种RTK信号通路的活性[39],包括 PDGFR⁃α,IGF1R⁃β和EPHA2这三条被认为与星形胶质瘤生长和侵袭有关的通路[26,40-41].此外,在相关的星形胶质瘤小鼠模型中观察到,SULF2的脱落会导致PDGFR⁃α的活性降低,并减少肿瘤细胞的增殖,延长宿主的生存时间[39].这些数据表明SULF2的表达对GBM的进展十分重要.
另外,HPSE和SULF2还能够调控HSPG在细胞表面的表达,由此促进 HS依赖的信号传导.如SULF2能通过上调细胞表面蛋白聚糖3的水平激活Wnt信号通路,从而促进Wnt⁃Frz复合体的形成,增强Wnt⁃β⁃连环素信号通路[42].同样,HPSE也能通过促进细胞表面HSPG的表达增强FGF2、Wnt和FGF等信号通路的传导[28,30,45].
最新研究显示,HPSE还能激活肿瘤细胞外泌体的形成.肿瘤细胞外泌体是与脂膜相连的细胞外囊泡,它能够促进肿瘤细胞和周围细胞的联系,帮助修饰肿瘤微环境,从而促进肿瘤的生长和播散[46].另有研究发现,给予GL261小鼠 GBM细胞重组 HPSE(recombinant HPSE,rHPSE)能够增强肿瘤细胞聚集和生存能力,而给予其HPSE抑制剂PG545处理则会减弱GBM的生长和繁殖[47].与野生型小鼠相比,GBM在HPSE转基因小鼠中生长更快,而在HPSE基因敲除小鼠中生长更慢,提示HPSE的水平决定GBM的成瘤能力.而HPSE基因敲除小鼠脑肿瘤周围的胶质瘢痕比野生型小鼠脑内的要薄,说明HPSE的缺乏可能会影响宿主脑内星形胶质细胞和小胶质细胞迁移到肿瘤微环境的能力[5].
2.3 HSPG是GBM潜在的诊断及判断预后的生物标记物已有研究显示,HSPG可以作为血液中的生物标记物.Kundu等[5]通过对182例患者的观察以及含有不同数量HPSE的小鼠模型的研究发现,HPSE在各级胶质瘤中的表达都比在正常脑组织中的高,其中,高级别肿瘤相对于低级别肿瘤表达高.此外,HPSE蛋白表达低(<75%)的患者3年生存率显著高于蛋白表达高的患者(>75%),HPSE表达最低的人群生存率最高.
如上文所述,HSPG的核心蛋白SDCs在细胞信号传导中起到了重要的作用.值得注意的是,脱落SDC的胞外域可以在血浆或血清样本中被检测到,因此可以将其作为检测肿瘤恶性程度的生物标记物[7].另外,可以利用细胞表面SDCs的水平来判断GBM患者的预后.Xu等[48]从基因和蛋白水平上分析了116例胶质瘤患者SDC1的表达,并且比较了其表达与肿瘤级别和患者预后的关系.结果证明高SDC1蛋白水平是胶质瘤患者预后较差的一个独立判断指标[48].
3 研究现状与展望
HSPG及其修饰酶是肿瘤微环境中重要的信号调控分子.HSPG能够与受体竞争相关蛋白配体,抑制信号传播,或者作为共同受体促进信号的传递,从而调控相关的细胞信号通路,并调节肿瘤细胞的增殖、迁移和粘附.此外,它还能通过对VEGF相关信号通路的调控,介导肿瘤中的血管形成.HSPG的修饰酶(HPSE和SULF)可通过修饰HSPG的HS链来影响肿瘤微环境中的信号通路,并调控HSPG在细胞表面的表达,促进信号的传导.HPSE还可以促进SDC1从细胞表面的脱落和激活肿瘤外泌体的形成.HPSE与SULF能够促进GBM中多种RTK信号通路的活性,在肿瘤细胞的发展中起重要作用.同时,HSPG的核心蛋白也能够作为酶底物与细胞膜相连,从而介导细胞信号的传播.
HSPG在GBM肿瘤微环境中重要的信号调控作用提示我们其作为GBM治疗靶点的可行性.通过HSPG,可以调控与肿瘤相关的下游信号通路,从而抑制肿瘤的发生.此外,HSPG及其修饰酶在前神经元型和间质性GBM中表达的显著不同,说明HSPG具有该肿瘤亚型特异性.因此,可将其作为GBM不同亚型的潜在治疗靶点.前文提到的PG545就是一种能抑制GL261肿瘤生长的HPSE抑制物,与之相似,SULF2抑制剂OKN⁃007能显著降低GL261小鼠胶质瘤模型中VEGFR⁃2的水平,从而减少肿瘤血管的生成.SST0001也是一种HPSE抑制剂,目前正处于多发性骨髓瘤的临床Ⅰ期实验中[49].此外,目前正处于胰腺癌的临床Ⅱ期实验中的HS类似物M402(图3),其临床前研究结果显示它可以抑制体内肿瘤细胞和宿主细胞的功能,减少肿瘤中微血管的密度[50].诸多HSPG修饰酶抑制剂的临床前研究预示了其临床治疗前景,有力证明了以HSPG为治疗靶点的可行性.
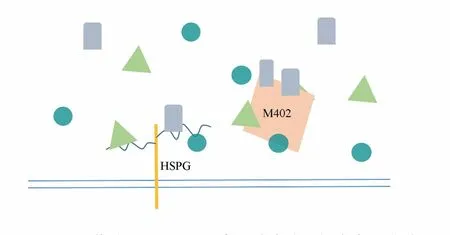
图3 M402作为硫酸乙酰肝素的类似物,能竞争性抑制HS与配体的连接
大量关于GBM相关分子研究的进展为我们提供了基因靶向治疗的思路.HSPG的实验室研究及临床前研究结果预示了其良好的靶向治疗前景.构建能够反映GBM遗传异质性的模型,加深对HSPG在不同亚型GBM中的功能和致病机制的认识,使其转化到临床应用中,最终为GBM患者开展精准治疗提供新策略.
[1]Saygin C,Carraway HE.Emerging therapies for acute myeloid leuke⁃mia[J].J Hematology Oncol,2017,10(1):93.
[2]Szopa W,Burley TA,Kramer⁃Marek G,et al.diagnostic and thera⁃peutic biomarkers in glioblastoma:current status and future perspec⁃tives[J].Biomed Res Int,2017,2017:8013575.
[3]Verhaak RGW,Hoadley KA,Purdom E,et al.An integrated genomic analysis identifies clinically relevant subtypes of glioblastoma charac⁃terized by abnormalities in PDGFRA,IDH1,EGFR and NF1[J].Cancer Cell,2009,17(1):98.
[4]Phillips HS,Kharbanda S,Chen R,et al.Molecular subclasses of high⁃grade glioma predict prognosis,delineate a pattern of disease progression,and resemble stages in neurogenesis[J].Cancer Cell,2006,9(3):157-173.
[5]Kundu S,Xiong A,Spyrou A,et al.Heparanase promotes glioma progression and is inversely correlated with patient survival[J].Mol Cancer Res,2016,14(12):1243-1253.
[6]Phillips JJ.Novel therapeutic targets in the brain tumor microenviron⁃ment[J].Oncotarget,2012,3(5):568-575.
[7]Hammond E,Khurana A,Shridhar V,et al.The role of heparanase and sulfatases in the modification of heparan sulfate proteoglycans within the tumor microenvironment and opportunities for novel cancertherapeutics[J].Front Oncol,2014,4:195.
[8]Justus CR,Sanderlin EJ,Yang LV.Molecular connections between cancer cell metabolism and the tumor microenvironment[J].Int J Mol Sci,2015,16(5):11055-11086.
[9]Watanabe A,Mabuchi T,Satoh E,et al.Expression of syndecans,a heparan sulfate proteoglycan,in malignant gliomas:participation of nuclear factor⁃kappa B in upregulation of syndecan⁃1 expression[J].J Neurooncol,2006,77(1):25-32.
[10]Smith EM,Mitsi M,Nugent MA,et al.PDGF⁃A interactions with fibronectin reveal a critical role for heparan sulfate in directed cell migration during Xenopus gastrulation[J].Proc Natl Acad Sci U S A,2009,106(51):21683-21688.
[11]Feyzi E,Lustig F,Fager G,et al.Characterization of heparin and heparan sulfate domains binding to the long splice variant of platelet⁃derived growth factor a chain[J].J Biol Chem,1997,272(9):5518-5524.
[12]Kreuger J,Salmivirta M,Sturiale L,et al.Sequence analysis of heparan sulfate epitopes with graded affinities for fibroblast growth factors 1 and 2[J].J Biol Chem,2001,276(33):30744-30752.
[13]Ashikari⁃Hada S,Habuchi H,Kariya Y,et al.Characterization of growth factorbinding structures in heparin/heparan sulfate using an octasaccharide library[J].J Biol Chem,2004,279(13):12346-12354.
[14]Dhoot GK,Gustafsson MK,Ai X,et al.Regulation of Wnt signaling and embryo patterning by an extracellular sulfatase[J].Science,2001,293(5535):1663-1666.
[15]Turner N,Grose R.Fibroblast growth factor signalling:from devel⁃opment to cancer[J].Nat Rev Cancer,2010,10(2):116-129.
[16]Rapraeger AC,Krufka A,Olwin BB.Requirement of heparan sulfate for bFGF⁃mediated fibroblast growth and myoblast differentiation[J].Science,1991,252(5013):1705-1708.
[17]Ford⁃Perriss M,Guimond SE,Greferath U,et al.Variant heparan sulfates synthesized in developing mouse brain differentially regulate FGF signaling[J].Glycobiology,2002,12(11):721-727.
[18]Goodger SJ,Robinson CJ,Murphy KJ,et al.Evidence that heparin saccharides promote FGF2 mitogenesis through two distinct mecha⁃nisms[J].J Biol Chem,2008,283(19):13001-13008.
[19] Parish CR.The role of heparan sulphate in inflammation[J].Nat Rev Immunol,2006,6(9):633-643.
[20]Kamimura K,Fujise M,Villa F,et al.Drosophila heparan sulfate 6⁃O⁃sulfotransferase(dHS6ST) gene.Structure,expression,and function in the formation of the tracheal system[J].J Biol Chem,2001,276(20):17014-17021.
[21]Habuchi H,Habuchi O,Kimata K.Sulfation pattern in glycosamin⁃oglycan:does it have a code[J].Glycoconj J,2004,21(1-2):47-52.[22]Ai X,Do AT,Lozynska O,et al.QSulf1 remodels the 6⁃O sulfation states of cell surface heparan sulfate proteoglycans to promote Wnt signaling[J].J Cell Biol,2003,162(2):341-351.
[23]Danesin C,Agius E,Escalas N,et al.Ventral neural progenitors switch toward an oligodendroglial fate in response to increased Sonic hedgehog(Shh)activity:involvement of Sulfatase 1 in modulating Shh signaling in the ventral spinal cord[J].J Neurosci,2006,26(19):5037-5048.
[24]Ai X,Kitazawa T,Do AT,et al.SULF1 and SULF2 regulate hepa⁃ran sulfate⁃mediated GDNF signaling for esophageal innervation[J].Development,2007,134(18):3327-3338.
[25]Hong X,Nelson KK,deCarvalho AC,et al.Heparanase expression of glioma in human and animal models[J].J Neurosurg,2010,113(2):261-269.
[26]Ridgway LD,Wetzel MD,Marchetti D.Heparanase modulates Shh and Wnt3a signaling in human medulloblastoma cells[J].Exp Ther Med,2011,2(2):229-237.
[27]Rapraeger AC.Syndecan⁃regulated receptor signaling[J].J Cell Biol,2000,149(5):995-998.
[28]Derksen PW,Keehnen RM,Evers LM,et al.Cell surface proteoglycan syndecan⁃1 mediates hepatocyte growth factor binding and promotes Met signaling in multiple myeloma[J].Blood,2002,99(4):1405-1410.
[29]Ramani VC,Yang Y,Ren Y,et al.Heparanase plays a dual role in driving hepatocyte growth factor(HGF) signaling by enhancing HGF expression and activity[J].J Biol Chem,2011,286(8):6490-6499.
[30]Alexander CM,Reichsman F,Hinkes MT,et al.Syndecan⁃1 is required for Wnt⁃1⁃induced mammary tumorigenesis in mice[J].Nat Genet,2000,25(3):329-332.
[31]Whipple CA,Young AL,Korc M.A Kras(G12D)⁃driven genetic mouse model of pancreatic cancer requires glypican⁃1 for efficient proliferation and angiogenesis[J].Oncogene,2011,31(20):2535-2544.
[32]Christianson HC,Svensson KJ,van Kuppevelt TH,et al.Cancer cell exosomes depend on cell⁃surface heparan sulfate proteoglycans for their internalization and functional activity[J].Proc Natl Acad Sci U S A,2013,110(43):17380-17385.
[33]Menard J,Christianson HC,Kucharzewska P,et al.Metastasis stim⁃ulation by hypoxia and acidosis⁃induced extracellular lipid uptake is mediated by proteoglycan⁃dependent endocytosis[J].Cancer Res,2016,76(16):4828-4840.
[34]Ferreras C,Rushton G,Cole CL,et al.Endothelial heparan sulfate 6⁃o⁃sulfation levels regulate angiogenic responses of endothelial cells to fibroblast growth factor 2 and vascular endothelial growth factor[J].J Biol Chem,2012,287(43):36132-36146.
[35]Fuster MM,Wang L,Castagnola J,et al.Genetic alteration of endo⁃thelial heparan sulfate selectively inhibits tumor angiogenesis[J].J Cell Biol,2007,177(3):539-549.
[36]Tan KW,Chong SZ,Wong FH,et al.Neutrophils contribute to in⁃flammatory lymphangiogenesis by increasing VEGF⁃A bioavailability and secreting VEGF⁃D[J].Blood,2013,122(22):3666-3677.
[37]Lai J,Chien J,Staub J,et al.Loss of HSulf⁃1 up⁃regulates heparin⁃binding growth factor signaling in cancer[J].J Biol Chem,2003,278(25):23107-23117.
[38]Narita K,Staub J,Chien J,et al.HSulf⁃1 inhibits angiogenesis and tumorigenesis in vivo[J].Cancer Res,2006 66(12):6025-60232.
[39]Lerner I,Hermano E,Zcharia E,et al.Heparanase powers a chronic inflammatory circuit that promotes colitis⁃associated tumorigenesis in mice[J].J Clin Invest,2011,121(5):1709-1721.
[40]Carapancea M,Cosaceanu D,Budiu R,et al.Dual targeting of IGF⁃1R and PDGFR inhibits proliferation in highgrade gliomas cells and induces radiosensitivity in JNK⁃1 expressing cells[J].J Neurooncol,2007,85(3):245-254.
[41] Liu TJ,LaFortune T,Honda T,et al.Inhibition of both focal adhesion kinase and insulin⁃like growth factor⁃I receptor kinase suppresses glioma proliferation in vitro and in vivo[J].Mol Cancer Ther,2007,6(4):1357-1367.
[42]Lai JP,Sandhu DS,Yu C,et al.Sulfatase 2 up⁃regulates glypican 3,promotes fibroblast growth factor signaling,and decreases survival in hepatocellular carcinoma[J].Hepatology,2008,47(4):1211-1222.
[43]Purushothaman A,Chen L,Yang Y,et al.Heparanase stimulation of protease expression implicates it as a master regulator of the aggressive tumor phenotype in myeloma[J].J Biol Chem,2008,283(47):32628-32636.
[44]Purushothaman A,Uyama T,Kobayashi F,et al.Heparanase⁃en⁃hanced shedding of syndecan⁃1 by myeloma cells promotes endothelial invasion and angiogenesis[J].Blood,2010,115(12):2449-2457.
[45]Filla MS,Dam P,Rapraeger AC.The cell surface proteoglycan syn⁃decan⁃1 mediates fibroblast growth factor⁃2 binding and activity[J].J Cell Physiol,1998,174(3):310-321.
[46]Atay S,Godwin AK.Tumor⁃derived exosomes:a message delivery system for tumor progression[J].Commun Integr Biol,2014,7(1):e28231.
[47]Hammond E,Handley P,Dredge K,et al.Mechanisms of hepara⁃nase inhibition by the heparan sulfate mimetic PG545 and three structural analogues[J].FEBS Open Bio,2013,3(1):346-351.
[48]Xu Y,Yuan J,Zhang Z,et al.Syndecan⁃1 expression in human glioma is correlated with advanced tumor progression and poor prognosis[J].Mol Biol Rep,2012,39(9):8979-8985.
[49]Souza PC,Smith N,Pody R,et al.OKN⁃007 decreases VEGFR⁃2 levels in a preclinical GL261 mouse glioma model[J].Am J Nucl Med Mol Imaging,2015,5(4):363-378.
[50]Zhou H,Roy S,Cochran E,et al.M402,a novel heparan sulfate mimetic,targets multiple pathways implicated in tumor progression and metastasis[J].PloS One,2011,6(6):e21106.
消 息
《转化医学电子杂志》征订启事
《转化医学电子杂志》是经国家新闻出版广电总局批准,中国人民解放军总后勤部主管,第四军医大学出版社主办,唐都医院承办的以光盘(CD⁃ROM)附纸质导读形式公开发行的医学电子专业学术期刊(月刊).图文声像并茂,报道信息容量大,具有很强的互动性.以全国各级医疗机构临床医护工作者、医教科研人员及医药卫生管理者为主要读者对象,开展学术交流,服务军队和地方医学事业发展.设置的栏目有专家视野(述评)、基础与转化医学、预防与转化医学、生物医学工程与转化医学、临床与转化医学、短篇报告、医学教育、综述、转化医学动态与咨讯、转化医学多媒体课件等.
本刊为月刊,大16开,96页,每月最后一日出版.中国标准连续出版物号:ISSN 2095⁃6894,CN 61⁃9000/R.每期定价20元(含光盘和纸质),全年定价240元.可向编辑部订阅.
编辑部地址:陕西省西安市灞桥区新寺路569号第四军医大学唐都医院《转化医学电子杂志》编辑部;
邮政编码:710038;
联系电话:029⁃84778169;
传真:029⁃84778169.
Research progresson effectsofheparan sulfate proteoglycans in GBM tumor micro⁃environment
JI Qing1,CHANG Qing1,2
1Department of Pathology,School of Basic Medical Sciences,Peking University Health Science Center,2Department of Pathology,Peking University Third Hospital,Beijing 100191,China
Glioblastoma(GBM)is a highly malignant glioma,diffusely invading brain tissue.Tumor microenvironment(TME)plays a critical role in the progression of GBM.Heparan sulfate proteoglycan(HSPG)is one of the important components in the TME of GBM.HSPGs can regulate the activity of several ligand⁃mediated signaling pathways by interacting with various protein ligands.HPSE and SULF,the modification enzymes of HSPGs,can also regulate signaling pathways and modulate the growth of tumor via enzymatic alteration of heparan sulfate chains.There are subtype⁃specific expressions of the modulation enzymes of HSPGs between proneual and mesenchymal GBM.Based on this charac⁃teristic,HSPGs will improve the treatment effect through the development subtype⁃specific therapy.Actually,HSPGs⁃targeted medicines such as PG545,OKN⁃007,M402 and SST0001 have acquired promising results of preclinical experiments,which shed lights in the precision medicine on GBM patients.
glioblastoma;heparan sulfate proteoglycans;tumor microenvironment
R739.41
A
2095⁃6894(2017)07⁃01⁃06
2017-05-02;接受日期:2017-05-17
国家自然科学基金资助项目(81101900);(能力提高)国家基础科学人才培养基金(J1030831/J0108)
纪 青.E⁃mail:sy.1995@foxmail.com
常 青.博士,副教授.研究方向:神经系统肿瘤的诊断与分子病理研究.E⁃mail:qingchang@bjmu.edu.cn
