三种用于血液透析和相关治疗用水微生物学监测方法的评价
2017-08-23钱雪峰乔美珍金美娟马文霞
钱雪峰,乔美珍,金美娟,马文霞,杨 波
(1 苏州大学附属第一医院,江苏 苏州 215006; 2 苏州市疾病预防控制中心,江苏 苏州 215006)
·论著·
三种用于血液透析和相关治疗用水微生物学监测方法的评价
钱雪峰1,乔美珍1,金美娟1,马文霞1,杨 波2
(1 苏州大学附属第一医院,江苏 苏州 215006; 2 苏州市疾病预防控制中心,江苏 苏州 215006)
目的评价三种方法用于监测血液透析和相关治疗用水微生物检测的效果。方法在某次飞行检查中采集36所受检单位的血液透析液和透析用水72份,分别采用血琼脂平皿(35℃,72 h)、胰蛋白酶大豆琼脂(TSA)平皿(35℃,72 h)、R2A营养琼脂(23℃,168 h)三种方法进行培养,比较三种方法菌落计数、菌落和超干预值(≥50 CFU/mL)检出率的差异。结果采用三种方法对透析液和透析用水进行检测,血琼脂平皿、TSA平皿、R2A营养琼脂菌落检出率分别为40.28%、63.89%和69.44%,差异有统计学意义(χ2=14.16,P<0.05);两两比较结果显示,R2A营养琼脂和TSA平皿检出率高于血琼脂平皿。血琼脂平皿与R2A营养琼脂、TSA与R2A营养琼脂检出菌落计数比较,差异有统计学意义(Z值分别为-4.515、-6.970,均P<0.05)。血琼脂平皿、TSA平皿、R2A营养琼脂法检测透析液和透析用水菌落数,超干预值检出率分别为1.39%、4.17%和20.83%,差异有统计学意义(χ2=19.83,P<0.05),R2A营养琼脂检出率高于其他两种方法。结论R2A营养琼脂和TSA平皿检出率优于血琼脂平皿,R2A营养琼脂超干预值检出率高于TSA平皿和血琼脂平皿,R2A营养琼脂(23℃,168 h)用于血液透析和相关治疗用水微生物监测优于其他两种方法。
血液透析; 透析液; 透析用水; 微生物学监测
[Chin J Infect Control,2017,16(8):698-701]
以代谢方式来分类,细菌可分为蓝细菌、自养菌和异养菌,水生细菌即是乏营养异养菌。能在透析液和透析用水中检测到的细菌主要是革兰阴性非发酵菌,如假单胞菌属、寡养单胞菌属、伯克霍尔德菌属、无色杆菌属、不动杆菌属、罗尔斯通菌属、土壤杆菌属等。革兰阳性菌相对较少,主要为棒状杆菌属和肠球菌属。真菌所占比例低于细菌,主要为近平滑假丝酵母菌和暗色丝状真菌[1]。血液透析患者如果每周透析3次,每次接触150 L透析液,每年将暴露于20 000 L以上的透析液中。患者若接受血液透析滤过治疗,每年至少会有3 000 L以上的液体进入血液循环系统[2]。如果透析液或透析用水中微生物含量超标,微生物就有机会通过透析膜进入血液。血液透析和治疗用水中细菌短期严重污染会导致菌血症,甚至败血症,即使低水平污染亦可引起热原反应。长期污染更是会导致患者慢性炎性反应和对促红细胞生成素反应性降低,加速机体蛋白分解、减少蛋白合成,并可能导致透析相关淀粉样变[3-4]。因此,全球许多国家和地区均要求对透析和相关治疗用水定期进行微生物学监测。本研究采用血琼脂平皿、胰蛋白酶大豆琼脂(TSA)、R2A营养琼脂进行血液透析和相关治疗用水的微生物学检测,比对三种方法的差异,探索适用于监测透析液和透析用水中微生物的最佳方法。
1 材料与方法
1.1 样本来源 2016年3月3—7日某市医院感染质量控制中心联合市肾脏病质量控制中心和市疾病预防控制中心,对本市范围内二级以上有血透室单元的医疗机构进行飞行检查。采集36所医疗机构血液透析室的透析液和透析用水72份。透析液采样部位:管道尾端透析机;透析用水采样部位:回路水采样口。
1.2 检测方法 将72份透析液和透析用水送疾病预防控制中心,每份标本取1 mL样本采用涂布平板法接种于TSA上,35℃培养48 h,48 h后若阴性可于72 h后再检查计数。同时平行样留医院感染质量控制中心,取1mL样本采用涂布平板法接种于血琼脂平皿35℃培养48 h,48 h后若阴性可于72 h后再检查计数;取1 mL样本采用涂布平板法接种于R2A营养琼脂23℃培养168 h(7 d),进行菌落计数。实验全程注意无菌操作,三种方法均设置阴性对照。
1.3 统计分析 应用SPSS 20.0软件进行统计学处理,以透析液和透析用水中是否有菌落检出作为检出率标准,以YY0572—2015《血液透析液及相关治疗用水》微生物污染物干预水平(50 CFU/mL)为超干预值检出率标准,菌落检出率和超干预值检出率比较采用χ2检验;采用Wilcoxon秩和检验对不同方法检出菌落计数的差异进行分析,P≤0.05为差异有统计学意义。
2 结果
2.1 透析液和透析用水菌落检出情况 采用三种方法对透析液和透析用水进行检测,血琼脂平皿、TSA平皿、R2A营养琼脂菌落检出率分别为40.28%、63.89%和69.44%,检出率比较,差异有统计学意义(χ2=14.16,P<0.05);两两比较结果显示,R2A营养琼脂和TSA平皿检出率高于血琼脂平皿,见表1。因透析液和透析用水检出的具体菌落计数资料不符合正态性,采用Wilcoxon检验进行比较。血琼脂平皿与R2A营养琼脂检出菌落计数比较,差异有统计学意义(Z=-4.515,P<0.05);TSA与R2A营养琼脂检出菌落计数比较,差异有统计学意义(Z=-6.970,P<0.05)。见表2。
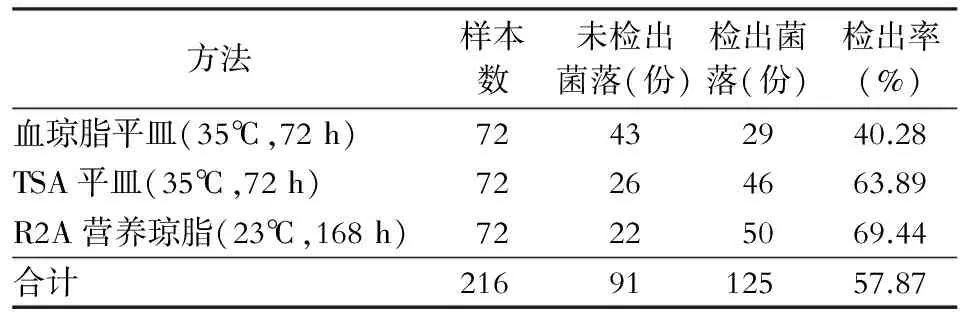
表1 三种方法检测透析液和透析用水菌落检出率比较
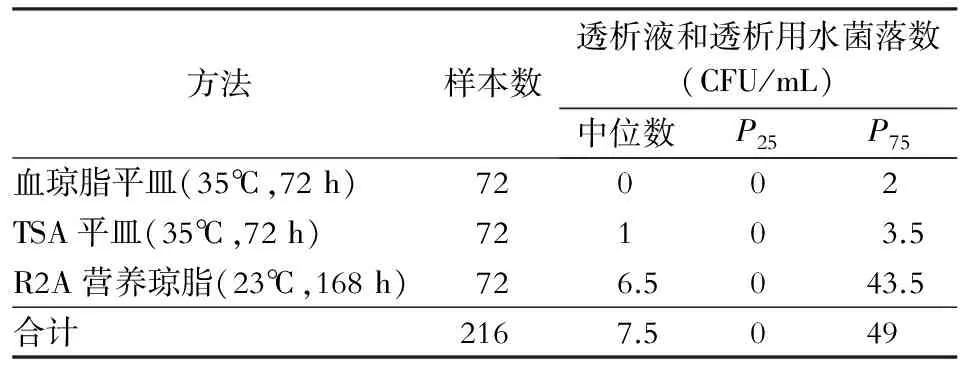
表2 三种方法检测透析液和透析用水菌落检出情况
2.2 透析液和透析用水菌落数超干预值情况 透析液和透析用水菌落数超干预值检出率:血琼脂平皿、TSA平皿、R2A营养琼脂法分别为1.39%、4.17%和20.83%,三种方法超干预值检出率比较,差异有统计学意义(χ2=19.83,P<0.05),R2A营养琼脂检出率高于血琼脂平皿、TSA平皿两种方法的检出率(χ2值分别为11.88、9.14,P<0.017)。见表3。

表3 三种方法检测透析液和透析用水菌落数超干预值情况
3 讨论
我国YY0572《血液透析液和相关治疗用水》给出了制备透析液用水在微生物学方面的最低要求。2005年版的标准操作方法是要求培养基应为TSA或等价物,35℃~37℃下培养48 h,48 h后若阴性可于72 h后再检查[5]。2015年版提出培养基宜选用胰化蛋白胨葡萄糖琼脂(TGEA)、R2A营养琼脂或其他确认能提供相同结果的培养基,推荐使用17℃~23℃的温度培养168 h(7 d),确认能提供相同培养结果的其他培养时间和温度也适用[6]。实际情况是,我国医疗机构目前大多使用血琼脂平皿35℃~37℃培养48 h,检测透析液和相关治疗用水中细菌菌落数,因其方法简便、培养基易得,可检出大多数致病菌;疾病预防控制中心和第三方检测机构多采用TSA平皿35℃~37℃下培养48~72 h。本研究比较血琼脂平皿、TSA、R2A营养琼脂检测血液透析和相关治疗用水菌落数存在差异。
全球许多国家和地区对透析液和透析用水的质量都有推荐要求、标准和监测方法,应用最广泛的是美国医疗器械进展委员会(The Association for the Advancement of Medical Instrumentation, AAMI)推荐、欧洲最佳实践指南(The European Best Practice Guideline, EBPG)[7]和国际标准化组织(International Organization for Standardization, ISO)标准。AAMI 2004标准建议使用TSA培养基,在30℃~37℃下培养48 h[8],2011年开始和ISO标准一样,推荐R2A或TGEA培养基在17℃~23℃下培养7 d[9-10]。西班牙肾脏病学会推荐使用R2A培养基,在23℃~27℃下培养7 d[1]。
革兰阴性水生细菌在经蒸馏、去离子、反渗透和软化处理所制备的透析用水中具有快速倍增的能力。用这些水制备的透析液同样也为细菌提供了一个非常好的生长环境[5]。在水系统的微生物监测中,如果没有主动消毒策略和敏感性高的监测培养技术,大量微生物的代谢产物就有干扰血透者免疫防御系统的风险[11]。水生细菌与内毒素的相关性较低,研究[12]表明,430 000个悬浮铜绿假单胞菌才贡献1 EU/mL内毒素水平。正因如此,仅单独监测透析液和透析用水的内毒素水平是不够的。
透析液中的细菌数通常高于透析用水,因为碳酸氢盐成分有利于细菌定植[13]。透析液浓缩物的细菌学监测很难标准化,因为可在环境中繁殖的微生物已进化出相应的应对机制,阻碍其在普通人工培养基上被检出。加入碳酸氢盐和氯化钠的低营养培养基可提高细菌检出的敏感性[14-15]。当使用一种敏感性不高的培养方法评估透析用水处理系统和透析液是否充分消毒时,会有低估微生物感染发生可能的风险,最终导致细菌超标、细菌生物膜形成和代谢产物通过透析膜进入患者体内导致疾病[16]。目前透析液和透析用水微生物学监测方法的主流观点是倾向于使用低营养培养基,降低培养温度和延长培养时间,认为培养基营养太丰富会杀死水生细菌[17]。但同时也有学者认为此方法并不适合所有水生微生物的生长,有些细菌更适合在富营养培养基和较高温度条件下生长[18]。还有一个必须考虑的因素是水中病原菌、水生藻类和真菌的影响,虽然就水生藻类和真菌在透析液和透析用水中的数量及其临床意义的研究甚少,但通常认为其最大允许数量应低于细菌数标准的10倍[1]。我们建议在接种R2A或TGEA等低营养培养基的同时,再接种一块血平皿置于35℃培养48 h,一块沙保罗琼脂(Sabouraud argar)平皿置于25℃培养168 h。接种血平皿是为提高对营养要求高的快生长病原菌检出率,接种沙保罗平皿是为能检出水中的真菌,既能提高对乏营养水生细菌的检出率,又能兼顾需高营养的病原菌和真菌的监测。
国家食品药品监督管理总局将于2017年1月1日实施新的血液透析及相关治疗用水标准YY0572-2015,其中对内毒素和细菌数提出了更高的要求,细菌数是不超过100 CFU/mL,干预值是50 CFU/mL[6],对微生物学监测方法的敏感性也提出了更高的要求。整个标准采用了制药GMP注射用水的热源标准,对透析用水系统消毒的要求会越来越高。各地疾病预防控制中心也应根据新标准进行水质监控。各血液透析中心应提前做好系统升级,以配合新标准的实施。
[1] Pérez-García R, García Maset R, Gonzalez Parra E, et al. Guideline for dialysate quality of Spanish Society of Nephrology(second edition,2015)[J]. Nefrologia, 2016, 36(3): e1-e52.
[2] Locatelli F, Altieri P, Andrulli S, et al. Hemofiltration and hemodiafiltration reduce intradialytic hypotension in ESRD[J]. J Am Soc Nephrol, 2010, 21(10): 1798-1807.
[3] Glorieux G, Neirynck N, Veys N, et al. Dialysis water and fluid: more than endotoxin[J].Nephrol Transplant, 2012, 27(11): 4010-4021.
[4] Beberashvili I, Sinuani I, Azar A, et al. Increased basal nitric oxide amplifies the association of inflammation with all-cause and cardiovascular mortality in prevalent hemodialysis patients[J]. Int Urol Nephrol, 2013, 45(6): 1703-1713.
[5] 国家食品药品监督管理局.血液透析和相关治疗用水YY0572-2005[S].北京,2005.
[6] 国家食品药品监督管理局.血液透析及相关治疗用水YY0572-2015[S].北京,2015.
[7] The EBPG Expert Group on Haemodialysis. European best practice guidelines for haemodialysis (Part I), Section IV, dialysis fluid purity[J]. Nephrol Dial Transplant, 2002, 17(Suppl 7): 45-62.
[8] Ward RA. New AAMI standards for dialysis fluids [J]. Nephrol News Issues, 2011, 25(13): 33-36.
[9] International Organization for Standardization. ISO13959:2014-Water for haemodialysis and related therapies[S]. ISO, 2014.
[10] International Organization for Standardization. ISO11663:2014-Quality of dialysis fluid for haemodialysis and related therapies[S]. ISO, 2014.
[11] Nystrand R. Microbiology of water and fluids for hemodialysis[J]. J Chin Med Assoc, 2008, 71(5): 223-229.
[12] Nystrand R. Thoughts about biofilm in dialysis water systems[J]. EDTNA ERCA J, 2003, 29(3): 127-130.
[13] van der Linde K, Lim BT, Rondeel JM, et al. Improved bacteriological surveillance of haemodialysis fluids: a comparison between Tryptic soy agar and Reasoner’s 2A media[J]. Nephrol Dial Transplant, 1999, 14(10): 2433-2437.
[14] Bugno A, Almodóvar AA, Pereira TC. Enumeration of heterotrophic bacteria in water for dialysis: comparison of the efficiency of Reasoner’2 agar and plate count agar[J]. Braz J Microbiol, 2010, 41(1): 15-18.
[15] Ledebo I, Nystrand R. Defining the microbiological quality of dialysis fluid [J]. Artif Organs, 1999, 23(1): 37-43.
[16] Nystrand R. Official recommendation for quality of fluids in dialysis-the need for standardisation[J]. J Ren Care, 2009, 35(2): 74-81.
[17] Ray J. Microbiological monitoring of dialysis water system-which culture method?[J]. J Ren Care, 2007, 33(2): 66-69.
[18] Button DK.Life in extremely dilute environments: the major role of oligobacteria[M]. Washington DC: American Society of Microbiology Press, 2004: 160-168.
(本文编辑:黄昕)
Threemethodsformicrobiologicalmonitoringondialysateanddialysiswaterforhemodialysis
QIANXue-feng1,QIAOMei-zhen1,JINMei-juan1,MAWen-xia1,YANGBo2
(1TheFirstAffiliatedHospitalofSoochowUniversity,Suzhou215006,China; 2SuzhouCenterforDiseaseControlandPrevention,Suzhou215006,China)
ObjectiveTo evaluate detection effect of three methods on monitoring microbes in dialysate and dialysis water for hemodialysis.MethodsSeventy-two dialysate and dialysis water specimens were collected from 36 medical institutions, specimens were cultured with three methods: blood agar plate incubated at 35℃ for 72 hours, Tryptic soy agar(TSA)plate incubated at 35℃ for 72 hours, and Reasoner’s 2A agar (R2A agar) plate incubated at 23℃ for 168 hours, colony counts, isolation of colony, and detection rate of colony exceeding action level(≥50 CFU/mL) were compared among three methods.ResultsThe colony isolation rates of microbes in dialysate and dialysis water detected by blood agar plate, TSA plate and R2A plate were 40.28%, 63.89%, and 69.44% respectively, difference was significant(χ2=14.16,P<0.05);pairwise comparison showed that isolation rates of colony on R2A agar plate and TSA plate were higher than blood agar plate. There was significant difference in isolated colony count between blood agar plate and R2A agar plate, TSA plate and R2A agar plate respectively(Z=-4.515, -6.970 respectively,bothP<0.05). The rates of isolated colony exceeding action level in dialysate and dialysis water detected by blood agar plate, TSA plate, and R2A agar plate were 1.39%, 4.17%, and 20.83% respectively, difference was significant(χ2=19.83,P<0.05),detection rate of R2A agar plate was higher than the other two methods.ConclusionThe detection rate of colony by R2A agar plate and TSA plate are better than blood agar plate, detection rate of colony exceeding action level by R2A agar plate is higher than TSA plate and blood agar plate, R2A agar plate for microbial monitoring(23℃,168 h) on dialysate and dialysis water is superior to the other two methods.
hemodialysis; dialysate; dialysis water; microbiological monitoring
2017-01-03
国家自然科学基金(81501425)
钱雪峰(1974-),男(汉族),江苏省苏州市人,副主任检验师,主要从事病原生物研究。
乔美珍 E-mail:qiaomeizhen99@163.com
10.3969/j.issn.1671-9638.2017.08.002
R459.5
A
1671-9638(2017)08-0698-04
