内镜保胆胆囊组织结石复发易感基因调控研究
2017-08-22许旭李全福张立广
许旭,李全福,张立广
(河北省保定市第二医院 肝胆外科,河北 保定 071051)
内镜保胆胆囊组织结石复发易感基因调控研究
许旭,李全福,张立广
(河北省保定市第二医院 肝胆外科,河北 保定 071051)
目的 采用高通量测序技术通过对胆囊结石复发患者胆囊黏膜中基因表达谱的检测及生物信息学的分析,初步了解基因在胆囊结石发生发展中的作用机制。方法用Illumina HiSeq 2500新一代高通量测序技术对7例胆囊结石及2例胆囊息肉复发患者进行mRNA表达谱差异筛选分析,并对得到的数据进行Gene Ontology(GO)和京都基因与基因组(KEGG)显著性富集统计。结果高通量测序结果显示,差异表达的mRNA差异基因共有150条。通过GO功能显著性富集分析,发现分子功能的GO功能显著富集是抗原结合;而对于生物过程,富集的GO功能是免疫应答;对于细胞成分,富集的GO功能是细胞外区域。KEGG通路富集分析发现最显著的途径是细胞因子-细胞因子受体作用途径(P =0.000)。结论目前的研究表明,研究胆囊结石复发易感基因,可以为预防内镜保胆术后胆囊结石复发的科学研究工作及临床治疗提供一个重要的参考。
易感基因;高通量测序;结石复发;差异表达基因
胆囊疾病通常表现为胆结石、胆囊息肉和胆囊癌。胆石通常发生率为世界人口的10%~20%,其随着年龄增加并且在女性中高于男性。胆结石一般是认为由于胆汁内的化学成分平衡失调所造成的。当患者胆汁中的胆固醇含量超出极限时,其化学成分析出,形成胆固醇结晶,最终形成胆结石[1]。除了上述因素外,胆汁中胆固醇过度分泌的分子遗传因素在胆囊结石形成中起到重要作用,例如LITH基因家族,能在基因水平引起胆囊内胆汁中胆固醇的病理性过饱和,最终导致胆囊结石的形成[2]。本研究采用Illumina HiSeq 2500新一代高通量测序技术对胆囊结石患者进行基因表达谱差异筛选分析,并对得到的数据进行Gene Ontology(GO)和京都基因与基因组(Kyoto Encyclopedia of Genes and Genomes,KEGG)显著性富集统计,通过基因功能的研究,探索胆囊结石复发的分子基础。
1 资料与方法
1.1 一般资料
收集保定市第二医院2009年1月-2014年1月收治的内镜微创保胆治疗胆囊结石复发患者7例,胆囊息肉复发患者2例,收集患者胆囊底部胆囊壁组织。其中,男2例,女7例,年龄36~64岁,中位年龄54岁。所有患者均无病毒性肝炎、糖尿病及代谢性疾病,临床均未使用过抗生素。胆囊壁组织迅速放入装有RNA样本保存液的冻存管内,冻存管置于-80℃液氮罐中,待样本全部收集完毕后,放置于干冰保存箱内。提取RNA进行反转录。测序文库的构建和序列测定使用Illumina公司的HiSeq 2500高通量测序平台完成。
1.2 差异表达基因的检测
收集样本后冻存于液氮,取出后把组织放入已预冷的研钵中进行研磨,待组织样本成粉末状后,Trizol法提取组织RNA。按照标准Illumina说明书构建cDNA文库,进行上机测序。测序后得到的原始读取(Raw reads)进行差异表达基因的检测:将下载的Ensembl GTF文件和通过TopHat匹配的原始文件传输到Cuffdiff,Cuffdiff使用原始的匹配文件重新估算GTF文件中列出的转录本的表达丰度,检测差异表达。在Cuffidff输出中只有q <0.01,测试显示成功的比较才被认为是差异表达。
1.3 差异表达基因的功能富集分析
DAVID v6.7是一套基于网络的功能注释工具。分别将差异表达基因和所有表达基因(所有样品的列表和背景)提交到网路界面,将错误发现率(false discovery rate,FDR)设定为 <5%(即P <0.05),只有GO FAT(Gene Ontology)和KEGG通路被选择作为此次分析的功能注释目录。
1.4 差异表达基因蛋白质相互作用(protein-protein interaction,PPI)网络构建
本研究采用的PPI数据来源于BioGRID数据库,这个数据库包含的PPIs从文献中手动搜索获得,且经过实验验证,该数据库的数据质量足够用于构建PPI预测模型。基于BioGRID数据库现有的蛋白质相互作用数据,利用Cytoscape软件中对表达差异显著的7个上调基因以及前20个下调基因进行搜索,获得PPI网络图。网络由节点(Node)和连线(Edge)构成,网络中节点代表蛋白质,线代表它们之间的相互作用。
2 结果
2.1 高通量测序结果及数据分析
成功构建了胆囊结石患者和胆囊息肉患者黏膜组织两个cDNA文库。经过Illumina Hiseq 2500高通量测序及数据分析处理,从胆囊结石和胆囊息肉这两组样品中分别得到4.46×107,3.41×107个读段对。利用TopHat将读段匹配到UCSC参考人基因组(hg19),唯一匹配的读段对应范围在4.17×107~3.21×107之间,匹配到Ensembl参考基因的读段比例为93%~94%。检测到胆囊结石与息肉之间有150个差异表达基因。值得注意的是在胆囊结石组织中有143个上调,而在胆囊息肉组织中只有7个基因上调。见表1。
2.2 基因本体论对于失调基因的富集分析
为了更好地理解差异表达基因的功能,进行了基因本体论对于失调基因的富集分析。GO类别分为3组:生物过程、细胞组分和分子功能。为了识别丰富的功能类别,首先使用DAVID的在线工具对显着差异调节的基因进行富集测试。选择了显著富集来自胆结石和胆囊息肉的失调基因的GO类别。胆结石和胆囊息肉之间的差异表达基因分为20个功能类别。见表2。本研究发现分子功能的GO功能显著富集是抗原结合(GO:0003823,P =0.000),而对于生物过程,富集的GO功能是免疫应答(GO:0006955,P =0.000),对于细胞成分,富集的GO功能是细胞外区域(GO:0005576,P =0.000)。为进一步评价差异表达基因的生物学意义,还进行了KEGG通路富集分析。在KEGG分析中最重要的途径是细胞因子-细胞因子受体相互作用(P =0.000)。此外,发现趋化因子信号通路(P =0.008)和NOD样受体信号通路(P =0.010)是高度富集的。
2.3 差异表达基因PPI网络构建
差异表达基因PPI网络构建只获得了2个上调基因和7个下调基因的PPI数据,共得到了差异表达基因相关的140条连线和121个节点,其中S100A9、RN7SK和CR2是连结度最高的3个节点。S100A9通过95条连线与87个节点相连接,为下调基因之间互相连接的关键节点。差异表达基因中的免疫球蛋白通过其他节点与S100A9相连构成了较长的通路,例如IGHA2/IGKV3-20-HMG20-S100A-RP11-297A16.3-IGKV4-1。而上调的RN7SK和CR2之间以及与下调基因之间没有已验证的蛋白质相互作用。见附图。
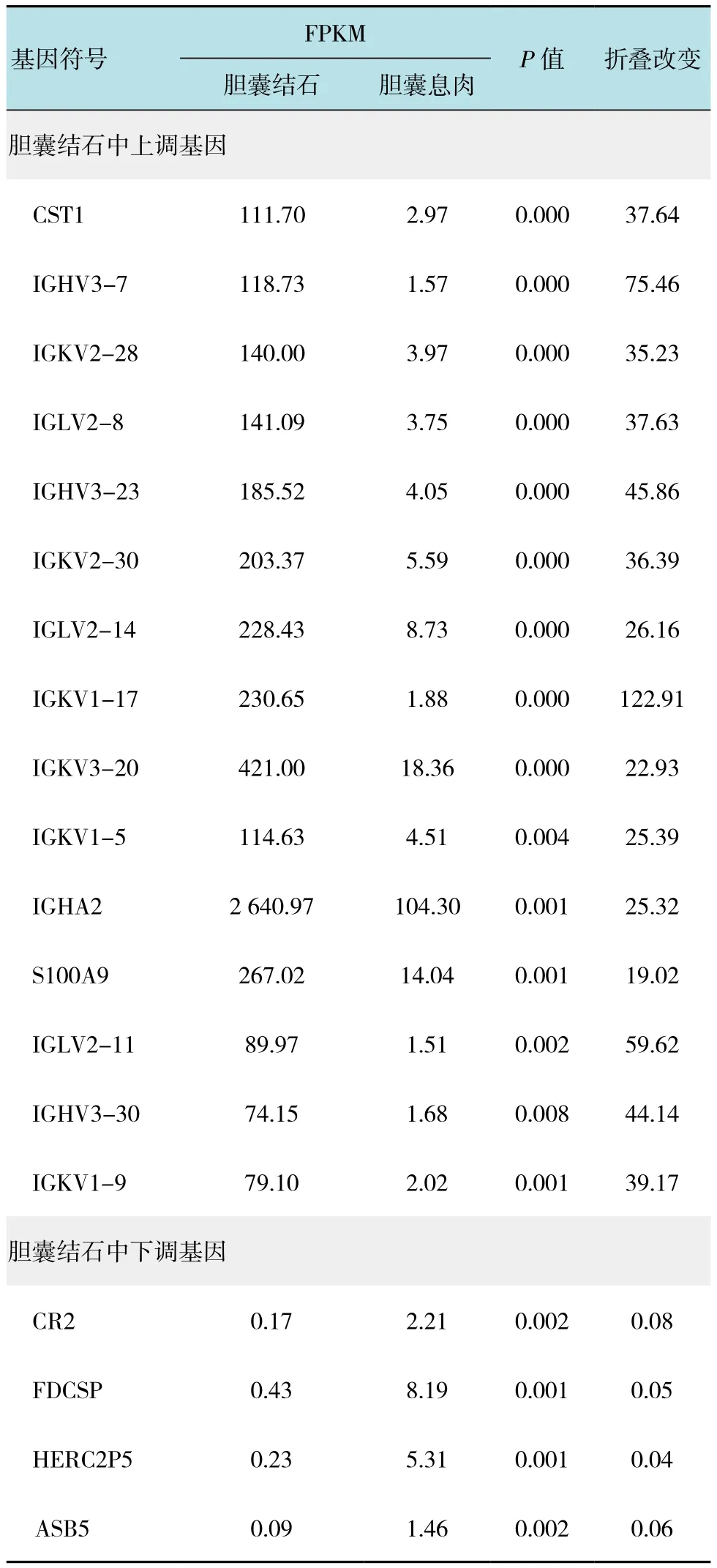
表1 在胆囊结石中上调的前15个基因列和下调的前4个基因列Table 1 Top significantly up-regulated 15 genes and down-regulated 4 genes about cholecystolithiasis

表2 差异表达基因GO功能分析Table 2 Significantly enriched GO terms of differentially expressed genes
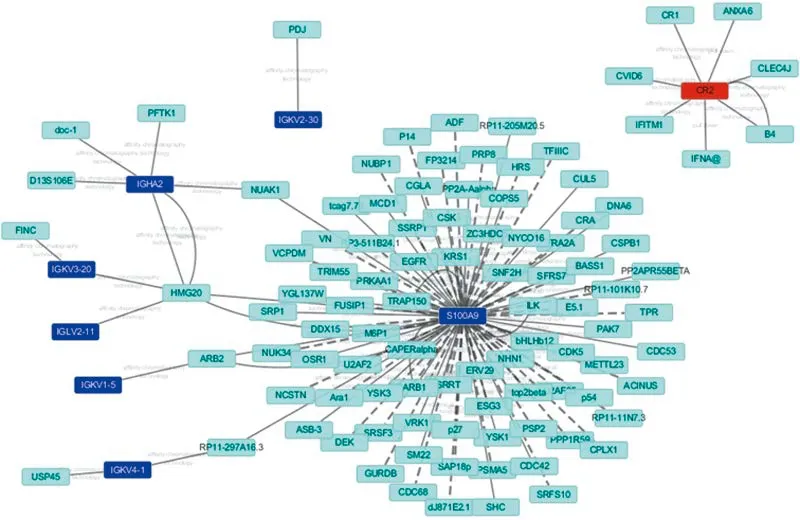
附图 PPI网络图Attached fig. The constructed protein-protein interaction networks of differentially expressed genes
3 讨论
胆囊结石和胆囊息肉是最常见的胆囊疾病类型,两者都是胆囊癌的危险因素。然而,胆结石和胆囊息肉的潜在发病机制在很大程度上仍然未知,这对于药物开发和这些疾病的治疗具有重要的意义。RNA-Seq是一种强大的工具,用于在全基因组规模上鉴定数千个基因转录的差异。本研究拟发现一些胆囊结石复发候选基因,并且提供这些基因在胆囊结石的发展中的作用。
本研究检测到胆囊结石与息肉之间有150个差异表达基因(143例胆囊结石上调,仅有7例胆囊息肉上调)。研究显示,在生物学功能上,差异性表达的基因多富集于与脂蛋白结合相关的生物学功能上,其大致与平滑肌收缩和物质转运载体相关,估计他们参与胆囊的收缩运动和胆汁浓缩[3]。通过比较胆囊结石患者和正常人的胆囊上皮组织,对表达差异显著地前200个基因整理分类后发现,蛋白质翻译和合成类,离子通道及转运蛋白类W及发育相关类占据前列[4]。LAMMERT等[5]于2001年首先提出了45条胆石病候选基因,它们主要是脂类代谢相关蛋白及胆囊相关蛋白。本研究的高通量测序胆囊结石易感基因基本上能涵盖这45条候选基因,间接上证明测序结果的可靠性。
为了更好地理解差异表达基因的功能,本研究进行了基因本体论对于失调基因的富集分析。细胞因子-细胞因子受体信号通路中包括15个差异表达基因,其中5个基因属于CXC超家族,5个基因属于CC超家族,CXC超家族和CC超家族都属于趋化因子,而IL-6、OSM为促红细胞生成素,TNFSF9为TNF超家族,IL-1B为TGF-β超家族。这些基因在胆囊息肉中表达下调,在胆囊结石中表达上调。趋化因子信号通路中包括11个差异表达基因,其中CXCL1、CCL3、CCL2、IL-8、CCL20、CXCL3、CXCL2、CCL8、CCL4L1均为趋化因子,CXCR1,CXCR2为趋化因子受体,这些基因在胆囊息肉中表达下调,在胆囊结石中表达上调。6个基因参与NOD样受体信号通路,其中IL-8、CXCL1、CXCL2、CCL2为趋化因子,IL-6及IL-1B为炎症细胞因子,这些因子可能通过参与T-cell分化、抗原特异的T细胞及B细胞免疫应答调控胆囊疾病的发生,这些基因在胆囊息肉中表达下调,在胆囊结石中表达上调。
PPI研究可以揭示蛋白质在分子水平的功能,并揭示细胞活动的规则,包括生长、发育、代谢、分化和凋亡[6]。全基因组规模的PPI的识别解释细胞控制机制是非常重要的[7]。本研究只获得了2个上调基因和7个下调基因的蛋白质相互作用数据,其中S100A9、RN7SK和CR2是连结度最高的3个节点。在胆囊结石中上调的基因中大部分为免疫球蛋白,说明这些免疫球蛋白可能通过参与免疫应答及炎症反应等参与胆囊结石的发病。而且值得关注的是已有研究证明S100A9在结石性胆囊炎中表达升高,并随着炎症反应的加剧而升高[8]。研究显示,S100A9和其他S100蛋白(包括S100A8和S100A12)与免疫系统的调节严格相关,其在急性和慢性炎性疾病和肿瘤中观察到,更重要的是,显示S100A8和S100A9蛋白在急性胆囊炎中比在慢性疾病中具有更高的量[9-10],这表明这些基因通过参与炎症在胆囊结石形成中发挥着重要作用。
综上所述,通过RNA-Seq比较胆囊结石和胆囊息肉之间的基因表达谱,鉴定出150个差异表达基因,研究基因在免疫应答和细胞因子-细胞因子受体相互作用的功能,可以帮助了解胆囊结石的形成机制。下一步将扩大样本例数,进一步深入研究,有望明确关键基因的定位、功能和调节,将有助于实现胆囊结石和胆囊息肉的预防和治疗。
[1]LI Q, GE X, XU X, et al. Comparison of the gene expression profiles between gallstones and gallbladder polyps[J]. Int J Clin Exp Pathol, 2014, 7(11): 8016-8023.
[2]GOODLOE R, BROWN-GENTRY K, GILLANI N B, et al. Lipid trait-associated genetic variation is associated with gallstone disease in the diverse Third National Health and Nutrition Examination Survey (NHANES III)[J]. BMC Med Genet, 2013,14: 120.
[3]KAZMI H R, CHANDRA A, NIGAM J, et al. Polymorphism and expression profile of cholecystokinin type a receptor in relation to gallstonedisease susceptibility[J]. Biochem Genet, 2016, 54(5):665-675.
[4]TALKISH J, MAY G, LIN Y, et al. Mod-seq: high throughput sequencing for chemical probing of RNA structure[J]. RNA, 2014,20(5): 713-720.
[5]LAMMERT F, CAREY M, PAIGEN B. Chromosomal organization of candidate genes involved in cholesterol gallstone formation: a murine gallstone map[J]. Gastroenterology, 2001, 120(1): 221-238.
[6]GIOT L, BADER J S, BROUWER C, et al. A protein interaction map of Drosophila melanogaster[J]. Science, 2003, 302(5651):1727-1736.
[7]LI S, ARMSTRONG C M, BERTIN N, et al. A map of the interactome network of the metazoan C. elegans[J]. Science, 2004,303(5657): 540-543.
[8]SZMYT M, KASPRZAK A, MALKOWSKI W, et al. Tissue expression of S100 proteins in gallbladder mucosa of the patients with calculous cholecystitis[J]. Folia Histochem Cytobiol, 2013,51(2): 141-148.
[9]GOYETTE J, GECZY C L. Inflammation-associated S100 proteins:new mechanisms that regulate function[J]. Amino Acids, 2011,41(4): 821-842.
[10]KASPRZAK A A, SZMYT M, MALKOWSKI W, et al. Expression of phenotypic markers of mast cells, macrophages and dendritic cells in gallbladdermucosa with calculous cholecystitis[J]. Pol J Pathol, 2013, 64(4): 281-289.
(吴静 编辑)
Integrating of the gene expression profiles in gallbladder stone and identify regulatory networks
Xu Xu, Quan-fu Li, Li-guang Zhang
(Department of Hepatobiliary Surgery, the Second Hospital, Baoding, Hebei 071051, China)
Objective The gene expression profile of gallbladder stone and gallbladder polyp were analyzed by high-throughput sequencing technology to explore the roles of the gene in the development of gallstone and their molecular mechanism in the occurrence and development of gallbladder stone.Methods7 patients with gallstones and 2 patients with gallbladder polyp was enrolled for RNA-Seq.Results150 DEGs was identified between gallstones and gallbladder polyps. We found GO terms for molecular functions significantly enriched in antigen binding, while for biological processes, the enriched GO terms were immune response, and for cellular component,the enriched GO terms were extracellular region. The most significant pathway in our KEGG analysis was Cytokinecytokine receptor interaction (P = 0.000).ConclusionThis present study suggests some promising genes may provide a clue to the role of these genes played in the development of gallstones and gallbladder polyps.
susceptibility gene; high-throughput sequencing; stone recurrence; differentially expressed genes
Q786
A
10.3969/j.issn.1007-1989.2017.07.015
1007-1989(2017)07-0071-05
2016-12-12
李全福,E-mail:xuxu8041230@163.com;Tel:15603211539
