鲷无胄虫的描述及无胄虫科的分类地位
2017-08-16周梓华丁雪娟
周梓华 蔡 星 丁雪娟
(华南师范大学生命科学学院, 广东省水产健康安全养殖重点实验室, 广州市亚热带生物多样性与环境生物监测重点实验室,广州 510631)
鲷无胄虫的描述及无胄虫科的分类地位
周梓华 蔡 星 丁雪娟
(华南师范大学生命科学学院, 广东省水产健康安全养殖重点实验室, 广州市亚热带生物多样性与环境生物监测重点实验室,广州 510631)
对寄生于大亚湾黑鲷(Acanthopagrus schlegeli)体表的鲷无胄虫(Anoplodiscus spari)进行了形态描述, 并扩增了该虫的28S rDNA C1-D2区部分序列, 构建了相关类群的分子系统树, 探讨了无胄虫科的分类地位。结果显示: 所获标本与Ogawa等的描述基本一致, 但交接管基部及末端位置略有不同: 本研究标本的交接管基部始于支持器的下方、末端于支持器三分叉的中支略伸出, 而Ogawa等的标本交接管基部靠近支持器三叉处、末端从三叉处延伸并略弯曲; 无胄虫属(Anoplodiscus)为单系起源, 隶属于指环虫目、四钩虫亚目、无胄虫科(Anoplodiscidae), 无胄虫科是一独立的科, 在分类地位上与四钩虫科(Tetraonchidae)互为姐妹群, 与Udonellidae科和微沟科(Microbothriidae)的关系较远。
鲷无胄虫; 无胄虫科; 28S rDNA; 分类地位
无胄虫科(Anoplodiscidae Tagliani, 1912)隶属于扁形动物门(Platyhelminthes)单殖吸虫纲(Monogenea), 目前仅含无胄虫属(Anoplodiscus)。无胄虫属是由Sonsino (1890)以采自真鲷(Pagrus major)上的Anoplodiscus richiardii为模式种而建立的, 属征为: 后吸器盘状, 无几丁质结构; 肠支单管, 具不对称侧分支; 前吸器1对, 吸槽状[1]。无胄虫属记录6个种: 寄生于赤鲷(Pagrus pagrus)的A.richiardii Sonsino, 1890和A.longivaginatus Paraguassu, 2002、寄生于黑鲷(Acanthopagrus schlegeli)的A.australis (Johnston, 1930) Ogawa et Egusa, 1981和A.spari (Yamaguti, 1958) Ogawa et Egusa, 1981、寄生于金鲷(Chrysophrys auratus)的A.cirrusspiralis Roubal, Armitage et Rohde, 1983及寄生于真鲷的A.tai Ogawa, 1994[1—5]。张剑英等[6]曾对无胄虫科无胄虫属作过介绍, 吴金英等[7]记述了采自香港海域黑鲷体表的鲷无胄虫(A.spari), 此为我国报道的唯一一种无胄虫[7,8], 但未提供该虫的相关图片。近年又有该虫引发养殖鱼类病害的报道[9]。
无胄虫的分类地位一直存在争议。Monticelli (1905)重描述了无胄虫属并将其归在Anisocotylidae科。Tagliani (1912)在该属的基础上建立了无胄虫亚科Anoplodiscinae。Price (1938)认为Anisocotylidae科名无效, 并将无胄虫属归入微沟虫科 (Microbothriidae)。Sproston (1946)又将无胄虫属归于鞋口虫科(Calceostomatidae)。在Yamaguti (1963)的分类系统中, 无胄虫归于微沟虫科。Ogawa等[1]根据无胄虫的幼虫具8对边缘小钩, 而微沟虫科的幼虫只有3对针状刺(spicules), 以及二者肠支和前吸器的差异, 将无胄虫亚科从微沟虫科中独立出来,并将其提升至科水平。在Boeger和Kritsky[10]的分类系统中, 无胄虫科归于三代虫目, 该三代虫目包括两个分支: 一个分支由无胄虫科、似四钩虫科(Tetraonchoididae)和沟穴虫科(Bothitrematidae)组成,另一个分支包含三代虫科(Gyrodactylidae)、棘杯虫科(Acanthocotylidae)和Udonellidae科。Justine等[11]在利用28S rDNA D1区部分序列探讨新鞋口虫科(Neocalceostomatidae)和沟穴虫科的分类地位时, 发现无胄虫科、沟穴虫科和Sundanonchidae科聚为一支, 该结果与Olson等[12]利用18S rDNA构建的进化树一致, 即无胄虫科和Sundanonchidae聚为一支。
分子系统学能够解决缺乏形态特征或形态特征无法解决的某些类群的分类地位问题, 而28S rDNA 5′端序列适合推断种间、属间及近缘科间的亲缘关系[13—15]。有鉴于此, 本文拟依据所获标本对鲷无胄虫的形态特征作一补充描述, 并利用28S rDNA C1-D2区部分序列探讨了无胄虫科的分类地位。
1 材料与方法
1.1 材料来源及形态学研究
宿主鱼黑鲷取自广东大亚湾养殖网箱, 先用肉眼观察其体表、鳍、眼、鼻、口腔等部位, 再用淡水侵泡3—5min, 后取出鱼鳃, 置于盛有过滤海水的培养皿中, 在解剖镜下进行观察。检获的单殖吸虫标本, 部分用布氏胶直接封片; 部分用70%酒精固定后经洋红或胭脂虫红染色, 梯度酒精脱水, 松油醇透明后用中性树胶封片; 其余标本用95%酒精固定保存。照片图为Olympus显微数码相机拍摄, 墨线图借助Olympus LB描绘器进行手绘、扫描成电子图片后用Photoshop CS4复墨。在光学显微镜下观察并测量, 量度单位以μm计, 量度取平均数(括号内数值为所测标本的量度变化范围)。标本保存于华南师范大学生命科学学院鱼类寄生虫学研究室。
1.2 DNA提取与PCR扩增
模板DNA的制备、28S rDNA部分序列的PCR扩增及PCR产物的纯化等参见丁雪娟和廖翔华[15]。PCR扩增引物参照Hassouna等[16]: 正向C1 (5′-AC CCGCTGAATTTAAGCAT-3′) 和反向D2 (5′-TG GTCCGTGTTTCAAGAC-3′)。扩增反应体系为50 μL: 10×PCR buffer 5.0 μL, 2 mmol/L dNTP 5.0 μL, 25 mmol/ L MgCl24.0 μL, 10 μmol/L引物各2.0 μL, Taq酶(5 U/μL) 0.5 μL, DNA模板液3.0 μL, 灭菌双蒸水28.5 μL。扩增反应步骤: 94℃预解链5min; 然后94℃ 1min, 56℃ 1min, 72℃ 1min, 30个循环; 最后72℃延伸5min。PCR产物经电泳、回收、纯化后送生工生物工程(上海)股份有限公司进行序列测定。
1.3 系统发育树构建
根据自测的无胄虫及鳞盘虫28S rDNA C1-D2区部分序列, 及从NCBI上下载的26种单殖吸虫的相应序列(表 1), 构建无胄虫相关类群的系统发育树。DNA序列用ClustalX[17]软件比对分析, 并手工删除两端无效序列。采用最大似然法(Maximum likelihood, ML) 和贝叶斯分析(Bayesian analysis, BA)构建系统树。ML分析由在线软件The CIPPES Science Gateway (http://www.phylo.org) 生成, 使用RAxML-HPC2 on XSEDE工具, 模型选择GTRCAT, Bootstrap设置为1000次。贝叶斯分析使用软件Mr-Modeltest2.1.2[18]搜索最佳模型参数(基于hLRT标准)。两种方法均选用4种寡钩亚纲单殖吸虫作为外类群。
2 结果
2.1 鲷无胄虫Anoplodiscus spari (Yamaguti, 1958) Ogawa & Egusa, 1981
宿主: 黑鲷Acanthopagrus schlegeli (Bloch)
寄生部位: 鳍和体表
标本采集时间和地点: 2014年11月; 广东惠州大亚湾(22°43′N, 114°28′E)
形态描述: 虫体呈梭形, 大小为1563 (1129—2062)×652 (370—999)。体前端平截, 上有1对吸槽、边缘不规则。眼点2对。咽发达, 卵圆形, 大小91 (102—150)×102 (91—138)。肠支单管, 具众多不对称的侧分支(图 1A)。
睾丸单个, 圆球形, 大小287 (156—338)×230 (165—281)(图 1A)。交接器由交接管和支持器组成; 交接管近环形, 管长414 (316—518), 基部位于支持器的下方, 末端位于三分叉中支外侧; 支持器一端呈三叉状展开, 其中一分叉较长且基部明显膨大(图 1B)。
卵巢卵圆形, 位于睾丸前, 大小127 (84—166)× 126 (90—166)。阴道开口于虫体右侧, 无几丁质结构。卵黄腺呈大滤泡状, 分布自交接器水平至肠支末端之前(图 1A)。
描述依据3个胭脂虫红、2个明矾洋红染色标本和2个布氏胶封片标本。
2.2 无胄虫科的分类地位
首次测得鲷无胄虫的28S rDNA C1-D2部分序列。原始序列由Clustal X比对后经手工删除两端无效序列, 最终组成一个由24种多钩类和4种寡钩类单殖吸虫构成的数据集, 序列长度647—963 bp。比对后序列全长1133 bp, 其中简约信息位点725个,保守位点248个, 变异位点818个。用Mrmodeltest软件估计的最适替代模型是GTR+I+G模型(Nst=6; Rates=invgamma)。生成的BA和ML树, 在拓扑结构上没有差异, 仅节点支持率有所不同。本文选取了ML的50%多数一致树, 并附有BA的PP (%)和ML的Bootstrap值(图 2)。
分子系统树显示: 各个科以较高的支持率聚为一支, 均是单系群。系统树由4个分支组成, 其中基部分支由三代虫科和Udonellidae科构成; 无胄虫科聚入指环虫目分支内, 与四钩虫科(Tetraonchidae)互为姐妹群, 同样被纳入该分支的还有指环虫科、锚首虫科和鳞盘虫科; 微沟虫科与单杯科组成一个分支; 分室科独自构成一个分支。4个分支均拥有较高的分支支持率(70%以上)。
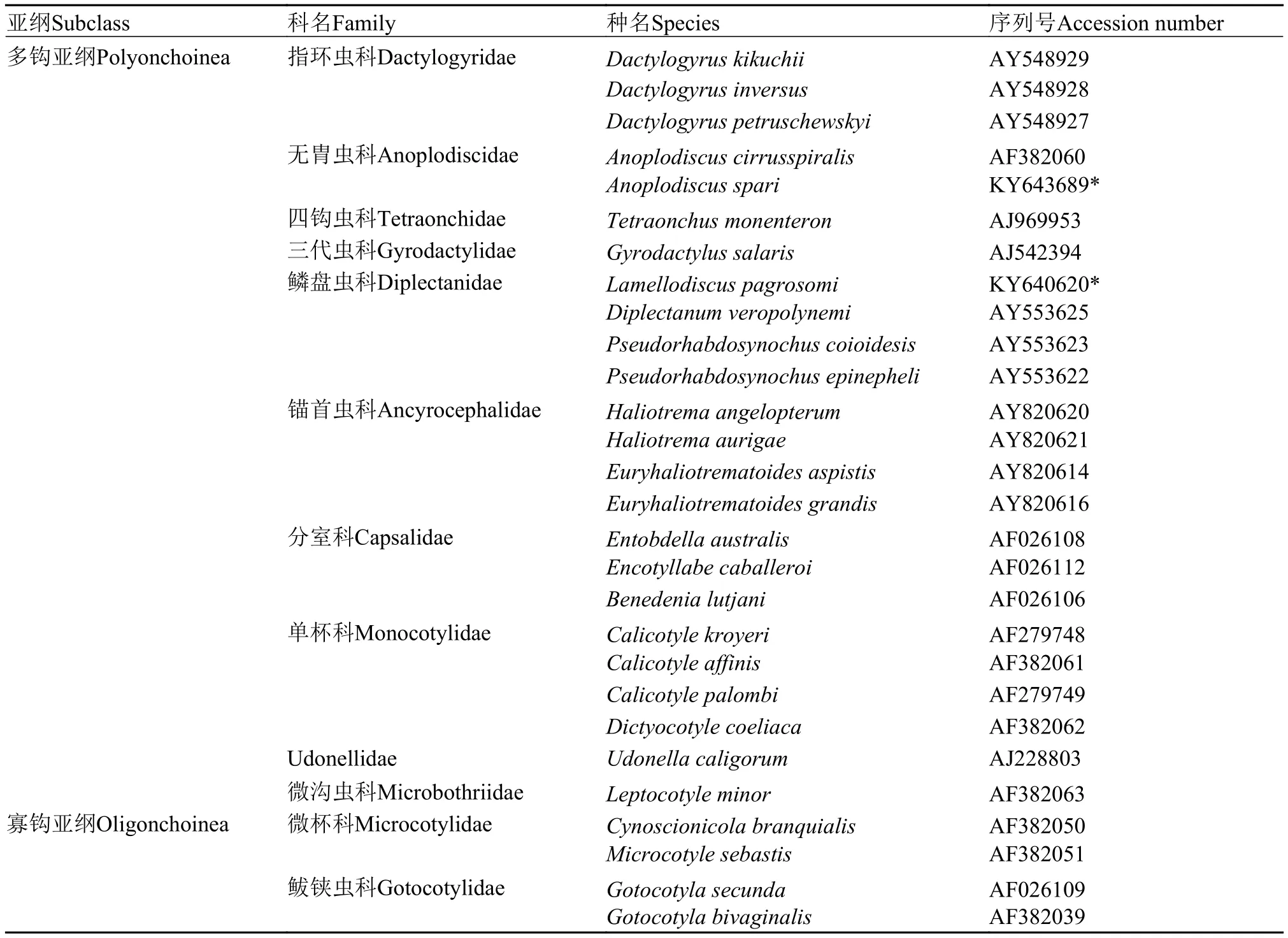
表 1 系统分析所涉及的单殖吸虫种类及序列信息Tab.1 List of monogenean species and GenBank accession numbers used in the present phylogenetic analyses
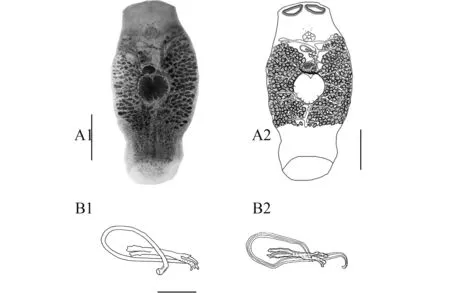
图 1 鲷无胄虫Fig.1 Anoplodiscus spari (Yamaguti, 1958) Ogawa et Egusa, 1981
3 讨论
本文对采自我国南海大亚湾的鲷无胄虫作了简单描述, 并补充了整体图和交接器结构图, 所获标本与Ogawa等(1981)的描述基本一致, 但交接管基部和末端位置略有差异: 在Ogawa等的描述中,交接管基部靠近支持器三叉处、末端从三叉处延伸并略弯曲(图B2), 而我们的标本中交接管基部在支持器的下方、末端从三分叉的中支略为突出(图B1)。
在Boeger和Kristky[10]的分类系统中, 无胄虫科与Udonellidae在同一支内, 均隶属于三代虫目, 表明二者具有较近的亲缘关系, 且Udonellidae科的后吸器亦缺乏几丁质结构; 但本研究显示无胄虫科与Udonellidae科位于两个不同的分支内: 无胄虫科位于指环虫目内、Udonellidae科属于三代虫目。生活史上, 无胄虫的幼虫阶段具有纤毛和8对几丁质边缘小钩[1], 而Udonella的幼虫及成虫阶段均没有纤毛也没有几丁质钩[19]。形态结构上, 无胄虫的边缘小钩和肠支结构与四钩虫和似四钩虫的更为相似。超显微结构上, 无胄虫与指环虫类的精子都为“4型”(单一轴丝, 无微管) 而Udonella是“2型”(双轴丝, 无微管)[20]。在本文的分子系统树上, 无胄虫科与四钩虫科互为姐妹群, 而与三代虫所在的进化支相距甚远。无胄虫曾被归入微沟虫科, 后Ogawa等[1]认为其为一独立的科, 本研究结果显示无胄虫科是一独立的科, 与微沟虫科分属于不同的进化支内。综上所述, 我们认为无胄虫成虫几丁质结构的缺失为一种同型性状, 而非共同衍征, 支持Justine等[11]的观点, 即无胄虫科应归入指环虫目。

图 2 基于28S rDNA部分序列构建的无胄虫科及相关类群的分子系统树Fig.2 The phylogenetic tree of Anoplodiscidae and some related groups based on the partial 28S rDNA sequences
本研究证实了无胄虫科为一独立的科, 支持将无胄虫科纳入指环虫目、四钩虫亚目。无胄虫成虫后吸器几丁质缺失是一种次生现象[21], 提示在研究探讨单殖吸虫的分类地位时, 不能仅依据成虫的形态结构, 还应考虑其生活史各个阶段的形态特征。另几丁质结构是单殖吸虫分类鉴定的主要依据[15], 但对于缺乏或生活史某个阶段缺乏几丁质结构的虫种(如本文的无胄虫), 单纯依赖形态特征的分类就显得尤为不足, 此时分子系统学能有效地弥补这一缺陷, 为单殖吸虫的正确分类提供科学依据。
致谢:
华南师范大学生命科学学院张剑英教授提供相关文献, 刘琳副教授协助英文润色, 2013级研究生方伟协助采集标本, 谨致谢忱。
[1]Ogawa K, Egusa S.The systematic position of the genus Anoplodiscus (Monogenea: Anoplodiscidae) [J].Systematic Parasitology, 1981, 2(4): 253—260
[2]Paraguassú A R, Luque J L, Alves D R.A new species of Anoplodiscus (Monogenea: Anoplodiscidae) parasitic on Pagrus pagrus (Osteichthyes: Sparidae) from the coastal zone of the State of Rio de Janeiro, Brazil [J].Memórias do Instituto Oswaldo Cruz, 2002, 97(8): 1197—1199
[3]Roubal F R, Armitage J, Rohde K.Taxonomy of Metazoan ectoparasites of snapper, Chrysophrys autratus (Family Sparidae), from southern Australia, eastern Australia and New Zealand [J].Australian Journal of Zoology, 1983, 31(94): 1—68
[4]Ogawa K.Anoplodiscus tai sp.nov.(Monogenea: Anoplodiscidae) from cultured red sea bream Pagrus major [J].Fish Pathology, 1994, 29(1): 5—10
[5]Roubal F R.The taxonomy and site specificity of the metazoan ectoparasites on the black bream, Acanthopagrus australis (Günther), in northern New South Wales [J].Australian Journal of Zoology, Supplementary Series, 1981, 30(84): 1—100
[6]Zhang J Y, Qiu Z Z, Ding X J.Parasites and Parasitic Diseases of Fishes [M].Beijing: Science Press.1999, 205 [张剑英, 邱兆祉, 丁雪娟.鱼类寄生虫与寄生虫病.北京: 科学出版社.1999, 205]
[7]Wu J Y, Lu J Y, Hu Y S.A new species and a new Chinese record of monogeneans from marine fishes in the South China Sea [J].Acta Zootaxonomica Sinica, 2002, 27(4): 677—684 [吴金英, 吕军仪, 胡應劭.寄生于南海鱼类中的单殖吸虫一新种和一新纪录(吸虫纲: 单殖目).动物分类学报, 2002, 27(4): 677—684]
[8]Zhang J Y, Yang T B, Liu L, et al.A list of monogeneans from Chinese marine fishes [J].Systematic Parasitology, 2003, 54(2): 111—130
[9]Xie J J, Xu W J, Shi H, et al.The diagnosis and prevention of Anoplodicus spari [J].Scientific Fish Farming, 2014, 2: 63—64 [谢建军, 许文军, 施慧, 等.黑鲷无胄虫病的诊断与防治.科学养鱼, 2014, 2: 63—64]
[10]Boeger W A, Kritsky D C.Phylogenetic relationships of the Monogenoidea [A].In: Littlewood D T J, Bray R A(Eds.), Interrelationships of the Platyhelminthes [C].London: Taylor & Francis.2001, 92—102
[11]Justine J L, Jovelin R, Neifar L, et al.Phylogenetic positions of the Bothitrematidae and Neocalceostomatidae (Monopisthocotylean Monogeneans) inferred from 28S rDNA sequences [J].Comparative Parasitology, 2002, 69: 20—25
[12]Olson P D, Littlewood D T J.Phylogenetics of the Monogenea - evidence from a medley of molecules [J].International Journal for Parasitology, 2002, 32(3): 233—244
[13]Jovelin R, Justine J L.Phylogenetic relationships within the polyopisthocotylean monogeneans (Platyhelminthes) inferred from partial 28S rDNA sequences [J].International Journal for Parasitology, 2001, 31(4): 393—401
[14]Mollaret I, Jamieson B G M, Justine J L.Phylogeny of the Monopisthocotylea and Polyopisthocotylea (Platyhelminthes) inferred from 28S rDNA sequences [J].International Journal for Parasitology, 2000, 30(2): 171—185
[15]Ding X J, Liao X H.Phylogenetic position of the monogeneans Pseudodactylogyrus, Heternchocleidus and Trianchoratus inferred from the 5’ terminal sequences of 28S rDNA [J].Acta Zootaxonomica Sinica, 2005, 30(2): 244—251 [丁雪娟, 廖翔华.伪指环虫、异钩虫和三钩虫的系统位置.动物分类学报, 2005, 30(2): 244—251]
[16]Hassouna N, Mithot B, Bachellerie J P.The complete nucleotide sequence of mouse 28S rRNA gene.Implications for the process of size increase of the large subunit rRNA in higher eukaryotes [J].Nucleic Acids Research, 1984, 12(8): 3563—3583
[17]Thompson J D, Gibson T J, Plewniak F, et al.The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools [J].Nucleic Acids Research, 1997, 25(24): 4876—4882
[18]Posada D, Crandall K A.Modeltest: testing the model of DNA substitution [J].Bioinformatics, 1998, 14(9): 817—818
[19]Littlewood D, Rohde K, Clough K A.The phylogenetic position of Udonella (Platyhelminthes) [J].International Journal for Parasitology, 1998, 28(8): 1241—1250
[20]Justine J L, Lambert A, Mattei X.Spermatozoon ultrastructure and phylogenetic relationships in the monogeneans (Platyhelminthes) [J].International Journal for Parasitology, 1985, 15(6): 601—608
[21]Whittington I D.The capsalidae (Monogenea: Monopisthocotylea): a review of diversity, classification and phylogeny with a note about species complexes [J].Folia Parasitologica, 2004, 51(2—3): 109—122
DESCRIPTION OF ANOPLODICUS SPARI (MONOGENEA: ANOPLODISCIDAE) AND THE TAXONOMIC POSITION OF ANOPLODISCIDAE
ZHOU Zi-Hua, CAI Xing and DING Xue-Juan
(School of Life Science, South China Normal University, Guangdong Provincial Key Laboratory for Healthy and Safe Aquaculture, Guangzhou Key Laboratory of Subtropical Biodiversity and Biomonitoring, Guangzhou 510631, China)
The current study described the whole worm and male copulatory organ of Anoplodicus spari collected from Acanthopagrus schlegeli off Daya Bay, South China Sea.Our specimens of Anoplodicus spari from South China Sea was basically consistent with the description of Ogawa et al.(1981) except for the slight difference in the position of the base and distal end of copulatory tube.The proximal end of the copulatory tube lied beneath the accessory piece and the distal end protruded from the three rami in our specimens, while the distal end extended from the rami and curved in the specimen of Ogawa (1981).The partial 28S rDNA sequences (C1-D2 domain) of Anoplodicus spari and other related groups were used to study the taxonomic position of Anoplodiscidae.The results showed the independent position of Anoplodiscidae, a valid family belonging to the clade of Tetraonchinea, Dactylogyridea.Anoplodiscidae and Tetraonchidae were a sister group in the phylogenetic tree, and this clade was distantly different from Udonellidae and Microbothriidae.
Anoplodicus spari; Anoplodiscidae; 28S rDNA; Taxonomic position
Q959.19
A
1000-3207(2017)04-0891-05
10.7541/2017.111
2016-07-01;
2016-11-07
国家自然科学基金项目(31172051和31572232)资助 [Supported by the National Natural Science Foundation of China (31172051, 31572232)]
周梓华(1992—), 男, 广东南海人; 硕士研究生; 主要从事海水鱼类单殖吸虫研究。E-mail: 289462085@qq.com
丁雪娟, E-mail: dingxj@scnu.edu.cn
