鱼源无乳链球菌的血清型及分子分型研究
2017-08-16张雨薇耿毅余泽辉汪开毓陈德芳向正刚李亚军郭坤宁牟维豪
张雨薇耿 毅余泽辉汪开毓陈德芳向正刚李亚军郭坤宁牟维豪
(1.四川农业大学动物医学院, 温江 611130; 2.四川农业大学水产系, 温江 611130)
鱼源无乳链球菌的血清型及分子分型研究
张雨薇1耿 毅1余泽辉1汪开毓1陈德芳2向正刚1李亚军1郭坤宁1牟维豪1
(1.四川农业大学动物医学院, 温江 611130; 2.四川农业大学水产系, 温江 611130)
为了解不同鱼源无乳链球菌(Streptococcus agalactiae)分子分型特征, 分析菌株之间的相关性和同源性,研究在采用S.agalactiae特异性cfb基因对分离菌株鉴定的基础上, 对26株不同鱼源S.agalactiae进行了荚膜多糖血清型(CPS)多重PCR鉴定, 同时采用多位点序列分型(MLST)和脉冲场凝胶电泳(PFGE)进行分子特征比较与同源性分析。结果显示, 26株菌CPS型存在Ia (n=22)和III型(n=4)两种类型, 其中黄河裸裂尻鱼源和罗非鱼源菌株均为Ia血清型, 齐口裂腹鱼源菌株存在Ia (n=2)和III (n=4)型两种CPS型; 多位点序列分型共得到3种STs序列型(ST-891、ST-103、ST-19), 其中黄河裸裂尻鱼源和罗非鱼源菌株均为新的序列型ST-891, 齐口裂腹鱼源菌株存在ST-103和ST-19两种STs型; PFGE聚类分析可分为16个PFGE谱型(A-P), 其中优势带型为P型(n=9)。相同荚膜多糖血清型—MLST分型菌株在PFGE带型中呈现高度聚集。CPS分型与MLST分型、PFGE分型有很好的相关性, 而CPS型、STs序列型、PFGE带型与宿主的来源没有明显的相关性。不同鱼源S.agalactiae分子特征的相似性, 提示其存在交叉感染的可能性, 而齐口裂腹鱼源S.agalactiae分子特征的多样性, 提示其存在遗传变异的情况。
无乳链球菌; 荚膜多糖血清分型; 多位点序列分型; 脉冲场凝胶电泳
无乳链球菌(Streptococcus agalactiae), 属于链球菌科(Streptococcace), 链球菌属(Streptococcus),也称B群链球菌(Group B Streptococcus, GBS), 是兼性厌氧G+的链状球菌。在自然情况下无乳链球菌可感染海鲷(Sparus auratus)[1]、银鲳(Pampus argenteus)[2]、罗非鱼(Orechromis niloticus)[3]、齐口裂腹鱼(Schizothotax prenanti)[4]、宝石鲈(Scrotum barcoo)[5]、红尾皇冠鱼(Aequidens rivulatus)[6]等野生或养殖的淡海水鱼类, 每年给世界水产养殖业造成严重的损失[7]。荚膜多糖是无乳链球菌最主要的毒力因子之一, 荚膜多糖血清分型(CPS)被广泛应用于无乳链球菌分子流行病学中, 其重复性好、特异性强且易于操作[8]。根据荚膜多糖基因簇的差异, 无乳链球菌可分为10种血清型(Ia、Ib、IIIX型)[9], 其中Ia和III型是鱼源无乳链球菌的主要流行血清型[3]。Chen等[10]报道人源Ia、III和V血清型无乳链球菌能够感染罗非鱼, 但在不同鱼源无乳链球菌之间是否存在交叉感染情况还有待进一步的研究。
目前有很多分子分型的方法被应用于无乳链球菌的流行病学监控[11], 其中就包括多位点序列分型(Multilocus Sequence Typing, MLST)和脉冲场凝胶电泳(Pulsed-field gel electrophoresis, PFGE)技术。Lusiastuti等[12]运用MLST方法对鱼源和牛源无乳链球菌进行分子分型研究发现二者属于不同的STs型, 推测无交叉感染的可能性。Kayansamruaj等[13]也通过RAPD、血清分型和MLST分析分子差异性, 认为鱼源无乳链球菌和人源、牛源无乳链球菌无相关性, 但也有报道推测人源和牛源无乳链球菌能够感染罗非鱼[14], 而罗非鱼源无乳链球菌能够感染其他的鱼类[1]。目前, 对于我国不同鱼源无乳链球菌间分子分型的比较研究还未见报道, 本研究对26株不同鱼源的无乳链球菌进行了CPS血清型的鉴定, 同时采用MLST和PFGE技术对其进行分子分型研究, 目的在于掌握目前我国不同鱼源无乳链球菌的分子特征, 为我国鱼类无乳链球菌感染的有效防控措施的制订提供依据。
1 材料与方法
1.1 菌株来源
不同鱼源无乳链球菌菌株由四川农业大学鱼病研究中心在2006—2015年分离并保存(表 1), 菌株总数为27株, 其中齐口裂腹鱼源6株、黄河裸裂尻鱼源10株、罗非鱼源10株及无乳链球菌标准菌株(ATCC51487)1株。
1.2 试验材料与设备仪器
脑心浸液培养基(BHI)购自杭州微生物试剂有限公司, 无乳链球菌标准菌株ATCC51487购自美国菌种保藏中心, 细菌DNA抽提试剂盒购自天根生化科技(北京)有限公司, DNA Marker和蛋白酶K购自大连TaKaRa公司, Sma I和溶菌酶购自生工生物工程(上海)股份有限公司, Sigma1-15普通离心机购自Sigma公司, GelDoc2000凝胶成像分析系统、Pulsed Field Certified Agarose、Quantity One®软件和CHEF Mapper®XA系统均购自Bio-Rad公司。
1.3 菌株的复苏与PCR特异性检测
将保存于–80℃无乳链球菌的保存液取出, 于常温下解冻复苏。在无菌条件下, 用移液枪吸取10 μL保菌液划线于BHI平板上, 28℃恒温培养48h后, 革兰氏染色观察细菌形态特征。对复苏无乳链球菌菌株的特异性鉴定参照王钧等[15]的方法进行PCR检测, cfb基因特异性引物(F: 5′-AAGTACATG CTGATCAAGT-3′, R: 5′-TCTTGATCAACTTGTTG TAC-3′)由成都擎科梓熙生物技术有限公司进行合成, 预期扩增片段600 bp。25 μL的PCR反应体系: PCR Master Mix (2×)12.5 μL、10 μmol/L的上下游引物各1 μL, 2 μL模板DNA, 加ddH2O至25 μL。PCR扩增产物经1.5%琼脂糖凝胶电泳观察结果并拍照记录。
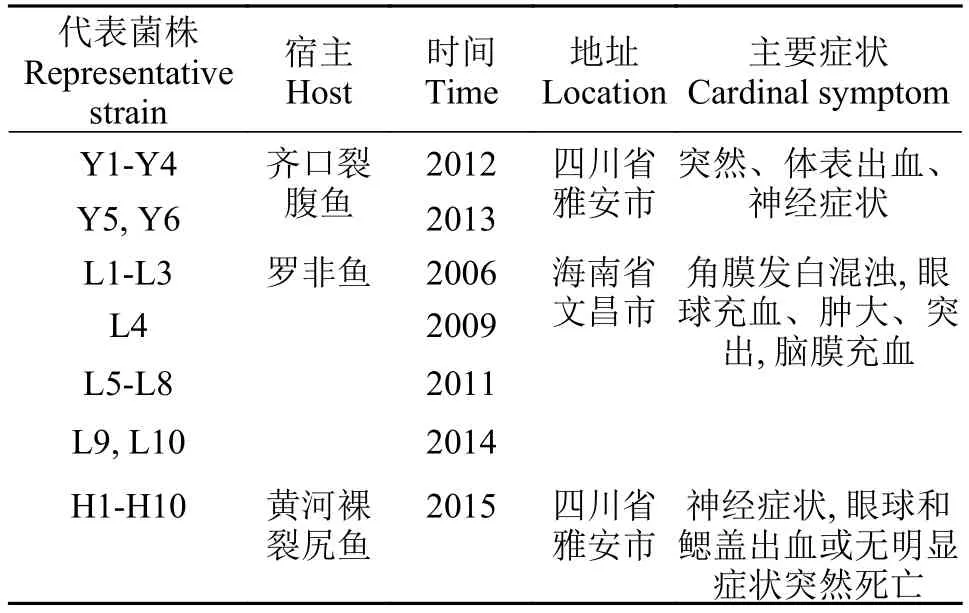
表 1 无乳链球菌菌株相关信息Tab.1 The relevant information of S.agalactiae
1.4 荚膜多糖分子血清分型
采用文献[16]的荚膜多糖差异建立的多重PCR方法鉴别不同动物源性无乳链球菌的荚膜多糖血清型。25 μL的PCR反应体系为: PCR Master Mix (2×)共12.5 μL, 2 μL模板DNA, 10 μmol/L的cpsG上下游引物各0.5 μL, 10 μmol/L的cpsL上下游引物各1 μL, 7.5 μL的ddH2O。反应条件: 首先95℃ 5min使变性;随后95℃ 60s、54℃ 60s、72℃ 2min, 15个循环; 接着95℃ 60s、56℃ 60s、72℃ 2min, 25个循环; 最后72℃ 10min。PCR扩增产物经1.5%琼脂糖凝胶电泳观察结果并拍照记录。
1.5 无乳链球菌的MLST基因分型分析
多位点序列分型的PCR扩增引物序列参照文献[17], 选取7个管家基因adhP、pheS、atr、glnA、sdhA、glcK、tkt进行PCR扩增, 相应引物(表 2)由成都擎科梓熙生物技术有限公司合成。25 μL的PCR反应体系: PCR Master Mix (2×)共12.5 μL, 10 μmol/L的上下游引物各1 μL, 2 μL模板DNA, 8.5 μL的ddH2O。反应条件:95℃ 5min;94℃ 45s、55℃45s、72℃ 45min, 33个循环;72℃ 10min。扩增产物经1.5%的琼脂糖凝胶电泳检测, 产物送成都擎科梓熙生物技术有限公司测序。测序结果提交至MLST数据库网站(http://pubmlst.org/)进行BLAST分析, 获得菌株的等位基因编号及序列型(Sequence types, STs), 未能成功BLAST出菌株序列型的则提交菌株的7个等位基因编号及菌株具体信息至MLST网络数据库获得新的序列编号。Clustal1.83将每株菌的7个管家基因的片段进行拼接后, 结果用MEGA5.02制作Neighbor-Joining种系进化树。
1.6 无乳链球菌PFGE分型分析
参照文献[18]中的试验方法操作, 主要步骤: 无乳链球菌接种于BHI, 28℃培养48h后, 用无菌接种环挑取单菌落溶于TE缓冲液(100 mmol/L Tris、100 mmol/L EDTA, pH为7.6)中, 制成细菌悬浊液;用10 mg/mL的溶菌酶、20 mg/mL的蛋白酶K和1 mg/mL的变溶菌素消化细菌; 将细菌悬浊液与凝胶溶液(每23.5 mL 0.5×TBE缓冲液中加入0.35 g低熔点琼脂糖)混合制成胶块。用50 U的Sma I限制性内切酶对胶块DNA进行酶切。在CHEF Mapper® XA进行电泳。电泳程序为: 电压为6 V/cm, 脉冲时间为10—45s, 电泳夹角为120°, 电泳时间为18h, 电泳温度保持在14℃。PFGE图像用Quantity One 4.6.2软件进行建树, 采用非加权组平均法(UPGMA)对PFGE图像进行聚类分析, 以相似性系数(F)>85%作为同类株的判断标准[19]。

表 2 无乳链球菌管家基因位点的相关试验参数Tab.2 The parameters of the housekeeping gene locus of S.agalactiae
2 结果
2.1 菌株复苏与基于cfb基因的特异性检测
26株不同鱼源无乳链球菌在28℃培养48h, 则在BHI上形成表面光滑、微隆起、边缘整齐的乳白色圆形菌落。革兰氏染色镜检发现所有无乳链球菌均为球形, 单个、成双或链状排列。使用引物cfb-F和cfb-R分别扩增26株无乳链球菌及ATCC51487标准菌株的cfb基因均可获得长度约为600 bp的清晰条带。
2.2 荚膜多糖血清分型结果
26株菌血清型PCR鉴定结果显示扩增出272和688 bp两个片段为血清型Ia型菌株, 共22株。扩增出352和688 bp两个片段为血清型III型菌株, 共4株。齐口裂腹鱼源无乳链球菌中存在Ia (n=2, n指代数量)和III(n=4)型两种血清型, 黄河裸裂尻鱼源和罗非鱼源无乳链球菌均只有Ia型一种血清型。
2.3 MLST的结果分析
26株无乳链球菌 AdhP、PheS、atr、glnA、sdhA、glcK和tkt7个管家基因PCR扩增产物经1.5%琼脂糖凝胶电泳后, 获得与预期结果相一致、清晰的条带。26株无乳链球菌中共出现了3种序列型(表 3), 其中ST-891(n=20, 76.9%)为优势血清型别, ST-19(n=4, 15.4%), ST-103(n=2, 7.7%), 同时ST-891为本次实验获得的新型序列号。图 1进化树结果表明STs与宿主的来源没有明显的相关性, 同一个ST-891序列型种既包含罗非鱼源无乳链球菌, 又包含黄河裸裂尻鱼源无乳链球菌; 同时齐口裂腹鱼源无乳链球菌则分布于不同的STs型中(ST-19与ST-103)。
2.4 无乳链球菌PFGE分型分析
经SmaⅠ酶切电泳后, 26株鱼源无乳链球菌(黄河裸裂尻鱼n=10, 罗非鱼n=10, 齐口裂腹鱼n=6)聚类分析可分为16个PFGE谱型(A-P)(图 2)。其中优势带型为P型9株, M型3株, 其余带型各1株。在Cluster P中包含了3株罗非鱼源无乳链球菌和6株黄河裸裂尻鱼源无乳链球菌。UPGMA聚类分析结果显示, 相同CPS血清型—STs型的无乳链球菌菌株在PFGE中呈现高度聚集。
3 讨论
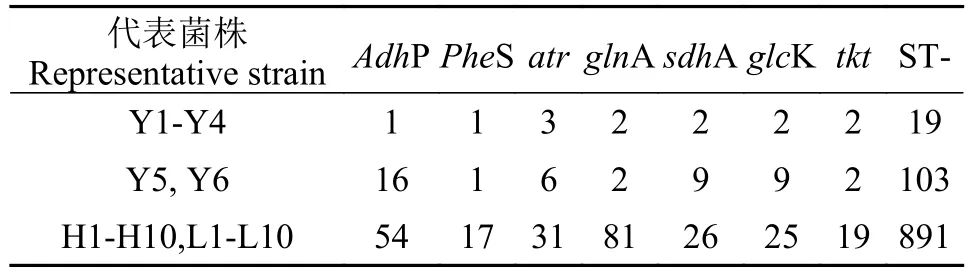
表 3 无乳链球菌测序菌株的等位基因型Tab.3 The alleles type of the sequencing bacterial strain of S.agalactiae
目前我国对于无乳链球菌的研究主要集中于耐药性[20]、毒力因子[21]和疫苗研究[22]等方面, 而对于不同鱼源无乳链球菌种间分子特征比较及其同源性分析的报道还很缺乏。荚膜多糖(Capsular polysaccharides, CPS)是特异性多糖, 无乳链球菌的主要毒力因子之一, 其血清型是由荚膜区域的血清特异基因决定[23]。传统的血清型鉴定方法包括协同凝集试验、免疫沉淀、酶免疫测定等, 但这些方法必须有特异性血清抗体且工作量较大[24], 已经无法满足无乳链球菌的分子流行病学研究。随着分子生物学的发展和无乳链球菌全基因组测序完成,基于PCR[25]鉴定荚膜区域血清型特异性基因的检测方法得到发展和完善, 该类方法在普通实验室条件下即可完成, 分辨率高、重复性好且分析结果准确可靠。本研究中26株不同鱼源无乳链球菌共鉴定出Ia (n=22)和III(n=4)型2种血清型, 其中黄河裸裂尻鱼源和罗非鱼源无乳链球菌均为Ia型, 齐口裂腹鱼源无乳链球菌存在Ia (n=2)和III(n=4)型2 种血清型。血清分型结果与诸多已报道的鱼源无乳链球菌大多为Ia和III型血清型结果相符[26,27], 表明我国鱼源无乳链球菌的荚膜多糖血清型较为稳定。

图 1 不同鱼源无乳链球菌的MLST的分子分型情况Fig.1 The molecular typing profiles of MLST of S.agalactiae isolated from fish
血清型分析仅是基于无乳链球菌的荚膜多糖进行的差异比较, 因此有必要结合更为准确、分辨率更高的基因分型方法, 如MLST和PFGE, 获得更细微的基因差异信息, 同时与血清型进行比较分析,掌握更完整的无乳链球菌流行病学信息, 为追溯无乳链球菌的感染源及疾病的防治提供参考。MLST是无乳链球菌分子流行病学检测的重要工具, 其优势在于操作简单, 是标准化的核苷酸测序技术, 且获得的数据易于保存分析。本研究中共鉴定出3种STs型, 其中ST-891(n=20)为优势序列型且为新获得的序列编号, 同时发现MLST分型与CPS血清型有很好的相关性, 黄河裸裂尻鱼源和罗非鱼源无乳链球菌CPS血清型均为Ia型且MLST分型均为ST-891; 齐口裂腹鱼源无乳链球菌中CPS血清型为Ia型的MLST分型为ST-103(n=2), CPS血清型为III型的MLST分型为ST-19(n=4), 表明齐口裂腹鱼源菌株分子分型具有多样性, 提示其存在遗传变异的情况。
PFGE分型技术对于流行性疾病的调查研究具有很高的辨识能力[28,29], 在实际应用中常和MLST分型技术联合监测细菌的分子流行病学信息[30,31]。PFGE中采用限制性内切酶Sma Ⅰ对无乳链球菌进行酶切分析, 并根据其条带的差异性将其分型, 以相似性系数(F)>85%作为同类株的判断标准共划分为A-P16个谱型, 其中作为优势带型的Cluster P包含了9株菌(罗非鱼源n=3, 黄河裸裂尻鱼源n=6)。且发现相同CPS–STs型菌株在PFGE脉冲场带型中呈现高度聚集现象。但2种分子分型方法相比较发现PFGE具有更高的辨识度, 能分辨出的基因差异更大, 而MLST的数据可操控能力更强, 数据可重复利用率高, 能将不同实验室之间的数据进行比较研究。因此, 这2种方法的结合将更为全面的展示不同鱼源无乳链球菌的分子特征差异性。不同鱼源无乳链球菌间分子特征的相似性提示其存在交叉感染的可能性, 而同种鱼源无乳链球菌间分子特征的多样性提示其发生了遗传变异。虽然在本研究中还没有探讨人源、鱼源和畜源无乳链球菌间分子特征的差异性, 但已有报道称人源的无乳链球菌能够感染鱼类[32]。因此, 在将来有必要进一步开展人、畜与鱼等不同动物源性无乳链球菌间的分子特征差异性研究, 分析菌株间的相关性和同源性,并追溯感染来源, 从而为无乳链球菌感染这种人兽共患病更科学有效的防治方案的制订提供依据。
[1]Evans J, Klesius P, Gilbert P, et al.Characterization of ihaemolytic Group B Streptococcus agalactiae in cultured seabream, Sparus auratus L., and wild mullet, Liza klunzingeri (Day), in Kuwait [J].Journal of Fish Diseases, 2002, 25(9): 505—513
[2]Duremdez R, Al-marzouk A, Qasem J, et al.Isolation of Streptococcus agalactiae from cultured silver pomfret, Pampus argenteus (Euphrasen), in Kuwait [J].Journal of Fish Diseases, 2004, 27(5): 307—310
[3]Li L, Wang R, Liang W, et al.Rare serotype occurrence and PFGE genotypic diversity of Streptococcus agalac-tiae isolated from tilapia in China [J].Veterinary Microbiology, 2013, 167(3): 719—724
[4]Yu Z H, Zhang J, Geng Y, et al.Isolation, identification and pathogenicity of Streptococcus agalactiae from Schizothorax prenanti [J].Journal of Fishery Sciences of China, 2014, 21(6): 1244—1252 [余泽辉, 张佳, 耿毅,等.齐口裂腹鱼无乳链球菌的分离鉴定及其感染的病理损伤.中国水产科学, 2014, 21(6): 1244—1252]
[5]Liu L, Li Y, He R, et al.Outbreak of Streptococcus agalactiae infection in barcoo grunter, Scortum barcoo (McCulloch & Waite), in an intensive fish farm in China [J].Journal of Fish Diseases, 2014, 37(12): 1067—1072
[6]Yao X L, Xu X L, Li H M, et al.Biological characteristics of pathogenic Streptococcus agalactiae isolated from Aequidens rivulatus [J].Progress in FIshery Sciences, 2015, 36(2): 106—112 [姚学良, 徐晓丽, 李贺密, 等.红尾皇冠鱼 (Aequidens rivulatus) 病原无乳链球菌的分离、鉴定与特性分析.渔业科学进展, 2015, 36(2): 106—112]
[7]Pasnik D J, Evans J J, Klesius P H.Duration of protective antibodies and correlation with survival in Nile tilapia Oreochromis niloticus following Streptococcus agalactiae vaccination [J].Diseases of Aquatic Organisms, 2005, 66(2): 129—134
[8]Poyart C, Tazi A, R Glier-Poupet H, et al.Multiplex PCR assay for rapid and accurate capsular typing of group B streptococci [J].Journal of Clinical Microbiology, 2007, 45(6): 1985—1988
[9]Slotved H-C, Kong F, Lambertsen L, et al.Serotype IX, a proposed new Streptococcus agalactiae serotype [J].Journal of Clinical Microbiology, 2007, 45(9): 2929—2936
[10]Chen M, Wang R, Luo F-G, et al.Streptococcus agalactiae isolates of serotypes Ia, III and V from human and cow are able to infect tilapia [J].Veterinary Microbiology, 2015, 180(1): 129—135
[11]Haguenoer E, Baty G, Pourcel C, et al.A multilocus variable number of tandem repeat analysis (MLVA) scheme for Streptococcus agalactiae genotyping [J].BMC Microbiology, 2011, 11(1): 1—13
[12]Lusiastuti A M, Seeger H, Indrawati A, et al.The Comparison of Streptococcus agalactiae Isolated from Fish and Bovine using Multilocus Sequence Typing [J].HAYATI Journal of Biosciences, 2013, 20(4): 157—162
[13]Kayansamruaj P, Pirarat N, Katagiri T, et al.Molecular characterization and virulence gene profiling of pathogenic Streptococcus agalactiae populations from tilapia (Oreochromis sp.) farms in Thailand [J].Journal of Veterinary Diagnostic Investigation, 2014, 26(4): 488—495
[14]Srensen U B S, Poulsen K, Ghezzo C, et al.Emergence and global dissemination of host-specific Streptococcus agalactiae clones [J].MBio, 2010, 1(3): e00178—10
[15]Wang J, Wang K Y, Xiao D, et al.Development of double PCR for rapid detection of Streptococcus agalactiae isolated from tilapia [J].Chinese Veterinary Science, 2011, 41(5): 496—502 [王均, 汪开毓, 肖丹, 等.罗非鱼源无乳链球菌双重PCR快速检测方法的建立.中国兽医科学, 2011, 41(5): 496—502]
[16]Imperi M, Pataracchia M, Alfarone G, et al.A multiplex PCR assay for the direct identification of the capsular type (Ia to IX) of Streptococcus agalactiae [J].Journal of Microbiological Methods, 2010, 80(2): 212—214
[17]Jones N, Bohnsack J F, Takahashi S, et al.Multilocus sequence typing system for group B Streptococcus [J].Journal of Clinical Microbiology, 2003, 41(6): 2530—2536
[18]Bosch T, Deneeling A J, Schouls L M, et al.PFGE diversity within the methicillin-resistant Staphylococcus aureus clonal lineage ST398 [J].BMC Microbiology, 2010, 40(10): 1—7
[19]Gomes-Neves E, Antunes P, Tavares A, et al.Salmonella cross-contamination in swine abattoirs in Portugal: Carcasses, meat and meat handlers [J].International Journal of Food Microbiology, 2012, 157(1): 82—87
[20]Chen M, Li L-P, Wang R, et al.PCR detection and PFGE genotype analyses of streptococcal clinical isolates from tilapia in China [J].Veterinary Microbiology, 2012, 159(3): 526—530
[21]Liu L H, Zhang D F, Li N Q, et al.Identification, serotype analysis and drug sensitivity test of Streptococcus agalactiae from Cirrhinus molitorella [J].Journal of Southern Agriculture, 2015, 46(11): 2053—2058 [刘礼辉, 张德锋, 李宁求, 等.鲮鱼源无乳链球菌的鉴定, 血清型分析及药敏试验.南方农业学报, 2015, 46(11): 2053—2058]
[22]Huang T, Li L P, Wang R, et al.Pathogenic bacteria Streptococcus agalactiae and S.iniae in diseased ovate pompano Teachinotus ovatus [J].Journal of Dalian Ocean University, 2014, 29(2): 161—166 [黄婷, 李莉萍,王瑞, 等.卵形鲳鲹感染无乳链球菌与海豚链球菌的研究.大连海洋大学学报, 2014, 29(2): 161—166]
[23]Ding Y, Zhao J, He X, et al.Antimicrobial resistance and virulence-related genes of Streptococcus obtained from dairy cows with mastitis in Inner Mongolia, China [J].Pharmaceutical Biology, 2016, 54(1): 162—167
[24]Li W, Su Y L, Mai Y Z, et al.Comparative proteome analysis of two Streptococcus agalactiae strains from cultured tilapia with different virulence [J].Veterinary Microbiology, 2014, 170(1): 135—143
[25]Li L, Wang R, Liang W, et al.Development of live attenuated Streptococcus agalactiae vaccine for tilapia via continuous passage in vitro [J].Fish & Shellfish Immunology, 2015, 45(2): 955—963
[26]Cheng S L, Liu X F, Zheng W, et al.Streptococcus agalactiae Infection in Fish [J].Progress in Veterinary Medicine, 2016, 37(2): 105—109 [程世亮, 刘新风, 郑文,等.鱼类无乳链球菌病.动物医学进展, 2016, 37(2): 105—109]
[27]Chaffin D O, Beres S B, Yim H H, et al.The serotype of type Ia and III group B Streptococci is determined by the polymerase gene within the polycistronic capsule operon [J].Journal of Bacteriology, 2000, 182(16): 4466—4477
[28]Mawn J, Simpson A, Heard S.Detection of the C protein gene among group B streptococciusing PCR [J].Journal of Clinical Pathology, 1993, 46(7): 633—636
[29]Ye X, Li J, Lu M, et al.Identification and molecular typing of Streptococcus agalactiae isolated from pond-cultured tilapia in China [J].Fisheries Science, 2011, 77(4): 623—632
[30]Suanyuk N, Kong F, Ko D, et al.Occurrence of rare genotypes of Streptococcus agalactiae in cultured red tilapia Oreochromis sp.and Nile tilapia O.niloticus in Thailand-Relationship to human isolates [J].Aquaculture, 2008, 284(1): 35—40
[31]Olive D M, Bean P.Principles and applications of methods for DNA-based typing of microbial organisms [J].Journal of Clinical Microbiology, 1999, 37(6): 1661—1669
[32]Yang Y, Liu Y, Ding Y, et al.Molecular characterization of Streptococcus agalactiae isolated from bovine mastitis in Eastern China [J].PloS One, 2013, 8(7): e67755
[33]Mahmmod Y, Klaas I, Katholm J, et al.Molecular epidemiology and strain-specific characteristics of Streptococcus agalactiae at the herd and cow level [J].Journal of Dairy Science, 2015, 98(10): 6913—6924
[34]Delannoy C M, Crumlish M, Fontaine M C, et al.Human Streptococcus agalactiae strains in aquatic mammals and fish [J].BMC Microbiology, 2013, 41(13): 1—9
SEROTYPES AND MOLECULAR TYPING OF STREPTOCOCCUS AGALACTIAE ISOLATED FROM FISH
ZHANG Yu-Wei1, GENG Yi1, YU Ze-Hui1, WANG Kai-Yu1, CHENG De-Fang2, XIANG Zheng-Gang1, LI Ya-Jun1, GUO Kun-Ning1and MOU Wei-Hao1
(1.Veterinary Medicine of Sichuan Agricultural University, Wenjiang 611130, China; 2.Aquaculture System of Sichuan Agricultural University, Wenjiang 611130, China)
To analyze molecular typing characteristics of Streptococcus agalactiae isolated from different fish sources and understand the correlation and homology between the strains, this study identified capsular polysaccharide serotype (CPS) with multiplex PCR for 26 S.agalactiae.Multilocus sequence typing (MLST) and pulsed field gel electrophoresis (PFGE) were adopted to study the molecular characteristics and homology based on the specific cfb gene of S.agalactiae.The results showed that CPS type had Ia (n=22) and III (n=4) two types, of which S.agalactiae isolated from Schizopygopsis pylzovi and tilapia were Ia, and S.agalactiae isolated from Schizothorax prenati existed Ia (n=2) and III (n=4) two types.Multilocus sequence typing
three STs sequence types (ST-891、ST-103、ST-19), among which the sequence types of S.agalactiae isolated from Schizopygopsis pylzovi and tilapia were new sequence type ST-891, and S.agalactiae isolated from Schizothorax prenati existed ST-19 and ST-103 two sequence types.PFGE cluster analysis created 16 banding patterns (A-P), and the cluster P was the preponderant type.Similar capsular polysaccharide serotype—MLST type strains presented high concentration in the PFGE type.CPS types, MLST types and PFGE types were correlated, but CPS types, STs sequence types and PFGE banding types had no obvious correlation with the host’s sources.The similarity of molecular characteristics of S.agalactiae isolated from different fish sources suggests the possibility of cross infection, and the diversity of molecular characteristics of Schizothorax prenati suggest the existence of heritable variation.
Streptococcus agalactiae; Capsular polysaccharide serotype; Multilocus sequence typing; Pulsed Field Gel Electrophoresis
S941.41
A
1000-3207(2017)04-0800-07
10.7541/2017.100
2016-07-10;
2016-11-04
四川省淡水鱼产业技术体系创新团队建设项目资助 [Supported by Sichuan Province Freshwater Fish Industry System Innovation Building Project Funding]
张雨薇(1992—), 女, 四川成都人; 硕士研究生; 研究方向为动物病原学与分子生物学。E-mail: 463714019@qq.com
耿毅(1974—), 男, 四川安岳人; 教授; 主要从事动物病原学与病理学的教学与研究工作。E-mail: gengyisicau@126.com
