不同温度下恩诺沙星及其代谢物在斑点叉尾鮰各组织中的残留及消除规律比较
2017-08-16杨秋红艾晓辉刘永涛胥宁赵
杨秋红艾晓辉刘永涛胥 宁赵 凤
(1.中国水产科学研究院长江水产研究所, 农业部淡水鱼类种质监督检验测试中心, 武汉 430223; 2.贵州省水产研究所, 贵阳 550025)
不同温度下恩诺沙星及其代谢物在斑点叉尾鮰各组织中的残留及消除规律比较
杨秋红1艾晓辉1刘永涛1胥 宁1赵 凤2
(1.中国水产科学研究院长江水产研究所, 农业部淡水鱼类种质监督检验测试中心, 武汉 430223; 2.贵州省水产研究所, 贵阳 550025)
分别在18℃和28℃水温下, 以20 mg/(kg·d)鱼体质量对斑点叉尾鲙给药恩诺沙星, 连续灌胃7d。给药后在不同的时间点取样, 用高效液相色谱荧光检测器检测, 研究恩诺沙星及其主要代谢产物环丙沙星在斑点叉尾鲙体内(血液、肌肉、皮肤、肝脏和肾脏)的残留消除规律。结果表明, 恩诺沙星在不同组织、不同水温消除速率不同: 水温为18℃, 皮肤、肝脏、肾脏和肌肉中的消除曲线方程分别为C=1022.1e–0.034t、C=2601.3e–0.046t、C=2903.6e–0.072t和C=1186.5e–0.036t, 消除半衰期分别为31.79d、45.29d、16.15d和35.54d; 水温为28℃, 皮肤、肝脏、肾脏和肌肉中的消除曲线方程分别为C=8805.5e–0.04t、C=3154e–0.08t、C=4145.1e–0.1t和C=1302.1e–0.068t, 消除半衰期分别为18.33d、6.26d、12.44d和10.34d。恩诺沙星在斑点叉尾鲙体内可代谢为环丙沙星, 恩诺沙星在斑点叉尾鲙体内的代谢速度较慢, 代谢物环丙沙星在斑点叉尾鲙体内的消除速度比恩诺沙星快; 在18℃水温下,斑点叉尾鲙肉中的恩诺沙星和环丙沙星完全消除需要150d以上; 在28℃水温下, 斑点叉尾鲙肉中的恩诺沙星和环丙沙星完全消除需要120d。在实验条件下, 建议水温为18℃和28℃时, 休药期分别为3240℃·日和4200℃·日。
斑点叉尾鲙; 恩诺沙星; 环丙沙星; 消除; 残留
恩诺沙星(Enrofloxacin, EF)又名乙基环丙氟哌酸、乙基环丙沙星, 俗称海达, 属第3代喹诺酮类药物, 是化学合成的第三代喹诺酮类广谱抗菌药物,是一族新型杀菌性抗菌药[1—3]。具有口服及肌注后吸收迅速、完全、消除半衰期较长、体内分布广泛、表观分布容积大等药动学特征, 因其具有抗菌谱广、抗菌力强、作用迅速、体内分布广泛, 与其他抗菌药之间无交叉耐药性及敏感微生物的最小抑菌浓度MIC较低等特点, 而广泛用于动物和人类多种感染性疾病的治疗, 对水产动物多种细菌感染性疾病也具有很好的疗效。但由于养殖人员缺乏相应的理论指导, 使用过程中导致药物滥用, 而且恩诺沙星代谢缓慢, 易残留于动物体的肌肉、肝脏和肾脏等组织中, 其毒副作用逐渐显现, 加上人们对食品安全意识的不断加强, 其药物及代谢产物环丙沙星(Ciprofloxacin, CF)残留问题已引起了国内外的普遍重视[4—8]。
鉴于此, 国内外已报道了恩诺沙星在养殖鱼类如虹鳟、大西洋鲑、鳗鲡、鲈、眼斑石首鱼和鲤等体内的残留情况, 有关恩诺沙星在斑点叉尾鲙(Ietalurus punetaus)体内的残留及消除规律研究尚未见报道。笔者主要研究了在不同水温下, 多次口服恩诺沙星后, 其在斑点叉尾鲙各组织中的残留和消除特点, 据此确定合理的用药方案, 确立休药期,为药物残留标准的限量提供基础性数据, 为渔药残留监控和食品安全提供科学依据。
1 材料与方法
1.1 材料
实验动物健康斑点叉尾鲙, 平均质量为(60.13±15.23) g, 由湖北省仙桃市水产局提供, 试验在实验室网箱中进行。室温由空调控制在16℃, 室内水温在(18±2)℃左右, 通过加热棒调节水温, 可控制水温在(28±2)℃, 实验在这2种温度下进行。实验前, 斑点叉尾鲙在室内网箱(1 m×2 m×1.5 m)内暂养一周, 每个网箱放置50尾, 共3个网箱。试验期间,每天上午8点和下午6点投喂饲料, 并记录水温。
试剂乙腈、正己烷、质谱水(色谱纯, 美国CNW公司), 四丁基溴化铵(分析纯, 国药集团化学试剂有限公司), 无水硫酸钠(分析纯, 国药集团),恩诺沙星标准品(纯度>99.0%, Dr.Ehrenstorfer GmbH), 环丙沙星标准品(纯度>95.0%, Dr.Ehrenstorfer GmbH), 水产用盐酸恩诺沙星粉(纯度99.8%,产品批号120418-8, 购自浙江国邦药业有限公司)。
仪器高效液相色谱(Waters515泵, 717自动进样器, 2475多通道荧光检测器, 配Empower色谱工作站, 美国Waters公司), METTLE-TOLEDO精密电子天平(AE-240, 梅特勒-托利多公司), 自动高速冷冻离心机(20PR-520, 日本HITACH公司), 旋转蒸发仪(Hei-VAP, 德国Heidolph公司), 氮吹仪(KD200,杭州奥盛仪器有限公司), 涡旋混合器(HQ-60, 北方同正)。
1.2 实验设计
称取盐酸恩诺沙星原粉400 mg, 用5%冰醋酸溶解后, 加饲料10 g, 定容至100 mL, 此时EF含量为4 mg/mL, 使用20 mg/(kg·d)的剂量连续灌胃7d, 每天固定在上午9点喂药。随后定时投喂无药的饲料,每天两次, 并记录水温。在第7天投药结束后, 立即采样, 此样品算作第0天样品, 其后从最后一次灌胃算, 1、3、5、7、9、11、13、15、20、30、45、65d ¢ ¢¢¢¢¢后采样, 算作第1、第3、第5、第7、第9、第11、第13、第15、第20、第30、第45、第65天¢¢¢¢¢¢的样品。每次各取斑点叉尾鲙5尾作为平行样, 现场取斑点叉尾鲙血浆、肌肉、皮肤、肝脏和肾脏,用均浆机或剪刀制成均匀样品, 及时送至实验室处理和检测。实验时间2013年7月—2013年10月。
1.3 方法
样品处理准确称取剪碎或研磨后的肌肉样品5.00 g(肝脏、肾脏、皮肤各1.00 g, 血浆1.00 mL), 依次加入5 g无水硫酸钠(肝脏、肾脏、皮肤、血浆各1 g)和10 mL酸化乙腈(肝脏、肾脏、皮肤、血浆各5 mL), 用涡旋仪混匀后, 超声10—15min后, 6000 r/min离心5min, 去上层清液。往残渣中继续加10 mL酸化乙腈(肝脏、肾脏、皮肤、血浆各5 mL), 重复操作, 合并上层清液, 于55℃氮吹仪上氮吹至干。用2.0 mL流动相充分溶解, 涡旋并离心后, 并经0.22 μm微孔过滤膜过滤后,供高效液相色谱仪测定。
标准溶液配制和标准曲线的制备准确称取0.020 g恩诺沙星和环丙沙星, 用乙腈稀释, 并定容至100 mL, 配制成200 mg/L的标准储备液。配制时使用棕色容量瓶, 低温避光储存, 有效期为6个月。将恩诺沙星和环丙沙星标准储备液用流动相依次稀释, 配制恩诺沙星和环丙沙星的浓度为5、10、20、50和100 ng/mL的低浓度标准曲线; 配制恩诺沙星和环丙沙星的浓度为100、200、500、1000和2000 ng/mL的高浓度标准曲线。采用高效液相色谱荧光检测器分析检测。以恩诺沙星、环丙沙星浓度为横坐标X, 以其峰面积为纵坐标Y, 绘制标准曲线, 并计算回归方程及相关系数。
回收率和检测限取不含恩诺沙星和环丙沙星药物的斑点叉尾鲙组织(以下简称空白样品)加入一定量的恩诺沙星、环丙沙星标准溶液, 放置至少30min, 每个样品同时做7个平行。再按照样品预处理方法进行处理后进样, 分别计算组织中恩诺沙星和环丙沙星的含量。空白样品中添加的质量浓度分别为: 1、4、20和100 μg/kg。以引起3倍基线噪音的药量的质量浓度作为最低检测限。
色谱条件色谱柱: 反相色谱柱C18柱(250 mm× 4.6 mm, 5 μm); 流动相鲶乙腈鲶四丁基溴化铵=10鲶90(v/v); 流速1.0 mL/min; 激发波长280 nm, 发射波长450 nm; 柱温: 30℃; 进样量: 10 μL。
数据处理标准曲线, 消除方程及休药期计算, 采用Microsoft Excel 2010进行处理和绘制, 消除规律柱状图采样Origin7.5进行计算和绘制。消除方程采用C=C0e–kt, C表示药物浓度, C0为残留消除对数曲线的截距(μg/kg或ng/mL), k表示消除速率常数。
2 结果
2.1 标准曲线与相关系数、方法检测限及回收率
在5—100 ng/mL和100—2000 ng/mL内恩诺沙星线性关系良好, 其线性方程分别为: Y=18101X–754315、Y=20404X–2×106; 相关系数r2均大于0.9980。在本试验条件下, 组织中恩诺沙星最低检测限为1.0 μg/L, 环丙沙星最低检测限为2.0 μg/L。各组织中低、中、高3个质量浓度加标水平的恩诺沙星和环丙沙星平均回收率在70.35%—90.63%, 分析方法满足要求。
2.2 水温为18℃时, 恩诺沙星及其代谢物在斑点叉尾鲖体内的残留消除情况
从表 1可以很明显地看出, 在水温为18℃时, 斑点叉尾鲙5种组织中EF的初始残留浓度大于CF的残留浓度, 而且在代谢过程中, EF代谢速率比CF快。第0天, 肝脏中EF浓度最高, 远远大于其他组织中的浓度, 其次是肾脏和血液, 皮肤和肌肉中较低。随后肝脏、肾脏和血液中的EF残留浓度在停止用药后第5天(以下简称第5天), 浓度迅速下降至初始浓度的5%左右, 降解速率极快。至第9天, 皮肤和肌肉中的EF残留浓度降至初始浓度的1/2以下。初始CF残留浓度在肝脏中最高, 其次是肾脏和肌肉中, 皮肤和血液中最少。随后时间, 血液中CF略有增加, 并在第9天消除至检测限以下。肾脏中的CF残留浓度在第3天也增高至971.88 μg/kg, 并于第30天消除完。肝脏和皮肤中的CF在第3天增至最高后, 逐步降低, 并均于第90天消除至检测限以下。肌肉中CF浓度从第0天的558.61 μg/kg逐步降低, 第7天降至最高浓度1/2以下, 第120天完全消除。

表 1 在水温为18℃条件下, 斑点叉尾鲙体内的恩诺沙星及其代谢物残留量Tab.1 Residues of enrofloxacin and its metabolites in tissues of channel catfish under the temperature of 18℃
2.3 水温为28℃时, 恩诺沙星及其代谢物在斑点叉尾鲖体内的残留消除情况
从表 2得出, 在水温为28℃时, 第0天斑点叉尾鲙5种组织中EF的初始残留浓度也是大于CF的残留浓度, EF代谢速率比CF快。第0天肝脏、皮肤和肾脏中EF浓度较高, 肌肉和血液中略低。第 0天肝脏中EF浓度最高, 达到110861.49 μg/kg, 第3天迅速降至1979.68 μg/kg, 随后在缓慢降低的过程中, 浓度偶有增加, 第90天完全消除。皮肤、肾脏和肌肉的EF浓度至第5天均降至初始浓度的10%以下。血液的EF浓度从最初的8831.38 μg/kg逐步降低, 至第30天降解完。从初始浓度至第3天, 血液中CF残留浓度均降低50%以上, 第7天消除完。肾脏中CF浓度至第45天消除完, 肝脏中CF浓度至第65天消除完。而皮肤和肌肉中CF残留浓度第90天才完全消除。
2.4 水温18℃和28℃时, 恩诺沙星及其代谢物在斑点叉尾鲖体内的残留消除比较
从初始浓度来看: 在2种水温下, EF的初始浓度总是比CF浓度高。水温为28℃, 皮肤和肌肉中EF的初始浓度比水温为18℃高, 血液、肝脏和肾脏初始浓度则在18℃时较高, 这说明在高水温下血液循环加快, 使得药物进入外周室的速率加快, 18℃时血液、肝脏和肾脏的药物吸收量大。除肌肉中CF的初始浓度略低外, 其余4种组织中, 水温为28℃CF初始浓度较水温为18℃时高, 这说明水温越高, EF转化为CF的速率越高。
从降解趋势来看: 水温为18℃, 5种组织中的EF第0天达到最高浓度, 随后迅速降解然后再缓慢降低; 除了肌肉中的CF是由第0d的最高逐步降解之外, 其余4种组织中的CF浓度都是先升高, 后降低。整体来说, 浓度降解趋势比较明了。水温为28℃,除肝脏中EF的浓度在第3天略有增加, 其余组织中CF和EF都是第0天初始达到最高浓度后开始降低,但是有一个很明显的特点, 在随后的消除过程中, EF和CF的残留浓度又会升高, 再降低, 出现反复吸收的过程。
从降解速率来看: 水温为28℃时, 不管是CF还是EF降解速率明显比水温为18℃的快。水温在28℃, 皮肤中EF浓度第0天为69153.72 μg/kg, 第3天急剧降至6882.77 μg/kg, 降解率为90.0%; 而同样情况, 肾脏降解率为91.3%。在水温为28℃时, 皮肤中CF浓度从第0到第3天降解率为87.5%, 肾脏降解率为61.5%。水温为18℃, 皮肤中EF浓度从第0到第3天降解率为30.9%, 差不多是水温为28℃时降解率的1/3; 同样情况肾脏降解率为64.9%, 几乎是水温为28℃时降解率的2/3。
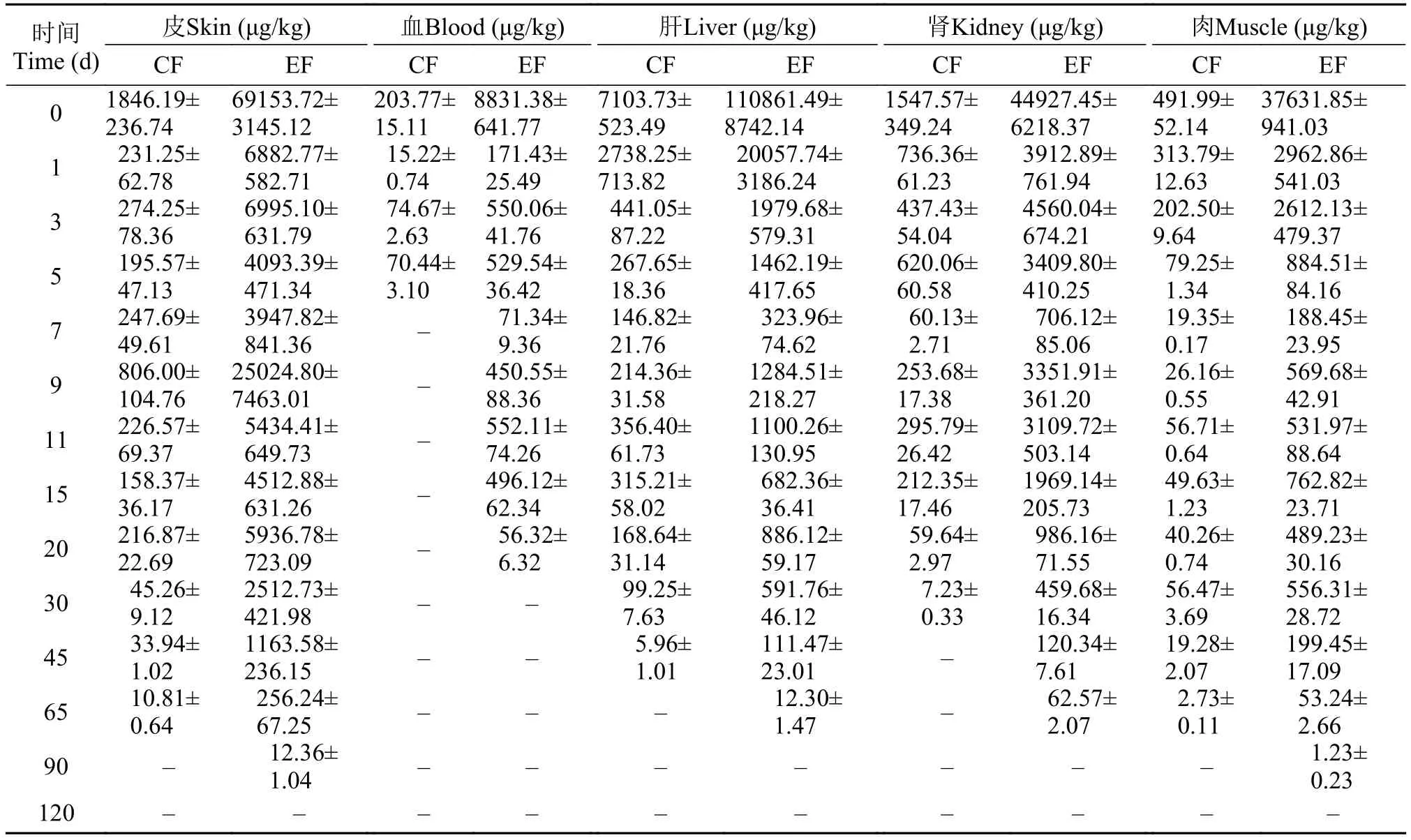
表 2 在水温为28℃条件下, 斑点叉尾鲙体内的恩诺沙星及其代谢物残留量Tab.2 Residues of enrofloxacin and its metabolites in tissues of channel catfish under the temperature of 28℃
从消除时间来看: CF的消除时间比EF消除时间短。28℃水温下药物的消除时间比18℃水温下药物消除时间短。水温18℃肝脏中的EF浓度至第150天仍残留1.34 μg/kg, 而28℃水温下, 第90天就已经未检出了。
2.5 皮肤、肝脏、肾脏和肌肉中EF的消除参数
采用Microsoft Excel处理得到药物浓度(C)-消除时间(t)关系的回归方程、相关系数(r2)以及消除半衰期(T1/2)(表 3)。在水温为18℃时, EF在皮肤、肝脏、肾脏和肌肉中的半衰期分别为31.79d、45.29d、16.15d和35.54d; 在水温为28℃时, EF在皮肤、肝脏、肾脏和肌肉中的半衰期分别为18.33d、6.26d、12.44d和10.34d。
3 讨论
3.1 恩诺沙星的代谢情况
周帅等[9]的研究结果表明: 恩诺沙星在水产动物体内反应以原形物为主, 其代谢产物检测到少量的环丙沙星, 且恩诺沙星在生物体内脱乙基反应生成环丙沙星, 然后进一步加氢还原生成哌嗪环开环化合物。房文红等[10]研究了恩诺沙星在在拟穴青蟹血淋巴中的代谢产物及其结构, 发现3种代谢产物,分别为环丙沙星, 羟基化恩诺沙星以及加氧恩诺沙星, 这表明, 恩诺沙星在不同动物体内的代谢存在较大的种属差异, 主要原因可能是参与药物代谢的酶组成和水平不同[11]。本研究结果表明, 采用恩诺沙星灌胃斑点叉尾鲙, 斑点叉尾鲙体内可同时检测到恩诺沙星和环丙沙星, 这表明恩诺沙星可代谢为环丙沙星, 但是代谢率较低。比如在结束灌药后,即第0天的检测结果来看, 18℃时EF为209864.87 μg/ kg, CF为5232.17 μg/kg, 后者是前者的2.5%; 28℃时EF为110861.49 μg/kg, CF为7103.73 μg/kg是前者的6.4%。
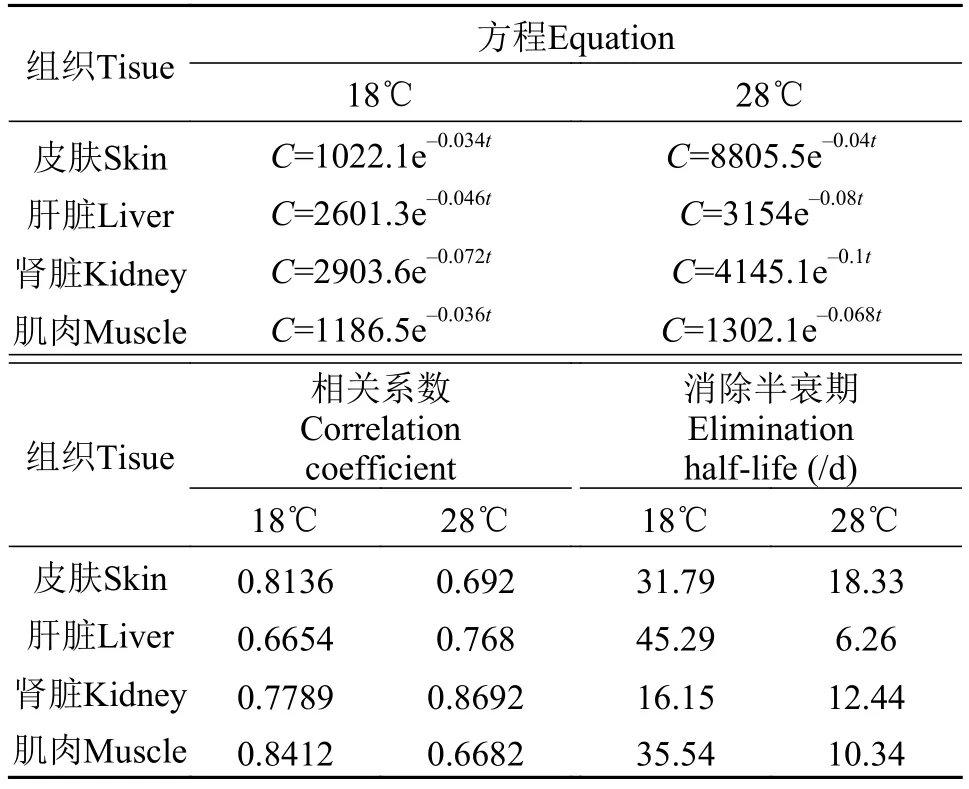
表 3 EF在斑点叉尾鲙皮肤、肝脏、肾脏和肌肉中的消除曲线方程和相关系数Tab.3 The equation of elimination curve and correlation index in skin, liver, kidney and muscle of channel catfish
3.2 温度对药物残留消除的影响
此试验表明, 试验水温对药物的吸收和分布速度有直接的影响。Ellis等[12]认为, 在一定水温范围内, 药物在鱼体中的代谢速率与水温成正比, 温度升高1℃, 鱼的代谢活力增加10%。艾晓辉等[13]的研究表明: 水温变化对水生动物药物代谢影响很大, 一般来说, 在一定范围内, 药物代谢强度与水温成正比。本实验结果表明: 水温高有利于EF在皮肤和肌肉中的迅速分布, 有利于EF迅速转化为CF并消除。有研究发现肝脏中各种细胞色素氧化还原酶负责药物代谢, 在鱼、蚌类等中都有这类酶。有研究证实, 这种酶将EF代谢为CF, 而且该酶对温度非常敏感, 28℃可能比较接近其最适温度, 因此药物消除快, 而18℃低于酶的最适温度, 酶活性低, 所以药物吸收和代谢时间延长[14]。
3.3 休药期的确定
本文研究了在不同水温下, 恩诺沙星及其代谢物在斑点叉尾鲙各个组织中的残留和消除规律, 为制定恩诺沙星在水产品中休药期提供了科学依据。制定休药期不仅要考虑最高残留限量, 还应该考虑水温等水环境状况。根据本实验结果, 在18℃水温下, 斑点叉尾鲙肉中的EF和CF完全消除需要150d以上; 在28℃水温下, 斑点叉尾鲙肉中的EF和CF完全消除需要120d, 因此建议水温为18℃和28℃时,休药期分别为3240℃·日和4200℃·日。
[1]Song H B, Wu G H, Shen M F, et al.Risk evaluation of enrofloxacin in aquatic product [J].Fishery Modernization, 2008, 35(5): 39—42 [宋洪波, 吴光红, 沈美芳, 等.恩诺沙星在水产品中残留的风险评估.渔业现代化, 2008, 35(5): 39—42]
[2]Wang H Y, Li Z X, Xing L H, et al.Pharmacokinetics of enrofloxacin and its metabolite ciprofloxacin in flounder Paralichthys olivaceus [J].Progress in Fishery Sciences, 2014, 35(3): 44—49 [王洪艳, 李兆新, 邢丽红, 等.恩诺沙星及其代谢产物环丙沙星在牙鲆体内代谢消除规律.渔业科学进展, 2014, 35(3): 44—49]
[3]Tang X Z, Li Z X, Xing L H, et al.Analysis on the metabolites of enrofloxacin in the carp liver by using HPLC/Q-TRAP MS [J].Farm Products Processing, 2016, 37(1): 148—149 [唐锡招, 李兆新, 邢丽红, 等.液相色谱-三重四级杆复合线性离子阱质谱法分析恩诺沙星在鲤鱼中的代谢产物.渔业科学进展, 2016, 37(1): 148—149]
[4]Ye J M, Wu K, Wu H L, et al.Research progress of pharmacokinetics and pharmacodynamics of enrofloxacin [J].Hubei Agricultural Sciences, 2015, 54(23): 5813—5815 [叶建美, 吴康, 吴洪丽, 等.恩诺沙星抗菌效果及药代动力学研究进展.湖北农业科学, 2015, 54(23): 5813—5815]
[5]Zhou S, Hu L L, Fang W H, et al.Pharmacokinetics of enrofloxacin and its metabolite ciprofloxacin in mud crab (Scylla paramamosain) [J].Fisheries Science, 2011, 35(8): 1182—1188 [周帅, 胡琳琳, 房文红, 等.恩诺沙星及其代谢产物环丙沙星在拟穴青蟹体内的药代动力学.水产学报, 2011, 35(8): 1182—1188]
[6]Ding F K, Cao J Y, Ma L B.Pharmacokinetics and tissue residues of difloxacin in crucian carp (Carassius auratus) after oral administration [J].Aquaculture, 2006(256): 121—128
[7]Sun H Y, Chen J Y, Wang Y F, et al.The residues and elimination of enrofloxacin and ciprofloxacin in loach Misgurnus anguillicaudatus [J].Progress in Fishery Sciences, 2015, 36(4): 128—131 [孙慧宇, 陈君义, 王云飞,等.恩诺沙星和环丙沙星在泥鳅体内的残留和消除规律.渔业科学进展, 2015, 36(4): 128—131]
[8]Bi T T, Zhao H Y, Zhang S L.Acute toxicity experience to goldfish of ofloxacin, norfloxacin lactate and enrofloxacin [J].Farm Products Processing, 2015, 8: 31—32 [毕田田, 赵海燕, 张双灵.氧氟沙星、乳酸诺氟沙星和恩诺沙星对金鱼的急性毒性试验研究.农产品加工, 2015, 8: 31—32]
[9]Zhou S, Hu L L, Sun B B, et al.Analysis of the metabolites of enrofloxacin from Litopenaeus vannamei in vivo and in vitro using UPLC/Q-TOF MS [J].Marine Fisheries, 2012, 34(3): 347—348 [周帅, 胡琳琳, 孙贝贝, 等.恩诺沙星在凡纳滨对虾体内和体外肝微粒体中的代谢产物比较分析.海洋渔业, 2012, 34(3): 347—348]
[10]Fang W H, Hu L L, Chen Y L, et al.Analysis on the metabolites of enrofloxacin in the hemolymph of mud crab (Scylla serrata) by means of LC/MSn [J].Marine Fisheries, 2008, 30(4): 350—355 [房文红, 胡琳琳, 陈玉露, 等.采用LC/MSn法分析恩诺沙星在锯缘青蟹血淋巴中的代谢产物.海洋渔业, 2008, 30(4): 350—355]
[11]Zhao D M, Li Y, Lu Y H.The role of drug metabolism in new drug development [J].Acta Pharmaceutica Sinica, 2000, 35(2): 156—160 [赵冬梅, 李燕, 卢业竑.药物代谢研究在新药开发中的应用.药学学报, 2000, 35(2): 156—160]
[12]Ellis, A,E.The Anatomy and Physiology of Teleosts [M].In: Roberts R J (Eds.), Fish Physiology.Bailliere Tindall, London.1978, 13—54
[13]Ai X H, Liu C Z, Zhou Y T.A study on pharmacokinetic of sulphamethoxazole in grass carpat different temperatures and administration regimes [J].Acta Hydrobiologica Sinica, 2005, 29(2): 210—214 [艾晓辉, 刘长征, 周运涛.不同水温和给药方式下磺胺甲恶唑在草鱼体内的药动学研究.水生生物学报, 2005, 29(2): 210—214]
[14]Wu G H, Zhang J B, Meng Y, et al.Pharmacokinetics of enrofloxacin in the Chinese mitten-handed crab, Eriochir sinensis at three water temperatures [J].Journal of Nanjing Agricultural University, 2008, 31(2): 105—110 [吴光红, 张静波, 孟勇, 等.不同水温下恩诺沙星在中华绒螯蟹体内药物代谢动力学.南京农业大学学报, 2008, 31(2): 105—110]
STUDIES ON ELIMINATION DYNAMICS OF ENROFLOXACIN RESIDUES AND ITS METABOLITES IN CHANNEL CATFISH AT TWO DIFFERENT WATER TEMPERATURES
YANG Qiu-Hong1, AI Xiao-Hui1, LIU Yong-Tao1, XU Ning1and ZHAO Feng2
(1.Freshwater Fish Germplasm Quality Supervision and Testing Center, Ministry of Agriculture, Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Science, Wuhan 430223, China; 2.Fisheries Research Institute of Guizhou Province, Guiyang 550025, China)
At water temperature of 18℃ and 28℃, channel catfish was administered orally with enrofloxacin (EF) in dose of 20 mg/kg for 7 days, the time courses of concentrations of enrofloxacin and ciprofloxacin in fish tissues (plasma, muscle, skin, liver and kidney) were measured with high-performance liquid chromatography and a fluorescence detector.The results indicated that elimination of enrofloxacin was different in skin, liver, kidney and muscle at 18℃ and 28℃: the equations of elimination curve of enrofloxacin in skin, liver, kidney and muscle were C=1022.1e–0.034t, C=2601.3e–0.046t, C=2903.6e–0.072tand C=1186.5e–0.036t, the elimination half-lives were 31.79d, 45.29d, 16.15d and 35.54d at 18℃, respectively; the equations of elimination curve of enrofloxacin were C=8805.5e–0.04t, C=3154e–0.08t, C=4145.1e–0.1tand C=1302.1e–0.068t, the elimination half-lives were 18.33d, 6.26d, 12.44d and 10.34d at 28℃, respectively.Enrofloxacin was changed into ciprofloxacin, the metabolism and elimination of enrofloxacin in channel catfish was relatively slower; enrofloxacin and ciprofloxacin in the channel catfish tissues could not be found after 150 days at 18℃, and 120 days at 28℃.The predicted withdrawal time was 3240℃·d and 4200℃·d respectively.
Channel catfish (Ietalurus punetaus); Enrofloxacin; Ciprofloxacin; Elimination; Residues
S948
A
1000-3207(2017)04-0781-06
10.7541/2017.97
2016-07-13;
2016-11-05
公益性行业(农业)科研专项(201503108-CC-1)资助 [Supported by the Fund for Agro-scientific Research in the Public Interest (201503108-CC-1)]
杨秋红(1986—), 女, 回族, 河南禹州人, 硕士; 研究方向为水产动物药理及药残控制技术。E-mail: qmini1986@163.com
艾晓辉, E-mail: aixh@yfi.ac.cn
