异育银鲫A+系和F系肌间骨的比较分析
2017-08-16王忠卫李熙银张晓娟桂建芳
李 志 周 莉 王忠卫 李熙银 张晓娟 汪 洋 桂建芳
(中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
异育银鲫A+系和F系肌间骨的比较分析
李 志 周 莉 王忠卫 李熙银 张晓娟 汪 洋 桂建芳
(中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
研究采用常规测量法和解剖法, 并结合CT透视, 比较分析了异育银鲫主养品种“中科3号”(A+系)和候选新品系F系的肌间骨的数目、形态和分布。结果表明, 6月龄和18月龄异育银鲫F系平均总肌间骨数分别为71.8±2.9和83.3±1.4, 均极显著少于相应月龄银鲫A+系总肌间骨数目(78.6±3.9和87.0±1.5)(P<0.01)。并统计了2个品系的每一肌节的平均肌间骨数目, 6月龄和18月龄异育银鲫F系的每一肌节的平均肌间骨数目极显著少于相应月龄银鲫A+系(P<0.01)。银鲫A+系和F系均有髓弓小骨和脉弓小骨, 没有椎体小骨。6月龄和18月龄银鲫F系髓弓小骨的平均数目为48.2±1.1和55.8±0.52, 均极显著少于相应月龄银鲫A+系的髓弓小骨(53.7±1.6和58.7±0.5)(P<0.01)。异育银鲫两个品系的脉弓小骨数目差异不显著; 2个品系均具有“I”形、“卜”形、“Y”形、一端多叉形、两端两分叉形、两端多叉形和树枝形7种类型的肌间骨, 髓弓小骨比脉弓小骨数量多且形状复杂。随着月龄的增长, 2个品系具有的总肌间骨数目以及复杂肌间骨数目均增加。6月龄和18月龄银鲫F系躯轴上肌节间的复杂“Y”形髓弓小骨数目均比相应月龄的银鲫A+系少, 而简单的“I”形髓弓小骨数目比相应月龄的A+系多, 表现出一种有利于食用的优势。研究结果为异育银鲫候选新品系F系提供了一个品质评价指标, 同时也为后续进行异育银鲫肌间骨遗传改良提供了形态学基础资料。
异育银鲫; A+系; F系; 肌间骨; 遗传改良
肌间骨(Intramuscular bone), 又名肌间刺或肌隔内骨, 分布于椎骨两侧肌间隔中, 由肌膈结缔组织中的间充质细胞直接骨化而来, 是硬骨鱼类特有的结构之一[1,2]。根据其附着位置分为髓弓小骨(Epineuria bone)、脉弓小骨(Epipleural bone)和椎体小骨(Epicentralia bone)三类。肌间骨可以作为硬骨鱼类分类的形态特征之一, 不同鱼类具有的肌间骨的类型、数量、形状以及分布存在差异[1—8], 而且具有不同游泳方式的鱼类如日本鳗鲡(Anguilla japonica)和斑马鱼(Danio rerio)的骨化模式也不同[9]。从低等到高等真骨鱼类, 肌间骨经历了“简单-复杂-退化”的演化[1—2,4]。鲑形目鱼类残留少量简单肌间骨, 而很多鲈形目鱼类没有肌间骨[1—2,4]。我国重要的大宗淡水养殖对象鲤科鱼类普遍具有肌间骨, 对鲜鱼的食用和深加工带来很大不便。近年来, 研究人员除了进行不同鱼类肌间骨解剖和形态学分析外, 也开始试图鉴定调控肌间骨形成的基因或microRNA[10,11]。有趣的是, 改良的三倍体鲫鲤 “湘云鲫 2 号”的肌间骨数目比野生二倍体鲫(Carassius auratus)和彭泽鲫(Carassius auratus variety pengze)少[12], 翘嘴鲌(Culter alburnus Basilewsky)和团头鲂(Megaloabrama Amblycephala Yin)杂交后代F1和F2在肌间骨总数、复杂型肌间骨数目以及躯体轴下肌肌间骨数目均比母本翘嘴鲌少[13]。
异育银鲫(Carassius gibelio Bloch)是我国重要的大宗淡水养殖种类之一。随着异育银鲫[14]、高体型异育银鲫(D)系[15]和异育银鲫“中科3号”(A+系)[16,17]等优良品种的培育成功及大规模推广养殖, 全国鲫鱼产量已从1983年的4.8×103kg增至2015年的291.2×107kg[18]。异育银鲫F系是由银鲫E系的卵子与团头鲂的精子受精后经过冷休克处理, 获得的一批具有类似团头鲂隆背性状的个体,并经多代雌核生殖扩群而来[19]。F系除了含有母本E系的156条染色体之外, 还含有来自团头鲂的微小染色体片段[20], 是一个具有养殖潜力的新品系。虽然银鲫以其肉质细嫩鲜美深受消费者青睐, 但众多细小的肌间骨给食用带来了不便。因此, 肌间骨的数量和分布是异育银鲫食用品质的一个重要性状,并且分析异育银鲫不同品系, 尤其是候选新品系F系与主养品种A+系相比, 其肌间骨的数量、形态和分布是否存在显著差异是新品种鉴定不可忽略的评价指标之一。同时, 尽管已对洞庭水系二倍体鲫[12]、异育银鲫[3]、淇河鲫(Carassius auratus variety qihe)[21]、彭泽鲫以及其他改良鲫鲤杂交品种(或品系)[12]的肌间骨的数量、形状和分布进行了比较研究, 但尚未有不同年龄、不同品系间异育银鲫肌间骨的比较分析报道。因此, 本研究对异育银鲫A+系和F系6月龄冬片鱼种和18月龄商品鱼的数目、形态和分布进行了详细的观察和统计。结果表明, 候选新品系F系的总肌间骨数目、每一肌节的平均肌间骨数目以及躯轴上肌节间的复杂“Y”形髓弓小骨数目均比A+系少, 而简单的“I”形髓弓小骨数目比A+系多, 表现出一种有利于食用的优势。同时, 研究结果也为后续进行异育银鲫肌间骨遗传改良提供了形态学基础资料。
1 材料与方法
1.1 实验材料
异育银鲫A+系和F系均来自中国科学院水生生物研究所官桥养殖基地, 采用兴国红鲤(Cyprinus carpio var.Xingguonensis)精子刺激雌核生殖的方式繁育苗种, 并同池饲养。为排除不同大小个体导致的肌间骨数量差异的影响, 同一年龄每个品系均选取体重相当的个体进行分析。采用传统的方法测量实验鱼的体重和体长, 2个品系的样品数和规格见表 1。
1.2 肌间骨的解剖和形态观察
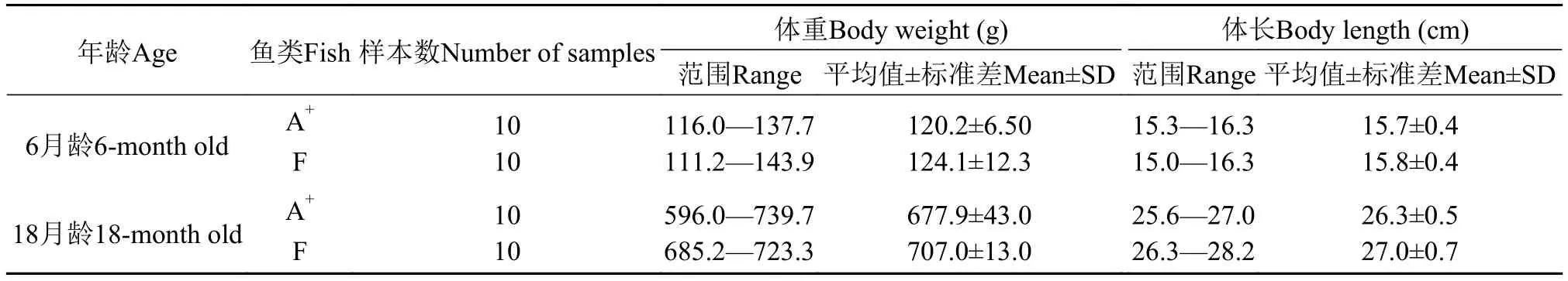
表 1 异育银鲫A+系和F系的体重与体长Tab.1 Weight and body length of clone A+strain and clone F strain of allogynogenetic gibel carp
在解剖肌间骨之前, 先将6月龄鱼在中科院水生生物研究所分析测试中心进行X光成像, 18月龄鱼在武汉大学中南医院放射科进行CT透视成像,获得整体骨骼及肌间骨的透视图像。肌间骨的解剖、形态观察以及分布按照吕耀平等[3]和黎玲等[12]描述的方法进行。用纱布将鱼包裹煮至九成熟, 小心剥去鱼皮。以脊椎骨和腹腔后缘为界, 将鱼体左右躯轴分别分为躯干轴上、躯干轴下、尾部轴上和尾部轴下4部分, 依肌节从头到尾的方向剔除肌肉, 取出肌间骨后并按在鱼体中的顺序和方向进行排列。用650D佳能数码相机对排列有序的肌间骨进行拍照记录。
1.3 数据统计分析
每一肌节的平均肌间骨数值=每侧的肌间骨数/对应一侧的肌节数。实验数据采用SPSS软件进行单因素方差分析, 数据间比较用Duncan法进行。柱状图由GraphPad Prism 6软件绘制, 取P<0.05为差异显著, P<0.01为极显著性差异。
2 结果
2.1 异育银鲫F系总肌间骨数目和每一肌节的平均肌间骨数目均少于A+系
由表 2可知, 6月龄异育银鲫A+系总肌间骨数目为74—85, 平均值为78.6±3.9; 18月龄A+系总肌间骨数目比6月龄A+系略多, 为86—90, 平均值为87.0±1.5。6月龄和18月龄异育银鲫F系平均总肌间骨数分别为71.8±2.9和83.3±1.4, 均显著少于异育银鲫A+系总肌间骨数目(P<0.01)。接着进一步统计了2个品系每一肌节的平均肌间骨数目, 无论是6月龄还是18月龄, 异育银鲫F系每一肌节具有的平均肌间骨数目均显著少于相应月龄异育银鲫A+系。每条鱼左右两侧的肌间骨数目不完全相等, 但个体之间肌间骨总数目接近, 不存在显著差异。
2.2 异育银鲫F系髓弓小骨的数目少于异育银鲫A+系

表 2 异育银鲫A+系和F系的肌间骨数目Tab.2 Intermuscular bone (IB) numbers of clone A+strain and clone F strain of allogynogenetic gibel carp
为了揭示异育银鲫A+系和F系肌间骨分布位置的差异, 我们首先拍摄了2个品系的整体骨骼图(图 1和图 2)。异育银鲫A+系上枕骨和顶骨之间的夹角为168°±2°(图 1B), 而异育银鲫F系上枕骨和顶骨之间的夹角为143°±4°(图 1F)。异育银鲫F系上枕骨和顶骨之间夹角的改变可能是导致异育银鲫F系产生隆背性状的原因。异育银鲫A+系和F系均含有存在于躯轴上和尾轴上肌节之间的髓弓小骨, 以及存在于躯轴下和尾轴下肌节之间的脉弓小骨, 没有存在于水平隔膜里的椎体小骨。将其躯体分为躯干轴上、躯干轴下、尾部轴上和尾部轴下4部分分别统计髓弓小骨和脉弓小骨的数目(表 3), 6月龄和18月龄异育银鲫F系髓弓小骨的平均数目为48.2± 1.1和55.8±0.5, 显著少于相应月龄异育银鲫A+系的髓弓小骨(53.7±1.6和58.7±0.5)(P<0.01)。异育银鲫两个品系的脉弓小骨数目差异不显著。
2.3 异育银鲫F系躯轴上肌节间的“Y”形髓弓小骨数目比异育银鲫A+系少

图 2 18月龄异育银鲫A+系和F系形态比较Fig.2 Comparisons of bone morphology between 18-month old clone A+and clone F of allogynogenetic gibel carp

表 3 异育银鲫A+系和F系各部位髓弓小骨和脉弓小骨的数目Tab.3 The numbers of epineural bone (ENB) and epipleural bone (EPB) in different parts between clone A+strain and clone F strain of allogynogenetic gibel carp
与已报道的其他鲤科鱼类相似[3,12], 异育银鲫A+系和F系的肌间骨也分为“I”形、“卜”形、“Y”形、一端多叉形、两端两分叉形、两端多叉形和树枝形7种类型(图 3)。2个品系身体两侧各种形态肌间骨分布情况如图 1—2所示, 髓弓小骨和脉弓小骨依次从前向后在鱼体内着生, 形状从尾部向前端逐渐复杂化。我们比较分析了异育银鲫A+系和F系7种不同形态类型的肌间骨数目的差异(图 4)以及躯体不同部位不同形态类型肌间骨数目的差异(表 4,以躯体左侧为例), 2个品系18月龄的成鱼具有的复杂形状肌间骨的数目多于6月龄鱼相应形状的肌间骨数目。2个品系脉弓小骨数量均比髓弓小骨少(表 3和表 4), 且形态均较髓弓小骨简单(图 1D、H和图 2B、D)。异育银鲫A+系和F系均没有观察到一端多叉形、两端两分叉形和两端多叉形的脉弓小骨。
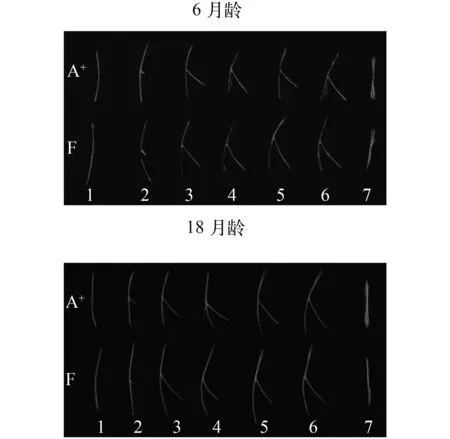
图 3 6月龄和18月龄异育银鲫A+系和F系7类肌间骨的比较Fig.3 Comparison of 7 various types of intermuscular bones between clone A+and clone F of allogynogenetic gibel carp at 6-month and 18-month
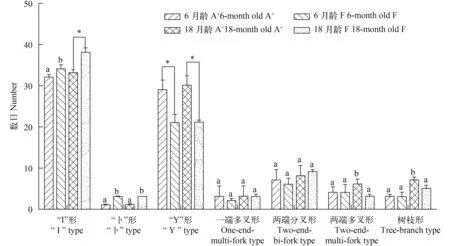
图 4 6月龄和18月龄异育银鲫A+系和F系7类不同肌间骨的平均数目Fig.4 Average numbers of 7 different types of intermuscular bones between clone A+and clone F of allogynogenetic gibel carp at 6-month and 18-month
6月龄和18月龄异育银鲫A+系和F系“I”形和“Y”形肌间骨数目都存在明显差异(图 4), 差异的肌间骨主要分布在躯轴上肌节处。如表 4所示, 在躯轴上部分, 异育银鲫F系一般含有3个“I”形髓弓小骨; 6—7个“Y”形髓弓小骨, 而异育银鲫A+系一般含有1个“I”形髓弓小骨和11个“Y”形髓弓小骨。如图 1C和图 1G所示, 在第18个椎骨之后6月龄异育银鲫F系含有11个“I”形髓弓小骨, 没有“Y”形髓弓小骨;而异育银鲫A+系含有11个“I”形和4个“Y”形髓弓小骨。当异育银鲫F系生长到18月龄, 第18个椎骨之后的“I”形髓弓小骨增加到15个, 仍然没有“Y”形髓弓小骨; 而18月龄的异育银鲫A+系含有15个“I”形和4个“Y”形髓弓小骨(图 2B、D)。上述结果表明,无论是6月龄还是18月龄的异育银鲫F系躯轴上肌节间的复杂“Y”形髓弓小骨数目均比异育银鲫A+系少, 而简单的“I”形肌间骨数目比A+系多, 表现出1种有利于食用的优势。

表 4 异育银鲫A+系和F系鱼体左侧不同形态肌间骨数目Tab.4 The numbers of various types of intermuscular bone (IB) in left side between allogynogenetic clone A+strain and allogynogenetic clone F strain of gibel carp
3 讨论
鱼类生物学和生物技术的进步, 尤其是遗传育种技术的发展, 是水产养殖可持续发展的源泉[22,23],对其产量的增长做出了重要贡献[24—26]。近年来, 快速生长异育银鲫品种的应用以及养殖技术的提高,市场上普遍出售的500 g左右的异育银鲫商品鱼已减弱了由众多细小肌间骨带来的食用不便[26]。本研究的结果表明, 异育银鲫候选新品系F系的食用品质优于主养品种异育银鲫“中科3号”, 其总肌间骨数目、每一肌节的平均肌间骨数目以及躯轴上肌节间的复杂“Y”形髓弓小骨数目均比异育银鲫A+系少, 而简单的“I”形髓弓小骨数目比A+系多。
对鱼类肌间骨的研究始于20世纪50年代, 研究工作主要集中在鲤科、鲑科、狗鱼科、胡瓜鱼科等鱼类肌间骨形态学描述和骨化模式的比较分析[1—9]。本研究观察到的异育银鲫A+系和F系的肌间骨的形状和分布规律与其他已报道的鲤科鱼类类似[3,4,12,27], 未发现椎体小骨; 同种鱼不同个体的肌间骨数目略有差别; 每条鱼左右两侧的肌间骨数目不完全相等; 躯干部轴上肌中的肌间骨数目最多;髓弓小骨比脉弓小骨数量多且形状复杂(表 2—4、图 1和图 2)。对鲤、鲢和斑马鱼肌间骨骨化时间和发育过程的观察表明, 肌间骨开始骨化的时间晚于主轴骨骼和附肢骨骼[6,28,29], 这表明鱼类肌间骨具有不同于脊椎骨和附肢骨的发育调控机制。与日本鳗鲡不同, 绝大多数鲤科鱼类的肌间骨从尾部向头部依次骨化, 而且具有产生后持续生长的能力。异育银鲫A+系和F系的髓弓小骨和脉弓小骨的形态都是从尾部向前端逐渐复杂化, 而且肌间骨的数量随年龄增加明显增多, 形状也随生长发育越来越复杂(表 2—4、图 1、图 2、图 4)。18月龄异育银鲫A+系和F系的“卜”型、“Y”型、一端多叉形、两端两分叉形、两端多叉形和树枝形髓弓小骨的数目明显多于6月龄鱼相应的肌间骨数目(图 4), 这暗示异育银鲫A+系和F系髓弓小骨的形态发生过程与鲢、瓯江彩鲤、唇逕和团头鲂等肌间骨的形态发生过程基本相同[5,6,8,9,30], 都是由简单的“I”形开始, 随着年龄和体长的增加, 逐渐向复杂形态发育。
近两年来研究人员开始尝试将肌节同源框C基因(Muscle segment homeobox C, msxC)和硬化蛋白基因(Sclerostin, SOST)等基因的表达与唇逕(Hemibarbus labeo)或淇河鲫肌间骨的发育联系起来[10,21,31], 以及试图鉴定调控肌间骨发育的microRNA[11], 但解析其形成的分子调控机制还有很长的路要走。尽管目前并不清楚肌间骨形成的分子机制, 研究人员已开始另辟蹊径, 通过生物技术操作来获得无肌间骨的突变体鱼以及肌间骨数目减少的新品种(系)。譬如, 通过人工诱导雌核生殖获得的一尾无肌间刺的草鱼突变体, 其脊椎骨和附肢骨发育正常, 除外观上表现散鳞外, 其体型和生长也都正常[32]。通过远缘杂交并结合人工雌核生殖, 并经多代选育获得的改良二倍体红鲫, 以及改良四倍体鲫鲤与改良二倍体红鲫倍间交配获得的改良三倍体鲫鲤“湘云鲫2号”的总肌间骨数目均少于野生二倍体鲫和彭泽鲫[12]。通过远缘杂交获得的鲌鲂F1和F2肌间骨数目减少, 均表现出比母本翘嘴鲌有利于食用和精深加工的优势。鲌鲂F2的总肌间骨数目略低于鲌鲂F1, 但每一肌节平均肌间骨数目显著低于鲌鲂F1[13]。这些结果表明, 通过远缘杂交可以获得肌间刺少的优良品种。
广泛分布于亚欧大陆的多倍体银鲫[33,34], 在其进化历程中经历了两轮连续的多倍化历程[35], 具有雌核生殖、两性生殖和类杂种生殖等多重生殖方式[36,37], 其性别由额外的微小染色体决定[38]。早在19世纪80年代初期, 蒋一珪等[14]发现异源精子不仅能刺激银鲫卵子行雌核生殖, 而且还具有促进生长等异精效应, 并由此提出了异精雌核发育(allogynogenesis)的观点。类似的异精效应还在其他一些行雌核生殖或杂种生殖的单性动物, 如亚马逊莫莉(Poecilia formosa)[39]、蜥蜴Ambystoma laterale-2 jeffersonianum和A.2 laterale-jeffersonianum[40,41]以及蛙Rana ridibunda和Rana esculenta[42]中被发现,并定义为盗窃生殖(Kleptogenesis), 意为一些单性动物能“偷窃”异种精子来源的DNA以增加后代的遗传多样性[41,43]。染色体荧光原位杂交结果表明,异育银鲫F系除了含有母本E系的156条染色体之外, 还含有5—15条来自其异精父本团头鲂的微小染色体片段[20]。与主养品种异育银鲫A+系相比, 异育银鲫F系头部正后方背有一隆起, 整体骨骼X光图可以清晰看到, F系上枕骨和顶骨之间的夹角变小, 导致头后体高增大, 呈隆背性状体型(图 1)。来自父本团头鲂精子的遗传物质除了改变体型外, 异育银鲫F系肌间骨的数目似乎也表现出类似鲫鲤[12]和鲌鲂[13]远缘杂交导致的有利于食用的优势, 其总肌间骨数目、每一肌节的平均肌间骨数目以及复杂“Y”形髓弓小骨数目均比A+系少, 而简单的“I”形髓弓小骨数目比A+系多。
鱼类肌间骨的主要功能是肌节间力量的传导[44—46], 如肉质较为疏松的鲤科鱼类的肌间骨形态十分复杂, 在肌肉收缩时限制肌节的变形[47,48]。鼬鳚(Lepophidium profundorum)的肌间骨在其发声的时候起到储存和释放能量的作用[49]。目前并不清楚异育银鲫A+系和F系两个品系间肌间骨差异的原因。Danos和Staab[45]认为机械力推动了真骨鱼类骨骼的变异和进化。鱼类肌肉中蛋白质含量的高低似乎与肌间骨的数量相关。肌肉中蛋白质含量较高的鱼类, 主要是肌纤维来传导肌肉力量, 不需或较少借助肌间骨来进行力量传递[1]。但目前缺乏直接的实验证据来证明这些猜测。对异育银鲫不同品系躯轴上肌肉蛋白质含量的比较分析, 以及异育银鲫F系基因组的解析, 有望阐明异育银鲫不同品系肌间骨差异的原因和肌间骨形成的分子调控机制, 为培育肌间骨少或无肌间骨的异育银鲫新品种奠定基础。
[1]Patterson C, Johnson G D.The intermuscular bones and ligaments of teleosteanfishes [J].Smithsonian Contribution to Zoology, 1995, 559: 1—85
[2]Danos N, Ward A B.The homology and origins of intermuscular bones in fishes: phylogenetic or biomechanical determinants [J].Biological Journal of the Linnean Society, 2012, 106(3): 607—602
[3]Dong Z J, Hang D Z, Li L J, et al.Preliminary study on intermuscular bones of several cultured cyprinids [J].Journal of Shanghai Fisheries University, 2006, 16(4): 425—429 [董在杰, 黄代中, 李丽娟, 等.几种常见鲤科养殖鱼类肌间刺的初步研究.上海海洋大学学报, 2006, 16(4): 425—429]
[4]Lü Y P, Bao B L, Jiang Y, et al.Comparative analysis of intermuscular bones in lower teleosts [J].Journal of Fisheries of China, 2007, 31(5): 661—668 [吕耀平, 鲍宝龙,蒋燕, 等.低等真骨鱼类肌间骨的比较分析.水产学报, 2007, 31(5): 661—668]
[5]Lü Y P, Zhou C C, Yang L M, et al.Ossification pattern of the intermuscular bone in Cyprinus carpio var.color [J].Journal of Shanghai Ocean University, 2014, 23(1):58—63 [吕耀平, 周晨晨, 杨丽美, 等.瓯江彩鲤肌间小骨的骨化模式.上海海洋大学学报, 2014, 23(1): 58—63]
[6]Ke Z H, Zhang W, Jiang Y, et al.Developmental morphology of the intermuscular bone in Hypophthalmichthys molitrix [J].Chinese Journal of Zoology, 2008, 43(6): 88—96 [柯中和, 张炜, 蒋燕, 等.鲢肌间小骨发育的形态学观察.动物学杂志, 2008, 43(6): 88—96]
[7]Fang L C, Li X J.A review of research on intermuscular bone formation in lower teleosts [J].Fisheries Science, 2013, 32(12): 749—752 [房连聪, 李学军.低等真骨鱼类肌间骨发生的研究.水产科学, 2013, 32(12): 749—752]
[8]Wan S M, Yi S K, Zhong J, et al.Developmental and morphological observation of intermuscular bones in Megalobrama amblycephala [J].Acta Hyrobiologica Sinica, 2014, 38(6): 1143—1151 [万世明, 易少奎, 仲嘉, 等.团头鲂肌间骨发育的形态学观察.水生生物学报, 2014, 38(6): 1143—1151]
[9]Yao W J, Lü Y P, Gong X L, et al.Different ossification patterns of intermuscular bones in fish with different swimming modes [J].Biology Open, 2015, 4(12): 1727—1732
[10]Lü Y P, Yao W J, Chen J, et al.Newly identified gene muscle segment homeobox C may play a role in intermuscular bone development of Hemibarbus labeo [J].Genetics and Molecular Research, 2015, 14(3): 11324—11334
[11]Wan S M, Yi S K, Zhong J, et al.Identification of microRNA for intermuscular bone development in blunt snout bream (Megalobrama amblycephala) [J].International Journal of Molecular Sciences, 2015, 16(5): 10686—10703
[12]Li L, Zhong Z Z, Liu S J, et al.Comparative analysis of intermuscular bone in fish of different ploidies [J].Science China Life Sciences, 2013, 43(3): 189—200 [黎玲,钟泽州, 刘少军, 等.不同倍性鱼肌间骨的比较分析.中国科学: 生命科学, 2013, 43(3): 189—200]
[13]Jang W P, Jia Y Y, Liu S L, et al.Comparative analysis of intermuscular bones in hybrid F1, F2 of (C.alburnus)(♀)×(M.amblycephala) (♂) [J].Acta Hyrobiologica Sinica, 2016, 40(2): 277—286 [蒋文枰, 贾永义,刘士力, 等.鲌鲂F1、F2及其亲本肌间骨的比较分析.水生生物学报, 2016, 40(2): 277—286]
[14]Jiang Y G, Liang S C, Chen B D, et al.Biological effect of heterologous sperm on gynogenetic offspring in Carassius auratus gibelio [J].Acta Hyrobiologica Sinica, 1983, 8(1): 1—13 [蒋一珪, 梁绍昌, 陈本德, 等.异源精子在银鲫雌核发育子代中的生物学效应.水生生物学报, 1983, 8(1): 1—13]
[15]Zhu L F, Jiang Y G.A comparative study of the biological characters of gynogenetic clones of silver crucian carp (Carassius auratus gibelio) [J].Acta Hyrobiologica Sinica, 1993, 17(2): 112—120 [朱蓝菲, 蒋一珪.银鲫不同雌核发育系的生物学特性比较研究.水生生物学报, 1993, 17(2): 112—120]
[16]Wang Z W, Zhu H P, Wang D, et al.A novel nucleocytoplasmic hybrid clone formed via androgenesis in polyploid gibel carp [J].BMC Research Notes, 2011, 4(1): 82
[17]Gui J F, Zhou L.Genetic basis and breeding application of clonal diversity and dual reproduction modes in polyploidy Carassius auratus gibelio [J].Science China Life Science, 2010, 40(2): 97—103 [桂建芳, 周莉.多倍体银鲫克隆多样性和双重生殖方式的遗传基础和育种应用.中国科学生命科学, 2010, 40(2): 97—103]
[18]The Ministry of Agriculture Fishery and Fishery Administration.China Fishery Statistical Yearbook [M].Beijing: China Agriculture Press.2016, 37 [农业部渔业渔政管理局编制.中国渔业统计年鉴.北京: 中国农业出版社.2016, 37]
[19]Zhou L, Wang Z W, Wang Y, et al.Crucian carp and gibel carp culture [A].In: Gui J F, Tang Q S, Li Z J, et al (Eds.), Success stories in Chinese aquaculture [C].Wiley-Blackwells, Oxford, UK.2017 (In press)
[20]Yi M S, Li Y Q, Liu J D, et al.Molecular cytogenetic detection of paternal chromosome fragments in allogynogenetic gibel carp, Carassius auratus gibelio Bloch [J].Chromosome Research, 2003, 11: 665—671
[21]Wang L Y, Tian X, Pang X L, et al.Differentially expression of SOST gene in the muscle tissues located between different intermuscular bones in Qihe crucian carp Carassius auratus [J].Chinese Journal of Biochemistry and Molecular Biology, 2016, 32(12): 1354—1359 [王良炎, 田雪, 庞小磊, 等.硬化蛋白基因在淇河鲫成鱼不同肌间骨相邻肌组织的表达差异分析.中国生物化学与分子生物学报, 2016, 32(12): 1354—1359]
[22]Gui J F.Fish biology and biotechnology is the source for sustainable aquaculture [J].Science China Life Science, 2014, 44(12): 1195—1197 [桂建芳.鱼类生物学和生物技术是水产养殖可持续发展的源泉.中国科学生命科学, 2014, 44(12): 1195—1197]
[23]Gui J F.Scientific frontiers and hot issues in hydrobiology [J].Chinese Science Bulletin, 2015, 60(22): 2051—2057 [桂建芳.水生生物学科学前沿及热点问题.科学通报, 2015, 60(22): 2051—2057]
[24]Gjedrem T, Rosseland B O.Genetic variation for tolerance to acidic water in salmonids [J].Journal of Fish Biology, 2012, 80(1): 1—14
[25]Gui J F, Zhu Z Y.Molecular basis and genetic improvement of economically important traits in aquaculture animals (review) [J].Chinese Science Bulletin, 2012, 57(15): 1751—1760
[26]Zhou L, Gui J F.Applications of genetic breeding biotechnologies in Chinese aquaculture [A].In: Gui J F, Tang Q S, Li Z J, et al (Eds.), Success stories in Chinese aquaculture [C].Wiley-Blackwells, Oxford, UK, 2017 (In press)
[27]Ma L X, Dong Z J, Su S Y, et al.Advance on intermuscular bone of fish [J].Agriculture Science of Jiangsu, 2012, 40(4): 234—235 [马良骁, 董在杰, 苏胜彦.鱼类肌间刺的研究进展.江苏农业科学, 2012, 40(4): 234—235]
[28]Ping Z.On the myoseptal spines of the carp (Cyprinus carpio L.) [J].Acta Zoologica Sinica, 1962, 14(2): 175—178 [秉志.幼鲤大侧肌肌隔骨针的观察.动物学报, 1962, 14(2): 175—178]
[29]Bird N C, Mabee P M.Developmental morphology of the axial skeleton of the Zebrafish, Danio rerio (Ostariophysi: Cyprinidae) [J].Developmental Dynamics, 2003, 228(3): 337—350
[30]Lü Y P, Chen J, Bao B L, et al.The ossificational process of the intermuscular bones in Hemibarbus labeo [J].Journal of Shanghai Fisheries University, 2012, 21(4): 549—553 [吕耀平, 陈洁, 鲍宝龙, 等.唇逕肌间小骨的骨化过程.上海海洋大学学报, 2012, 21(4): 549—553]
[31]Tian X, Wang L Y, Chen L, et al.The mRNA and protein expression of gene SOST during ossification process of intermuscular bone in crucian carp (Carassius auratus) in Qihe River [J].Journal of Fisheries of China, 2016, 40(5): 673—680 [田雪, 王良炎, 陈琳, 等.SOST基因在淇河鲫肌间骨骨化过程中的表达研究.水产学报, 2016, 40(5): 673—680]
[32]Xu X F, Zheng J B, Qian Y Q, et al.Normally grown and developed intermuscular bone-deficient mutant in grass carp, Ctenopharyngodon idellus [J].Chinese Science Bulletin, 2015, 60(1): 52—57 [徐晓锋, 郑建波, 钱叶青, 等.生长发育正常的无肌间刺草鱼突变体.科学通报, 2015, 60(1): 52—57]
[33]Jiang F F, Wang Z W, Zhou L, et al.High male incidence and evolutionary implications of triploid form in northeast Asia Carassius auratus complex [J].Molecular Phylogenetics and Evolution, 2013, 66(1): 350—359
[34]Ivan J, Gui J F.Recent invasion and low level of divergence between diploid and triploid forms of Carassius auratus complex in Croatia [J].Genetica, 2011, 139(6): 789—804
[35]Li X Y, Zhang X J, Li Z, et al.Evolutionary history of two divergent Dmrt1 genes reveals two rounds of polyploidy origins in gibel carp [J].Molecular Phylogenetics and Evolution, 2014, 78(1): 96—104
[36]Gui J F, Zhou L.Genetic basis and breeding application of clonal diversity and dual reproduction modes in polyploid Carassius auratus gibelio [J].Science China Life Science, 2010, 53(4): 409—415
[37]Zhang J, Sun M, Zhou L, et al.Meiosis completion and various sperm responses lead to unisexual and sexual reproduction modes in one clone of ployploid Carassius gibelio [J].Scientific Reports, 2015, 5(10): 10898
[38]Li X Y, Zhang Q Y, Zhang J, et al.Extra microchromosomes play male determination role in polyploid gibel carp [J].Genetics, 2016, 203(3): 1415—1424
[39]Schartl M, Nanda I, Schlupp I, et al.Incorporation of subgenomic amounts of host species DNA in the gynogenetic Amazon Molly [J].Nature, 1995, 373(6509): 68—71
[40]Bi K, Bogart J P.Identification of intergenomic recombinations in unisexual salamanders of the genus Ambystoma by genomic in situ hybridization (GISH) [J].Cytogenetic and Genome Research, 2006, 112(3—4): 307—312
[41]Bogart J P, Bi K, Fu J Z, et al.Unisexual salamanders (genus Ambystoma) present a new reproductive mode for eukaryotes [J].Genome, 2007, 50(2): 119—136
[42]Uzzell T, Gunther R, Berger L.Rana-ridibunda and ranaesculenta-leaky hybridogenetic system (Amphibia-Salientia) [J].Proceedings of the Academy of Natural Sciences of Philadelphia, 1976, 128(1): 147—171
[43]Avise J C.Evolutionary perspectives on clonal reproduction in vertebrate animals [J].Proceedings of the National Academy of Sciences, 2015, 112(29): 8867—8873
[44]Long J, John H, Adcock B et al.Force transmission via axial tendons in undulating fish: a dynamic analysis [J].Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 2002, 133(4): 911—929
[45]Danos N, Staab K L.Can mechanical forces be responsible for novel bone development and evolution in fishes [J].Journal of Applied Ichthyology, 2010, 26(2): 156—161
[46]Jr JHL, Nipper K S.The importance of body stiffness in undulatory propulsion [J].American Zoologist, 1996, 36(6): 678—694
[47]Azizi E, Gillis G B, Brainerd E L.Morphology and mechanics of myosepta in a swimming salamander (Siren lacertina) [J].Comparative Biochemistry and Physiology AMolecular and Integrative Physiology, 2002, 133(4): 967—978
[48]Brainerd E L, Azizi E.Muscle fiber angle, segment bulging and architectural gear ratio in segmented musculature [J].Journal of Experimental Biology, 2005, 208(17): 3249—3261
[49]Fine M L, Lin H, Nguyen B B, et al.Functional morphology of the sonic apparatus in the fawn cusk-eel Lepophidium profundorum (Gill, 1863) [J].Journal of Morphology, 2007, 268(11): 953—966
COMPARATIVE ANALYSIS OF INTERMUSCULAR BONES BETWEEN CLONE A+AND CLONE F STRAINS OF ALLOGYNOGENETIC GIBEL CARP
LI Zhi, ZHOU Li, WANG Zhong-Wei, LI Xi-Yin, ZHANG Xiao-Juan, WANG Yang and GUI Jian-Fang
(State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
Allogynogenetic gibel carp is a joint name of a series of clone strains bred from the gibel carp (Carassius gibelio Bloch).The numbers and distribution of intermuscular bones (IBs) are valuable economic traits.In this study, we compared the differences in number, morphology and distribution of IBs in clone A+and clone F of an allogynogenetic gibel carp.The average numbers of clone F IBs at six months and 18 months are 71.8±2.9 and 83.3±1.4, respectively; both numbers are significantly less than those of clone A+(78.6±3.9 and 87.0±1.5) (P<0.01).Similarly, the average numbers of clone F IBs within each sarcomere at 6-month and 18-month are remarkably smaller than those of clone A+.Both clone A+and F have epineuralia bones (ENBs) and hypomeralia bones, and no epicentralia bones.The average numbers of clone F ENBs in the left body side at 6-month and 18-month are 48.2±1.1 and 55.8±0.5, respectively; both numbers are significantly less than those of clone A+(53.7±1.6 and 58.7±0.5) (P<0.01).There was no difference found in the epipleural bones (EPBs) of clone A+and clone F.The IBs of these two clone strains are divided into seven shape categories, including non-forked (I), one-end-unequal-bi-fork (卜), one-end-equal-bi-fork (Y), one-end-multi-fork, twoend-bi-fork, two-end-multi-fork, and tree-branch types.Generally, both numbers and morphological complexity of ENBs are higher than those of EPBs.The numbers of total IBs and IBs with complicated shapes are positively related with age.In the trunk on axis, clone F has fewer “Y” type ENBs and more “I” type ENBs than those of clone A+, indicating that clone F exhibits an improved economic trait.Therefore, our results provide an evaluative criterion for a novel strain (clone F) and basic data for genetic improvement of IBs in gibel carp.
Gibel carp; Allogynogenetic clone A+; Allogynogenetic clone F; Intermuscular bones; Genetic improvement
Q174
A
1000-3207(2017)04-0860-10
10.7541/2017.107
2017-03-14;
2017-04-06
中国科学院战略性先导专项(XDA08030201); 现代农业产业技术体系(NYCYTX-49)资助 [The Strategic Priority Research Program of the Chinese Academy of Sciences (XDA08030201);The earmarked fund for Modern Agro-industry Technology Research System (NYCYTX-49)]
李志(1980—), 女, 河南周口人; 实验师; 主要从事鱼类发育遗传研究。E-mail: lizhi@ihb.ac.cn
桂建芳, E-mail: jfgui@ihb.ac.cn
