云南盘鮈消化系统解剖学、组织学及消化酶活性研究
2017-08-16赵健蓉赵月月葛海龙苏胜齐王志坚
赵健蓉赵月月葛海龙苏胜齐王志坚
(1.西南大学生命科学学院, 淡水鱼类资源与生殖发育教育部重点实验室, 水产科学重庆市市级重点实验室, 重庆 400715; 2.西南大学动物科技学院, 重庆 400715)
云南盘鮈消化系统解剖学、组织学及消化酶活性研究
赵健蓉1赵月月1葛海龙1苏胜齐2王志坚1
(1.西南大学生命科学学院, 淡水鱼类资源与生殖发育教育部重点实验室, 水产科学重庆市市级重点实验室, 重庆 400715; 2.西南大学动物科技学院, 重庆 400715)
采用形态学、组织学及酶学方法对云南盘逗(Discogobio yunnanensis)成体消化系统进行研究。结果表明, 云南盘逗消化系统有以下特征: 口下位, 口腔上皮分布有较多味蕾及杯状细胞, 食道粗大, 含有大量黏液细胞, 无胃, 肠道较长, 盘旋于体腔中, 成鱼盘旋10回, 肠道系数为5.06±0.61, 肠分为前中后三段, 肠腔中密布肠绒毛。消化腺为肝胰脏, 肝脏分为左右两叶, 胰脏弥散分布在肝脏中。消化系统不同部位消化酶活性大小不同, 脂肪酶活性: 肝胰脏>前肠>中肠>后肠, 胰蛋白酶、淀粉酶、碱性磷酸酶活性: 前肠>中肠>肝胰脏>后肠。云南盘逗口下位, 食道粗短, 肠道细长, 肠绒毛丰富, 肠道含较高的胰蛋白酶和淀粉酶活性, 消化系统所具有的这些特征与其以固着藻类为食有关。
云南盘逗; 消化系统; 解剖学; 组织学; 消化酶
云南盘逗(Discogobio yunnanensis)俗称油桐子、油桐鱼, 隶属鲤形目(Cypriniformes)鲤科(Cyprinidae)野鲮亚科(Labeoninae)盘逗属(Discogobio),分布于大宁河、郁江、雅砻江下游、金沙江下游及南盘江水系等, 属于底栖激流冷水性鱼类, 具口吸盘, 喜流水生活。目前对云南盘逗的研究主要集中在不同地理居群形态变异[1]、营养成分分析[2]、繁殖力[3]、年龄与生长[4]、酶水解条件[5]、线粒体基因组[6]及口吸盘发育、显微结构和功能[7]方面。而有关云南盘逗消化系统方面的研究尚未报道, 目前国内外研究者主要对鱼类消化系统的发生、组织学、组织化学结构特征、消化酶活性分布及消化系统结构与食性关系等方面进行研究[8—13]。研究表明鱼类消化系统对食物的消化吸收与其生长、发育、繁殖等生命活动紧密相关。本研究主要对云南盘逗消化系统形态、组织结构及消化酶活性分布进行研究。目的在于丰富云南盘逗基础生物学资料的同时, 判定其食性, 从而为云南盘逗的人工繁殖及饲养提供指导意见, 并为其以后的开发利用提供理论基础。
1 材料与方法
1.1 材料
云南盘逗性成熟个体于2015年6月在巫溪大宁河购买。暂养在4 m×0.55 m×0.4 m循环水缸内, 光照周期14 L鲶10 D, 即14h光照10h黑暗, 微流水饲养,不间断充气。在实验室条件下驯养半年, 待其无死伤情况且可正常进食人工饲料时, 开始取材。水质参数如下: 水温(20.5±0.5)℃, 溶氧(7.59±0.03) mg/L, pH 7.98±0.79, 氨氮小于0.02 mg/L。饲料: 希望801配合饲料, 购于重庆希望有限公司。选取 30尾雌雄各半健康正常的成鱼, 体长(9.481±1.823) cm,体质量(14.711±6.916) g, 用于形态解剖和组织观察。
1.2 消化系统解剖学研究
取鲜活鱼经MS-222(间氨基苯甲酸乙酯甲磺酸盐)麻醉后解剖, Nikon SMZ1000解剖镜下观察其消化系统形态特征。测量肠道长度、肝重, 计算比肠长(比肠长=肠长/体长)、比肠重(比肠重=肠重/体重)、比肝胰脏重(比肝胰脏重=肝胰脏重/体重)。
1.3 消化系统组织学研究
解剖活鱼, 取口腔上皮、食道、前肠、中肠、后肠、肝胰脏于波恩氏液(Bouin’s)中固定24h, 石蜡包埋切片, 切片厚度4—5 μm, 苏木精-伊红染色法(Haematoxylin-eosin, HE)染色, NIKON ECLIPSE 80i显微摄像系统观察、照相。
1.4 消化系统酶学研究
取10尾健康正常的鱼, 麻醉后, 在碎冰上解剖,取出肝胰脏, 剔除肠道外壁多余脂肪, 先在体视镜下根据黏膜褶皱的走向, 将消化道分为前中后三段,计算三段相应比例(前中后肠长度比例约为1鲶1鲶1),后按比例取前中后肠, 将样品立即置于–80℃超低温冰箱保存, 用于进一步消化酶测定。
从冰箱中取出待测样品, 置于冰上解冻, 准确称取组织重量, 按重量(g)鲶体积(mL)=1鲶9的比例, 加入9倍体积的生理盐水, 使用F6/10 FLUKO手持匀浆机冰浴条件下机械匀浆5min, 转速5000 r/min, 以保证样品被充分研磨, 将匀浆液置于冷冻离心机中离心10min, 转速2500 r/min, 取上清液再用生理盐水按1鲶9稀释成1%组织匀浆, 用于可溶性蛋白含量和消化酶活性测定。在pH 8.0, 37℃条件下, 紫外分光光度计在波长253 nm时测定, 以每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003定义为1个胰蛋白酶活力单位。紫外分光光度计在波长660 nm时测定, 以组织中每毫克蛋白在37℃与底物作用30min, 水解10 mg淀粉定义为一个淀粉酶活力单位。在37℃条件下, 紫外分光光度计在波长420 nm时测定每克组织蛋白在本反应体系中与底物反应1分钟, 每消耗1 μmol底物为一个脂肪酶活力单位。酶标仪在波长520 nm时测定, 以每克组织蛋白在37℃与基质作用15min产生1 mg酚为一个碱性磷酸酶活力单位。本实验使用全波长酶标仪(Thermo)和紫外分光光度计(UV-2450)测定吸光度。
1.5 显微观察与数据分析
每项指标采用IPP图像分析软件随机选取30个样本测量相关数据。制片后采用NIKON ECLIPSE 80i显微摄像系统观察、照相。鱼体消化道各段任意取3张切片随机选10个视野。测得的数值经Excel(2010)及SPSS 19.0软件进行单因素方差分析, P<0.05表示差异显著。origin9.0软件作图。所有统计值均用平均值±标准差(Mean±SD)表示。
2 结果
2.1 消化系统形态学特征
云南盘逗消化系统由消化道和消化腺组成。消化道由口咽腔、食道、肠道和肛门组成(图版Ⅰ-a)。口和咽无明显的界限, 合称口咽腔。吻圆钝, 吻皮向腹面延伸盖住上颌, 吻端着生许多小乳突, 边缘呈流苏状, 下颌发达, 特化为椭圆形吸盘, 其上着生小乳突, 吸盘中央形成马蹄形褶皱。口下位, 略弯曲呈弧形。舌退化, 第五对鳃弓特化为中间型下咽骨, 其上着生两行下咽齿, 下咽齿侧扁型。食道粗短, 连接口咽腔与肠。内壁具有粗大网状褶皱(图版Ⅰ-b)。无胃, 成鱼肠道细长(图版Ⅰ-c), 呈螺旋状盘旋在腹腔中, 盘旋10回。肠管内壁具褶皱, 根据褶皱走向可将肠分为前、中、后三段, 前肠褶皱走向呈连续V字形(图版Ⅰ-d); 中肠褶皱不连续呈点柱状, 散列分布在肠管中(图版Ⅰ-e); 后肠褶皱走向与肠平行, 呈线型分布(图版Ⅰ-f)。解剖可观察到肠管从前到后逐渐变细, 肠壁也逐渐变薄。肠道长度为(45.160±12.244) cm, 比肠长为5.059±0.611, 比肠重为0.025±0.005。云南盘逗的外消化腺由肝脏和胰脏组成。胰脏弥散分布在肝脏组织中, 合称肝胰脏。肝胰脏分左右两叶, 位于肠道背面, 性腺的腹面。肝脏呈红褐色, 比肝胰脏重为0.013±0.002。胆囊为一深绿色囊状结构, 紧贴于肝脏两叶间, 部分埋于盘旋肠道中。
2.2 消化系统组织学特征
口咽腔口腔壁由黏膜层、黏膜下层、肌层组成。黏膜层为复层扁平上皮, 其上分布有大量的杯状和球状的黏液细胞, 也可见丰富的瓶状或卵圆形的味蕾, 瓶状顶部延伸到上皮表面, 开口于口咽腔。黏膜层较薄, 黏膜下层与基膜层分界不明显。肌层较厚, 由横纹肌组成(图版Ⅱ-a)。
食道食道壁黏膜层发达, 由固有膜支撑向腔内形成大量黏膜褶皱, 黏膜上皮由复层扁平上皮细胞组成, 其上分布有大量黏液细胞, 黏液细胞圆形或椭圆形, 密度为(14.011±1.185)个/100 μm2。黏膜下层由疏松结缔组织组成, 其间散布有大量纵行横纹肌纤维束。肌肉层厚, 内层环肌厚, 外层纵肌较薄, 均由平滑肌组成。最外层浆膜层薄, 由间皮细胞和薄层结缔组织(图版Ⅱ-b)。
肠肠道壁同食道一样, 也是由黏膜层、黏膜下层、肌层、浆膜层4层组成。黏膜层向肠腔突起形成指状黏膜褶皱, 黏膜层由单层柱状上皮细胞组成, 其上分布有较多圆形或椭圆形黏液细胞。黏膜下层较薄, 由疏松结缔组织组成。肌层较薄,内层环肌, 外层纵肌, 均由平滑肌组成。最外层为薄层结缔组织和间皮细胞组成的浆膜层。肠道黏膜层可见有少许血细胞和淋巴细胞分布, 在黏膜下层及肌肉层有大量毛细血管分布(图版Ⅱ-c-f)。前肠黏膜层游离面纹状缘明显。黏膜褶皱从前到后逐渐趋于平缓, 前肠黏膜褶皱高为(351.293± 36.387) μm, 黏膜褶皱高显著性高于中后肠(P< 0.05)。同食道相比, 肠道黏液细胞数量显著性减少(P<0.05)。中肠黏液细胞最多, 前肠次之, 后肠最少。食道肌肉层最厚(P<0.05), 肠道前中后部肌层厚度差异不显著(P>0.05)。云南盘逗消化道组织形态学指数见表 1。
消化腺云南盘逗胰脏弥散分布在肝脏中,合称肝胰脏。肝脏表面包被着由致密结缔组织形成的被膜, 小叶间结缔组织不发达, 肝细胞索也不明显, 肝血窦以中央静脉为中心呈放射状排列(图版Ⅱ-g), 其内含丰富红细胞, 可见小叶间胆管与小叶间静脉伴行(图版Ⅱ-h)。肝细胞形状多样, 细胞中有一些较大的空泡状结构, 胞体较大, 细胞间界限不明显, 但细胞核大且清晰呈圆形, 位于细胞边缘, 其内核仁常为一个, 位于细胞核中央。胰脏弥散分布在肝脏组织中, 肝脏组织外也有少量分布(图版Ⅱ-i-j), 胰腺细胞呈卵圆形, 染色较肝细胞深。
2.3 消化酶活性变化
云南盘逗消化系统不同部位消化酶活性不同。前肠胰蛋白酶活性最高(P<0.05), 后肠胰蛋白酶活性最低; 肝胰脏的脂肪酶活性最高(P<0.05), 肠道中脂肪酶活性从前到后依次降低; 淀粉酶活性顺序:前肠>中肠>肝胰脏>后肠; 前肠碱性磷酸酶活性显著高于其他各部(P<0.05), 中肠次之, 后肠和肝胰脏碱性磷酸酶活性差异不显著(P>0.05); 云南盘逗消化酶活性分布见图 1。
3 讨论
3.1 消化道结构与其功能关系
云南盘逗口咽腔较大, 侧扁型下咽齿, 利于将食物碾磨、切割; 食道粗短, 其上分布大量网状褶皱, 利于将食物快速输送到肠道; 云南盘逗肠道比肠长为5.059±0.611, 与鳙(Aristichthys nobilis)、鲢(Hypophthalmichthys molitrix)相近[12,14], 为杂食性鱼类。云南盘逗口下位, 下唇特化为马蹄形褶皱的口吸盘, 可附着于石壁上辅助运动并刮食石壁上固着藻类为食。云南盘逗成鱼肠道在体腔中盘旋10回,有利于藻类等食物的消化吸收。

表 1 云南盘鳇消化道组织形态指数Tab.1 Morphological index of digestive tract of D.yunnanensis
云南盘逗口腔上皮中分布有较多的味蕾和杯状细胞, 可对食物进行甄别与选择; 杯状细胞可分泌含抗菌、溶菌的水解酶类, 以阻止病原体的侵入,同时分泌的黏液对食物具有一定的吸附作用, 利于将食物顺利吞咽进入食道[15,16]。食道复层扁平上皮对食道有一定的保护及修复功能, 分布大量的黏液细胞可润滑食物, 减少食物对食道的机械磨损[17],这与乌鳢(Channa argus)[18]研究结果一致。食道肌肉层发达, 其中散布大量横纹肌纤维束, 利于将食物快速推入肠道消化。肠道是云南盘逗消化吸收的主要场所。黏膜褶皱可增大肠道与食物接触表面积利于消化吸收[19], 其肠道褶皱高度从前到后逐渐趋于平缓, 表明肠道消化吸收能力越来越弱。肠道中黏液物质的分泌可继续润滑食物, 减小食物对肠道机械损伤, 同时也可加快肠道对食物的消化吸收[17]。前肠的黏液细胞分泌黏液物质可减缓食物向后肠的运动, 从而延长食物在前肠中消化吸收时间, 使食物在前肠中较为充分的被吸收; 中肠较多的黏液细胞分泌黏液可利于肠道的蠕动, 从而使在前肠中未被消化吸收的食物在中肠得到充分消化吸收; 后肠黏液细胞数量显著性少于前中肠, 说明云南盘逗前中肠是消化吸收的主要场所, 后肠消化吸收能力减弱。后肠黏液细胞数量减少这一现象与湘华鲮(Sinilabeo decorus tungting)、鲢、鳙等肠道系数较大的鱼类一致[14,10], 而与肠道系数相对较小的长鳍篮子鱼(Siganus canalicullatus)、黄斑篮子鱼(Siganus oramin)情况不同[20,21], 推测后肠黏液细胞数量与肠道的长度相关。肠道肌肉层厚度显著性小于食道, 肠道前中肠较厚的环肌层加强肠道的蠕动能力, 从而使食物在前中肠被充分吸收, 而后肠较厚的的纵肌层利于将食物残渣迅速排出体外。这一特点在稀有逗鲫(Gobiocypris rarus)消化道研究中也有发现[22]。肠道黏膜层、黏膜下层及肌层分布有丰富的血细胞及毛细血管, 利于将消化吸收后的产物迅速运输到其他部位, 这与大鳍异鮡(Creteuchiloglanis macropterus)研究结果相一致[23]。
3.2 消化酶活性
Kawai等[24]研究指出鱼类不同组织中蛋白酶活性不同。云南盘逗胰蛋白酶活性从前肠到后肠逐渐降低, 肝胰脏胰蛋白酶活性介于中肠、后肠之间,与湘华鲮[10]、鲢和鳜(Siniperca chuatsi)[11]胰蛋白酶活性相似, 说明云南盘逗前中肠是食物中蛋白质消化吸收的主要场所, 肝胰脏中胰蛋白酶活性较低主要原因是肝胰脏分泌蛋白酶原, 蛋白酶原活性较低, 需分泌到肠道中经肠激酶激活后才有较强活性[20,25]。而在对青鱼(Mylopharyngodon piceus)、鲤(Cyprinus carpio)、草鱼(Ctenopharyngodon idellus)胰蛋白酶活性研究发现, 蛋白酶活性呈现前低后高的趋势, 说明不同种鱼肠道蛋白酶活性变化呈现不同规律[11]。云南盘逗肠道中脂肪酶及淀粉酶活性均呈先高后低趋势, 说明前中肠为消化吸收主要部位。碱性磷酸酶是一种辅助上皮细胞吸收的一种金属酶类, 与脂类、葡萄糖、钙、无机磷等吸收呈正相关, 主要存在于前肠纹状缘及上皮细胞较浅部位[26,27]。前肠碱性磷酸酶活性显著性高于其他部位, 说明前肠是云南盘逗消化吸收最重要部位, 与许氏平鲉(Sebastes schlegeli)[28]研究结果一致; 中肠碱性磷酸酶活性略低于前肠, 且显著性高于后肠和肝胰脏, 推测中肠在消化吸收过程中主要作用是进一步对食物进行消化吸收, 从而使食物充分消化吸收利用。云南盘逗消化道内含较高的胰蛋白酶, 其次为淀粉酶, 因而在饲料投喂中, 应适当提高其饵料中蛋白质及淀粉类成分含量。
云南盘逗口下位, 食道粗短, 肠道细长, 肠绒毛丰富, 肠道含较高的胰蛋白酶和淀粉酶活性, 消化系统所具有的这些特征与其食性(固着藻类为食)相关。
[1]Yang Q, Zhou W, Shu S S.Morphological variations and differentiation of Discogobio yunnanensis from different population [J].Acta Zootaxonomical Sinica, 2011, 36(1): 117—124 [杨琴, 周伟, 舒树森.云南盘鮈不同地理居群的形态变异及分化.动物分类学报, 2011, 36(1): 117—124]
[2]Pu D C, Su S Q, Yao W Z, et al.Analysis and evaluation of the nutritional components in Discogobio yunnanensis muscle [J].Food Science, 2015, 36(10): 129—133 [蒲德成, 苏胜齐, 姚维志, 等.云南盘逗肌肉营养成分分析与营养评价.食品科学, 2015, 36(10): 129—133]
[3]Yan Z B, Liu A H, Wang Z J.The Preliminary Research on the Fertility of Discogobio yunnanensis [C].Book of Abstracts, Academic Symposiums for Chinese Ichthyological Society 2008.2008 [晏正碧, 刘安洪, 王志坚.云南盘逗繁殖力初步研究.中国鱼类学会2008学术研讨会论文摘要汇编.2008]
[4]Geng X C, He Y X, Wang Z J.The Determination of the Age and Growth of Discogobio yunnanensis [C].Book of Abstracts, Academic Symposiums for Chinese Ichthyological Society 2008.2008 [耿相昌, 何洋兴, 王志坚.云南盘逗年龄与生长.中国鱼类学会2008学术研讨会论文摘要汇编.2008]
[5]Zhang H F, Li B C.Investigation on the technological condition of controlled enzymatic hydrolysis for Discogobio yunnanensis [J].Chinese Journal of Spectroscopy Laboratory, 2010, 27(5): 1720—1724 [张惠芬, 李宝才.云南盘逗酶水解条件研究.光谱实验室, 2010, 27(5): 1720—1724]
[6]Xue Y, Chen H J, Li Y, et al.Mitochondrial genome of the sucking disc gudgeon, Discogobio yunnanensis (Teleostei, Cypriniformes) [J].Mitochondrial DNA, 2016, 27(2): 1451—1452
[7]Zhou W, Cui G H, Liu D S.Development, surface ultra structure of the sucking disc of Discogobio yunnanensis (Regan) and it’s function [J].Acta Zoological Sinica, 1993, 39(2): 118—123 [周伟, 崔桂华, 刘得胜.云南盘逗口吸盘发育, 表面亚显微结构及功能.动物学报, 1993, 39(2): 118—123]
[8]Zhao Z M, Zhao Y L, Liu M J, et al.Morphological and histological characterization of the digestive system of Sinobdella sinensis bleeker, 1870 [J].Acta Hydrobiologica Sinica, 2016, 40(6): 1201—1207 [赵子明, 赵媛莉,刘美剑, 等.中华刺鳅消化系统形态与组织学研究.水生生物学报, 2016, 40(6): 1201—1207]
[9]Tuo Y.Preliminary observation on morphology and histology of digestive system in Hemibarbus maculates Bleeker [J].Sichuan Journal of Zoology, 2014, 33(6): 879—887 [庹云.花逕消化系统形态学及组织学的初步观察.四川动物, 2014, 33(6): 879—887]
[10]Yang Y H, Wang L X, Li X Z, et al.Comparative study on morphology and histology of digestive system of Silurus lanzhouensis and catfish (Silurus asotus) [J].Acta Hydrobiologica Sinica, 2017, 41(1): 174—181 [杨元昊,王立新, 李学智, 等.兰州鲇与鲇消化系统的形态学及组织学比较研究.水生生物学报, 2017, 41(1): 174—181]
[11]Wu T T, Zhu X M.Studies on the activity of digestive enzymes in mandarin fish, black carp, grass carp, common carp, crucian carp and silver carp [J].Journal of Fishery Sciences of China, 1994, 1(2): 10—17 [吴婷婷, 朱晓鸣.鳜鱼, 青鱼, 草鱼, 鲤, 鲫, 鲢消化酶活性的研究.中国水产科学, 1994, 1(2): 10—17]
[12]Zeng D, Ye Y T.Studies on digestive system and different feeding habits of some fishes in freshwater [J].Journal of Southwest Agricultural University, 1998, 20(4): 361—364 [曾端, 叶元土.鱼类食性与消化系统结构的研究.西南农业大学学报, 1998, 20(4): 361—364]
[13]Zhang Y W, Jin Z M, Chen X, et al.Comparative studies on the digestive system of four kinds of cypriniformes [J].Journal of Anhui Agricultural Sciences, 2011, 39(27): 16796, 16825 [张雨薇, 金志民, 陈鑫, 等.4种鲤形目鱼类消化系统的比较研究.安徽农业科学, 2011, 39(27): 16796, 16825]
[14]Bi B, Sun Z W, Mao T Q, et al.Relationship between digestive tract structure and feeding habits in common carp, grass carp, silver carp and bighead carp [J].Chinese Journal Fisheries, 2011, 24(1): 26—29 [毕冰, 孙中武,毛天强, 等.鲤, 鲢, 鳙, 草鱼消化道结构与食性的研究.水产学杂志, 2011, 24(1): 26—29]
[15]Wang J X, Shi G, Li P, et al.Morphology and histology of digestive tract in Oplegnathus fasciatus [J].Journal of Fisheries of China, 2006, 30(5): 618—626 [王健鑫, 石戈, 李鹏, 等.条石鲷消化道的形态学和组织学.水产学报, 2006, 30(5): 618—626]
[16]Chen G H, Wang Y B, Wang J, et al.Histology of the digestive system in Cheilinus undulates Rupell [J].Acta Hydrobiologica Sinica, 2010, 34(4): 685—693 [陈国华,王永波, 王珺, 等.波纹唇鱼消化系统的组织学.水生生物学报, 2010, 34(4): 685—693]
[17]Liu H R, Zhang Y G.Preliminary study on distribution and type of goblet cells in digestive tract of Silurus meridionalis [J].Sichuan Journal of Zoology, 2002, 21(1): 6—8 [刘怀如, 张耀光.南方鲇消化道杯状细胞分布及类型探讨.四川动物, 2002, 21(1): 6—8]
[18]Liu H M.Study on the Histology and Enzyme in the Digestive Tract of Ophicephalus argus [D].Thesis for Master of Science.Ocean University of China, Qingdao.2006 [刘红梅.乌鳢消化系统组织学及消化酶的研究.硕士学位论文.中国海洋大学, 青岛.2006]
[19]Ma L.Scanning electron microscopic study of the gut mucosa rohu, Labeo rohita [J].Journal of Fisheries of China, 1989, 13(2): 170—172 [马力.扫描电子显微镜研究露斯塔野鲮的肠黏膜.水产学报, 1989, 13(2): 170—172]
[20]Yang J H, Zhang L Z, Zhuang P, et al.The digestive tube index and the activity distribution of three kinds of digestive enzymes in the digestive organs of cultured Siganus canaliculatus [J].Marine Sciences, 2009, 33(7): 43—50 [杨金海, 章龙珍, 庄平, 等.人工养殖长鳍篮子鱼消化道指数及3种消化酶活性分布.海洋科学, 2009, 33(7): 43—50]
[21]Qu Y J, Li J E, Gou X W, et al.Histological and histochemical study of digestive tract of Siganus oramin [J].South China Fisheries Science, 2013, 9(5): 51—57 [区又君, 李加儿, 勾效伟, 等.黄斑篮子鱼消化道组织学和组织化学研究.南方水产科学, 2013, 9(5): 51—57]
[22]Wang Y M, Shi J R, Zhang Y G, et al.Histological study on the digestive tract of cultivated Gobiocypris rarus [J].Sichuan Journal of Zoology, 2013, 32(3): 410—414 [王永明, 史晋绒, 张耀光, 等.人工养殖稀有逗鲫消化道组织学观察.四川动物, 2013, 32(3): 410—414]
[23]Huang Z H, Yi J H, Chen D M, et al.Morphological and histological observations of digestive system in Creteuchiloglanis macropterus [J].Freshwater Fisheries, 2015, 45(2): 8—14 [黄自豪, 易建华, 陈冬明, 等.大鳍异鲦消化系统形态学和组织学观察.淡水渔业, 2015, 45(2): 8—14]
[24]Kawai S, Ikeda S.Studies on digestive enzymes of fishes.2.Effect of dietary change on activities of digestive enzymes in carp intestine [J].Bulletin of the Japanese Society of Scientific Fisheries, 1972, 38(3): 265
[25]Das K M, Tripathi S D.Studies on the digestive enzymes of grass carp, Ctenopharyngodon idella (Val.) [J].Aquaculture, 1991, 92: 21—32
[26]Tengjaroenkul B, Smith B J, Caceci T, et al.Distribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia, Oreochromis niloticus L [J].Aquaculture, 2000, 182(3): 317—327
[27]Feng X Y, Zhen J S, Wang M L.A study of the histochemistry on the digestive tract of the Sebastes schlegeli [J].Journal of Ocean University of Qingdao (Natural Science), 2003, 33(3): 399—404 [冯晓燕, 郑家声, 王梅林.许氏平鲉消化道的组织化学研究.青岛海洋大学学报:自然科学版, 2003, 33(3): 399—404]
[28]Zhen J S, Feng X Y.Distribution of intestinal enzymes in digestive tract of Sebastes schlegeli [J].Journal of Fishery Sciences of China, 2002, 9(4): 309—314 [郑家声, 冯晓燕.许氏平鲉消化道中部分消化酶的研究.中国水产科学, 2002, 9(4): 309—314]
ANATOMICAL, HISTOLOGICAL OBSERVATIONS OF DIGESTIVE SYSTEM AND DIGESTIVE ENZYME ACTIVITY IN DISCOGOBIO YUNNANENSIS
ZHAO Jian-Rong1, ZHAO Yue-Yue1, GE Hai-Long1, SU Sheng-Qi2and WANG Zhi-Jian1
(1.Key Laboratory of Freshwater Fish Reproduction and Development (Ministry of Education), Key Laboratory of Aquatic Science of Chongqing, School of Life Sciences, Southwest University, Chongqing 400715, China; 2.College of Animal Science and Technology Southwest University, Chongqing 400715, China)
The present study investigated the structure and function of the digestive system in Discogobio yunnanensis by morphological, histological and zymologic methods.Results showed that the mouth of D.yunnanensis was inferior, and the digestive tract was composed of oral cavity, esophagus and gut without an obvious stomach.Many taste buds and goblet cells were distributed in oral epithelia.The esophagus was short and thick with abundant goblet cells in the mucous layer.The intestinal index was 5.06±0.61, and the gut was the largest part, which hovered in the body cavity.According to the morphology, the gut with abundant villi was divided into the cranial, middle and posterior parts.Digestive gland was hepatopancreas, and the liver was divided into two parts, with pancreas diffused in.The different digestive parts had diverse digestive enzyme activities.The activities of lipase in different digestive parts ranged as follows: hepatopancreas>foregut>midgut>hindgut, while those of trypsase, amylase and alkaline phosphatase were foregut>midgut>hepatopancreas>hindgut.These results suggest the adaptation of this fish in feeding fixed algaes.
Discogobio yunnanensis; Digestive system; Anatomy; Histology; Digestive enzyme
Q174
A
1000-3207(2017)04-0853-07

图版Ⅰ 云南盘逗消化系统解剖学观察
PlateⅠ Anatomical observations of digestive system in Discogobio yunnanensis
a.消化系统解剖图; b.整条肠道; c.食道; d.前肠; e.中肠; f.后肠 E.食道; L.肝脏; MI.中肠; PI.后肠; S.脾脏; T.精巢
a.Anatomy of the digestive system; b.Digestive tract; c.Esophagus; d.Anterior intestine; e.Middle intestine; f.Posterior intestine E.Esophagus; L.Liver; MI.Middle intestine; PI.Posterior intestine; S.Spleen; T.Testis
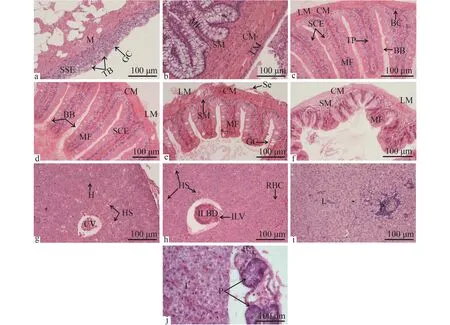
图版Ⅱ 云南盘逗消化系统组织学观察
PlateⅡ Histological observations of digestive system in Discogobio yunnanensis
a.口咽腔上皮横切; b.食道横切; c-d.前肠横切; e.中肠横切; f.后肠横切; g-h.肝脏; i-j.胰脏 BB.纹状缘; BC.血细胞; CM.环肌; CV.中央静脉; GC.杯状细胞; H.肝细胞; HS.肝血窦; ILBD.小叶间胆管; ILV.小叶间静脉; L.肝脏; LM.纵肌; MC.肌层; MF.黏膜褶皱; P.胰脏; RBC.红细胞; Se.浆膜层; SM.黏膜下层; SSE.单层柱状上皮; TB.味蕾; TP.固有膜
a.cross-section of buccopharyngeal cavity epithelium; b.cross-section of esophagus; c-d.cross-section of anterior intestine; e.cross-section of middle intestine; f.cross-section of posterior intestine; g-h.liver; i-j.pancreas BB.brush border; BC.blood cell; CM.circular muscle; CV.showing central vein; GC.goblet cell; H.hepatocyte; HS.hepatic sinusoid; ILBD.interlobular bile duct; ILV.interlobular vein; L.liver; LM.longitudinal muscle; MC.muscular; MF.mucosal fold; P.pancreas; RBC.red blood cell; Se.serosa; SM.submucosa; SSE.stratified squamous epithelium; TB.taste bud; TP.tunica propria
10.7541/2017.106
2016-08-04;
2016-11-20
重庆市科委项目(cstc2016shmsx80089)资助 [Supported by the Chongqing Science and Technology Commission (cstc 2016shmsx80089)]
赵健蓉(1993—), 女, 四川巴中人; 硕士研究生; 主要从事资源动物学研究。E-mail: jianrong1993@126.com
王志坚(1969—), 男, 四川南充人; 教授, 博士; E-mail: wangzj1969@126.com
