青鳉prdm14的原核表达、多克隆抗体制备及其应用
2017-08-16李玲玉陈天圣
李玲玉 方 健 于 淼 陈天圣
(华中农业大学水产学院, 农业部淡水生物繁育重点实验室, 武汉 430070)
青鳉prdm14的原核表达、多克隆抗体制备及其应用
李玲玉 方 健 于 淼 陈天圣
(华中农业大学水产学院, 农业部淡水生物繁育重点实验室, 武汉 430070)
青鳉(Oryzias latipes)是研究遗传发育和细胞多能性的重要模式鱼类, 为探究prdm14同源基因的潜在作用, 实验将青鳉prmd14经原核表达后制备了兔抗Prdm14多克隆抗体。首先, 将prdm14基因的部分编码区连接到pET32a质粒中, 构建重组表达载体pET32a-prdm14∆600。随后将重组载体转化至大肠杆菌(Escherichia coli)Rosetta(DE3), 经异丙基-β-d-硫代半乳糖苷(Isopropyl-β-d-thiogalactoside, IPTG)诱导表达, 获得分子量为60 kD的Prdm14重组蛋白。接着大量诱导蛋白表达并切胶纯化, 免疫家兔(Oryctolagus cuniculus), 6周后获得阳性抗体, 最后通过ELISA和Western blot检测抗体效价及其特异性。结果显示, 在37℃、0.6 mmol/L IPTG、诱导3h的条件下, 可获得Prdm14重组蛋白的高效表达; 制备的兔抗青鳉Prdm14多克隆抗体能够特异性识别青鳉组织中表达的Prdm14蛋白以及在HepG2细胞中过表达的青鳉Prdm14: EGFP融合蛋白。综上所述, 研究首次制备了一种能有效识别青鳉Prdm14的多克隆抗体, 该抗体的获得为后续研究prdm14基因在鱼类多能性干细胞中的作用提供了有力工具。
青鳉; Prdm14; 原核表达; 多克隆抗体; 干细胞
细胞的多能性调控和分化的分子机制是干细胞生物学领域的一个重要问题。研究表明PRDM家族成员参与了细胞早期的分化, 它们能通过组蛋白酶的激活或者相互作用来调控目的基因的表达, 从而参与转录调节和染色体的表观修饰过程[1,2]。作为PRDM家族中重要的一员, PRDM14包含一个PR/SET结构域和6个锌指结构。人类PRDM14在胚胎干细胞中表达, 能直接靶向干细胞因子OCT4的近端增强子从而调控OCT4的表达, 同时能与干细胞中一些关键的转录因子OCT4、NANOG、SOX2、KLF4等结合, 激活细胞多能性基因同时抑制细胞分化标志基因的表达, 是干细胞调控网络的核心因子, 在胚胎干细胞多能性状态的维持, 体细胞潜在全能性的重新获得及表观遗传学重编程中具有重要作用[3—6]。在小鼠中, prdm14在胚胎干细胞中具有相似的功能[7,8], 同时它也在原始生殖细胞中表达并对生殖细胞的特化和发育有至关重要的影响[9], 实验表明prdm14缺失小鼠雌性和雄性均不育[10,11]。PRDM14也是一个重要的原癌基因, 在许多癌细胞中高度表达, 能促进肿瘤细胞的生长并降低其对化疗药物的敏感性[12—14], 对细胞的生长和分化也具有重要的作用[15]。
作为一个新近才被发掘的基因, 相对于小鼠和人prdm14的诸多研究, 其他物种的同源基因被鉴定的较少, 目前鱼类中仅斑马鱼(Danio rerio)和牙鲆(Paralichthys olivaceus)的同源基因有过报道[16,17]。序列分析表明prdm14基因在结构域的区段具有较高的保守性, 斑马鱼和牙鲆prdm14的结构域和小鼠的同源性均可达到68%[16,17]。但是目前对鱼类prdm14同源基因的研究数据有限, 它是否具有干细胞多能性的维持和生殖细胞的特化等功能还有待深入研究。
模式鱼类青鳉(Oryzias latipes)具有生殖周期短, 易室内饲养, 胚胎发育过程易观察, 遗传背景多样, 基因组信息完善等优点[18], 是研究基因功能及鱼类遗传育种的重要材料[19—21]。目前青鳉的胚胎干细胞[22]、单倍体干细胞[23]、生殖干细胞[24]均已获得, 它是除小鼠之外研究干细胞和生殖细胞调控机制的理想模式生物。由于在高等动物中prdm14是干细胞多能性网络的一个重要调控因子, 因此青鳉的prdm14基因也可能参与了细胞多能性的调控和生殖细胞的特化等过程, 这有待进一步的分析和验证。前期我们已经鉴定了青鳉的prdm14基因(结果另文发表), 本实验制备了特异性的兔抗青鳉源Prdm14多克隆抗体, 该抗体能有效地检测内源的和过表达的青鳉Prdm14蛋白。
1 材料与方法
1.1 实验材料
大肠杆菌DH5α、Rosetta(DE3)购自北京全式金生物技术有限公司; 质粒pIRES-DsRed、pET32a、pCAG-EGFP均由本实验室构建或保存; 野生型青鳉从中国科学院水生生物研究所获得; 人肝癌细胞系HepG2由本实验室保存。
1.2 Prdm14原核表达载体的构建与鉴定
根据Ensembl(http://www.ensembl.org/index.html)数据库中青鳉prdm14基因的序列(ENSORLG 00000008105)设计引物F1(5′-AAAGAATTCATGT GGCTGTCCCTCTCCTGCTC-3′)和R1582(5′-AAACCGCGGTTAATTCCAGGGTCGATATT CAGAATT-3′), 以青鳉卵巢的cDNA为模板通过PCR扩增得到prdm14全长编码序列(1761 bp), 并构建真核表达载体pPrdm14-IRES。将pET32a载体及pPrdm14-IRES质粒分别取1 μg用限制性内切酶EcoRⅠ和HindⅢ (NEB, 美国)双酶切, 所得产物经1%琼脂糖凝胶电泳后切取prdm14目的片段以及pET32a骨架质粒进行胶回收, 再用T4 DNA连接酶(NEB, 美国)进行连接。将连接产物转化至大肠杆菌DH5α, 挑取克隆后用Omega (美国)质粒提取试剂盒提质粒, 并用HindⅢ、NotⅠ和EcoRⅤ, PmlⅠ和EcoRⅠ分别酶切鉴定。经验证的pET32a-prdm14质粒取1 μg, 酶切去除两个SacⅠ位点之间的600 bp序列, 切胶回收剩余片段, 再通过DNA连接酶环化,得到包含部分prdm14 CDS (1161 bp)的原核表达载体pET32a-prdm14∆600。最后用扩增CDS全长的引物F1和R1582以1 ng质粒为模板进行PCR验证, 反应条件为: 94℃预变性5min; 94℃变性30s, 58℃退火30s, 72℃延伸2min, 30个循环; 72℃ 10min。
1.3 诱导Prdm14原核表达
将pET32a-prdm14及pET32a-prdm14∆600质粒分别转入Rosetta (DE3)菌中, 涂含Amp (100 μg/mL)的抗性平板, 挑取单克隆至3 mL LB培养液, 于37℃下200 r/min恒温振荡培养12h, 再按1‰、2‰、3‰、5‰、7‰和10‰体积分别转入含有2 mL LB培养液的摇菌管中, 37℃培养2h后加入0.6 mmol/L异丙基-β-d-硫代半乳糖苷(Isopropyl-β-d-thiogalactoside, IPTG)诱导, 同时以未诱导组及转入pET32a空载体组为对照。诱导3h后取1 mL菌液离心沉淀, 加入80 μL Tris-EDTA以及20 μL SDS蛋白上样缓冲液煮沸10min, 1000 r/min离心5min后取上清进行10%聚丙烯酰胺凝胶电泳(SDS-PAGE, 康为世纪), 最后用考马斯亮蓝染色并观察菌体蛋白表达情况。
1.4 融合蛋白纯化及抗体制备
将Prdm14融合蛋白条带从胶上切下, 放入液氮中充分研磨, 加入等体积的PBS缓冲液混匀至乳胶状态。取1只家兔, 腹部多点皮下注射抗原200 μg。每隔2周时间, 按照以上步骤进行加强免疫注射, 共免疫注射3次; 另取1只家兔不做任何处理, 作为阴性对照。第3次免疫后7d, 对家兔进行颈动脉采血。将离心管中的血液室温静置2h后, 再置4℃冰箱内过夜。待血液凝固血块收缩后, 2500 r/min离心30min, 取上清分装于干净的离心管中, –20℃保存, 同时取部分抗血清经抗原亲和纯化抗体, 再经ELISA检测抗体效价。实验中抗体的免疫制备过程由上海佑隆生物有限公司完成。
1.5 Prdm14: EGFP融合表达载体构建及鉴定
为进一步验证抗体的特异性, 我们构建了融合EGFP的表达系统。设计引物fusion-F (5′-CATC ATTTTGGCAAAGAATTCATGTCGGTGTC CCTCTCCTG-3′)、fusion-R (5′-GCTCACCATGG TGGCGAATTCATTCCAGGGTCGATATTCAG-3′), 去除prdm14基因的TAA终止密码子以便将基因阅读框融合到EGFP蛋白中, 并在连接处各设计1个EcoRⅠ酶切位点。以pPrdm14-IRES质粒为模板扩增prdm14 基因CDS, 同时将pCAG-EGFP载体用EcoRⅠ酶切, PCR产物及线性化质粒通过1%琼脂糖凝胶电泳、切胶回收后用一步法In-Fusion PCR扩增试剂盒(Vazyme, 南京)融合, 构建Prdm14: EGFP融合表达载体, 最后再用EcoRⅠ单酶切鉴定。将鉴定正确的质粒扩大培养后, 大量提取质粒以备后用。
1.6 细胞培养及转染
将HepG2细胞按1×106个/孔接种于六孔板中,培养条件: DMEM(Hyclone, 美国)培养液, 含10%已灭活胎牛血清(Fetal bovine serum, FBS, 四季青, 杭州)及100 kU/L青霉素和100 kU/L链霉素; 37℃, 5%CO2。培养24h后更换培养液为不含血清的DMEM以提高转染效率, 然后用LipofectamineTM2000(Invitrogen, 美国)转染试剂进行转染, 每孔加入6 μL转染试剂及2 μg去除内毒素的pCAG-prdm14EGFP质粒, 对照组加入pCAG-EGFP空载体; 处理3h后, 再次更换培养液为含10%胎牛血清的DMEM培养基,将细胞培养板置于培养箱内继续培养; 48h后在倒置荧光显微镜(Ti-S, Nikon)下观察并拍照。
1.7 动物组织及细胞总蛋白提取
分别取性成熟青鳉精巢(Testis)、卵巢(Ovary)、脑(Brain)组织各0.5 g, 以及上述转染后2种细胞各1×107个, 用动物组织或细胞蛋白提取试剂盒(生工,上海)提取总蛋白, 经BCA蛋白定量试剂盒(康为世纪, 北京)测定蛋白浓度, 最后加入1/4体积SDS上样缓冲液, 煮沸10min, 于1000 r/min离心5min, 取上清液置–20℃保存待用。
1.8 Western blot检测
将菌体蛋白或组织及细胞蛋白经10% SDSPAGE电泳后, 置半干电转仪(Bio-Red, 美国)中18 V电压转膜25min, 5%脱脂奶粉封闭过夜; 再加入制备的兔多抗αPrdm14 (1鲶1000)或其他一抗(αHis, 1鲶1500; αβ-Actin, 1鲶1200; αGFP, 1鲶1000, Vazyme)置3D摇床上孵育2h (室温)或4℃过夜; 用Tris-HCl吐温缓冲溶液(TBS+0.1% Tween, TBST)洗膜6次, 每次10min; 随后用辣根过氧化物酶(Horseradish peroxidase, HRP)标记的羊抗兔二抗(1鲶10000)或鼠二抗(1鲶10000)室温孵育1h; 再经TBST洗膜3次, 每次10min; 最后用ECL发光试剂盒(Thermo, 美国)显色并用GE化学发光凝胶成像系统成像观察。
2 结果
2.1 原核重组载体构建
如图 1A所示。通过酶切pPrdm14-IRES质粒得到含prdm14全长编码序列(1761 bp)的片段, 并将该片段插入pET-32a载体(图 1B), 构建重组载体pET32a-prdm14。质粒分别经HindⅢ、NotⅠ和EcoRⅤ, PmlⅠ和EcoRⅠ酶切, 分别得到预期大小的片段。构建的载体经测序分析, 确认插入片段序列无移码突变。大肠杆菌表达系统是目前最为常用的外源蛋白表达系统, 但是在实践过程中外源重组蛋白极易形成没有生物活性的包涵体[25], 而且复杂的mRNA二级结构会导致重组蛋白表达效率降低, 因此本实验同时构建了一个相对较短的重组蛋白载体pET32a-prdm14∆600, 以获得足量高纯度的目的蛋白, 该重组蛋白包含Prdm14的N端及PR结构域, 并能翻译386个氨基酸残基。进一步的实验证实了pET32a-prdm14和pET32a-prdm14∆600质粒构建成功。重组载体结构如图 1B所示, pET32a-prdm14载体包含prdm14 CDS全长, 含8个外显子共1761 bp; pET32a-prdm14∆600载体中删除了prdm14 CDS第4个外显子后部至第7个外显子之间的600 bp。
2.2 诱导重组蛋白表达、纯化及抗体制备

图 1 prdm14基因原核表达载体构建示意图Fig.1 Construction of prdm14 prokaryotic expression vector
转入pET32a-prdm14载体的细菌在IPTG诱导后, 经SDS-PAGE电泳分析显现1条83 kD的特异性条带, 转入pET32a-prdm14∆600载体的细菌则诱导出1条约60 kD的条带, 均与预期目的条带大小一致。同时, 未加IPTG诱导的菌和空载体对照组没有出现相应的条带。因此, 确认Prdm14融合蛋白在Rosetta (DE3)中正确表达。不同接种浓度的诱导结果均显示表达Prdm14全长的菌体产生融合蛋白的量明显比短片段的低, 且按5‰比例接种时表达量最高。大量诱导Prdm14∆600重组蛋白后切胶纯化, 共得到5 mg纯化蛋白, 纯度>95 %, 满足后续实验要求。
免疫家兔6周后获得多克隆抗体, 经ELISA检测效价为1鲶243000, 阳性判定点为OD阳/OD阴>2.5。
2.3 多克隆抗体特异性检测
以转入pET32a载体的细菌为空白对照, αHis (1鲶1500)为阳性对照, Western blot结果显示, 青鳉Prdm14多克隆抗体(1鲶1000)能够特异性识别Prdm14及Prdm14∆600重组蛋白(图 2A)。对表达Prdm14∆600重组蛋白的细菌裂解物进行10、100、1000和10000倍稀释, 经Western blot检测, 结果表明在1鲶1000稀释的抗体条件下, 该多克隆抗体可识别1000倍稀释的Prdm14∆600重组蛋白(图 2B)。此外,青鳉精巢、卵巢、脑蛋白样品的Western blot检测结果均显示单一的64 kD条带, 与青鳉内源的Prdm14蛋白大小一致, 而且采用免疫前血清作为一抗时未出现任何条带(图 2C)。以上结果均证明兔抗青鳉多克隆抗体能够特异性识别青鳉Prdm14蛋白。
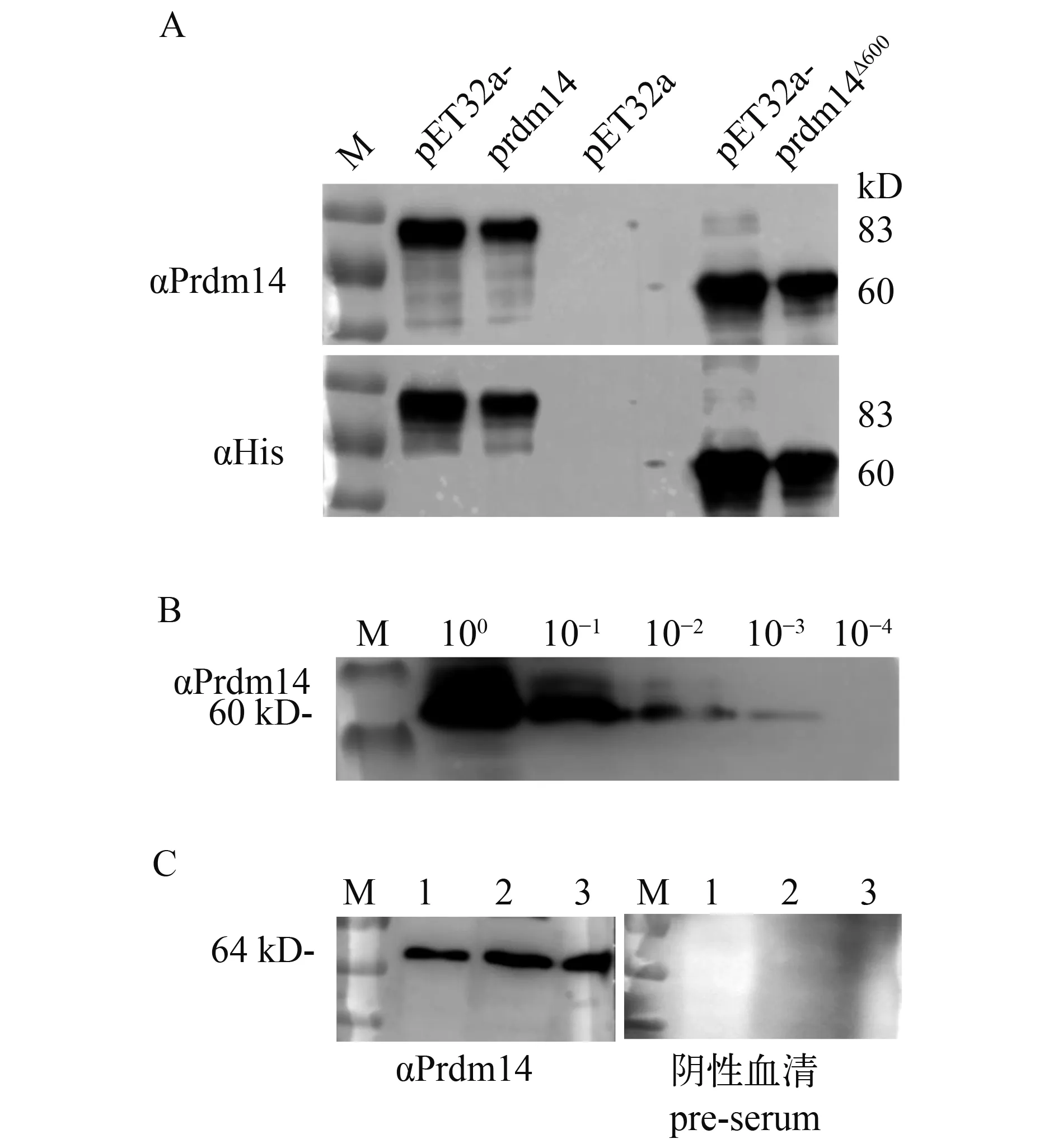
图 2 多克隆抗体特异性检测Fig.2 Examination of the specificity of Prdm14 polyclonal antibody
2.4 多克隆抗体对过表达蛋白的检测
为进一步检测抗体是否能特异识别过表达的Prdm14蛋白, 我们构建了pCAG-prdm14EGFP融合表达载体。用高保真PCR聚合酶(Vazyme)扩增得到的prdm14编码序列经fusion PCR与线性化的pCAG-EGFP质粒连接(图 3A), 构建Prdm14与EGFP融合的表达载体pCAG-prdm14EGFP (图 3B)。所获质粒用EcoRⅠ酶切得到约1.8 kb及6.6 kb的片段, 与预期大小一致, 说明pCAG-prdm14EGFP载体构建成功。
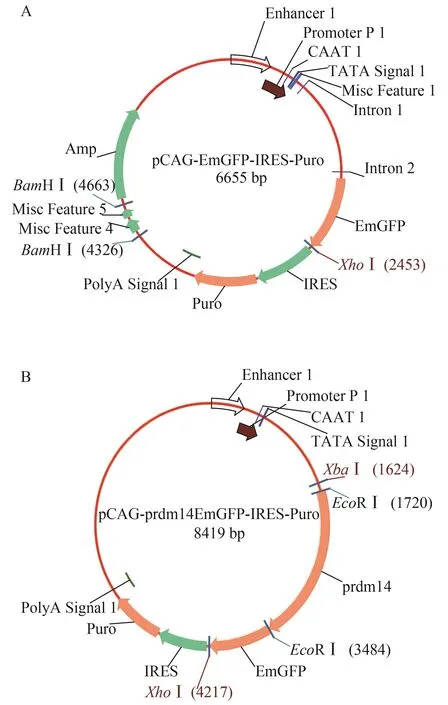
图 3 EGFP及Prdm14融合EGFP表达载体图谱Fig.3 Maps of pEGFP and Prdm14: EGFP fusion protein expression vector
在倒置荧光显微镜下观察, 转染pCAG-prdm 14EGFP质粒的HepG2细胞约30%呈现明亮的绿色(图 4A、B和C), 表明Prdm14融合EGFP载体构建成功且能正常表达。同时, 转入pCAG-EGFP质粒的对照组细胞也有约50%能观察到绿色荧光(图 4D、E和F)。后期提取细胞总蛋白进行Western blot检测(图 5), 同时以αβ-Actin (1鲶1200)为内参(图 5C)。以αPrdm14为一抗时, 转染pCAG-prdm14EGFP的细胞出现一条约90 kD的条带以及一条63 kD的条带(图5A), 分别与融合蛋白及人的PRDM14蛋白大小相符, 而对照组在相应位置没有条带出现, 这说明αPrdm14可特异性识别细胞中过表达的青鳉Prdm14鲶EGFP融合蛋白。以αGFP (1鲶1000)为一抗时, 仅有对照组出现一条约26 kD的条带(图 5B), 大小与EGFP蛋白一致。因此, 该多克隆抗体能用于鉴定体外过表达的青鳉Prdm14蛋白。
3 讨论
在人和小鼠中的研究表明, PRDM14是干细胞多能性维持, 生殖细胞形成, 体细胞重编程过程中的关键转录调节因子, 但在斑马鱼中的研究发现其与初级运动神经元的生长有关[16], 是否在细胞的多能性调控中有重要作用尚不得而知, 而且鱼类干细胞的多能性调控分子机理目前鲜有报道。因此本实验以模式鱼类青鳉为对象, 开展青鳉Prdm14原核表达的研究并制备兔抗青鳉多克隆抗体, 为进一步研究prdm14基因的功能奠定基础。
本实验构建了含基因全长的重组质粒和含较短基因片段的重组质粒, 并诱导得到高效表达的重组蛋白。在原核表达系统中外源重组蛋白由于缺乏所需要的酶和辅助因子, 温度、培养基等的影响,或蛋白质合成太快不能正确的折叠而容易形成包涵体。包涵体具有高密度, 易于分离纯化的优点,但是不具有生物学活性[26]。过大的目的蛋白分子量会使得其难以诱导表达, 或表达效率降低, 更容易形成包涵体, 而且抗原过大时免疫所产生的抗体特异性不佳。因此本实验最终采用小片段的蛋白进行免疫并获得抗体。由短片段得到的兔抗青鳉Prdm14多克隆抗体能特异性识别Prdm14重组蛋白(83 kD)及Prdm14∆600重组蛋白(60 kD)。
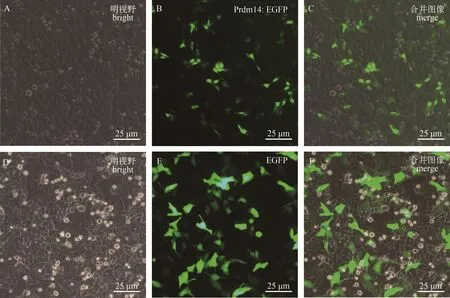
图 4 pCAG-prdm14EGFP载体在HepG2细胞中的表达Fig.4 Expression of pCAG-prdm14EGFP vector in HepG2
研究表明prdm14在小鼠原始生殖细胞中特异性表达[10,27], 而且斑马鱼prdm14在神经系统中有表达[16]。本实验中对青鳉精巢、卵巢、脑组织总蛋白进行Western blot检测, 结果均出现一条64 kD条带, 与预期的青鳉Prdm14蛋白大小一致, 说明制备的多克隆抗体能特异性识别鱼体中表达的Prdm14蛋白, 同时证明Prdm14在青鳉性腺和脑中都有表达, 与我们所检测的其RNA的表达结果一致(结果另文发表)。
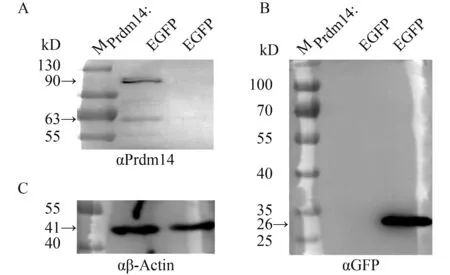
图 5 Prdm14: EGFP融合蛋白在HepG2细胞中的检测Fig.5 Western blot analysis of Prdm14: EGFP fusion protein in HepG2
在HepG2细胞中转染pCAG-prdm14EGFP融合表达载体及pCAG-EGFP空载体时, 细胞都表达绿色荧光。与对照组EGFP蛋白广泛表达在细胞质和细胞核中不同的是, 融合蛋白主要被定位在细胞核中, 这与人类PRDM14作为转录因子的细胞核定位的特性一致。以αPrdm14为一抗对细胞总蛋白进行Western blot检测时, 实验组出现约90和63 kD的条带, 分别与Prdm14鲶EGFP融合蛋白和人源PRDM14蛋白大小一致, 这说明该抗体可以用来鉴定体外表达的Prdm14蛋白。值的一提的是, 63 kD条带的出现, 可能是由于HepG2细胞内源人属PRDM14活化上调而被检测到, 但其中的机制仍需要进一步探究。此外, 在显微镜下能观察到细胞核中表达的融合蛋白的荧光, 但是以GFP抗体进行蛋白杂交时却不能检测到预期的融合蛋白的条带, 仅在对照组检测到26 kD的EGFP蛋白。在其他试验中我们也发现当目的基因在EGFP的N端进行融合表达时, GFP抗体经常不能检测到EGFP融合片段, 而当目的基因在C端融合时却能被检测到。基于SDSPAGE是蛋白变性后的电泳结果, 理论上不论N端或C端的融合, EGFP抗体都应该能检测到融合蛋白, 因此N端融合不能被检测的原因尚有待研究。
综上所述, 本实验构建了青鳉Prdm14原核表达载体, 诱导表达并纯化了重组蛋白, 制备了兔抗青鳉源Prdm14多克隆抗体, 并应用该抗体识别了内源的Prdm14蛋白和细胞中过表达的Prdm14鲶EGFP融合蛋白。该特异性抗体的获得为下一步阐明青鳉prdm14基因的功能奠定了基础。
[1]Fog C K, Galli G G, Lund A H.PRDM proteins: important players in differentiation and disease [J].BioEssays, 2012, 34(1): 50—60
[2]Hohenauer T, Moore A W.The Prdm family: expanding roles in stem cells and development [J].Development, 2012, 139(13): 2267—2282
[3]Assou S, Carrour T L, Tondeur S, et al.A meta-analysis of human embryonic stem cells transcriptome integrated into a web-based expression atlas [J].Stem Cells, 2007, 25(4): 961—973
[4]Tsuneyoshi N, Sumi T, Onda H, et al.PRDM14 suppresses expression of differentiation marker genes in human embryonic stem cells [J].Biochemical and Biophysical Research Communications, 2008, 367(4): 899—905
[5]Chia N Y, Chan Y S, Feng B, et al.A genome-wide RNAi screen reveals determinants of human embryonic stem cell identity [J].Nature, 2010, 468(7321): 316—320
[6]Ma Z, Swigut T, Valouev A, et al.Sequence-specific regulator Prdm14 safeguards mouse ESCs from entering extraembryonic endoderm fates [J].Nature Structural & Molecular Biology, 2011, 18(2): 120—127
[7]Boyer L A, Lee T I, Cole M F, et al.Core transcriptional regulatory circuitry in human embryonic stem cells [J].Cell, 2005, 122(6): 947—956
[8]Kamikawa Y F, Donohoe M E.Histone demethylation maintains Prdm14 and Tsix expression and represses xIst in embryonic stem cells [J].PloS One, 2015, 10(5): e0125626 (1—17)
[9]Grabole N, Tischler J, Hackett J A, et al.Prdm14 promotes germline fate and naive pluripotency by repressing FGF signaling and DNA methylation [J].EMBO Reports, 2013, 14(7): 629—637
[10]Yamaji M, Seki Y, Kurimoto K, et al.Critical function of Prdm14 for the establishment of the germ cell lineage in mice [J].Nature Genetics, 2008, 40(8): 1016—1022
[11]Yamaji M, Ueda J, Hayashi K, et al.PRDM14 ensures naive pluripotency through dual regulation of signaling and epigenetic pathways in mouse embryonic stem cells [J].Cell Stem Cell, 2013, 12(3): 368—382
[12]Dettman E J, Justice M J.The zinc finger SET domain gene Prdm14 is overexpressed in lymphoblastic lymphomas with retroviral insertions at Evi32 [J].PloS One, 2008, 3(11): e3823 (1—9)
[13]Dettman E J, Simko S J, Ayanga B, et al.Prdm14 initiates lymphoblastic leukemia after expanding a population of cells resembling common lymphoid progenitors [J].Oncogene, 2011, 30(25): 2859—2873
[14]Nishikawa N, Toyota M, Suzuki H, et al.Gene amplification and overexpression of PRDM14 in breast cancers [J].Cancer Research, 2007, 67(20): 9649—9657
[15]Zhang T, Meng L, Dong W, et al.High expression of PRDM14 correlates with cell differentiation and is a novel prognostic marker in resected non-small cell lung cancer [J].Medical Oncology, 2013, 30(3): 605—611
[16]Liu C, Ma W R, Su W J, et al.Prdm14 acts upstream of islet2 transcription to regulate axon growth of primary motoneurons in zebrafish [J].Development, 2012, 139(24): 4591—4600
[17]Fan L, Jiang J J, Gao J N, et al.Identification and Characterization of a PRDM14 Homolog in Japanese Flounder (Paralichthys olivaceus) [J].International Journal of Molecular Sciences, 2015, 16(5): 9097—9118
[18]Kasahara M, Naruse K, Sasaki S, et al.The medaka draft genome and insights into vertebrate genome evolution [J].Nature, 2007, 447(7145): 714—719
[19]Iwamatsu T.Stages of normal development in the medaka Oryzias latipes [J].Mechanisms of Development, 2004, 121(7-8): 605—618
[20]Yan Y, Du J, Chen T S, et al.Establishment of medakafish as a model for stem cell-based gene therapy: efficient gene delivery and potential chromosomal integration by baculoviral vectors [J].Experimental Cell Research, 2009, 315(13): 2322—2331
[21]Inoue K, Takei Y.Diverse adaptability in oryzias species to high environmental salinity [J].Zoologicalence, 2016, 19(7): 727—734
[22]Hong Y H, Christoph W, Manfred S.Pluripotency and differentiation of embryonic stem cell lines from the medakafish (Oryzias latipes) [J].Mechanisms of Development, 1996, 60(1): 33—44
[23]Yi M S, Hong N, Hong Y H.Generation of medaka fish haploid embryonic stem cells [J].Science, 2009, 326 (5951): 430—433
[24]Hong Y H, Liu T M, Zhao H B, et al.Establishment of a normal medakafish spermatogonial cell line capable of sperm production in vitro [J].Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(21): 8011—8016
[25]Li Z Y, Li C P, Zhu L Q, et al.The chaperone activity of trigger factor is distinct from its isomerase activity during co-expression with adenylate kinase in Escherichlia coli [J].IFEBS Letters, 2001, 506(2): 108—112
[26]Carrió M M, Villaverde A.Role of molecular chaperones in inclusion body formation [J].FEBS Letters, 2003, 537(1—3): 215—221
[27]Burton A, Muller J, Tu S J, et al.Single-cell profiling of epigenetic modifiers identifies PRDM14 as an inducer of cell fate in the mammalian embryo [J].Cell Reports, 2013, 449(3): 687—701
PROKARYOTIC EXPRESSION, PREPARATION AND APPLICATION OF ANTIPRDM14 POLYCLONAL ANTIBODY OF MEDAKA (ORYZIAS LATIPES) PRDM14
LI Ling-Yu, FANG Jian, YU Miao and CHEN Tian-Sheng
(Key Laboratory of Freshwater Animal Breeding, Ministry of Agriculture, College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China)
PRDM14, a member of PRDM family, plays an important role in germ cells and the maintenance of pluripotency in embryonic stem (ES) cells in mice and humans, but its functions in other species are largely unknown.Medaka (Oryzias latipes) is an excellent fish model to study the developmental biology and stem cell pluripotency.In order to study the potential function of medaka prdm14, the recombinant medaka Prdm14 protein was expressed and used to generate the rabbit anti-Prdm14 polyclonal antibody.First, the recombinant expression vector pET32a-prdm14∆600was constructed by inserting a part of prdm14 CDS into pET32a vector.Second, the vector was transformed into Escherichia coli Rosetta (DE3) and the protein (60 kD) was induced by isopropyl-β-d-thiogalactoside (IPTG).Third, the protein was purified and used as the antigen to immunize rabbit (Oryctolagus cuniculus).Last, six weeks after injection, the antiserum was collected, and the antibody titer and specificity were detected by ELISA and Western blot.The results showed the recombinant Prdm14 could be highly induced at 37℃ with 0.6 mmol/L IPTG for 3h.The polyclonal anti-Prdm14 antibody reacted specifically with Prdm14 in medaka adult tissues or Prdm14: EGFP fusion protein ectopically expressed in HepG2.In conclusion, we generated a polyclonal antibody for medaka Prdm14, which provides a powerful tool to analyze the underlying function of prdm14 in fish stem cells.
Medaka (Oryzias latipes); Prdm14; Prokaryotic expression; Polyclonal antibody; Stem cells
Q786
A
1000-3207(2017)04-0748-07
10.7541/2017.93
2016-08-03;
2016-11-23
国家重点基础研究计划(2013CB967700); 华中农业大学自主科技创新基金(2013RC014和2662015PY049)资助 [Supported by the State Key Development Program for Basic Research of China (2013CB967700); the Fundamental Research Funds for the Central Universities (2013RC014, 2662015PY049)]
李玲玉(1991—), 女, 河南信阳人; 硕士研究生; 研究方向为鱼类遗传育种及干细胞。E-mail: lilingyu@webmail.hzau.edu.cn
陈天圣, 教授; E-mail: tiansheng.chen@mail.hzau.edu.cn
