导管消融治疗迷宫术后复发房性心动过速的中、远期疗效分析
2017-08-09郑素琳詹贤章薛玉梅方咸宏廖洪涛邓海魏薇廖自立刘方舟刘洋梁远红吴书林
郑素琳 詹贤章 薛玉梅 方咸宏 廖洪涛 邓海 魏薇 廖自立 刘方舟 刘洋 梁远红 吴书林
·临床研究·
导管消融治疗迷宫术后复发房性心动过速的中、远期疗效分析
郑素琳 詹贤章 薛玉梅 方咸宏 廖洪涛 邓海 魏薇 廖自立 刘方舟 刘洋 梁远红 吴书林
目的 评价导管消融治疗迷宫术后复发房性心动过速(房速)的中、远期疗效,探讨房速复发的相关因素。方法 纳入2010年4月至2015年6月在广东省人民医院接受导管消融治疗的迷宫术后复发房速患者59例。应用三维标测系统进行高密度电解剖标测,结合拖带标测指导导管消融。术后定期随访,采用多因素Cox比例风险回归模型分析导管消融治疗迷宫术后房速复发的危险因素。结果 共记录到88种房速,其中1例患者房速为短阵性发作,与窦性心律交替出现,难以进行电解剖标测及拖带标测。平均每例患者有(1.49±0.75)种房速,以折返性房速多见,占76.1%(67/88),局灶性房速占22.7%(20/88)。59例患者中,56例(94.9%)即时消融成功。术后平均随访(30.8±17.7)个月,首次导管消融治疗后3例患者即时消融失败,12例复发,术后复发时间为3.5(1.3,12.0)个月,消融成功率为74.6%(44/59)。6例患者接受再次导管消融治疗,二次导管消融治疗后总体成功率为79.7%(47/59)。多因素分析提示左心房内径为预测复发的独立危险因素(HR1.108,95%CI1.002~1.226,P=0.045)。结论 迷宫术后复发房速患者行导管消融治疗安全、有效,左心房内径是房速消融术后复发的独立危险因素。
心房颤动; 外科迷宫术; 房性心动过速; 导管消融
迷宫术是外科治疗心房颤动(房颤)的有效手段。在我国,迷宫术多与心脏瓣膜病外科开胸手术同期进行。由于心房存在切口、瘢痕或补片,此外原有自然解剖结构如房室瓣环、界嵴、Bachmann束和腔静脉等,构成多个传导障碍区,为房性心动过速(房速)的发生提供了解剖基础,术后多表现为折返性房速,具有持续发作、药物治疗及电复律治疗效果欠佳等特点[1-3]。1996年首次提出对迷宫术后复发的房速患者行经皮导管消融术具有可行性,且疗效理想[1]。近年来,有关迷宫术后房速导管消融治疗的研究报道较少,且成功率差异大[2, 4-8],多数研究样本量小,缺乏对导管消融术后复发危险因素的分析。本研究通过对59例行导管消融治疗迷宫术后房速患者的临床及随访资料进行分析,评价其中、远期疗效,探讨房速复发的相关因素。
1 对象与方法
1.1 研究对象
纳入2010年4月至2015年6月在广东省人民医院接受导管消融治疗的外科迷宫术后复发房速患者59例,其中男29例(49.2%),平均年龄28~71(50.05±11.63)岁;56例为风湿性心脏病合并房颤患者,3例为先天性心脏病合并房颤患者。除了胺碘酮外,术前停用所有抗心律失常药物至少5个半衰期,术前48 h内行经食管超声心动图检查排除心腔内血栓。所有患者均签署手术知情同意书。
1.2 电生理检查及导管消融
本中心应用高密度标测(high density precise mapping)、电激动标测(activation mapping)、基质电压标测(substrate/voltage mapping)及拖带标测技术(entrainment mapping)进行标测,根据标测结果指导导管消融,简称HAVE术式。
标测流程:
(1)按常规方法于右心房及冠状窦(coronary sinus, CS)内放置电生理标测电极,在心动过速下,分别于CS电极远端、近端,右心房间隔部、游离壁进行拖带标测,结合起搏后间期 (post pacing interval, PPI)与心动周期(tachycardia cycle length, TCL)的差值、标测电极激动顺序等特点,初步判断房速的来源。
(2)在Carto (强生公司, 美国)或Ensite NavX(圣尤达公司,美国)三维电解剖标测系统指导下行心房高密度电解剖标测。基质标测中,将电压低于0.1 mV定义为电静止区(瘢痕区),0.1~0.5 mV为低电压区。考虑迷宫术后房速心电图中P波的起始位置较难辨认,标测兴趣窗(window of interest, WOI)的设置参考De Ponti等[9]的研究,对其公式改良如下:WOI = Backward+Forward;Backward=TCL/2+a;Forward=TCL×0.95-Backward。Backward 为前窗宽,Forward 为后窗宽,TCL为心动过速周长,a为体表心电图P波波峰至参考电极A波的间期。分析心房激动时间与TCL比值,结合电激动标测结果,进一步确定房速起源及机制,鉴别局灶性房速与折返性房速(房扑)。
(3)若三维电解剖标测显示为局部激动向周围扩布性传导,激动时间小于TCL的70%,最早兴奋点附近拖带标测PPI与TCL差值小于30 ms,而远离最早激动部位的PPI与TCL差值逐渐增大,则提示为“局灶性房速”。若三维电激动标测图上显示激动呈“早晚相接”(Carto系统为“红紫相接”,Ensite NavX系统中为“白紫相接”),则提示为折返性房速。送入冷盐水灌注消融导管(Thermocool, 强生公司,美国;Coolpath/Coolflex,圣尤达公司,美国)确认低电压区和瘢痕区,行拖带标测确定折返环及缓慢传导区。
导管消融流程:
以局灶性房速最早激动部位为消融靶点;折返性房速则于折返环路上缓慢传导区或瘢痕区之间、瘢痕区与解剖屏障之间行线性消融。房速标测的同时,常规行肺静脉电位双向传导阻滞检测,必要时再次行肺静脉电隔离。如果在检验中诱发出TCL不稳定或心动过速易被导管机械终止等不利于完成激动标测的房速,结合心房电压标测,分析在瘢痕区及低电压区中可能存在的传导缝隙,行导管消融,作心房基质改良,预防再发心动过速。
导管消融参数设置:右心房导管消融预设功率30~35 W、温度43℃;左心房导管消融预设功率25~35 W、温度43℃,冷盐水灌注速度为12~25 ml/min。
导管消融终点定义为:消融中终止心动过速,心房刺激不再诱发心动过速;折返性房速中,尽可能起搏消融线的两侧证实达到双向完全传导阻滞。
1.3 术后处理及随访
患者术后继续使用华法林治疗,维持国际标准化比值(INR)2.0~3.0,3个月后若能维持窦性心律,可根据患者外科手术史情况、结合左心功能、CHA2DS2-VASc评分等决定是否继续应用华法林。术中未消融成功者电复律后服用胺碘酮,如服药过程中对胺碘酮出现不良反应或不耐受,改用Ⅰ类抗心律失常药物。消融即时成功的患者不继续服用Ⅰ、Ⅲ类抗心律失常药物。术后1、3、6、12、18个月门诊复诊,复查24 h动态心电图,术后6~12个月复查超声心动图检查,之后每年复查一次。有症状时随时复诊并完善心电图等相关检查。复发定义为:术后动态心电图或心电图记录到房速发作持续时间大于30 s。
1.4 统计学分析
所有数据采用SPSS 20.0统计软件进行处理。计量资料以均数±标准差表示,采用独立样本t检验;偏态分布资料以中位数(四分间距)表示。用单因素Cox回归分析筛选影响导管消融术后复发的因素,初步筛选出P≤0.1的变量,再进行多因素Cox回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 59例患者基本资料及电生理特点(表1~2,图1~2)
59例患者迷宫术后复发房速的时间为11.0(3.0,24.0)个月,房速复发后至行导管消融术时间为3.5(1.0,11.0)个月。术前左心房内径为(43.0±7.0)mm,纽约心脏病协会(NYHA)心功能分级均为Ⅱ~Ⅲ级(表1)。共记录到88种房速(表2),其中有1例(1.7%)患者房速为短阵性发作,与窦性心律交替出现,难以进行准确电解剖标测及拖带标测;23例(39.0%)患者存在2种以上房速,平均每例患者有(1.49±0.75)种房速。26例(44.8%)患者房速起源于左心房,27例(46.6%)起源于右心房,5例(8.5%)患者左、右心房内均有起源。房速电生理机制复杂,以折返性房速多见,占76.1%(67/88)。病例中可见合并多种机制的房性心律失常(图1),双环折返性房速(图2),左、右心房同时参与的大环折返性房速等。
2.2 导管消融及随访结果(表3,图3~4)
共56例(94.9%)患者即时消融成功。3例不成功患者中,1例为房间隔卵圆窝附近起源局灶房速,予片状消融及基质改良后,仍可反复诱发短阵发作,维持约2~4 s后可自行终止;1例成功消融二尖瓣峡部依赖房扑与三尖瓣峡部依赖房扑后仍可反复诱发房速,激动顺序多变,可自行终止;1例围绕二尖瓣环折返性房速,于二尖瓣峡部、左心房前壁进行线性消融,同时行右心房基质改良,心动过速仍未能终止,最后予电复律。
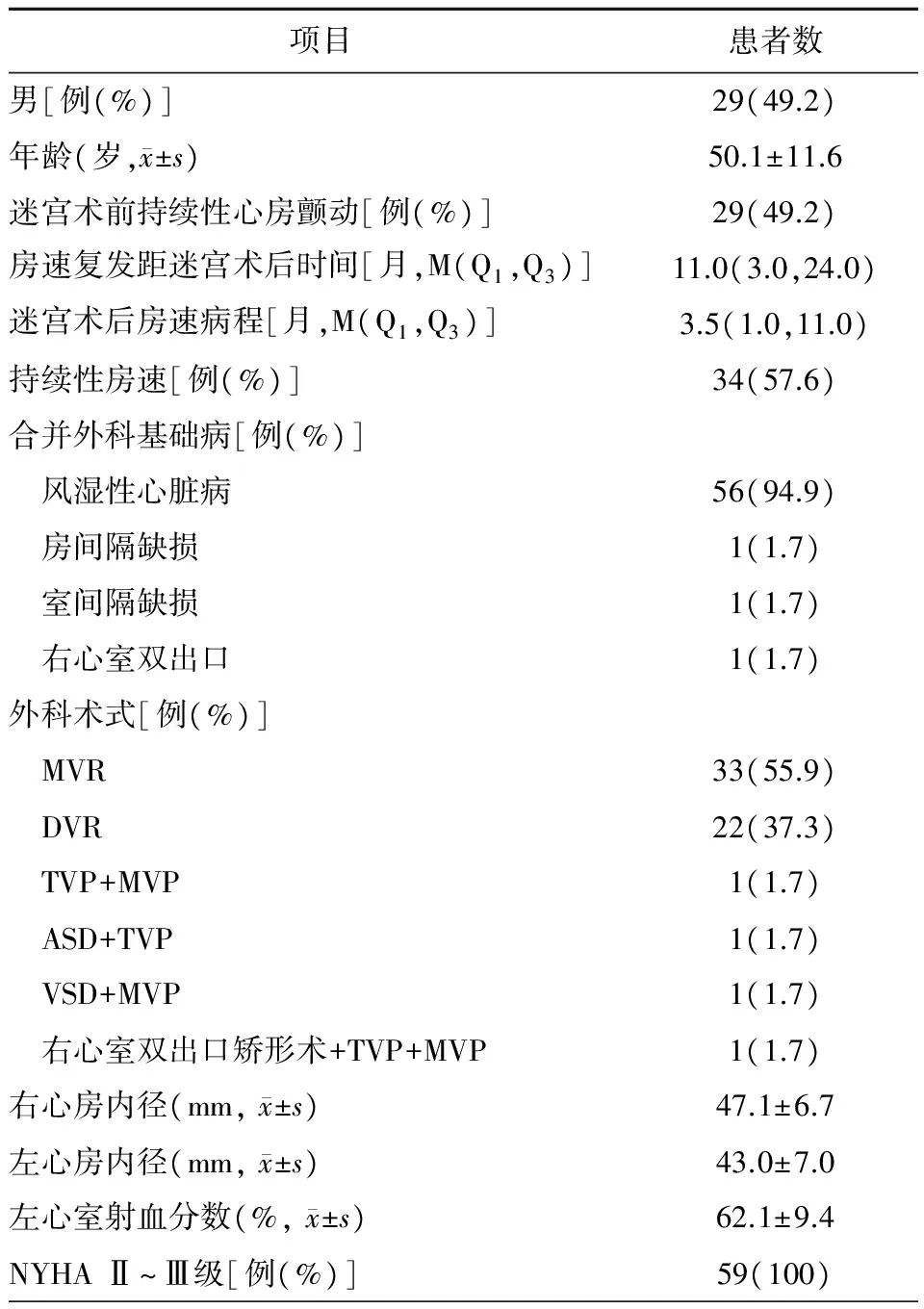
表1 59例患者临床资料
注:MVR,二尖瓣置换术;DVR,主动脉瓣、二尖瓣置换术;TVP,三尖瓣整形术;MVP,二尖瓣整形术; ASD,房间隔修补术;VSD,室间隔修补术;NYHA,纽约心脏病协会
术后随访(30.8±17.7)个月,失访5例,随访率91.5%。1例患者在随访24个月时因脑出血就诊,发现复发房颤,1个月后死亡。2例分别于随访20个月及32个月时因心力衰竭死亡。首次导管消融后,3例即时消融失败,12例术后复发,复发时间为术后3.5(1.3,12.0)个月,最终导管消融成功44例(74.6%)。12例复发患者中2例复发房颤,4例复发消融前房速,口服胺碘酮或普罗帕酮治疗,临床症状可耐受,未接受再次导管消融;6例患者接受二次消融治疗,其中3例复发术前同一种房速,1例为左下肺静脉前庭后壁起源局灶性房速,1例为绕左心房顶部房扑,1例为三尖瓣峡部依赖房扑,另外3例复发为新的房速,分别为三尖瓣峡部消融线上局灶性房速、右心房游离壁切口性房速、三尖瓣峡部依赖房扑,经过再次导管消融,均取得即时消融成功。此6例再次导管消融后,在继续随访中3例复发。二次导管消融后总体成功率为79.7%(47/59)。Kaplan-Meier曲线示预测平均维持窦性心律的时间为(49.9±4.1)个月(95%CI41.9~57.9)。
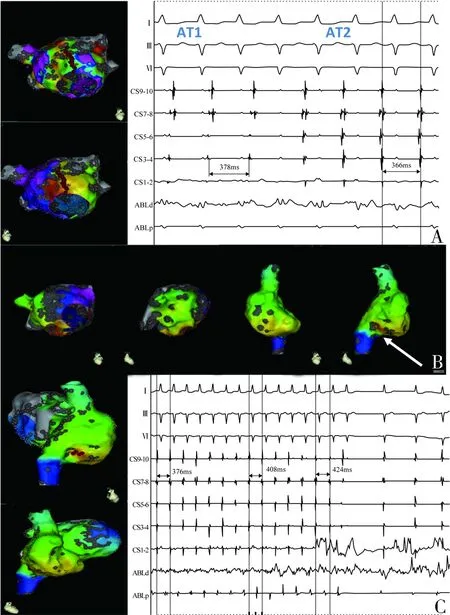
图1 合并两种电生理机制的房速 A:左心房高密度标测提示为绕二尖瓣环顺钟向折返房速(AT1),可见前壁近间隔处存在大片低电压区,于前壁低电压及瘢痕区与二尖瓣环之间线性消融,消融过程中,心动过速激动顺序及周长发生改变(AT2);B:再次行电激动标测,结果显示左心房最早激动点位于间隔处,考虑此处为被动激动,继续行右心房电解剖标测,提示为局灶性房速,最早激动点位于右心房下外侧壁;C:于最早激动区域消融,心动过速终止,消融成功
2.3 复发危险因素分析(表4)
对59例患者导管消融后复发的影响因素进行Cox比例风险回归模型的单因素分析,变量包括年龄、性别、右心房内径、左心房内径、左心室射血分数、三尖瓣反流、迷宫术前持续性房颤、导管消融术前房速病程、房速种类、房速机制、持续性房速及导管消融后双向传导阻滞等。以P≤0.1的因素纳入多因素回归分析。结果提示左心房内径为预测复发的独立危险因素(HR1.108,95%CI1.002~1.226,P=0.045)。
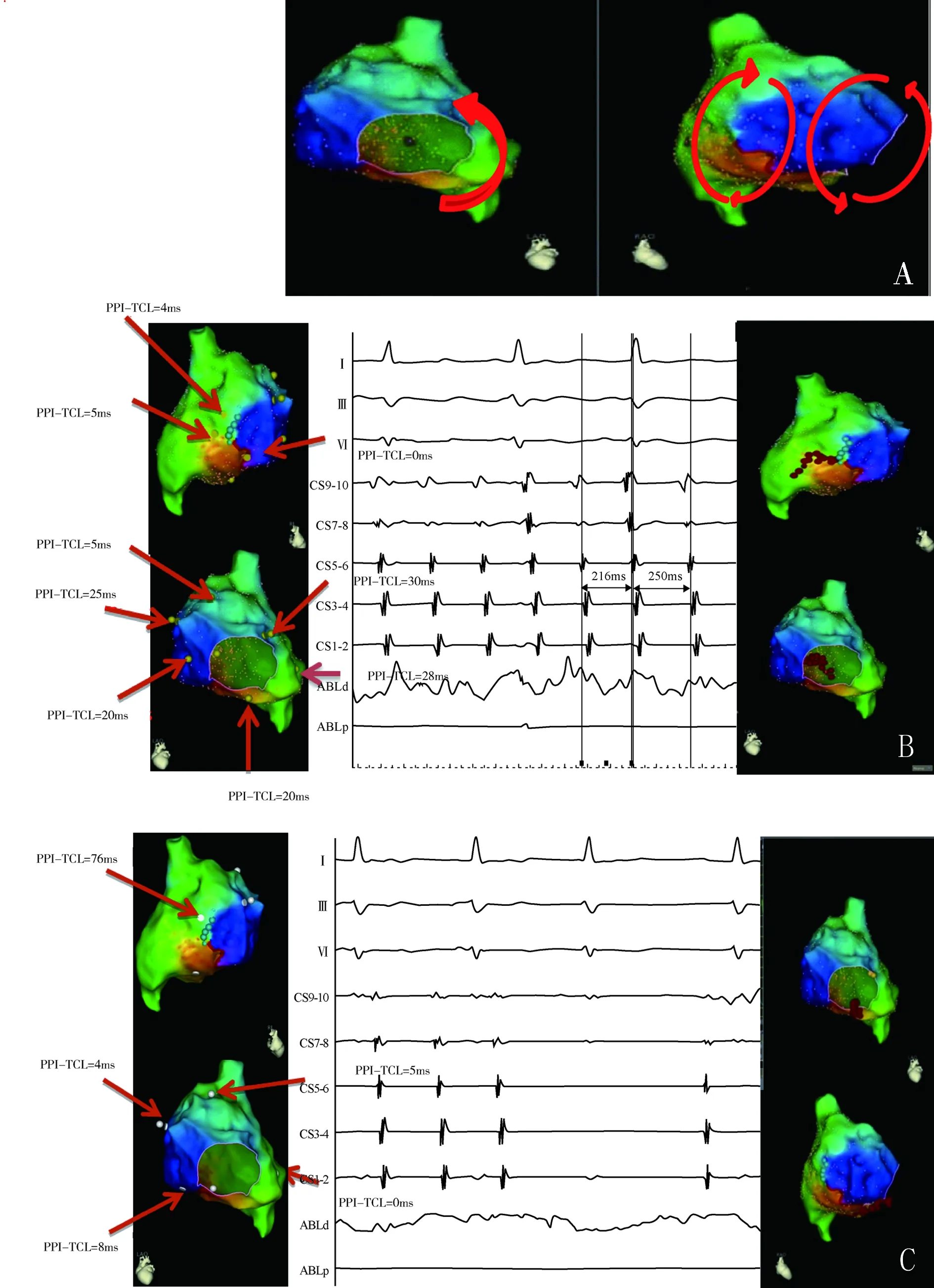
注:PPI,起搏后间期;TCL,心动周期图2 双环折返性房速 A:电激动标测显示绕三尖瓣环逆钟向折返,但未能排除同时存在绕右心房游离壁切口处顺钟向折返;B:予以拖带检测,于两种可能存在折返环的径路上均能获得较理想的PPI值,考虑存在双环折返;于游离壁切口处下端至下腔静脉口之间线性消融,可见TCL延长(由216 ms延长至250 ms);C:再次于双环路线上行拖带检测,绕切口处PPI值明显延长,PPI-TCL>30 ms,绕三尖瓣环处拖带PPI接近TCL,考虑绕切口处折返环已被阻断,心动过速由绕三尖瓣环折返环维持,于三尖瓣峡部消融,转复为窦性心律,消融成功
3 讨论
外科迷宫术可与心脏外科手术同期进行,为房颤合并心脏基础病(如瓣膜病、先天性心脏病)患者提供了一种非药物治疗方法。但术后可出现房性心律失常,而且有持续难终止、临床症状明显与药物疗效欠佳等特点,其电生理机制以折返多见[3,10-13]。有研究结果显示,迷宫术后复发房性心律失常与导管消融时所选择的消融路线、消融能源、消融径线不连续及部分未达到透壁损伤等因素相关[14]。这与本研究结果相似。
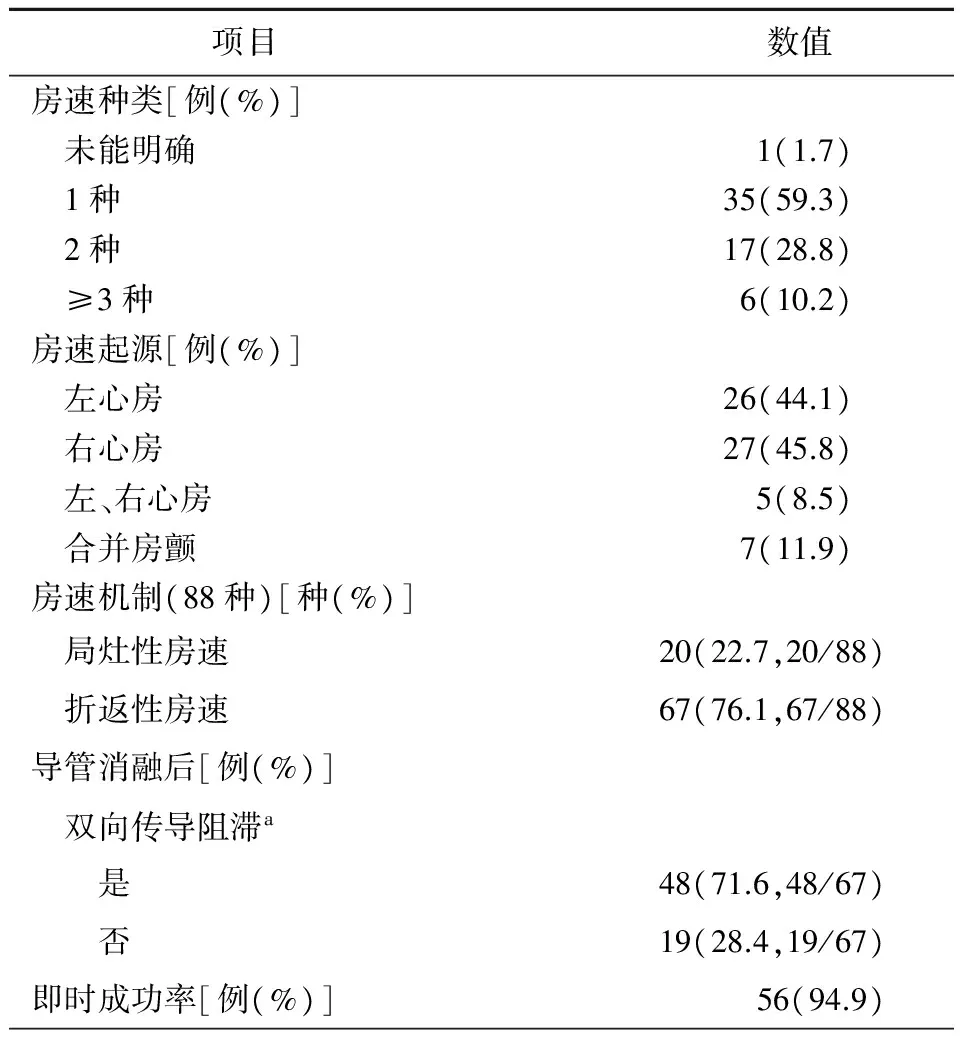
表2 59例患者房速分布及导管消融结果
注:a,只有折返性房速需验证双向传导阻滞
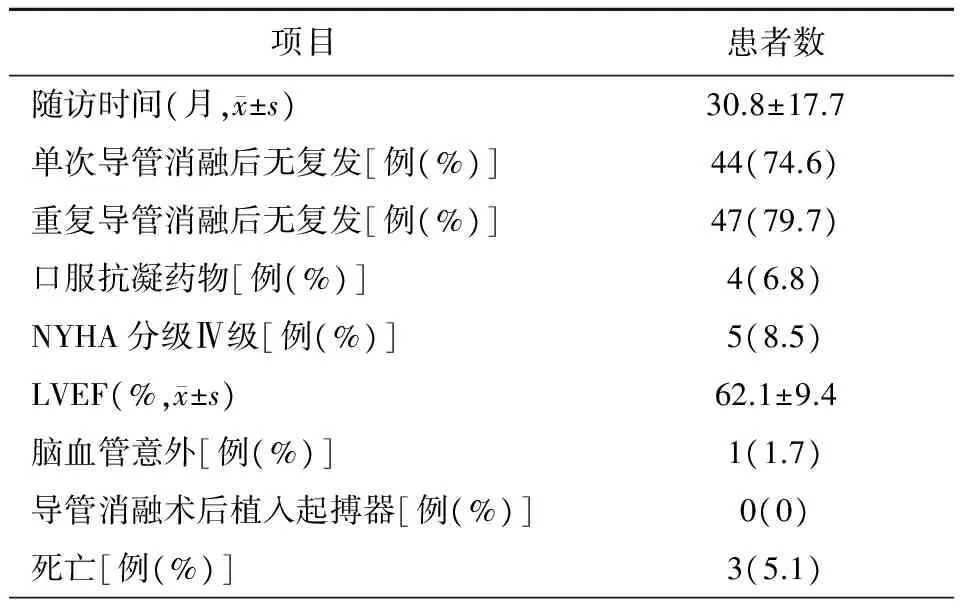
表3 59例患者随访资料
注:NYHA,纽约心脏病协会;LVEF,左心室射血分数

表4 影响导管消融后复发的危险因素Cox比例风险回归模型多因素分析结果
本研究应用HAVE术式,对TCL稳定的房速进行高密度激动标测及电压基质标测,结合拖带标测,指导心动过速机制的判断,进行有效的消融。59例患者消融结果显示,单次导管消融成功率可达74.6%,再次导管消融后经中、远期随访,总体成功率达79.7%。提示HAVE术式有助于迷宫术后房速的标测,可提高对心动过速机制的识别率,更好地指导消融策略的制定,减少不必要的消融损伤,提高手术成功率。Huo等[5]研究了82例患者,共标测到103种房速,平均每例患者接受1.3次导管消融治疗。单次导管消融后,近1/3患者复发。复发原因可能与消融线间恢复传导相关,尤其与过长、过多的消融线导致左心房电基质重构有关。再次导管消融行基质改良后,成功率达87%。导管消融前,进行细致的电激动标测,根据具体的标测结果及患者特点,个体化设计消融策略,可避免增加不必要的消融损伤,减少复发可能。
本研究经过(30.8±17.7)个月随访,患者单次导管消融成功率为74.6%,二次导管消融后总体成功率达79.7%(图3)。术中、术后无并发症发生,消融疗效肯定。随访资料显示,在进行了积极的干预治疗后,少数患者的心功能仍呈进行性减退, NYHA分级Ⅳ级的患者数较导管消融前增加8%(表3),提示在基础病及外科手术、导管消融术后致心脏心肌瘢痕增多等因素的作用下,心脏重构仍在进展。结合Kaplan-Meier曲线中所预测的平均维持窦性心律时间(49.9±4.1)个月分析,推测远期复发患者数将增多。Trumello等[7]对36例迷宫术后房性心律失常患者导管消融后复发情况进行了Kaplan-Meier曲线分析,随访(97±42)个月,单次导管消融后复发率为47%(17/36),消融后中位复发时间为(92±42)个月。本研究与之相比,复发率较低,考虑与本研究入组患者数较多,且均为房速无单纯房颤复发患者相关。另一方面也提示,随着后续随访时间的延长,复发率将有增高可能。考虑与患者心脏基础病的进展、心房损伤范围大、心肌纤维化及风湿活动等因素相关。
本研究Cox风险模型分析显示,左心房内径为预测复发的独立危险因素。即使在单次导管消融中检验各消融线已明确阻断,但瘢痕左心房在术后的日常生活中承受心脏前后负荷的能力较正常心房的代偿能力低,致使左心房心肌慢性重构可能,易复发心律失常。既往对于迷宫术后房速导管消融后再次复发的预测因子鲜有报道,但曾有研究对房颤导管消融后复发房速,再次导管消融的复发预测因子进行报道。该研究对117例入选患者随访12个月,复发率为47%,行多因素Cox比例风险模型分析显示,其中房速的种类大于1种与再次导管消融后房速的复发呈显著相关(HR2.01,95%CI0.34~1.05,P=0.01),左心房内径与复发无明显相关(P>0.05),且房速的种类与消融时产生的消融损伤呈正比,增加心房内瘢痕,易产生新的心律失常[15]。本研究单因素分析显示,房速种类与房速复发无明显相关(P>0.1)。多因素分析中包括房速机制及房速病程等,统计学上亦未见明显相关性,可能与样本量少、术后随访时间短有关。
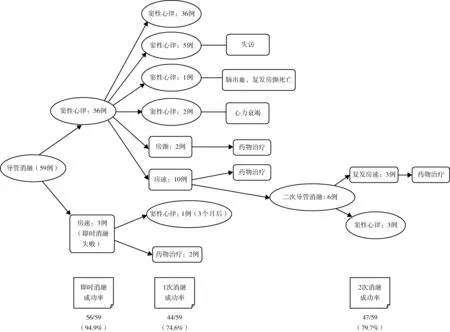
图3 导管消融术后随访情况
综上所述,外科迷宫术后易复发房速,多表现为折返性机制,与迷宫术后消融线不连续、未透壁损伤所致的电传导恢复相关。导管消融治疗,即时成功率高。通过中、远期随访,大部分患者可于单次导管消融后维持窦性心律,再次导管消融治疗可提高成功率。左心房内径是导管消融术后复发的独立预测因素。
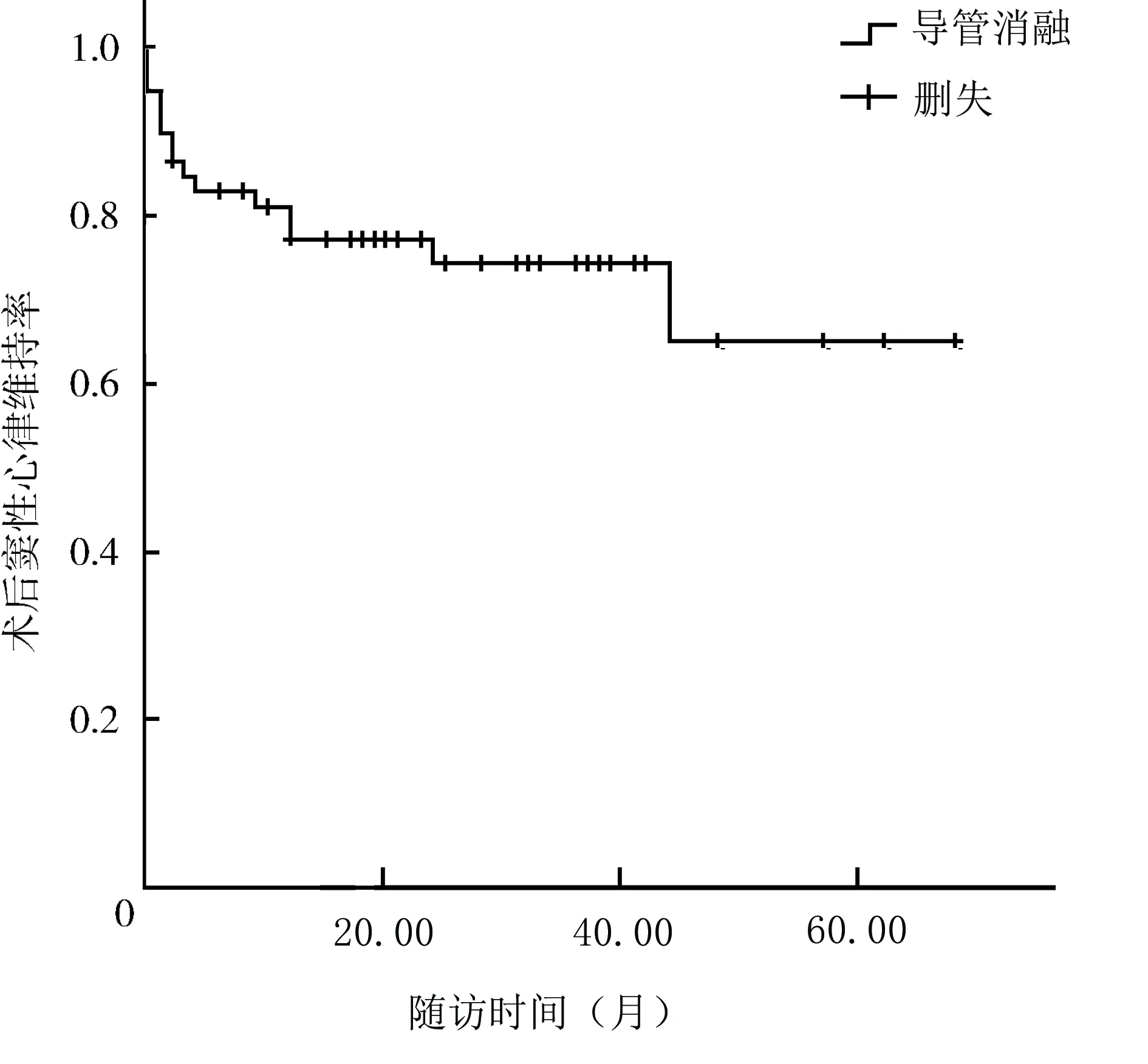
图4 导管消融术后维持窦性心律的Kaplan-Meier曲线
[1] Baker BM, Lindsay BD, Bromberg BI, et al. Catheter ablation of clinical intraatrial reentrant tachycardias resulting from previous atrial surgery: localizing and transecting the critical isthmus. J Am Coll Cardiol,1996,28(2):411-417.
[2] Henry L, Durrani S, Hunt S,et al. Percutaneous catheter ablation treatment of recurring atrial arrhythmias after surgical ablation. Ann Thorac Surg,2010,89(4):1227-1231.
[3] Magnano AR, Argenziano M, Dizon JM,et al. Mechanisms of atrial tachyarrhythmias following surgical atrial fibrillation ablation. J Cardiovasc Electrophysiol,2006,17(4):366-373.
[4] Wazni OM, Saliba W, Fahmy T,et al. Atrial arrhythmias after surgical maze: findings during catheter ablation. J Am Coll Cardiol,2006,48(7):1405-1409.
[5] Huo Y, Schoenbauer R, Richter S,et al. Atrial arrhythmias following surgical AF ablation: electrophysiological findings, ablation strategies, and clinical outcome. J Cardiovasc Electrophysiol,2014,25(7):725-738.
[6] Zeng Y, Cui Y, Li Y,et al. Recurrent atrial arrhythmia after minimally invasive pulmonary vein isolation for atrial fibrillation. Ann Thorac Surg,2010,90(2):510-515.
[7] Trumello C, Pozzoli A, Mazzone P,et al. Electrophysiological findings and long-term outcomes of percutaneous ablation of atrial arrhythmias after surgical ablation for atrial fibrillation. Eur J Cardiothorac Surg,2016,49(1):273-280.
[8] Beukema RJ, Adiyaman A, Smit JJ,et al. Catheter ablation of symptomatic postoperative atrial arrhythmias after epicardial surgical disconnection of the pulmonary veins and left atrial appendage ligation in patients with atrial fibrillation. Eur J Cardiothorac Surg,2016,49(1):265-271.
[9] De Ponti R, Verlato R, Bertaglia E,et al. Treatment of macro-re-entrant atrial tachycardia based on electroanatomic mapping: identification and ablation of the mid-diastolic isthmus. Europace,2007,9(7):449-457.
[10] Cox JL, Boineau JP, Schuessler RB,et al. Modification of the maze procedure for atrial flutter and atrial fibrillation. I. Rationale and surgical results. J Thorac Cardiovasc Surg,1995,110(2):473-484.
[11] Sie HT, Beukema WP, Misier AR,et al. Radiofrequency modified maze in patients with atrial fibrillation undergoing concomitant cardiac surgery. J Thorac Cardiovasc Surg,2001,122(2):249-256.
[12] Cox JL, Ad N, Palazzo T,et al. Current status of the Maze procedure for the treatment of atrial fibrillation. Semin Thorac Cardiovasc Surg,2000,12(1):15-19.
[13] Takahashi K, Miyauchi Y, Hayashi M,et al. Mechanisms of postoperative atrial tachycardia following biatrial surgical ablation of atrial fibrillation in relation to the surgical lesion sets. Heart Rhythm,2016,13(5):1059-1065.
[14] McElderry HT, McGiffin DC, Plumb VJ,et al. Proarrhythmic aspects of atrial fibrillation surgery: mechanisms of postoperative macroreentrant tachycardias. Circulation,2008,117(2):155-162.
[15] Ammar-Busch S, Kaess BM, Bruhm A,et al. Atrial tachycardias following persistent atrial fibrillation ablation: predictors of recurrence after the repeat ablation. J Cardiovasc Electrophysiol,2015,26(1):1315-1320.
Mid and long-term outcomes of catheter ablation of recurrent atrial tachycardias post Mini-Maze surgery
ZHENGSu-lin,ZHANXian-zhang,XUEYu-mei,FANGXian-hong,LIAOHong-tao,DENGHai,WEIWei,LIAOZi-li,LIUFang-zhou,LIUYang,LIANGYuan-hong,WUShu-lin.
DepartmentofCardiology,GuangdongProvincialCardiovascularInstitute.GuangdongGeneralHospital.GuangdongAcademyofMedicalScience,Guangzhou510080,China
CorrespondingAuthor:ZHANXian-zhang,Email:gdzxz@163.com
Objective To analyze the clinical characteristics and follow-up data of catheter ablation of recurrent atrial tachycardias (ATs) after Mini-Maze surgery, and to explore prognostic factors for recurrence.Methods 59 patients in Guangdong General Hospital with ATs post Mini-Maze and concomitant open-heart surgery from April. 2010 to June. 2015 were included. According to high density precise mapping, activation mapping, voltage mapping and entrainment mapping, they underwent electrophysiological study and ablation which was guided by three-dimensional mapping system. All patients were followed up regularly. We explored the prognostic factors for recurrence by the Cox regression analysis. Results There were 88 types of ATs being mappedwith mean (1.49±0.75) types of ATs identified per case. Most ATs were macro-reentry ATs(67/88,76.1%)and focal ATs (20/88,22.7%), respectively. 56 patients (94.9%) achieved immediate ablation success. In a mean follow-up of (30.8±17.7 )months, recurrences were observed in 12 patients after the first time catheter ablation. Recurrent time was 3.5(1.3,12.0)months and the overall ablation success rate was 74.6% (44/59). 6 patients
second ablation and the achievement of freedom from arrhythmias reached 79.7% (47/59). Multivariate analysis showed that the LA diameter was the independent predictor for recurrence (HR1.108, 95%CI1.002 to 1.226,P=0.045). Conclusion Catheter ablation of ATs post Mini-Maze with concomitant surgery is save and feasible. LA diameter is the independent predictor for recurrence.
Atrial fibrillation; Surgical ablation; Cox-Maze; Atrial tachycardia; Catheter ablation
10.3969/j.issn.1004-8812.2017.07.002
广州市科技计划(2014Y-00196,158100073)
510080 广东广州,广东省心血管病研究所心内科 广东省人民医院 广东省医学科学院
詹贤章,Email:gdzxz@163.com
R541.7
2017-05-05)
