粒细胞集落刺激因子对心肌梗死大鼠心室肌电生理特性影响的离体实验研究
2017-08-09罗涛王永智邓旭波史成龙史文举浦奎
罗涛 王永智 邓旭波 史成龙 史文举 浦奎
·基础研究·
粒细胞集落刺激因子对心肌梗死大鼠心室肌电生理特性影响的离体实验研究
罗涛 王永智 邓旭波 史成龙 史文举 浦奎
目的 探讨粒细胞集落刺激因子(G-CSF)对离体心肌梗死大鼠心室肌电生理特性的影响。方法 结扎左冠状动脉建立心肌梗死模型,术后存活的67只Wistar大鼠被分为4组:Sham组、对照组、术后即刻给药组(E-G组)和延迟给药组(D-G组),利用离体心脏灌流吸附电极记录单相动作电位时程(MAP),记录有效不应期(ERP)、ERP和MAP90的离散度;常规电生理方法记录窦性心动周期(SCL)、最大动作电位幅度(APA)、零相上升最大速度(Vmax)、心室颤动阈值(VFT)及心室颤动时程(VFD)。结果 心肌梗死后7 d,E-G组电生理参数(SCL、VFT、VFD、APA、ERP/MAP90、ERP和MAP90离散度)和D-G组电生理参数(SCL、ERP和MAP90离散度)较对照组均有明显改善(均P<0.05);心肌梗死后3个月,E-G组上述电生理参数较对照组延续改善(P<0.05),但D-G组除了部分电生理参数(SCL、APA、Vmax和MAP90离散度)较对照组改善(P<0.05)外,其他电生理参数较对照组无明显改善(P>0.05),ERP和MAP90甚至有恶化趋势。结论 G-CSF干预能够改善缺血心室肌电生理参数,即刻干预较延迟干预改善更明显,即刻干预电生理参数改善能够延续到缺血心室肌慢性恢复期,降低心肌梗死后室性心律失常发生率。
粒细胞集落刺激因子; 心肌梗死; 单相动作电位时程; 离散度
治疗学的发展如溶栓治疗(thrombolysis)和经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)显著提高了急性心肌梗死(myocardial infarction, MI)患者的存活率。但MI后室性心律失常的发生率仍非常高,主要原因为受损的心室肌组织不能通过细胞再生修复,只能由无收缩功能的瘢痕组织替代,并通过改变心室肌离子通道功能,导致心室肌细胞电生理特性的改变,促进心律失常的发生,即“致心律失常性重构”。
目前,应用干细胞治疗MI成为了心血管领域的研究热点。但直接将干细胞移植到MI患者体内后,不可避免地发生心律失常,导致移植治疗的失败,可能的机制假说有:移植的干细胞本身具有潜在致心律失常特性,缺乏缝隙连接蛋白43(Connexin 43,Cx43)及解剖学紊乱形成的折返机制,局部微环境对干细胞的影响,自主神经高度再分布及不均一支配等[1-2]。因此,干细胞的人工植入方法存在局限性,而经细胞因子动员干细胞具有体内动员、体内归巢、体内分化等特点,具有良好的应用前景。
粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)是一种造血生长因子,能够动员骨髓中多种干细胞至外周血调控细胞的增殖、分化及凋亡。目前研究发现G-CSF在MI后“机械重构”和“电重构”中的不同作用机制:通过动员并募集骨髓干细胞到局部心肌组织发挥转分化或旁分泌效应;通过骨髓干细胞以外的其他途径发挥效应,如与心肌细胞上的G-CSF受体(G-CSF receptor,G-CSFR)结合,通过激活下游Jak2-Stat3信号通路发挥作用,以及其他未知的途径[3]。
离体心脏灌流的电生理方法,可以在去除自主神经体液等影响下,单独观察药物、压力作用对心脏的作用。本研究应用该技术研究MI大鼠离体心脏的整体电生理现象,初步探讨G-CSF能否通过影响缺血心室肌电生理特性,进而降低室性心律失常发生率。
1 材料与方法
1.1 实验动物分组及存活情况
雄性Wistar大鼠,8~10周龄,体重220~250 g,购自中国人民解放军军事医学科学院实验动物中心。饲养条件:室温18~25℃,相对湿度45%~65%,正常饲料喂养,自由饮水。将大鼠随机分组建立假手术(Sham)模型和MI模型,建立MI模型的大鼠根据给药方案不同分为对照组(Control,仅给予生理盐水)和G-CSF治疗组(G组)。在G组中又根据给药时间的不同分为2个亚组:MI后1 h即刻给药为即刻给药组(Early-G,E-G组)和MI后24 h给药为延迟给药组(Delay-G,D-G组)。分别于术后7 d和3个月时结束实验观察,利用Working Heart离体灌流系统和MP150 16导电生理记录仪进行离体心脏的电生理实验。
实验中共有80只大鼠成功接受左冠状动脉结扎手术,观察期间有13只大鼠死亡,最后纳入实验结果的为67只,其中22只大鼠为假手术组(无一死亡),各组大鼠术后存活情况见表1。各实验组存活大鼠均纳入实验。
本实验中两种药物的剂量和给药方式为:G-CSF,100 μg/(kg·d),每日注射1次,连续5 d;E-G组第1天采用静脉注射方式,以后连续4 d采用皮下注射方式;D-G组每天均采用皮下注射方式。
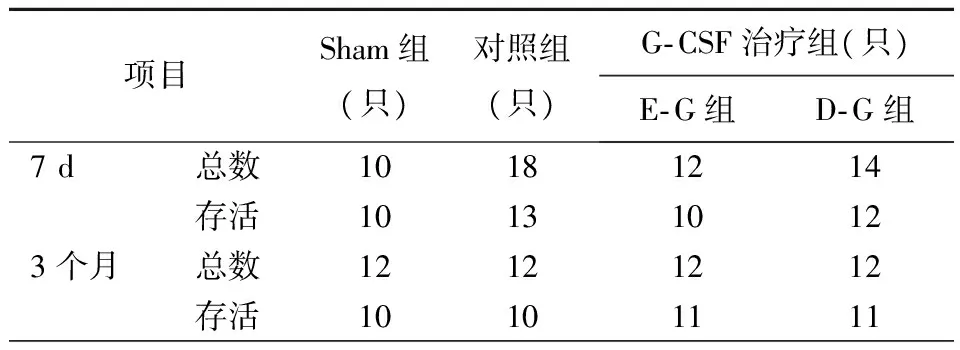
表1 大鼠术后存活情况
注:G-CSF,粒细胞集落刺激因子;E-G组,术后即刻给药组; D-G组,延迟给药组
1.2 动物MI模型的建立[4]
0.4%戊巴比妥钠(20 mg/kg)腹腔内注射麻醉大鼠,腹部向上固定于手术台上。胸部皮肤备皮后消毒,于胸骨左缘1~2 mm处行2 cm纵行切口,以止血钳分离皮下组织,钝性撕裂胸大肌,暴露出左侧肋骨。接上小动物呼吸机,调节呼吸机参数(频率114次/min,呼吸时比1∶1.5)后开机,可见动物胸部随呼吸机频率起伏,并伴有动物的自主呼吸。以组织钳于胸骨左缘1~2 mm处剪断第4肋骨,以止血钳扩张间隙后,纵隔及左侧胸腔即可暴露,可见跳动的心脏,挤压右侧胸壁,并以止血钳协助扩张胸壁创口,将心脏挤出胸腔。于肺动脉圆锥和右心耳交界处,主动脉起始部2~3 mm处,将缝合针(3/8弧度,3×6规格)自左心室侧穿入,由肺动脉圆锥处穿出,连同一小束心肌结扎缝合线。结扎成功后立刻可见左心室前壁苍白、运动减弱。同时可见到心电生理记录仪(MP150)I导联出现ST段抬高和室性心律失常。如未见到上述改变,则于原处再缝合一针并予以结扎。
结扎大鼠左侧冠状动脉后,心电图显示ST段抬高,逐渐出现ST-T动态演变和缺血性心律失常[如室性早搏二联律、短阵室性心动过速(室速)、心室颤动(室颤)转复等](图1)。同时出现ST段动态演变和缺血性心律失常的大鼠被认定为MI模型成功,纳入实验。
MI大鼠模型建立的注意事项:(1)动物麻醉不宜过深,因戊巴比妥钠有呼吸抑制作用,开胸后可能会造成气胸,导致术后大鼠恢复自主呼吸时间较长,甚至不能恢复;(2)肌注青霉素(20×104U/kg),放回鼠笼;(3)气管插管时尽量靠上,否则极容易插入食管,插管后一定要检验是否在气管内;(4)严密监测大鼠心电图,确保建模成功以及出现恶性室性心律失常时及时抢救;(5)缝合胸壁时要尽量挤出胸腔内血液;(6)术后环境要舒适,尤其是冬天要保持室内温度在18~25℃。
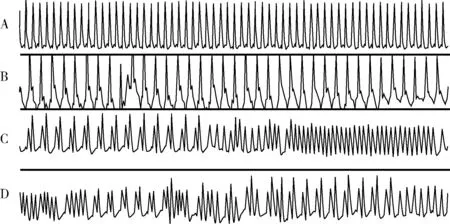
图1 大鼠心肌梗死模型制作过程中心电图的动态演变 A:正常心电图;B:结扎左冠状动脉后ST段逐渐抬高;C:结扎冠状动脉后出现缺血性心律失常,图为室性早搏二联律并短阵室速;D:短阵室速转为室性早搏二联律
1.3 试剂与溶液
K-H(Krebs-Henseleit)灌流液成分 (mmol/L):NaCl 119 mmol/L, KCl 4.8 mmol/L, MgCl21.2 mmol/L, KH2PO4(2H2O) 1.2 mmol/L, CaCl22.5 mmol/L, NaHCO324.9 mmol/L, D-glucose 10 mmol/L (pH使用HCl调至7.3~7.4)。
1.4 电生理指标的测定
将模型大鼠开胸放置于4℃ K-H液中,经初步修剪后,将模型心脏主动脉固定于Working Heart灌流系统灌流管头端,开始以37℃经95%氧气和5%二氧化碳混合气饱和的K-H液逆向灌流,此时心脏重新开始跳动。约经20 min心脏跳动稳定后,分别在两侧心室刺入两对电极,分别用于电刺激和记录。单相动作电位的记录方法为:使用直径0.4 mm银丝,稍加压力与心室外膜接触[5]。参考电极通过对照浸泡过的海绵间接接触心外膜,左心室接触部位为梗死边缘区,右心室接触部位为远离梗死区。数据使用Biopac MP150多导电生理记录仪记录。
1.5 测定的指标和方法
测量窦性心动周期(sinus cycle length, SCL),测定起搏阈值,然后以脉宽2 ms,起搏电压为2倍起搏阈值进行左心室递减起搏刺激,采用S1S2刺激法测量心室有效不应期(effective refractory period, ERP):S1S2间期以5 ms时距递减,负向扫描至不能引起心室去极化。心室ERP定义为不能引起除极的最长S1S2间期。计算心室ERP离散度:左心室ERP与右心室ERP的差值,即LERP-RERP[6]。
测量心室肌外膜单相动作电位时程(monophasic action potential duration, MAP):MAP20、MAP50和MAP90,分别为零相除极化起始至复极化达20%、50%、90%振幅的水平距离,测量动作电位最大振幅(action potential amplitude, APA);计算心室MAP90离散度:左心室MAP90与右心室MAP90的差值,即LMAP90-RMAP90[6]。
在左心室(电极固定于梗死周边部位)测定心室ERP完毕后发放Burst刺激(起搏周长为50 ms)诱发室速,共发放5次,每次持续1 s,间隔30 s。室速定义为在S1S2或Burst刺激后心电图出现快速心室激动,体表心电图表现为宽大QRS波。室速持续时间大于1 min定义为持续性室速,应用Burst刺激(起搏周长为50 ms)终止,记录每只模型大鼠室速的发生次数和持续时间[7]。
待模型大鼠室速相关参数记录完毕、心脏稳定20 min后,发放频率为25 Hz的矩形脉冲,起搏周长为8 ms,刺激时程为500 ms,电流强度以0.1 mA步进,直至诱发出室颤,记录此时的室颤阈值及室颤持续时间,是否能自发终止或以室颤刺激程序终止[8]。
1.6 统计学分析
2 结果
2.1 各组大鼠MAP、ERP和ERP离散度比较情况(图2)
MI后7 d,对照组左心室MAP20、MAP50、MAP90和ERP均较Sham组明显延长(均P<0.05);E-G组除MAP50外,MAP20、MAP90、ERP均较对照组显著改善(均P<0.05),MAP90和ERP恢复到Sham组水平(均P>0.05);而D-G组MAP20、MAP50、MAP90和ERP较对照组均未见明显改善(均P>0.05)。对照组右心室MAP20、MAP50、MAP90和ERP均较Sham组明显延长(均P<0.05);E-G组MAP20、MAP50、MAP90和ERP均较对照组有明显改善(均P<0.05),但除ERP外,均未恢复到Sham组水平(均P<0.05);而D-G组MAP20、MAP50、MAP90和ERP较对照组均未见改善(均P>0.05),甚至MAP20、MAP90和ERP有恶化趋势。对照组ERP和MAP90离散度均较Sham组延长(均P<0.05),E-G组和D-G组ERP和MAP90离散度较对照组均明显改善(均P<0.05)。
MI后3个月,对照组左心室MAP20、MAP50、MAP90和ERP均较Sham组明显延长(均P<0.05);E-G组MAP90和ERP均较对照组有明显改善(均P<0.05);D-G组MAP20、MAP50、MAP90和ERP较对照组均未见明显改善(均P>0.05)。对照组右心室MAP20、MAP50、MAP90和ERP均较Sham组明显延长(均P<0.05);E-G组MAP20、MAP50、MAP90和ERP均较对照组有明显改善(均P<0.05),但除MAP90外,均未恢复到Sham组水平(均P<0.05);D-G组MAP20、MAP50、MAP90和ERP较对照组均未见改善(均P>0.05),甚至MAP90和ERP有恶化趋势。对照组MAP90和ERP离散度均较Sham组延长(均P<0.05),E-G组MAP90和ERP离散度均较对照组有明显改善(均P<0.05),D-G组MAP90离散度较对照组有明显改善(P<0.05)。
2.2 各组大鼠SCL、VFT和VFD情况比较(图3)
MI后7 d,对照组SCL较Sham组明显缩短(P<0.05),E-G组和D-G组SCL较对照组均明显改善(均P<0.05),但均未恢复到Sham组水平(均P<0.05);对照组VFT较Sham组明显减小(P<0.05),E-G组较对照组VFT明显升高(P<0.05),但未恢复到Sham组水平(P<0.05),D-G组VFT较对照组改善不明显(P>0.05);对照组VFD较Sham组明显延长(P<0.05),E-G组较对照组VFD明显缩短(P<0.05),并恢复到Sham组水平(P>0.05);D-G组VFD较对照组改善不明显(P>0.05)。
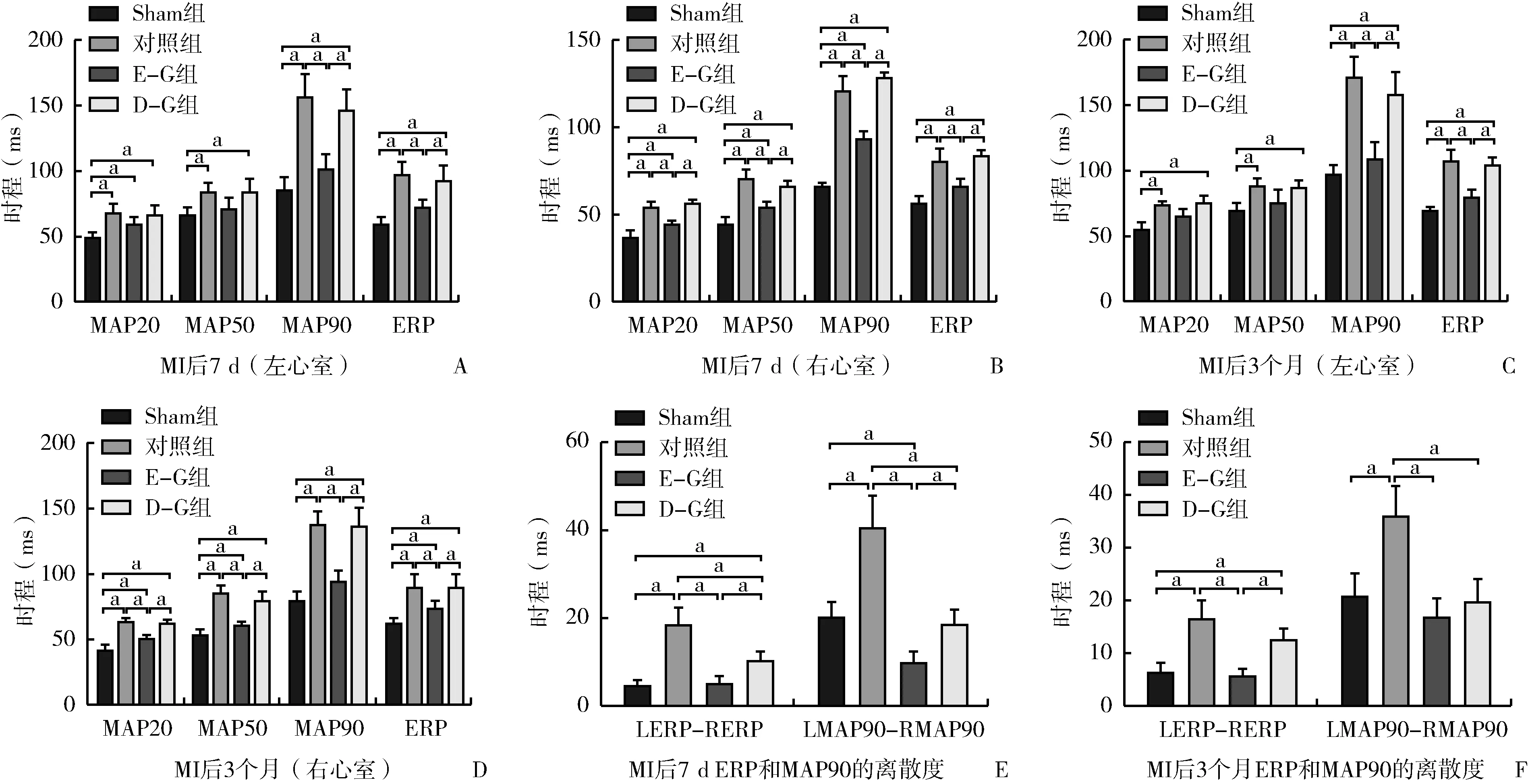
注:MAP,单相动作电位时程;ERP,有效不应期;MI,心肌梗死; E-G组,术后即刻给药组; D-G组,延迟给药组图2 MAP、ERP和心室离散度各项指标比较 A:MI后7 d左心室MAP和ERP各项指标比较;B:MI后7 d右心室MAP和ERP各项指标比较;C:MI后3个月左心室MAP和ERP各项指标比较;D:MI后3个月右心室MAP和ERP各项指标比较;E:MI后7 d MAP90和ERP离散度比较;F:MI后3个月MAP90和ERP离散度比较。a,两组间比较,P<0.05
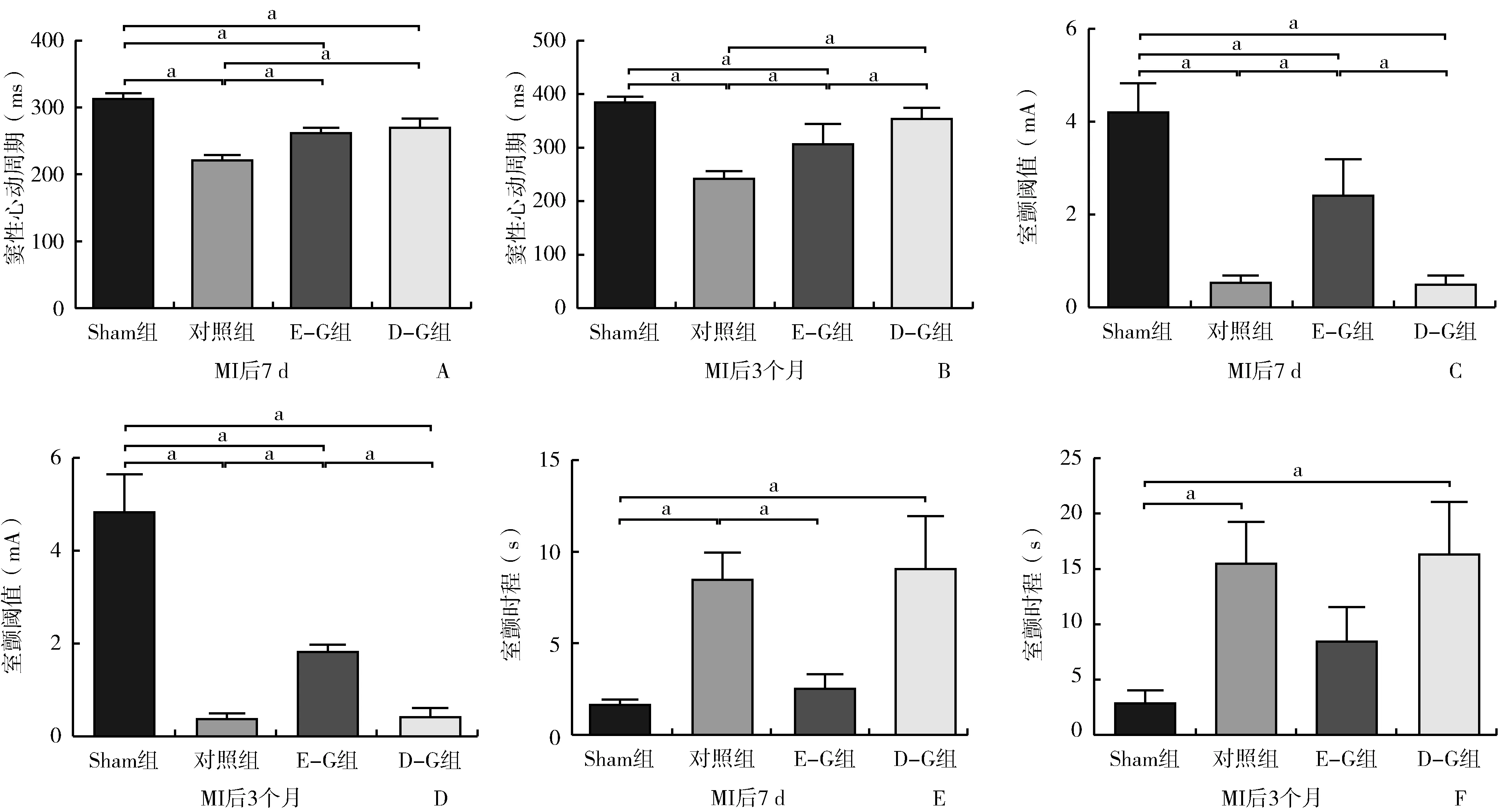
注:SCL,窦性心动周期;VFT,心室颤动阈值;VFD,心室颤动时程; MI, 心肌梗死;E-G组,术后即刻给药组; D-G组,延迟给药组图3 各组大鼠SCL、VFT和VFD比较 A:MI后7 d各组SCL比较;B:MI后3个月各组SCL比较;C:MI后7 d各组VFT比较;D:MI后3个月各组VFT比较;E:MI后7 d各组VFD比较;F:MI后3个月各组VFD比较;a,两组间比较,P<0.05
MI后3个月,对照组SCL较Sham明显缩短(P<0.05),E-G组和D-G组SCL较对照组均明显改善(均P<0.05),D-G组SCL接近恢复到Sham组水平(P>0.05);对照组VFT较Sham组明显减小(P<0.05),E-G组较对照组VFT明显升高(P<0.05),但未恢复到Sham组水平(P<0.05),D-G组VFT较对照组改善不明显(P>0.05);对照组VFD较Sham组明显延长(P<0.05),E-G组和D-G组VFD较对照组改善不明显(P>0.05),但E-G组VFD改善趋势更好(P>0.05)。
2.3 各组大鼠其它电生理参数(APA、Vmax和ERP/MAP90)比较(表2~5)
MI后7 d,对照组左心室APA较Sham组降低(P<0.05),E-G组APA较对照组有明显改善(P<0.05),而D-G组APA较对照组无明显改善(P>0.05);各组左心室Vmax均无明显改变(均P>0.05);对照组和D-G组左心室ERP/MAP90均较Sham组降低(均P<0.05),E-G组ERP/MAP90较对照组改善(P<0.05),D-G组ERP/MAP90较对照组无明显改善(P>0.05)。各组之间右心室APA和Vmax均无明显改变(均P>0.05);右心室对照组ERP/MAP90较Sham组降低(P<0.05),E-G组ERP/MAP90较对照组有改善趋势,但差异无统计学意义(P>0.05),D-G组ERP/MAP90较对照组无明显改善(P>0.05)。
MI后3个月,对照组左心室APA较Sham组降低(P<0.05),E-G组和D-G组APA较对照组均有明显改善(均P<0.05),但D-G组APA未恢复到Sham组水平(P>0.05);对照组左心室Vmax较Sham组均明显降低(均P<0.05),E-G组和D-G组Vmax较对照组明显改善(P<0.05);对照组和D-G组左心室ERP/MAP90较Sham组均降低(均P<0.05),E-G组ERP/MAP90较对照组改善(P<0.05),D-G组ERP/MAP90较对照组无明显改善(P>0.05);对照组右心室APA较Sham组降低(P<0.05),E-G组APA较对照组无明显改善(P>0.05),D-G组APA较对照组改善(P<0.05),但D-G组APA未恢复到Sham组水平(P>0.05);对照组右心室Vmax较Sham组明显降低(P<0.05),E-G组和D-G组Vmax均较对照组改善(均P<0.05);对照组右心室ERP/MAP90较Sham组降低(P<0.05),E-G组ERP/MAP90较对照组改善(P<0.05),D-G组ERP/MAP90较对照组无明显改善(P>0.05)。

表2 各组大鼠心肌梗死后7 d 左心室电生理参数比较±s)
注:E-G组,术后即刻给药组; D-G组,延迟给药组; APA,最大动作电位幅度;Vmax,零相上升最大速度;ERP,有效不应期;MAP90,单相动作电位90%;a,与Sham组比较,P<0.05;b,与对照组比较,P<0.05;c,与E-G组比较,P<0.05
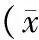
表3 各组大鼠心肌梗死后7 d右心室电生理参数比较±s)
注:E-G组,术后即刻给药组; D-G组,延迟给药组; APA,最大动作电位幅度;Vmax,零相上升最大速度;ERP,有效不应期;MAP90,单相动作电位时程90%;a,与Sham组比较,P<0.05;b,与对照组比较,P>0.05
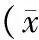
表4 各组大鼠心肌梗死后3个月左心室电生理参数比较±s)
注:E-G组,术后即刻给药组; D-G组,延迟给药组; APA,最大动作电位幅度;Vmax,零相上升最大速度;ERP,有效不应期;MAP90,单相动作电位时程复极化90%;a,与Sham组比较,P<0.05;b,与对照组比较,P<0.05;c,与E-G组比较,P<0.05
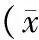
表5 各组大鼠心肌梗死后3个月右心室电生理参数比较±s)
注:E-G组,术后即刻给药组; D-G组,延迟给药组; APA,最大动作电位幅度;Vmax,零相上升最大速度;ERP,有效不应期;MAP90,单相动作电位90%;a,与Sham组比较,P<0.05;b,与对照组比较,P<0.05;c,与E-G组比较,P<0.05
3 讨论
冠状动脉闭塞后1周至数月,非梗死区出现心肌肥厚,梗死边缘区动作电位时程(action potential duration, APD)延长,动作电位上升支幅度和速率均下降,具体机制为:(1)梗死区细胞内钠电流同正常比无明显改变,但梗死边缘区钠钾泵功能下降及细胞内钠漏引起细胞内钠通道活性降低,因此动作电位上升支Vmax下降。(3)2个月梗死周边心肌细胞中L型钙离子通道电流(ICa.L)峰值显著减少,ICa.L峰值电流密度减小是梗死瘢痕周边区心肌细胞膜电容增加的结果。而电流-电压(I-V)关系、电压依赖性稳态失活曲线及恢复曲线并无明显改变[9]。应用钡作为电流离子通过钙通道,仍持续存在钙通道电流密度下降及电流衰减加速,表明功能性钙通道数量减少。梗死心肌细胞钙失活曲线发生改变,向超极化方向移位,引起少量ICa.L内流。ICa.L通道动力学改变可部分解释梗死区总ICa.L电流密度减少,并使梗死心肌动作电位2相电压及时程减小。肥厚梗死心肌细胞中再度出现T型钙电流(该电流通常在心脏发育成熟后心室肌中消失,只保留在窦房结或房室结等起搏细胞中)。上述钙通道动力学及功能变化可能使肥厚心肌细胞APD延长。(3)临近梗死区的心内膜下心肌细胞延迟整流钾通道电流(Ik)密度显著降低,而幅度无明显改变。远离梗死区的心肌细胞Ik尾电流及I-V关系曲线并无明显改变,尾电流密度在正电位时减少,同时伴典型的强内向整流;Ik尾电流的电压依赖性激活移位到更正电位水平,但失活及激活曲线的斜率并无改变[10]。瞬时外向钾通道电流(Ito)及Ik不同的密度比例能够解释心外膜及心内膜心肌细胞APD的不同,容易因动作电位离散度增加而引起各向异质性,进而导致折返性心律失常。(4)另有研究认为,梗死心肌边缘区域心肌细胞复极化后不应态的离子机制同样是钠通道失活延迟恢复,但原因为梗死恢复过程中钠离子通道电流(INa)的慢性改变而不是由于细胞外钾水平的升高,这同急性MI期有差别[11]。因此,将治疗靶点定位于梗死心肌边缘区域心肌细胞复极化后不应态可能会减少梗死后心律失常的发生。最近有研究将KCNH2-G628S基因(延迟整流性钾通道电流Ikr变异基因)转染到已发生室性心动过速的猪梗死心肌边缘区域,结果室性心动过速均消失,且无致心律失常性及其他不良反应,推测其机制可能为Ikr抑制平衡了INa的慢性改变,使复极化后不应态消失[12]。MI大鼠MAP20主要受Ito影响,MAP50主要为ICa.L和Ikr、延迟整流性钾通道慢成分(Iks)综合作用的结果,MAP90主要受内向整流钾通道电流(Ik1)的影响。本研究发现MI大鼠MAP时程延长,离散度增加,容易诱发室速和室颤,而即刻G-CSF干预较延迟G-CSF干预能显著降低MI大鼠MAP90和ERP离散度、VFT和VFD,推测可能的机制为G-CSF可能通过影响相关离子电流而有效改善APD、早期后除极和延迟后除极。
目前,G-CSF应用于心肌缺血后治疗已经进入Ⅲ期临床试验阶段[13-14],但效果仍充满争议。有学者推测,实验条件的不均一性可能是造成实验结果分歧的重要原因,如G-CSF开始治疗的时间窗、给药剂量、观察时间的差异和稳定的梗死范围均会影响到观察的结果。因此,本研究通过建立大鼠MI模型,产生了稳定的梗死范围,观察了G-CSF不同给药方案对MI后心室肌整体电生理特性的影响,并将观察时限延续到MI后3个月,系统评价了G-CSF的远期效应。Harada等[15]指出G-CSF的作用具有时效性,随着开始给药时间的延迟,G-CSF对心脏的改善作用逐渐减弱。另外的研究也显示,在MI后3个月G-CSF的这种疗效已经不存在,甚至心脏功能更加恶化[16]。本研究结果也证实上述观点,即延迟干预组部分电生理指标较缺血状态下未明显改善,甚至有恶化趋势,推测可能的机制为:(1)G-CSF在MI早期主要通过与G-CSFR结合激活下游信号通路发挥其急性心脏保护作用;(2)MI慢性恢复期,梗死周边区交感神经过度再分布促心律失常发生。Kuhlmann等[17]研究发现,G-CSF与干细胞因子( stem cell factor,SCF) 联合应用可以增加梗死心肌边缘区域心肌细胞直径、动脉生成及Cx43的表达,通过减少缓慢传导导致的折返使室性心动过速发生率下降。Kuwabara等[18]研究发现,G-CSF可以直接作用于心肌细胞表面的G-CSFR进而激活Wnt和Jak2信号通路,上调Cx43及磷酸化水平,通过募集β-catenin和cadherin蛋白保护心肌细胞之间缝隙连接功能。本研究组前期研究结果同样发现G-CSF干预能够减少室性心律失常发生率,但心功能恶化[19]。Kanlop等[20]研究发现与我们类似实验结果,即G-CSF能够改善缺血/再灌注梗死心肌电生理参数。但Lee等[21]发现G-CSF可以通过影响心脏交感神经再分布促进心律失常发生。而Baldo等[22]发现G-CSF对缺血心肌电生理效应具有两面性,一方面可以减少室性心律失常发生率,另一面不利于室颤的自主复律。综合上述研究结果,G-CSF在对心肌缺血后心律失常的发生有利有弊,可能通过不同的机制影响心肌电生理参数。
本研究较为全面地验证了G-CSF对离体MI大鼠心脏整体电生理特性的作用,表明G-CSF能够改善离体梗死心室肌整体电生理参数,减少MI后室性心律失常的发生。目前自主神经系统与免疫炎症系统相互影响在心血管疾病中越来越受到重视,因此G-CSF通过“神经-炎症轴”调控室性心律失常发生的具体机制是将来研究的重点。
[1] Liu YW, Su CT, Yen CY, et al.Arrhythmogenesis: a roadblock to cardiac stem cell therapy. Curr Treat Options Cardiovasc Med, 2016, 18(10): 61.
[2] Goedel A, My I, Sinnecker D, et al. Perspectives and challenges of pluripotent stem cells in cardiac arrhythmia research. Curr Cardiol Rep, 2017, 19(3): 23.
[3] D′Amario D, Leone AM, Borovac JA, et al. Granulocyte colony-stimulating factor for the treatment of cardiovascular diseases: An update with a critical appraisal. Pharmacol Res, 2017,[Epub ahead of print].
[4] Zhou X, Li YM, Ji WJ, et al. Phenytoin can accelerate the healing process after experimental myocardial infarction? Int J Cardiol, 2006, 107(1): 21-29.
[5] Fabritz L, Kirchhof P, Franz MR, et al. Prolonged action potential durations, increased dispersion of repolarization, and polymorphic ventricular tachycardia in a mouse model of proarrhythmia. Basic Res Cardiol, 2003, 98(1): 25-32.
[6] 邢雁伟,王硕仁,王润桃. 心梗大鼠离体心脏的动作电位和不应期电生理研究. 中国实验动物学报,2005, 13(2):101-105.
[7] Nguyen T, El Salibi E, Rouleau JL. Postinfarction survival and inducibility of ventricular arrhythmias in the spontaneously hypertensive rat: effects of ramipril and hydralazine. Circulation, 1998, 98(19): 2074-2080.
[8] Yumoto A, Fukushima Kusano K, Nakamura K, et al. Hepatocyte growth factor gene therapy reduces ventricular arrhythmia in animal models of myocardial ischemia. Acta Med Okayama, 2005, 59(3): 73-78.
[9] Litwin SE, BridgeJH. Enhanced Na(+)-Ca2+exchange in the infarcted heart. Implications for excitation-contraction coupling. Circ Res, 1997, 81(6): 1083-1093.
[10] Yuan F,PintoJM,Li Q, et al. Characteristics of I(K) and its response to quinidine in experimental healed myocardial infarction. J Cardiovasc Electrophysiol, 1999, 10(6): 844-854.
[11] Pu J, Boyden PA, Alterations of Na+ currents in myocytes from epicardial border zone of the infarcted heart. A possible ionic mechanism for reduced excitability and postrepolarization refractoriness. Circ Res, 1997, 81(1): 110-119.
[12] Sasano T,McDonald AD, Kikuchi K, et al. Molecular ablation of ventricular tachycardia after myocardial infarction. Nat Med, 2006, 12(11): 1256-1258.
[13] Achilli F, Malafronte C, Cesana F, et al. Granulocyte-colony stimulating factor for large anterior ST-elevation myocardial infarction: rationale and design of the prospective randomized phase III STEM-AMI OUTCOME trial. Am Heart J, 2015, 170(4): 652-658.
[14] Steppich B, Hadamitzky M, Ibrahim T, et al. Stem cell mobilisation by granulocyte-colony stimulating factor in patients with acute myocardial infarction. Long-term results of the REVIVAL-2 trial. Thromb Haemost, 2016, 115(4): 864-868.
[15] Harada M, Qin Y, Takano H, et al. G-CSF prevents cardiac remodeling after myocardial infarction by activating the Jak-Stat pathway in cardiomyocytes. Nat Med, 2005, 11(3): 305-311.
[16] Cheng Z, Ou L, Liu Y, et al. Granulocyte colony-stimulating factor exacerbates cardiac fibrosis after myocardial infarction in a rat model of permanent occlusion. Cardiovasc Res, 2008, 80(3): 425-434.
[17] Kuhlmann MT, Kirchhof P, Klocke R, et al. G-CSF/SCF reduces inducible arrhythmias in the infarcted heart potentially via increased connexin43 expression and arteriogenesis. J Exp Med, 2006, 203(1): 87-97.
[18] Kuwabara M, Kakinuma Y, Katare RG, et al. Granulocyte colony-stimulating factor activates Wnt signal to sustain gap junction function through recruitment of beta-catenin and cadherin. FEBS Lett, 2007, 581(25): 4821-4830.
[19] Liu HM, Luo T, Zhou X, et al. Disassociation between left ventricular mechanical and electrical properties in ischemic rat heart after G-CSF treatment. Cardiovasc Drugs Ther, 2011, 25(3): 203-214.
[20] Kanlop N, Thommasorn S, Palee S, et al. Granulocyte colony-stimulating factor stabilizes cardiac electrophysiology and decreases infarct size during cardiac ischaemic/reperfusion in swine. Acta Physiol (Oxf), 2011, 202(1): 11-20.
[21] Lee TM, Chen CC, Chang NC. Granulocyte colony-stimulating factor increases sympathetic reinnervation and the arrhythmogenic response to programmed electrical stimulation after myocardial infarction in rats. Am J Physiol Heart Circ Physiol, 2009, 297(2): H512-H522.
[22] Baldo MP, Rodrigues SL, Mill JG. Acute effects of granulocyte colony-stimulating factor on early ventricular arrhythmias after coronary occlusion in rats. J Pharmacol Pharmacother, 2012, 3(1): 39-42.
Effects of granulocyte colony-stimulating factor on electrophysiological properties of post-infarct ventricles in ex vivo rat hearts
LUOTao,WANGYong-zhi,DENGXu-bo,SHICheng-long,SHIWen-ju,PUKui.
DepartmentofCardiology,DepartmentofMedicalServices,ChinesePLANo.254hospital,Tianjin300142,China
Correspondingauthor:PUKui,Email:tluo.cardiolab@live.com
Objective To observe the effects of granulocyte colony stimulating factor (G-CSF) on electrophysiological properties of post-infarct ventricles. Methods Sixty-seven survival Wistar rats were divided into 4 groups: Sham group, Control group, MI early G-CSF group (E-G) and MI delay G-CSF group (D-G) after ligation of the left coronary artery as myocardial infarction model. Monophasic action potential(MAP) was recorded by absorption electrode in ex vivo perfused rat hearts.Effective refractive period( ERP),sinus cardiac length( SCL), action potential amplitude( APA), maximal depolariged(Vmax), ventricular fibrillation threshold(VFT) and ventricular fibrillation duration(VFD) were measured. Results The electrophysiological parameters (SCL,VFT,VFD,APA,ERP/MAP90,dispersion of ERP and MAP90) of the E-G group were improved significantly (allP<0.05) at day 7 post MI.Improvement in SCL,dispersion of ERP and MAP 90 were found in the D-G group as well at day 7 post MI(allP<0.05). Substained improvement in electrophysiological parameters were found in the E-G group at 3 months after MI(P<0.05). Besides SCL, APA, Vmax and dispersion of MAP90,all other parameters in the D-G group were similar to that of the control group with no statistical significance and even had a tendency of deterioration in ERP and MAP90 3 months after MI.Conclusion G-CSF intervention could improve electrophysiological properties of ischemic ventricles. Early G-CSF intervention showed better outcomes compared to delay G-CSF intervention on electrical remodeling ischemia myocardiumwhich may have effect on reducing the development of ventricular arrhythmia.
Granulocyte colony stimulating factor; Myocardial infarction; Monophasic action potential duration; Dispersion
10.3969/j.issn.1004-8812.2017.07.006
300142 天津,解放军第254医院心血管内科(罗涛、王永智、邓旭波、史成龙、浦奎),医务处(史文举)
浦奎,Email:tluo.cardiolab@live.com
R542.22
2017-05-03)
