β-谷甾醇在复杂体系中抗氧化作用的研究
2017-08-07朱瑞涛冯丽霞张彩凤谢文磊
左 玉 朱瑞涛 冯丽霞 张彩凤,2 谢文磊
(太原师范学院化学系1,太原 030031) (山西省腐植酸工程技术研究中心2,太原 030031) (河南工业大学化学化工学院3,郑州 450001)
β-谷甾醇在复杂体系中抗氧化作用的研究
左 玉1朱瑞涛1冯丽霞1张彩凤1,2谢文磊3
(太原师范学院化学系1,太原 030031) (山西省腐植酸工程技术研究中心2,太原 030031) (河南工业大学化学化工学院3,郑州 450001)
研究β-谷甾醇在非均相食品体系和非均相生物体系的抗氧化活性以及VC和VE对其抗氧化活性的影响。结果表明,不同浓度的β-甾醇均具有一定的抗氧化活性,但抗氧化能力随浓度升高逐渐降低。β-谷甾醇与VC协同作用时,FTC法测得在葵花油乳状液中VC的加入使3种浓度β-谷甾醇抗氧化能力明显提高;而在大豆磷脂脂质体中,0.008 mg/mL β-谷甾醇和VC共同作用时的抗氧化效果最好;TBARS法测得0.001 6 mg/mL β-谷甾醇和0.008 mg/mL VC共同作用表现出较强的协同增效作用。在考察β-谷甾醇与VE的协同作用时发现:在大豆磷脂脂质体中,FTC法测得的0.008 mg/mL β-谷甾醇和0.001 6 mg/mL VE共同作用显示抗氧化协同增效作用,其余各种不同浓度的β-谷甾醇与VC、VE共同作用时均不显示协同增效作用。
β-谷甾醇 脂质氧化 抗氧化活性 协同作用
自然界的甾醇主要存在于动植物的油类与脂肪中,有1 700多种。在众多的甾醇中,目前已发现的40多种植物甾醇具有很强的代表性,其中以β-谷甾醇、豆甾醇、菜油甾醇和菜籽甾醇为主[1]。有关植物甾醇的性质和作用已有较多文章进行了综述,说明其广泛应用于食品[2-3]、医药[4-5]、日用化学品[6]及纺织化工等领域[7]。许多植物甾醇还具有较强的抗氧化能力[8]。当前,人们对植物甾醇中β-谷甾醇的介绍也较为普遍,但对其抗氧化活性,尤其是在如复合抗氧化剂体系、食品体系和生物膜体系等非均相复杂体系下,用多种抗氧化指标对β-谷甾醇抗氧化活性的研究鲜见报道。
本试验研究β-谷甾醇在由葵花油水包油乳状液模拟的非均相食品体系和用大豆磷脂脂质体模拟的非均相生物体系的抗氧化活性以及VC和VE对其抗氧化活性的影响。试验过程中,分别用硫氰酸铁法(FCT)测定脂质过氧化物和硫代巴比妥酸反应物法(TBARS)检测脂质过氧化物降解产生的小分子醛丙二醛。试验以期明确β-谷甾醇及其协同作用的抗氧化机理,为进一步应用于食品和生命体的研究提供借鉴。
1 材料与方法
1.1 材料与仪器
葵花籽油:天津嘉里粮油工业有限公司;大豆磷脂:黑龙江前进油厂;β-谷甾醇:北京百灵威化学技术有限公司;VE、TBHQ:Sigma公司;AAPH:Aldrich化学试剂公司;Tween 20:上海三浦化学试剂公司;FeCl2·4H2O:天津双船化学试剂厂;TCA:上海化学试剂采购供应站;TBA:中国医药(集团)上海化学试剂公司;其他试剂均为国产分析纯。
722S型分光光度计、旋转蒸发器RE-52C、SHZ-DA(Ⅲ)循环水式真空泵、KQ-100超声波清洗仪:巩义市英裕予华仪器厂;TL80-2型医用离心机、80-1型离心沉淀机:江苏姜堰市天力医疗器械有限公司;SHZ-C水浴恒温振荡器:江苏省金坛市华锋仪器有限公司。
1.2 葵花油水包油乳状液的制备
葵花油水包油乳状液的制备参考Chang等[9]和Yen等[10]的工作:将5.0 g葵花油置于100 mL圆底烧瓶中,依次加入25 mL含0.5 g 20 mg/mL Tween 20的pH为7.4的磷酸盐缓冲溶液、1.0 mL 5 mg/mL AAPH、抗氧化剂和磷酸盐缓冲溶液,使总体积为50 mL。在超声波振荡器中振荡20 min,形成乳白色不透明乳状液。由于β-谷甾醇为油溶性,需用氯仿溶解,再将其与葵花油混合,减压蒸发除去氯仿。
1.3 大豆磷脂脂质体的制备
大豆磷脂脂质体的制备参考Aihua等[11]的薄膜法的工作:称取10.0 g大豆磷脂,用氯仿溶解定容至250 mL(40 mg/mL),储存于冰箱中备用。再量取10.0 mL磷脂的氯仿溶液于100 mL圆底烧瓶中,45 ℃减压蒸去氯仿,加入一定量的磷酸盐缓冲溶液,在超声波振荡器中振荡20 min,制备脂质体,脂质体溶液呈乳白色不透明状。在测定β-谷甾醇抗氧化性能时,β-谷甾醇的氯仿溶液预先与磷脂溶液混合,然后减压蒸去氯仿。
1.4 脂质的氧化
向制备好的葵花油乳状液中加入1.0 mL AAPH,或向大豆磷脂脂质体中加入0.5 mL AAPH后,将体系置于转速为175 r/min 的水浴恒温振荡器中,发生氧化反应(恒温37 ℃)。2种体系中β-谷甾醇的添加量分别为油重和大豆磷脂质量的0.02%、0.05%、0.10%。
1.5 抗氧化活性的测定
1.5.1 硫氰酸铁法(FTC)
采用Mitsuda等[12]和Yen等[13]的方法:每隔1.5 h取0.1 mL反应液,加4.7 mL 75%乙醇(V/V)、0.1 mL 3.94 mol/L硫氰酸铵和0.1 mL 0.02 mol/L的FeCl2/3.5%HCl溶液。室温反应3 min后,于500 nm处测吸光度。
1.5.2 硫代巴比妥酸反应物法(TBARS)
采用Kosugi等[14]的方法测定脂质过氧化物降解产生的丙二醛MDA,并稍有改动。每隔1.5 h取0.5 mL反应液,加2 mL 0.02 mol/L TBA、2 mL 20%(m/V) TCA和1 mL 0.08%(m/V)TBHQ。置于沸水浴加热20 min,冷却10 min,加2 mL氯仿,3 000 r/min离心10 min。取上清液在532 nm处测其吸光度。
1.6 抑制率的计算
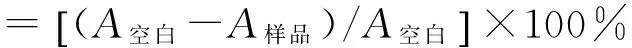
式中:A空白和A样品分别为t时间空白试样和对应时间点被测样品的吸光度。
1.7 数据处理与分析
至少平行进行3次,取其中平行效果较好的3次结果,采用Origin 8.0等数据分析软件对数据进行计算和统计学分析,采用单因素方差分析(ANOVA),并以平均值±标准偏差(SD)表示。对各组数据采用方差分析,P<0.05有统计学意义。
2 结果与讨论
2.1 不同浓度β-谷甾醇抗氧化活性的研究
2.1.1 葵花油水包油乳状液
由图1可以看出,不同浓度β-谷甾醇在葵花油水包油乳状液中对脂质的氧化均具有抑制作用,在相同时间内,β-谷甾醇的加入降低了体系中脂质过氧化物和TBARS的量,并且不同质量浓度之间均以相同的规律递变,即0.02 mg/mL>0.05 mg/mL>0.10 mg/mL,说明随着β-谷甾醇浓度升高,抗氧化能力逐渐降低。在氧化反应初期,β-谷甾醇的存在能使脂质过氧化物的形成明显减慢,抑制氧化的效果明显,但是抑制脂质过氧化物生成的能力随着时间的增加下降较快,在反应结束时的抑制率分别是38.40%(0.02 mg/mL)、27.71%(0.05 mg/mL)和26.80% (0.10 mg/mL)(显著性分析结果表明P<0.05,以下均相同)。氢过氧化物是脂质氧化的初级产物,容易分解。Satue等[15]的研究表明,抗氧化剂对氢过氧化物的形成和分解有不同的活性。在乳状液中,可能β-谷甾醇抑制脂质过氧化物分解的能力好于抑制它的生成,使得抑制TBARS生成的抑制率有所提高,抑制率分别为42.22%(0.02 mg/mL)、40.28%(0.05 mg/mL)和34.17%(0.10 mg/mL)。
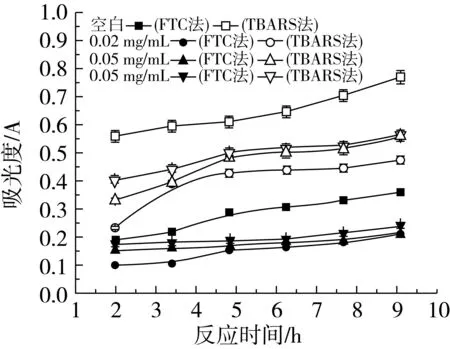
图1 不同浓度β-谷甾醇在葵花油水包油乳状液中抗氧化活性的研究
2.1.2 大豆磷脂脂质体
由图2可以看出,不同浓度β-谷甾醇在大豆磷脂脂质体中对脂质的氧化均具有抑制作用,在相同时间内,β-谷甾醇的加入降低了体系中脂质过氧化物和TBARS的量,并且不同质量浓度之间均以相同的规律递变,即:0.001 6 mg/mL>0.004 mg/mL>0.008 mg/mL,说明随着β-谷甾醇浓度升高,抗氧化能力逐渐降低,且用FTC法测得的抑制率低于TBARS法,在0.001 6、0.004、0.008 mg/mL时过氧化物的抑制率为22.51%、21.05%和18.42%,MDA的抑制率分别是50.36%、42.34%和40.86%。
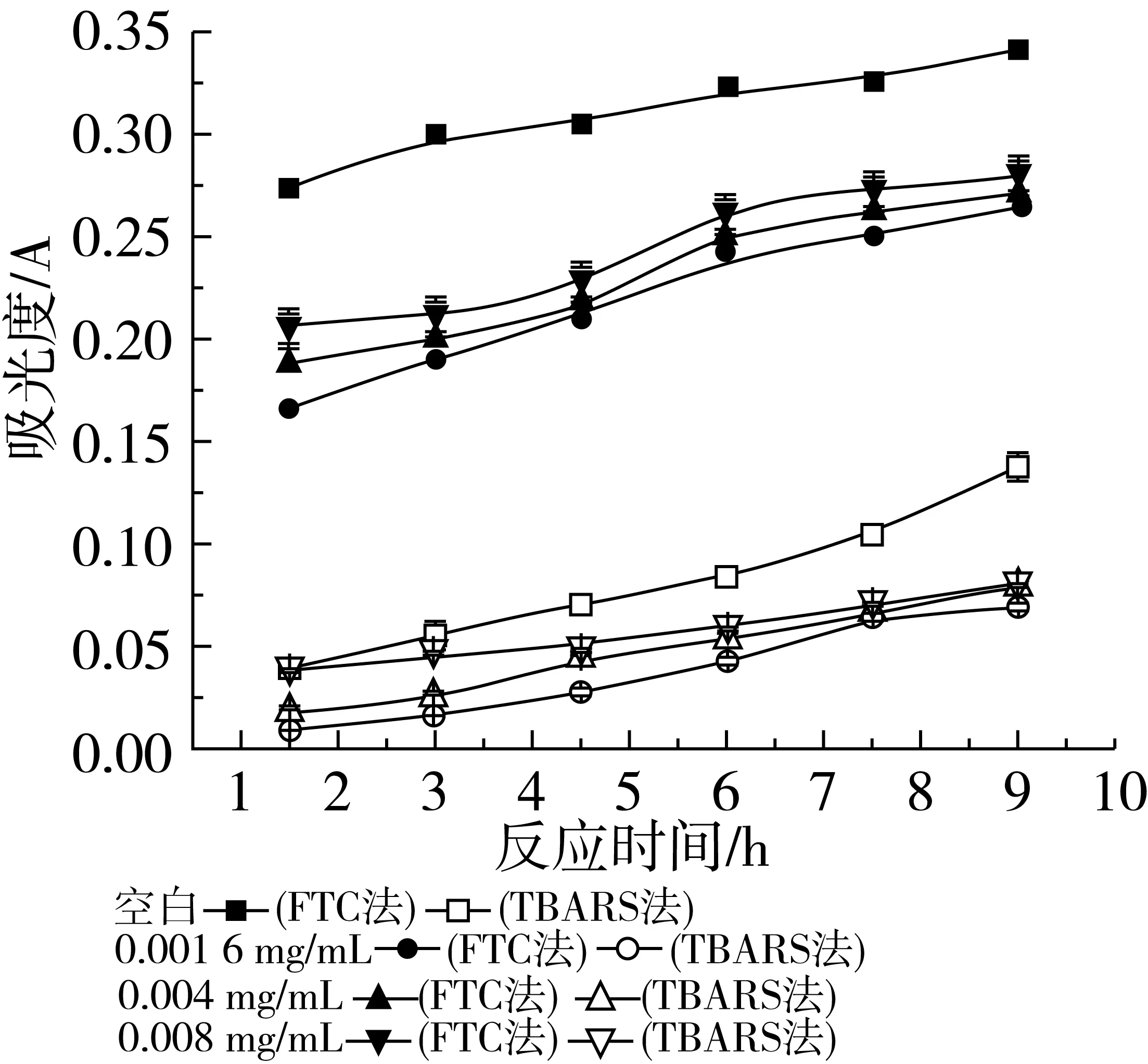
图2 不同浓度β-谷甾醇在大豆磷脂脂质体中抗氧化活性的研究
2.2 不同浓度β-谷甾醇和VC抗氧化活性的研究
在一些生物抗氧化剂里添加VC、VE或BHT、BHA等,其所形成的抗氧化剂复合体的抗氧化效果往往强于单一抗氧化剂的抗氧化效果,这种作用称为协同作用[16]。研究β-谷甾醇与VC或VE共同作用时所形成的复合抗氧化剂的抗氧化活性,所得数据采用加和法和直接比较法进行分析,加和法公式为Y=P(x1+x2)-(Px1+Px2),P(x1+x2)为复合抗氧化剂的抑制率,Px1和Px2分别为单一组分在相同浓度下的抑制率。Y>0,存在(正)协同作用;Y<0,存在负协同作用,即无协同作用[17-18]。直接比较法,复合抗氧化剂的抑制率大于等浓度的单一抗氧化剂的抑制率,表明组分间存在协同作用,反之无协同作用[19]。
2.2.1 葵花油水包油乳状液
β-谷甾醇与VC在葵花油乳状液中的协同作用如图3和图4。由图3a和图4a可以看出,在乳状液中加入VC使得3种浓度的β-谷甾醇抗氧化能力明显提高。在与0.02 mg/mL VC协同时,当β-谷甾醇的加入量为0.05 mg/mL时,2种抗氧化剂共同作用表现出的抗氧化效果最好,其抑制率达到67.78%,其余2种组合的抑制率分别为61.86%和49.36%。在与0.10 mg/mL VC协同时脂质过氧化物在4.5 h时的吸光度值均达到最大。随β-谷甾醇加入量不同,抗氧化能力的顺序为0.02 mg/mL β-谷甾醇+0.10 mg/mL VC>0.10 mg/mL β-谷甾醇+0.10 mg/mL VC>0.05 mg/mL β-谷甾醇+0.10 mg/mL VC,其抑制率分别是67.75%、57.17%和53.42%。VC的加入虽然增强了β-谷甾醇单独作用时的抗氧化活性,但并没有VC单独存在时的抗氧化活性高,2种浓度下VC的抑制率分别是71.26%和73.45%。通过加和法进行比较,说明组分间没有协同作用。
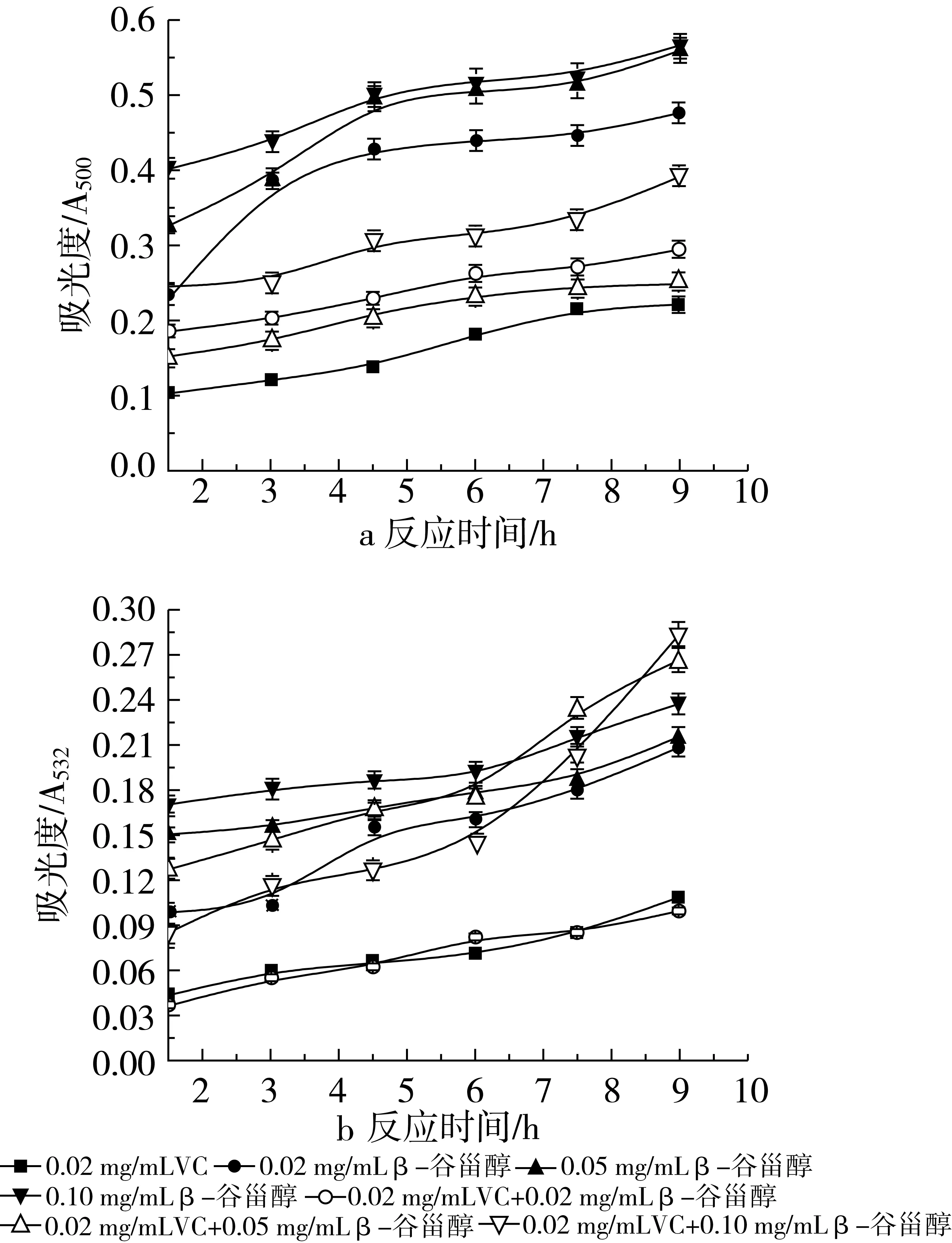
图3 不同浓度β-谷甾醇和0.02 mg/mL VC在葵花油水包油乳状液中抗氧化活性的研究
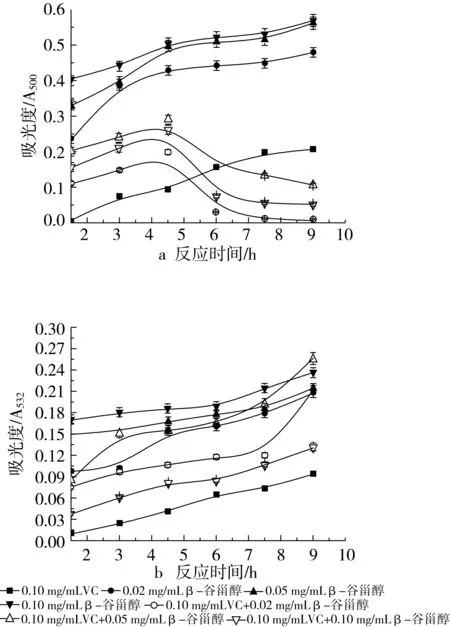
图4 不同浓度β-谷甾醇和0.10 mg/mL VC在葵花油水包油乳状液中抗氧化活性的研究
图3b和图4b是用TBARS法测得的结果。由9 h内吸光度值的变化,发现β-谷甾醇和VC在不同浓度配比下表现出不同的抗氧化活性,2种抗氧化剂的混合使用与每种单独作用时一样,均有较好的抗脂质氧化作用。在与0.02 mg/mL VC协同时,当β-谷甾醇加入量为0.02 mg/mL时,吸光度值与VC单独使用时的吸光度值比较接近,呈现了相近的抗氧化活性,其抑制率为72.50%。与0.05 mg/mL和0.10 mg/mL的β-谷甾醇共同作用时,分别在反应后期的7.5 h和9 h时,吸光度值出现了超越β-谷甾醇单独作用时的吸光度值,说明抗氧化剂消耗完毕,不能抑制脂质氧化物生成。在与0.10 mg/mL VC协同时,当β-谷甾醇的加入量与VC相同时,抑制脂质氧化的效果达到最佳,此时的抑制率是63.61%;其次为与0.02 mg/mL β-谷甾醇作用时的抑制率41.11%,再次是与0.05 mg/mL β-谷甾醇作用时的抑制率28.61%,这2种浓度的组合使得反应后期的抗氧化活性逐渐降低至不显示活性。VC在0.01 mg/mL和0.02 mg/mL时表现出比复合物质强的抗氧化活性,其抑制率分别是70.00%和73.89%。采用同上的分析方法验证是否存在协同作用,Y=P(x1+x2)-(Px1+Px2)=P(β-谷甾醇+VC)-(Pβ-谷甾醇+PVC),由于PVC>Pβ-谷甾醇或P(β-谷甾醇+VC),所以Y始终小于0,复合抗氧化剂不产生协同作用。可以看出,复合物没有对生成丙二醛的协同抑制作用。
2.2.2 大豆磷脂脂质体
图5和图6表明了不同浓度β-谷甾醇和不同浓度VC在大豆磷脂脂质体中对脂质氧化的影响。VC的添加量分别为0.001 6 mg/mL和0.008 mg/mL时用FTC法所测得的结果如图5a和图6a。可以看出,当β-谷甾醇中添加VC后,其抗氧化活性均有所提高,而且随着VC添加量的增加,抑制率也不断增加。加入0.001 6 mg/mL VC时,复合物的抑制率如下:0.001 6 mg/mL β-谷甾醇+0.00 16 mg/mL VC,37.13%;0.004 mg/mL β-谷甾醇+0.001 6 mg/mL VC,34.50%;0.008 mg/mL β-谷甾醇+ 0.001 6 mg/mL VC,38.60%。加入0.008 mg/mL VC时,按上述β-谷甾醇浓度配比的抑制率分别是39.47%、36.26%、40.06%。由2组数据可以看出,虽然添加了不同浓度的VC,但均是当β-谷甾醇的质量浓度为0.008 mg/mL,其抗氧化效果最好,其次是0.001 6 mg/mL β-谷甾醇,效果最差的是0.004 mg/mL β-谷甾醇添加量。
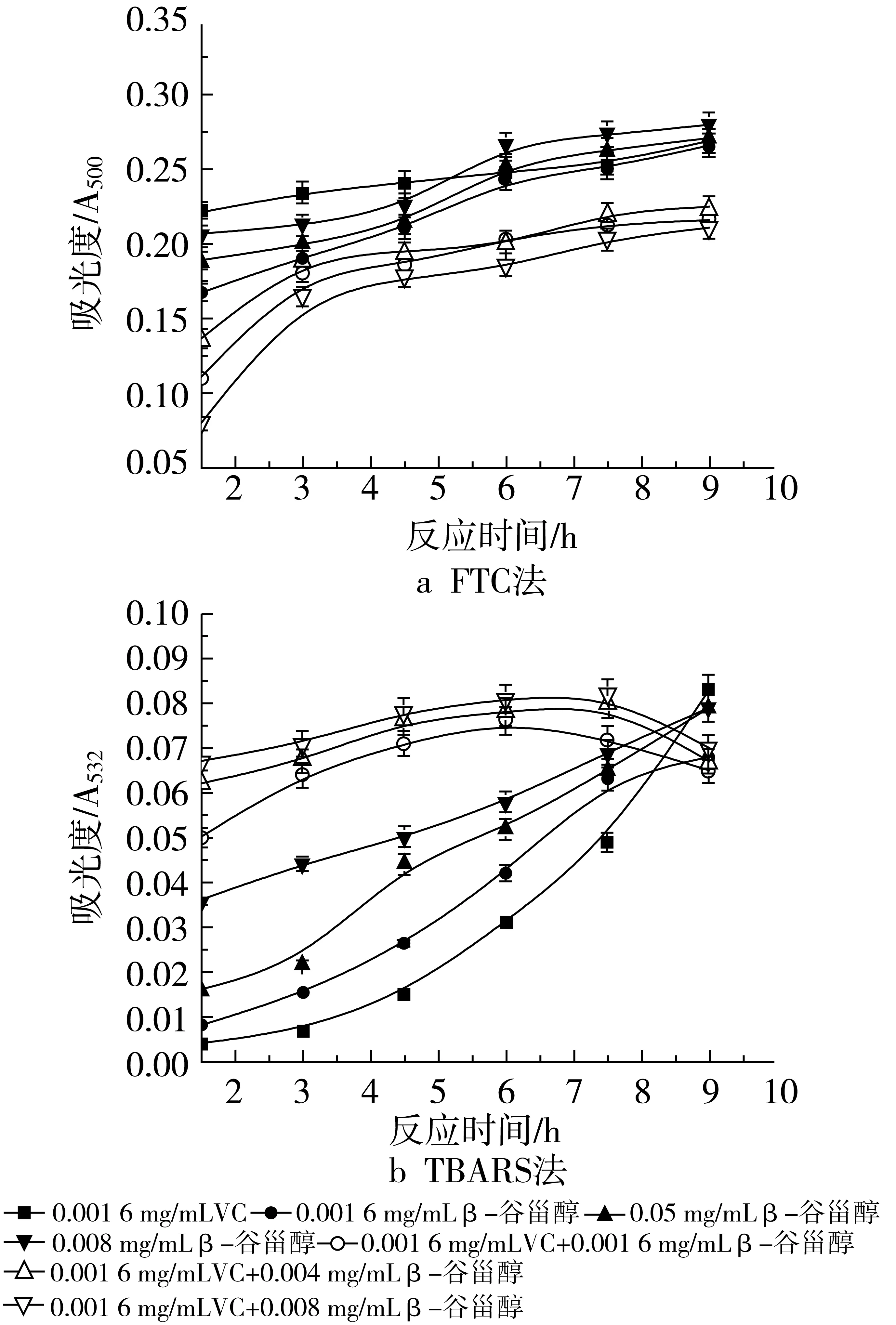
图5 不同浓度β-谷甾醇和0.001 6 mg/mL VC抗氧化活性的研究
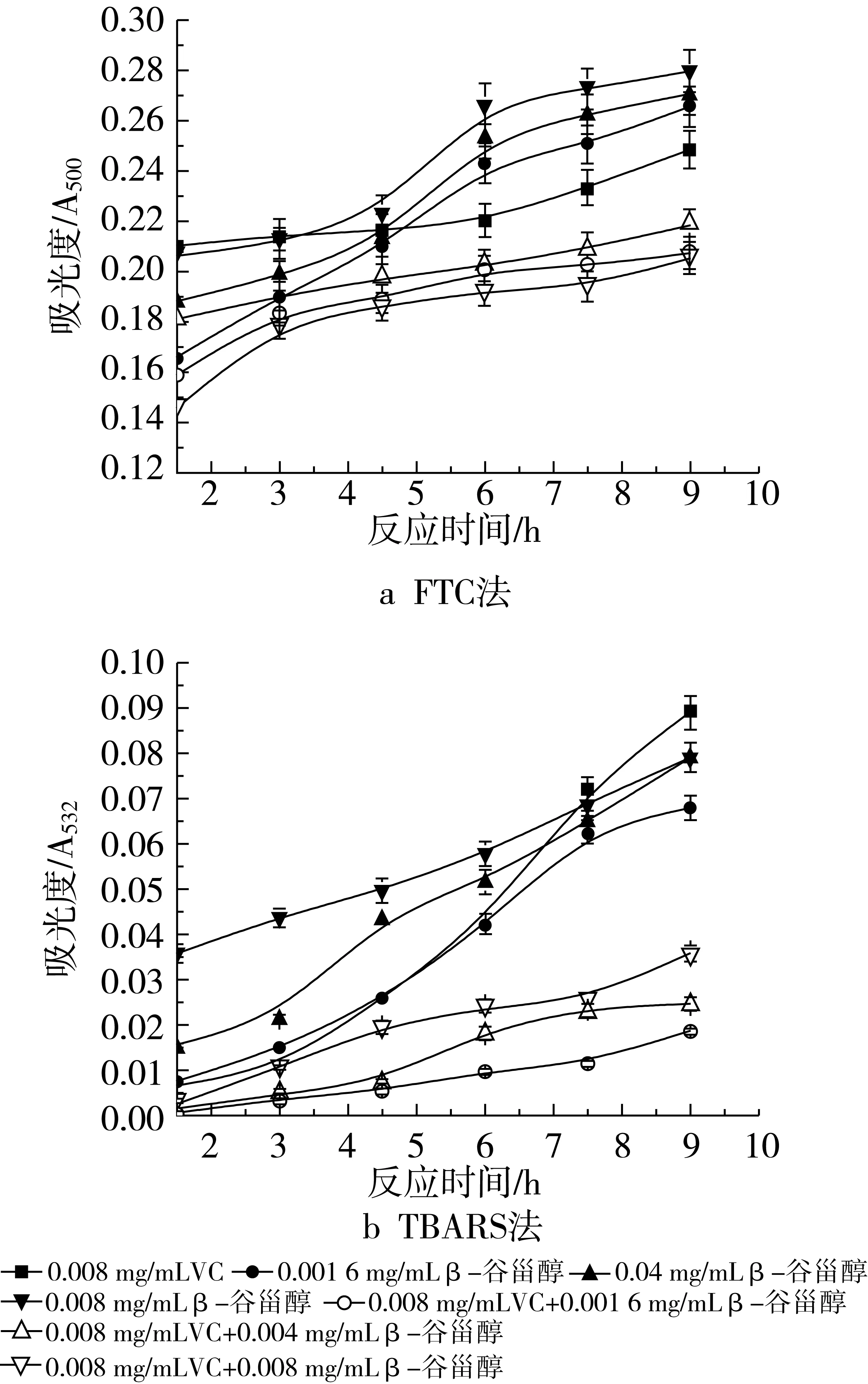
图6 不同浓度β-谷甾醇和0.008 mg/mL VC抗氧化活性的研究
图6b和图5b是用TBARS法所测得的结果。当VC的添加量为0.001 6 mg/mL时,在氧化反应的前7.5 h,其吸光度值均大于β-谷甾醇单独存在时的吸光度值,当反应进行到后期,吸光度值才逐渐减少。在该VC浓度下,不同浓度配比的复合物的抑制率如下:0.001 6 mg/mL β-谷甾醇+0.001 6 mg/mL VC,30.77%;0.004 mg/mL β-谷甾醇+0.001 6 mg/mL VC,23.08%;0.008 mg/mL β-谷甾醇+0.001 6 mg/mL VC,21.15%。该浓度VC没有表现出协同作用,反而使其复合抗氧化活性不如单一组分。当VC质量浓度为0.008 mg/mL时,复合物的抑制率分别为:0.001 6 mg/mL β-谷甾醇+0.008 mg/mL VC,88.46%;0.004 mg/mL β-谷甾醇+0.008 mg/mL VC,81.75%;0.008 mg/mL β-谷甾醇+0.008 mg/mL VC,73.72%,随β-谷甾醇浓度的升高,抑制率是逐渐下降的,但都大于β-谷甾醇或VC单独作用的抗氧化活性(0.008 mg/mL VC的抑制率是61.31%)。通过加和法验证协同作用,说明只有0.001 6 mg/mL β-谷甾醇和0.008 mg/mL VC的共同作用可以起到抑制大豆磷脂脂质体随时间氧化的作用,即表现出较强的协同增效作用。
2.3 不同浓度β-谷甾醇和VE对复杂体系中脂质氧化的影响
2.3.1 葵花油水包油乳状液
VE的添加量分别为0.02 mg/mL和0.10 mg/mL时用FTC法所测得的结果如图7a和图8a所示。当添加相对少量的VE(质量浓度为0.02 mg/mL)时,2种抗氧化剂共同作用的抗氧化活性大于β-谷甾醇或VE单独存在的抗氧化活性,抑制率分别是65.46% (0.02 mg/mL β-谷甾醇+0.02 mg/mL VE)、64.56%(0.05 mg/mL β-谷甾醇+0.02 mg/mL VE)和58.38%(0.10 mg/mL β-谷甾醇+0.02 mg/mL VE)。通过加和法验证协同作用,表明0.02 mg/mL VE的加入与β-谷甾醇不产生协同作用,但复合物的抗氧化活性高于单一组分。在体系中加入较大量的0.10 mg/mL VE后,抗氧化活性并不是随抗氧化剂浓度的增加而增加,抑制率分别是38.66%(0.02 mg/mL β-谷甾醇+0.10 mg/mL VE)、22.55%(0.05 mg/mL β-谷甾醇+0.10 mg/mL VE)和41.75%(0.10 mg/mL β-谷甾醇+0.10 mg/mL VE)。可以看出,0.10 mg/mL β-谷甾醇+0.10 mg/mL VE的组合表现出比单一β-谷甾醇作用时高的抑制率,但Y= 41.75%-26.80%-38.14%<0,仍不显示协同作用。而0.10 mg/mL VE+0.02 mg/mL β-谷甾醇与0.02 mg/mL β-谷甾醇单独作用的抗氧化活性相差不大,0.10 mg/mL VE+0.05 mg/mL β-谷甾醇比同浓度的β-谷甾醇的抑制率要小。
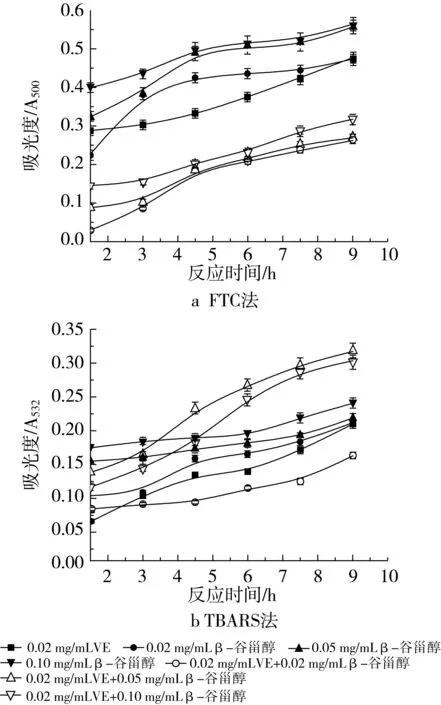
图7 不同浓度β-谷甾醇和0.02 mg/mL VE抗氧化活性的研究
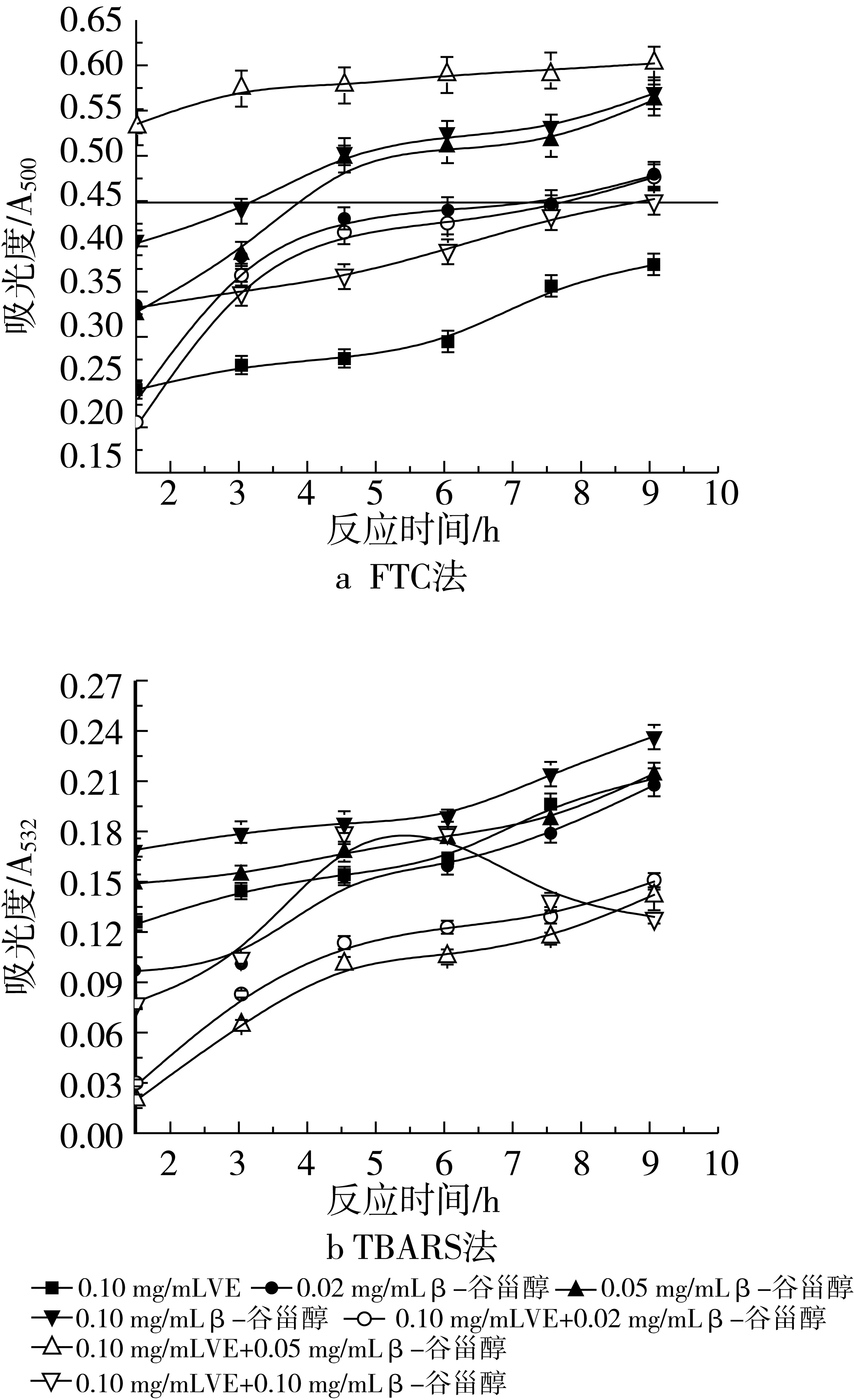
图8 不同浓度β-谷甾醇和0.10 mg/mL VE抗氧化活性
图7b和图8b是用TBARS法所测得的结果。当与0.02 mg/mL VE协同作用时,只有在体系中添加了0.02 mg/mL β-谷甾醇才显示出低于同浓度β-谷甾醇或VE单独使的吸光度值。若在体系中添加0.05 mg/mL或0.10 mg/mL β-谷甾醇,在反应初期的1.5~3 h内出现了低于同浓度β-谷甾醇单独作用的吸光度值的现象,但随着反应的不断进行,吸光度值也明显增加以至超出了相同浓度β-谷甾醇的吸光度值。3种浓度配比的抑制率分别是56.11% (0.02 mg/mL β-谷甾醇+0.02 mg/mL VE)、12.50%(0.05 mg/mL β-谷甾醇+0.02 mg/mL VE)和16.39%(0.10 mg/mL β-谷甾醇+0.02 mg/mL VE)。通过加和法计算表明,0.02 mg/mL VE的加入不使复合抗氧化剂显示协同作用。当与0.10 mg/mL VE共同作用时,出现了不同于上述的现象,0.02 mg/mL β-谷甾醇+0.10 mg/mL VE和0.05 mg/mL β-谷甾醇+0.10 mg/mL VE这2种组合使得乳状液氧化的进程变缓,抑制率达到了58.06%和60.28%,而0.10 mg/mL VE+0.10 mg/mL β-谷甾醇的作用却出现在反应的4.5~6 h时,吸光度值达到了最高值,但反应的继续进行使得吸光度值呈下降趋势,此种配比的抗氧化剂的总抑制率也达到了57.58%。通过与0.02 mg/mL和0.10 mg/mL VE单独作用的抑制率(41.11%和42.78%)比较可发现,0.10 mg/mL VE的加入仍旧不使复合抗氧化剂显示协同作用,但其抑制率高于同浓度下β-谷甾醇或VE的抑制率。
2.3.2 大豆磷脂脂质体
图9a为在磷脂体系中β-谷甾醇与0.001 6 mg/mL VE共同作用时的抗氧化性能,随着VE的加入,抗氧化活性有较大提高,例如,各浓度的吸光度值从β-谷甾醇单独作用时的0.265、0.270和0.279变化到0.166、0.172和0.143,说明了β-谷甾醇和VE的共同作用具有比单一β-谷甾醇作用时更好的抗氧化活性。不同浓度配比的抑制率分别由22.51%(0.001 6 mg/mL β-谷甾醇)、21.05%(0.004 mg/mL β-谷甾醇)和18.42%(0.008 mg/mL β-谷甾醇)升高到51.46% (0.001 6 mg/mL β-谷甾醇+0.001 6 mg/mL VE)、49.71%(0.004 mg/mL β-谷甾醇+0.001 6 mg/mL VE)和58.19%(0.008 mg/mL β-谷甾醇+0.001 6 mg/mL VE)。采用加和法考察协同作用,不难看出,只有0.008 mg/mL β-谷甾醇和0.001 6 mg/mL VE共同作用时才显示抗氧化协同增效作用。由图10a所示的过氧化物浓度变化趋势同样可以看出,当VE的添加量增加到0.008 mg/mL时,仍具有2种抗氧化剂的共同作用比单一抗氧化剂作用时好的抗氧化活性的特征,但与添加0.0016 mg/mL VE相比,抑制率略有下降,分别为42.11% (0.001 6 mg/mL β-谷甾醇+0.008 mg/mL VE)、40.35%(0.004 mg/mL β-谷甾醇+0.008 mg/mL VE)和39.77%(0.008 mg/mL β-谷甾醇+0.008 mg/mL VE)。采用加和法考察其协同作用,结果表明该浓度的VE不显示协同作用。
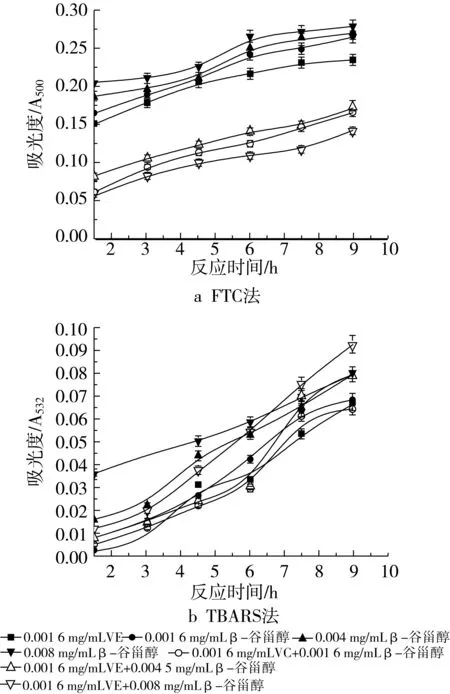
图9 不同浓度β-谷甾醇和0.0016 mg/mL VE抗氧化活性的研究
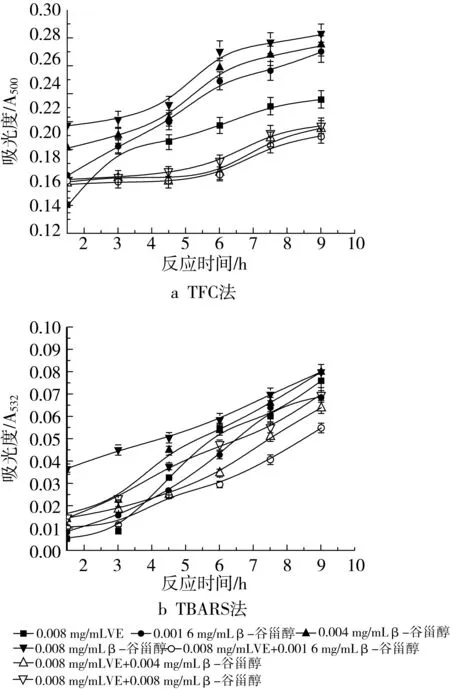
图10 不同浓度β-谷甾醇和0.008 mg/mL VE抗氧化活性的研究
图9b和图10b是在VE的添加量分别为0.001 6 mg/mL和0.008 mg/mL时用TBARS法所测得的结果。无法看出VE的加入是否提高了β-谷甾醇的抗氧化能力,因为吸光度-时间曲线的差异不十分明显,导致了不同组合的抗氧化剂具有相近的抗氧化活性。通过抑制率的计算,添加0.001 6 mg/mL VE时的抑制率分别是49.64%(0.001 6 mg/mL β-谷甾醇+0.001 6 mg/mL VE)、42.34%(0.004 mg/mL β-谷甾醇+0.001 6 mg/mL VE)和32.85%(0.008 mg/mL β-谷甾醇+0.0016 mg/mL VE),添加0.008 mg/mL VE时的抑制率分别是60.58%(0.001 6 mg/mL β-谷甾醇+0.008 mg/mL VE)、54.01%(0.004 mg/mL β-谷甾醇+0.008 mg/mL VE)和49.64%(0.008 mg/mL β-谷甾醇+0.008 mg/mL VE),经粗略计算,β-谷甾醇与0.008 mg/mL VE共同作用时,抑制大豆磷脂脂质体氧化的能力比β-谷甾醇单独作用时略微增强,但并不显著,而且也不显示协同增效作用。
3 结论
3.1 在试验的2个复杂体系中,用FTC法和TBARS法测得不同浓度β-谷甾醇均具有抗氧化活性,但不同体系中其抗氧化活性并不相同。随着β-谷甾醇浓度升高,抗氧化能力逐渐降低。
3.2 在考察β-谷甾醇与VC的协同作用时发现,在葵花油乳状液中,FTC法测得VC的加入使3种浓度β-谷甾醇抗氧化能力明显提高,其中,0.05 mg/mL β-谷甾醇+0.02 mg/mL VC和0.10 mg/mL β-谷甾醇+0.10 mg/mL VC的抗氧化活性最好。在大豆磷脂脂质体中,FTC法测得添加VC后,0.008 mg/mL β-谷甾醇的抗氧化效果最好,其次是0.001 6 mg/mL β-谷甾醇,效果最差的是0.004 mg/mL β-谷甾醇添加量。TBARS法测得0.001 6 mg/mL β-谷甾醇和0.008 mg/mL VC共同作用表现出较强的协同增效作用。
3.3 在考察β-谷甾醇与VE的协同作用时发现,在大豆磷脂脂质体中,FTC法测得的0.008 mg/mL β-谷甾醇和0.001 6 mg/mL VE共同作用显示抗氧化协同增效作用。
这说明β-谷甾醇作为一种抗氧化剂具有较好的应用前景,对其药理学研究和进一步应用于食品和生命体的研究提供理论依据,并对食品科学、生命科学和深入理解抗氧化剂的保健功能具有参考价值。
[1]Awad A B, Fink C S, Trautwein E A, et al. β-sitosterol stimulates ceramide metabolism in differentiated caco2 cells [J]. Journal of Nutritional Biochemistry, 2005, 16: 650-655[2]Toivo J, Phillips K, Lampi A M, et al. Determination of sterols in foods: recovery of free, esterified, and glycosidic sterols [J]. Journal of Food Composition and Analysis, 2001, 14: 631-643
[3]Baker V A, Herpurn P A, Kennedy S J, et al. Safety evaluation of phytosterol esters. part l. Assessment of oestrogenicity using a combination of in vivi and in vitro assays [J]. Food and Chemical Toxicology, 1999, 37: 13-22
[4]Patrick J D, Bounic. Sterols and sterolins: new drugs for the immune system [J]. Therapeutic Focus Reviews, 2002, 7(14): 775-778
[5]Moon E J, You M L, Lee O H, et al. A novel angiogenic factor derived from Aloe vera gel: β-sitosterol, a plant sterol [J]. Angiogenesis, 1999, 3: 117-123
[6]梁梦兰.一些新型非离子表面活性剂的制备和应用[J]. 日用化学品科学,2000,1(23):170-175 Liang Menglan. Some novel nonionic surfactants-preparation and applications [J]. Detergent and Cosmetics, 2000, 1(23):170-175
[7]彭莺,刘福祯,高欣.天然植物甾醇的应用与提取工艺[J]. 化工进展,2002,21(1):49-53 Peng Ying, Liu Fuzhen, Gao Xin. Research on and application of phytosterols [J]. Chemical Industry and Engineering Progress, 2002,21(1):49-53
[8]吴时敏,吴谋成.植物甾醇的研究进展与趋向(II)-植物甾醇的应用基础和开发研究[J]. 中国油脂,2002,27(3): 60-63 Wu Shimin, Wu Moucheng. Advancement and tendency on phytosterol research (Ⅱ)-applied base and exploiture [J]. China Oils and Fats, 2002, 27(3):60-63
[9]Chang L W, Yen W J, Huang S C, et al. Antioxidant activity of sesame coat [J]. Food Chemistry,2002, 78: 347-354
[10]Yen W J, Chang L W, Duh P D. Antioxidant activity of peanut seed testa and its antioxidative component, ethyl protocatechuate [J]. Food Science and Technology,2005, 38: 193-200
[11]Aihua Z, Qiang G, Quan G H, et al. Interaction of malachite green with iecithin iiposomes [J]. Colloids and Surfaces A: Physicochem. Eng Aspects, 2003, 224: 75-82
[12]Mitsuda H, Yasumoto K, Iwami K. Antioxidative action of indole compounds during the autoxidation of linoleic acid [J]. Eiyo Shokuryou, 1966, 45: 13-19
[13]Yen G C, Hsieh C L. Antioxidant activity of extracts from Du-zhong (Eucommiaulmoides) toward various lipid peroxidation models in vitro [J]. Journal of Agricultural and Food Chemistry,1998, 43: 574-578
[14]Kosugi H, Kojima T, Kikugawa, K. Thiobarbituric acid reactive substances from peroxidized lipids [J]. Lipids,1989, 24: 873-881
[15]Satue M T, Huang S W, Frank E N. Effect of natural antioxidants in virgin olive oil on oxidative stability of refined, bleached, and deodorized olive oil [J]. Journal of the American Oil Chemists Society,1995, 72, 1131-1137
[16]左玉,李鹏鸽,谢文磊.胆固醇在复杂体系中的抗氧化作用[J]. 食品与发酵工业,2014,40(8):100-108 Zuo Yu, Li Pengge, Xie Wenlei. The study of antioxidant activities of cholesterol in complicated systems [J]. Food and Fermentation Industries, 2014, 40(8):100-108
[17]Dziedzic S Z,Hudson B J F. Phosphatidyl ethanolamine as a synergist for primary antioxidants in edible oils [J]. Journal of the American Oil Chemists Society, 1984, 61: 1042-1045
[18]Saito H, Ishihara K. Antioxidant activity and active sites of phospholipids as antioxidants [J]. Journal of the American Oil Chemists Society,1997,74:1531-1536
[19]左玉,冯丽霞,朱瑞涛,等. 欧李红色素在复杂体系中抗氧化作用的研究[J]. 食品与发酵工业,2015,41(5):150-156 Zuo Yu, Feng Lixia, Zhu Ruitao, et al. The study of antioxidant activities of the red pigments extracted from Cerasus humilis in complicated systems [J]. Food and Fermentation Industries, 2015, 41(5):150-156.
Antioxidant Activities of β-Sitosterol in Complicated Systems
Zuo Yu1Zhu Ruitao1Feng Lixia1Zhang Caifeng1,2Xie Wenlei3
(Department of Chemistry, Taiyuan Normal University1, Taiyuan 030031) (Humic Acid in Shanxi Province Engineering Technology Research Center2, Taiyuan 030031) (School of Chemistry and Chemical Energineering, Henan University of Technology3, Zhengzhou 450001)
The antioxidant activity of β-sitosterol was investigated in heterogeneous food system and heterogeneous biological system, and the influence of VC and VE on antioxidant activity was studied. The results indicated that β-sitosterol with different concentrations had a certain antioxidant activity, but the antioxidant capacity was decreased with the increasing of concentration. It was clear that antioxidant activities of β-sitosterol with three concentrations were significantly increased by the addition of VC in sunflower oil-in-water emulsion system under FTC method during the synergistic interactions between β-sitosterol and VC. It was shown that the combination of 0.001 6 mg/mL β-sitosterol and 0.008 mg/mL VC in soybean PC liposome resulted in strong synergistic interactions by using TBARS test and the combination of 0.008 mg/mL β-sitosterol and 0.001 6 mg/mL VE had slightly synergistic interactions by using FTC assay. The combination of other β-sitosterol and α-tocopherol/ascorbic acid would not lead to synergistic interactions.
β-sitosterol, lipid peroxidation, antioxidant activity, synergistic effects
2015-07-10
左玉,女,1982年出生,讲师,应用化学和天然产物的研究与应用
谢文磊,男,1965年出生,教授,应用化学和天然产物的研究与应用
O69
A
1003-0174(2017)02-0080-08
