黑龙江省芸豆主栽品种蛋白质功能性质分析
2017-08-07郑文彬张洪微张丽萍崔素萍
郑文彬 韩 晶 王 颖 张洪微 张丽萍 崔素萍
( 黑龙江八一农垦大学食品学院,大庆 163319)
黑龙江省芸豆主栽品种蛋白质功能性质分析
郑文彬 韩 晶 王 颖 张洪微 张丽萍 崔素萍
( 黑龙江八一农垦大学食品学院,大庆 163319)
为了解黑龙江省芸豆蛋白质功能特性,利用荧光及紫外分光光度法,对En、紫荆花、白沙克、日本红、西班牙白、英国红6种芸豆蛋白质功能性质进行了测定分析。研究表明,在pH 4.0左右时,6种芸豆蛋白质溶解性最低;白沙克芸豆蛋白质游离巯基及总巯基含量均最高,分别为41.3 μmol/g和75.2 μmol/g;En芸豆蛋白质疏水性最强;6种芸豆蛋白质质量浓度为5 g/100 mL时,起泡力均最大,起泡稳定性随蛋白质浓度的增加而增加,随时间的延长而降低;6种芸豆蛋白质质量浓度在1~7 g/100 mL之间,随着蛋白质浓度的增大,乳化性及乳化稳定性增大;随着蛋白质浓度的增大,6种芸豆蛋白质吸水能力增强,吸油能力随着蛋白质所占比例的减小而增强;芸豆蛋白质质量浓度为11 g/100 mL时,6种芸豆蛋白质均产生凝胶现象;芸豆蛋白质的各功能特性具有一定的相关性。
芸豆蛋白质 功能性质 起泡力 乳化性 吸油性
芸豆是豆科菜豆属,是一种小宗杂粮作物,芸豆具有很高的营养和药用价值,其中蛋白质质量分数为20.29%~27.73%[1]。为了提高芸豆蛋白质的加工品质,国内外很多学者对芸豆蛋白质的功能特性进行了研究。尹寿伟等[2]在使用微射流技术对白芸豆分离蛋白进行处理时,发现被处理后芸豆分离蛋白的溶解性和乳化性均有所改善而不影响其蛋白质本身特性。熊家艳等[3]研究发现花芸豆分离蛋白在pH 5时,持水量最低为87.7%,在pH 9时,持水量最高为95.4%。刘高梅等[4]研究了超声波处理对泾川白芸豆蛋白功能性的影响,当超声波功率在0~400 W时,泾川白芸豆蛋白的溶解度随超声波功率增加而逐渐提高。Wani等[5]通过对紫花芸豆蛋白水解后功能性质的研究发现,紫花芸豆胰蛋白酶水解物的溶解性、吸油性、吸水性和起泡力都显著增强。Yin等[6]研究发现,圆芸豆在受到外部高压时,其蛋白高级结构逐渐展开,巯基含量和二硫键含量明显增加,从而可使圆芸豆的凝胶性增强。
如能充分了解芸豆蛋白质的功能特性,可为芸豆的加工提供技术支持。黑龙江省是我国绿色农产品生产基地,芸豆种植面积位于全国之首,有关对黑龙江芸豆主栽品种蛋白质功能性质的研究鲜见报道。本研究拟以黑龙江芸豆主栽品种En、紫荆花、白沙克、日本红、西班牙白、英国红6种芸豆为材料,研究6种芸豆蛋白质的功能特性,以期为芸豆等杂粮作物的开发和产业化提供依据。
1 材料与方法
1.1 试验材料
En、紫荆花、白沙克、日本红、西班牙白、英国红6种不同品种芸豆:黑龙江省农垦科学院。花生油:山东鲁花集团有限公司。
1.2 试剂与仪器
Ellman试剂:将DTNB( 5,5′-二硫代-2-硝基苯甲酸)溶入pH 7.0的磷酸缓冲溶液配制成1×10-3mol/L溶液;Tris-Gly缓冲液:将Tris与甘氨酸按1∶4.8的比例混合后溶于水配制成0.025 mol/L溶液。
RF-5301PC型荧光分光光度计:日本岛津公司;SPECORD© 200 PLUS紫外分光光度计:德国耶拿分析仪器股份公司;CHRISTALpha型冷冻干燥机:德国Marin Christ公司。
1.3 试验方法
1.3.1 原料预处理
将大豆和6种芸豆用粉碎机粉碎制粉,过60目筛子后,立即使用。
1.3.2 芸豆蛋白质的提取
将芸豆粉按1∶10(m/V)的比例溶于蒸馏水中,用2 mol/L NaOH 溶液调芸豆粉溶液至pH 9.0 ,在50 ℃下,搅拌1 h,然后离心(3 500 r/min,离心30 min),取上清液备用。再按1∶8(m/V)比例,在沉淀中加蒸馏水进行二次提取[8]。合并2次离心后的上清液,室温下用1.0 mol/L HCL调节到pH4.4,在4 ℃下搅匀2 h,在4 000 r/min下,离心20 min,弃其上清液,所得沉淀经2次蒸馏水洗后,冷冻干燥得到芸豆蛋白质。
1.3.3 芸豆蛋白质功能性质测定
1.3.3.1 芸豆蛋白质溶解性测定
将芸豆粉和对照大豆粉用25 mLPBS磷酸缓冲溶液制备成质量分数为5%,pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0梯度的蛋白分散系,室温下搅拌1 h,3 000 r/min下离心20 min,取上清液,用凯氏定氮法(GB 75009.5—2010食品中蛋白质的测定)测定上清液及样品中总蛋白质含量[9]。蛋白质的溶解度用氮溶解度指数NSI(%)表示。
1.3.3.2 芸豆蛋白质表面游离巯基含量及总巯基含量的测定
将蛋白质质量分数为5%的大豆蛋白对照及芸豆蛋白的豆浆,在10 ℃、3 000 r/min下离心20 min,取上清液1 mL,加入3 mL Tris缓冲液和0.1 mL Ellman溶液,混匀后于25 ℃恒温水浴中保温5 min,用紫外分光光度计在412 nm波长下测定吸光值。以不加样品而加Ellman溶液作为试剂空白,以不加Ellman溶液而加样品作为样品空白[10]。表面巯基含量公式:
式中:A412为除去样品空白和试剂空白后的吸光值;D为稀释倍数;13 600为摩尔吸光系数/L/(mol·cm);C为样品中蛋白质含量/g/L。
取2 mL 5%的蛋白质溶液,向其加入0.2%的β-巯基乙醇后振荡摇匀2 h,加入4 mL 12%三氯乙酸(TCA)沉淀蛋白质1 h,3 000 r/min离心10 min,用12%TCA洗涤沉淀4次,将洗涤后的沉淀溶于3 mL Tris-Gly缓冲液中,取其2 mL液体,测总疏基含量[11]。
1.3.3.3 芸豆蛋白质表面疏水性测定
测试探针为8-苯胺基-1-萘磺酸(ANS),将蛋白质含量为5 mg/100 mL的大豆蛋白对照及芸豆蛋白的豆浆,在10 ℃,3 000 r/min下离心20 min,将其上清液蛋白质浓度稀释至0.04~0.2 mg/mL 之间。取不同浓度稀释样品2 mL,在390 nm的激发波长和470 nm的发射波长下分别测定样品的荧光强度(FI0)和大豆蛋白对照及芸豆蛋白加入10 μL ANS溶液(8 mmol/L)后的荧光强度(FI1),FI1和FI0的差值即为FI[12],以蛋白质浓度为横坐标,FI为纵坐标做图,曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数,记为S0。
1.3.3.4 芸豆蛋白质起泡力和起泡稳定性测定
取5 mL不同质量浓度的芸豆蛋白粉悬浮液(1、3、5、7、9 g/100 mL)及大豆蛋白质对照悬浮液,用高速分散器10 000 r/min搅打2 min,记录搅打前、后的体积。起泡力用体积增加的百分比表示。随后,将搅打起泡的样品静置20、40、60和120 min,记录不同时间段内的体积[7]。
式中:FC为起泡力/%;FS为起泡稳定性/%;V1为搅打前的体积/mL;V2为搅打后的体积/mL;V3为搅打后的泡沫体积/mL;V4为放置一段时间后的泡沫体积/mL。
1.3.3.5 芸豆蛋白质乳化性及乳化稳定性测定
称取一定量芸豆蛋白质和大豆蛋白质样品加入蒸馏水,分别配制成1、3、5、7 g/100 mL溶液30 mL,用分散器以10 000 r/min速度匀浆30 s,随后加入5 mL花生油,匀浆30 s,再加入5 mL花生油,再匀浆90 s,测定乳浊液体积V1。在2 500 r/min下离心5 min,测量乳化层体积V2。随后85 ℃下加热15 min、冷却,再在2 500 r/min下离心5 min,记录加热后剩余乳化层体积V3[13]。
式中:EA为乳化性/%;ES为乳化稳定性/%;V1为乳浊液体积/mL;V2为离心后乳化层体积/mL;V3为加热再离心后乳化层体积/mL。
1.3.3.6 芸豆蛋白质吸油性和吸水性测定
称取0.5 g芸豆蛋白质加入已称重m1的离心管中,用蒸馏水配制成质量浓度为2、4、6、8、10 g/100 mL的溶液,分散、摇匀,室温静置30 min,期间每隔5 min振荡1次,3 800 r/min离心30 min,弃去上清液,将离心管于50 ℃下干燥25 min,脱去附着在管壁的残余水分,称质量为m2[14]。
式中:WAC为吸水能力;m为样品质量/g;m1为离心管质量/g;m2为离心管和沉淀物质量/g。
称取1 g芸豆蛋白质与花生油按照1∶6、1∶8、1∶10、1∶12、1∶14质量与体积比例混匀,加入已称重的离心管m3中,搅拌1 min,室温静置30 min,3 800 r/min下离心30 min,用吸管吸去上层液层,再将离心管倒置25 min,吸除流出的油脂,称质量m4[15]。
式中:OAC为吸油能力;m为样品质量/g;m3为离心管质量/g;m4为离心管和沉淀物质量/g。
1.3.3.7 芸豆蛋白质最低凝胶点测定
取0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 g芸豆蛋白质溶于10 mL pH 7.0的0.1 mol/L NaCl溶液中,用磁力搅拌器搅拌20 min,制成2、4、6、8、10、12、14、16、18 g/100 mL的溶液,再用0.1 mol/L NaOH或HCl将溶液调至pH为7.0。经过90 ℃水浴中加热30 min,冷却至室温,于4 ℃条件下静置12 h,观察凝胶情况:把试管倒置,凝胶不流出来的样品定义为“+”,可形成自持凝胶;反之为“-”,不能形成凝胶[16]。
1.3.4 芸豆蛋白质功能性之间的相关性分析
利用SPSS12.0分析系统对芸豆蛋白质功能性之间的相关性进行统计分析。
1.4 统计分析方法
所有试验均设3次重复,取平均值,利用SPSS12.0分析系统对数据进行统计分析。
2 结果分析
2.1 芸豆蛋白质溶解性分析

图1 6种芸豆蛋白质溶解性
6种芸豆蛋白质溶解性见图1。在pH 4.0时,溶解性均最小,说明6种芸豆蛋白质的等电点均在pH 4.0左右。6种芸豆蛋白质的溶解性相似,该测量结果与毛豆、蚕豆、扁豆等其他豆类测量结果相似[17-18]。在pH 10.0时,蛋白质的溶解性均最大,其中,紫荆花芸豆蛋白质的溶解性为59.2%,略大于其他品种,而西班牙白芸豆蛋白质溶解性最小为52.3%。
2.2 芸豆蛋白质表面游离巯基含量及总巯基含量分析
6种芸豆蛋白质游离巯基含量及总含量见表1。

表1 6种芸豆蛋白巯基含量
由表1可知,6种芸豆蛋白质的游离巯基含量在28.4~41.3 μmol/g之间,而总巯基含量在50.3~75.2 μmol/g之间。6种芸豆品种间蛋白质游离巯基含量和总巯基含量差别较大,其中西班牙白游离巯基含量和总巯基含量均最小,而白沙克含量均最大;且西班牙白和日本红与其他品种的蛋白游离巯基含量有较显著性差异(P<0.05),而英国红、紫荆花、En芸豆之间差异不显著。其中,白沙克、英国红的游离巯基含量及总巯基含量比较高,且各品种间总巯基含量差异显著。
2.3 芸豆蛋白质表面疏水性分析
6种芸豆蛋白质的疏水性指数结果见表2,各品种间蛋白质疏水性指数差异显著(P<0.05)。一般来说,蛋白质的表面疏水性越强,它的亲水性就越弱,表现为溶解度越小。由疏水性指数可知,En与西班牙白芸豆蛋白质疏水性指数较大,所以其溶解性较小,而紫荆花指数较小,所以其溶解性较大。这与2.1中溶解性的测定结果相符合。
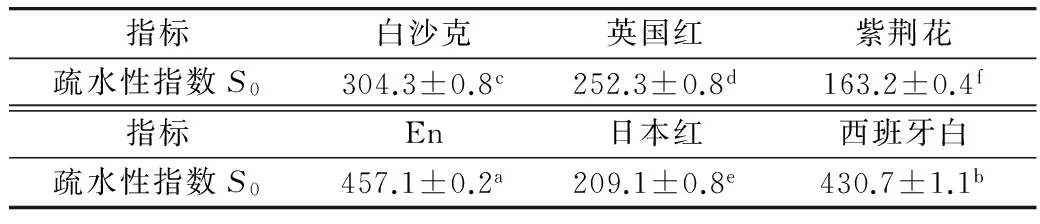
表2 6种芸豆蛋白质疏水性指数
2.4 芸豆蛋白质起泡力和起泡稳定性分析
6种芸豆蛋白质的起泡力如图2所示。
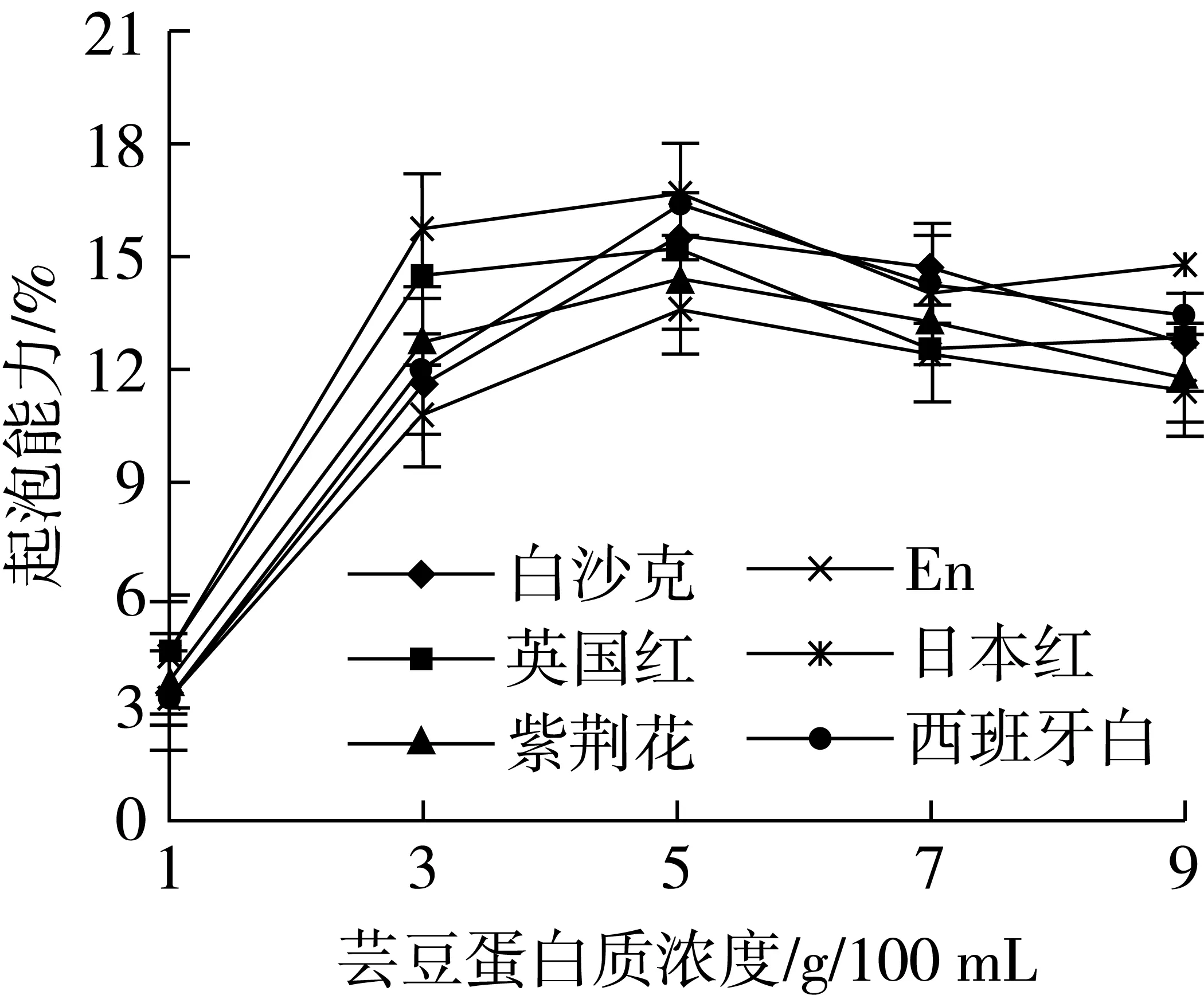
图2 6种芸豆蛋白质的起泡力
由图2可知,当芸豆蛋白质质量浓度为5 g/100 mL左右时,6种芸豆蛋白质的起泡力均达到最大值,分别为En13.62%、紫荆花14.31%、白沙克15.37%、日本红16.59%、西班牙白16.38%、英国红15.26%,日本红的起泡力最强,En的起泡力最弱;芸豆蛋白质溶液质量浓度在1~5 g/100 mL之间时,起泡力随着蛋白浓度的增大而增大,这是因为高浓度的蛋白质,其黏度也高,有助于在界面形成多层的黏合蛋白质膜[7]。当蛋白质浓度继续增加时,起泡力就随着浓度的增加而减小。同时如表3所示,不同品种在同一时间内,随着蛋白质浓度的增加,起泡稳定性逐渐增大,这是由于,当蛋白质浓度较大时,蛋白质之间的相互作用形成了较厚的吸附膜,这有助于泡沫的稳定。相同浓度下的芸豆蛋白质溶液的起泡稳定性随着时间的延长而降低,其中当溶液质量浓度为9 g/100 mL,时间为20 min时,英国红起泡稳定性最高为83.6%,En起泡稳定性最低为79.9%。
2.5 芸豆蛋白质乳化性及乳化稳定性分析
6种芸豆蛋白的乳化性如图3所示,蛋白质质量浓度在1~7 g/100 mL范围内,芸豆蛋白的乳化性随着蛋白浓度的增大而增强。芸豆蛋白的乳化稳定性如图4所示,蛋白的乳化稳定性也是随着蛋白浓度的增大而缓慢增强。其中,En的乳化性及乳化稳定性高于其他品种,因为蛋白质的疏水性和乳化性具有显著相关性,疏水作用对于形成稳定的乳化物很重要。因此,乳化性强的芸豆蛋白其疏水性也强。表3、图3的结果与原理基本相符。蛋白质的吸附特点是分级吸附,当浓度增大时,单分子吸附层变多分子吸附层,从而形成更加紧密且有强度的界面膜,使得其乳化能力和乳化稳定性增大[7]。
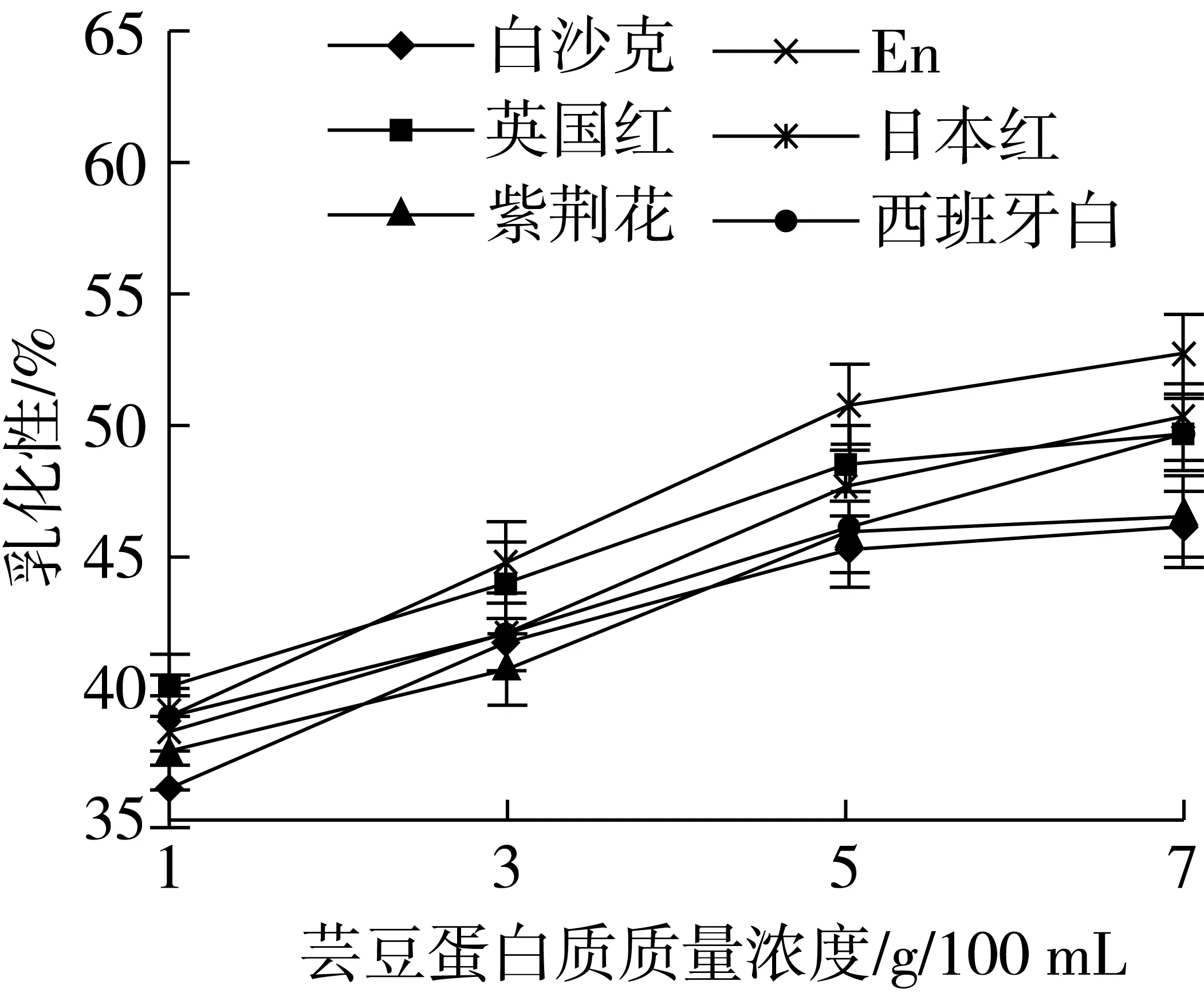
图3 6种芸豆蛋白的乳化性
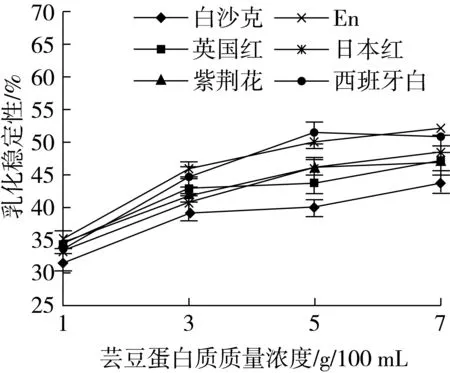
图4 6种芸豆蛋白的乳化稳定性
2.6 芸豆蛋白质吸油性和吸水性的测定结果
芸豆蛋白质的吸水能力如图5所示。6种芸豆蛋白质在试验浓度范围内的吸水能力随着溶液浓度的增大而增强,其溶液质量浓度在2~6 g/100 mL之间时,吸水能力增幅较大,之后趋于平缓。蛋白质的吸水能力源于其分子表面的极性基团和极性水分子的亲和性,极性基团越多,吸水性越强,溶解度也就越强。其中英国红和紫荆花的吸水能力较强,最大值分别为1.46%和1.44%,而其溶解度也是最大的。6种芸豆蛋白的吸油性如图6所示。在试验范围内随着油所占比例的增大,其吸油能力逐渐增强,但增幅较平缓。通常来说,蛋白质的疏水基团越多,疏水性越强,其吸油能力越强,同理它的溶解性就越弱。由2.3中疏水性测得的结果看,其中西班牙白、En的疏水性较强,吸油能力较强,它的溶解性最弱。相反英国红、紫荆花的疏水性较弱,吸油能力较弱,溶解性较强,基本符合测定结果。

表3 6种芸豆蛋白的起泡稳定性测定结果/%
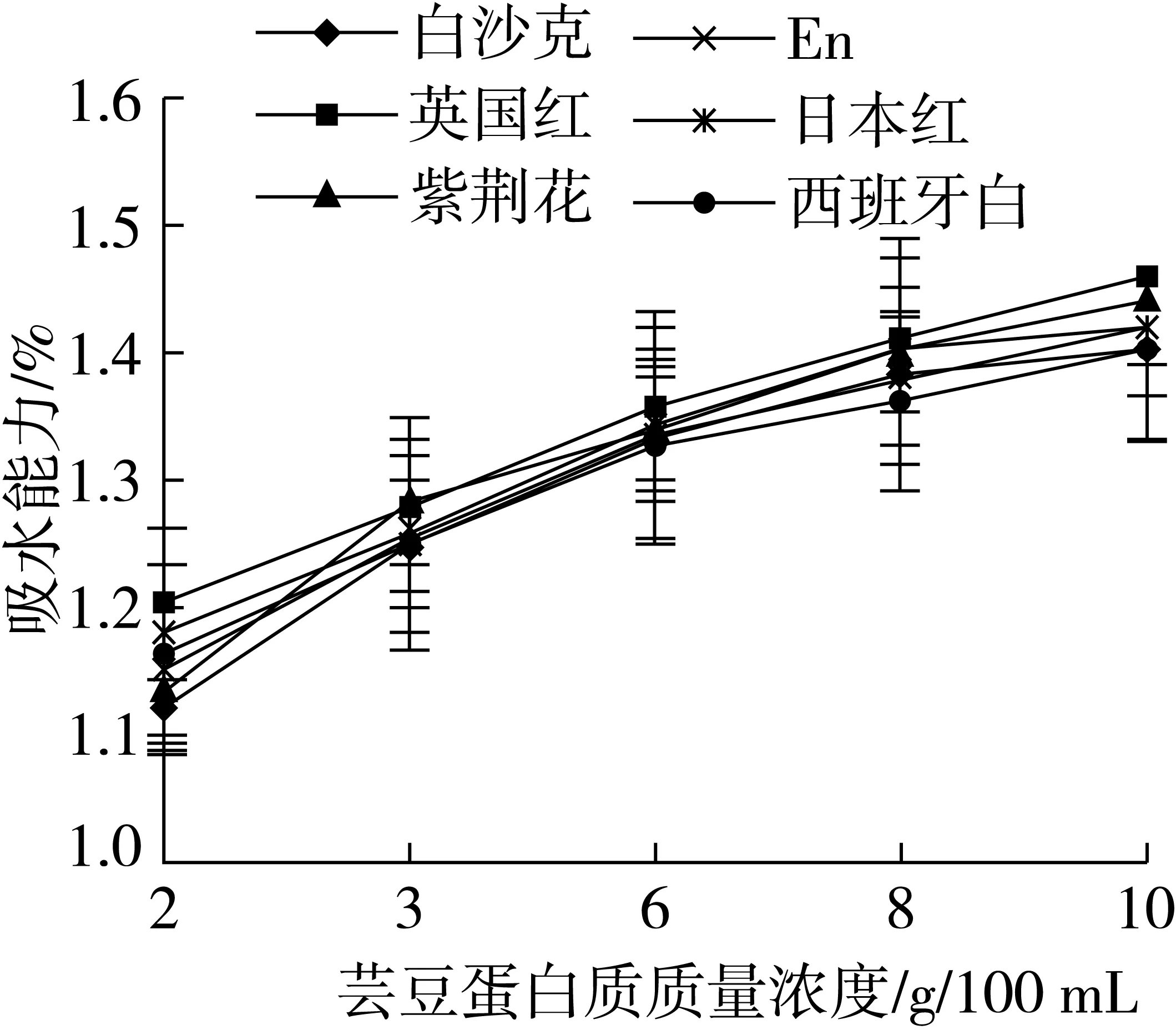
图5 6种芸豆蛋白的吸水能力

图6 6种芸豆蛋白的吸油能力
2.7 芸豆蛋白最低凝胶点的测定结果
芸豆蛋白质的凝胶情况如表4所示。蛋白质分散于水中形成胶体,且分子间相互聚集,形成相互作用力,即排斥力和吸引力。当排斥力小于吸引力时,分子间疏水相互作用加强,最终形成有空隙的立体网状结构,继而形成凝胶[19]。由表4可知,芸豆蛋白的最低凝胶质量浓度在10 g/100 mL左右。其中白沙克、En和西班牙白芸豆在蛋白质溶液质量浓度为11 g/100 mL时产生凝胶;英国红、紫荆花和日本红在蛋白质溶液质量浓度为10%时产生凝胶。

表4 6种芸豆蛋白的凝胶情况
2.8 芸豆蛋白质功能性之间的相关性分析
如表5所示,其中溶解性与吸水性呈正相关,二者相关性系数为0.304,如英国红与紫荆花芸豆蛋白质溶解度较强,最大值分别为58.1%和59.2%,而其吸水性也都较强,其最大值分别为1.46%和1.44%。芸豆蛋白质溶解性与疏水性呈反相关,其相关系数为-0.646,如紫荆花芸豆蛋白质溶解性较大,而其疏水性反而较小,疏水指数为163.2为最小。芸豆蛋白质的乳化性、吸油性和疏水性呈正相关,芸豆蛋白质中疏性越强,其吸油性、乳化性越大,如En芸豆,其疏水指数较大为457.1,而其吸油性和乳化性均较强,分别为5.41%和52.3%。蛋白质凝胶作用强弱通常受蛋白质浓度大小的影响,也就是受蛋白质溶解性的影响,如紫荆花、英国红芸豆蛋白质溶解性较大,所以较容易凝胶,西班牙白蛋白质溶解性较小而不易凝胶。芸豆蛋白质凝胶点与溶解性成反相关,其相关系数为-0.553。芸豆蛋白中游离巯基含量和乳化稳定性呈反相关,相关系数为-0.599,这是由于自由巯基不能在乳化过程中形成二硫键,降低了蛋白质与蛋白质之间的相互作用,削弱了蛋白质膜稳定脂肪的能力;而游离巯基含量与蛋白质凝胶点呈正相关,其系数为0.370,游离巯基越多,凝胶速率越差,凝胶弹性越差。由此可见,芸豆蛋白质的功能特性并非完全独立,而是相互影响、相互作用的。

表5 6种芸豆蛋白质功能性之间的相关性分析
3 讨论
黑龙江省6种芸豆主栽品种蛋白质各功能性质之间并非是相互独立、完全不同的,而是存在着相互关联作用。如芸豆蛋白质的溶解性与吸水性成正相关,而与疏水性成反相关,这主要涉及芸豆蛋白质与水分子之间的相互作用;芸豆蛋白质的乳化性、吸油性和疏水性呈正相关,并且这3项指标的高低与蛋白质表面疏水性指数的大小有一定的关系;蛋白质表面疏水性指数越高,其吸油性、乳化性越大,亲水性就越弱,表现为溶解度越小;芸豆蛋白质凝胶点与溶解性成反相关。
蛋白质功能性质大多数影响着食品感官质量,也对食品成分制备、食品加工或储存过程中的物理特性起重要作用。影响蛋白质功能性质的因素有很多,除蛋白质本身固有的物理化学性质如蛋白质分子的大小、形状、化学组成、结构等性质,食品在加工过程中的环境因素,加工方法也都影响蛋白质的功能性质[20]。因此,了解芸豆蛋白质的功能性质对芸豆的深加工具有一定的指导意义。
4 结论
4.1 黑龙江省芸豆主栽品种En、紫荆花、白沙克、日本红、西班牙白、英国红6种芸豆蛋白质的等电点接近pH 4.0。
4.2 6种芸豆蛋白质的起泡能力及起泡稳定性、乳化性及乳化稳定性、吸水能力及吸油能力等各项指标在品种间存在着差异,蛋白质疏水性指数品种间存在着显著差异(P<0.05)。
4.3 6种芸豆蛋白质的最低凝胶点的蛋白质质量浓度在11 g/100 mL左右。
4.4 6种芸豆蛋白质的溶解性与吸水性呈正相关,溶解性与疏水性呈反相关,乳化性与吸油性、疏水性呈正相关,蛋白质凝胶点与溶解性成反相关。游离巯基与乳化稳定性呈反相关,与蛋白质凝胶点呈正相关。
[1]柴岩, 冯佰利, 孙世贤. 中国小杂粮品种[M]. 北京:中国农业科学技术出版社, 2007: 1-20 Chai Y, Feng B L, Sun S X. Chinese varieties of small grains[M]. Beijing: China Agricultural Science and Technology Press, 2007: 1-20
[2]尹寿伟, 唐传核, 温其标. 微射流处理对芸豆分离蛋白构想和功能特性的影响[J].华南理工大学学报,2009, 37(10):114-116 Yin S W, Tang C H, Wen Q B. Micro-jet treatment on kidney bean protein isolate ideas and functional properties[J]. Journal of South China University of Technology, 2009, 37(10):114-116
[3]熊家艳,邓利玲,范超敏.黔江肾豆蛋白质提取工艺优化及其功能性质研究[J].食品科学, 2012,33(18):25-31 Xiong J Y, Deng L L, Fan C M. Protein extraction process optimization and functional properties of Qianjiang kidney bean[J]. Food Science, 2012,33(18):25-31
[4]刘高梅, 任海伟. 不同功率超声波对芸豆蛋白理化和功能性质的影响[J].中国粮油学报, 2012, 27(12):17-21 Liu G M, Ren H W. Effect of different power ultrasound on kidney bean protein physicochemical and functional properties[J]. Journal of The Chinese Cereals and Oils Association, 2012, 27(12):17-21
[5]Wani I A,Sogi D S,Shivhare U S. Physico-chemical and functional properties of native and hydrolyzed kidney bean (PhaseolusvulgarisL.) protein isolates [J]. Food Research International, 2014, 29(8): 336-345
[6]Yin Shouwei , Tang Chuanhe,Wen Qibiao . Functional properties and in vitro trypsin digestibility of red kidney bean (PhaseolusvulgarisL.) protein isolate: effect of high-pressure treatment[J]. Food Chemistry, 2008, 110(4): 938-945
[7]张丙云, 袁亚兰, 高瑜璟, 等. 芸豆蛋白的营养价值和功能特性研究[J]. 食品工业科技, 2010, 31(11): 347-350 Zhang B Y, Yuan Y L, Gao Y J, et al. Study on the nutritional value of beans and functional properties of proteins[J]. Science and Technology of Food Industry, 2010, 31(11): 347-350
[8]Wang C, Tian J,Wang Q. ACE inhibitory and antihypertensiveproperties of apricot almond meal hydrolysate[J]. European Food Research and Technology, 2011, 232(3):549-556
[9]Nakahara T,Sano A,Yamaguchi H, et al. Antihypertensive effect of peptide-enriched soy sauce-like seasoning and identification of its angiotensin I-converting enzyme inhibitory substances [J]. Journal of Agricultural and Food Chemistry,2009,58(2):821-827
[10]任海伟, 李志忠, 王鸣刚, 等. 超滤对芸豆蛋白酶解物抗氧化活性的影响[J]. 食品科学, 2009, 30(18):212-216 Ren H W, Li Z Z, Wang M G, et al. Effect of ultrafiltration on kidney bean protein hydrolyzate antioxidant activity[J]. Food Science, 2009, 30(18): 212-216
[11]Guan X, Yao H Y, Chen Z X,et al. Some functional properties of oat bran protein concentrate modified by trypsin [J].Food Chemistry, 2007, 101:163-170
[12]Beveridge T, Toma S J, Nakai S. Determination of SH-and SS-groups in some food proteins using ellman’s reagent [J].Journal of Food Science, 1974, 39:49-51
[13]Cui C, Zhou X S, Zhao M M, et al. Effect of thermal treatment on the enzymatic hydrolysis of chicken proteins [J]. Innovative Food Science & Emerging Technologies, 2009, 10(1): 37-41
[14]Cardamoen M, Puri N K. Spectrofluorimetric assessment of the surface hydrophobicity of proteins [J]. Biochemical Journal,1992,282(2):589-593
[15]Naczk M, Diosady L L,Rubin L J. Functional properties of canola meals produced by a two-phase solvent extraction systems [J]. Journal of Food Science, 1985, 50:1685-1692[16]Cepeda E, Villaran M C, Aranguiz. Functional properties of faba bean protein flour dried by spray drying and freeze drying [J].Journal of Food Engineering, 1998, 36:303-310[17]Lopea O P, Falomr C O, Vazquez M R O. Chickpea protein isolate: Physicochemical, functional and nutritional characterization [J].Journal of Food Science, 1991, 56(3):726
[18]李小华, 于新. 非洲山毛豆蛋白质组成及其功能特性研究[J]. 中国粮油学报, 2010, 25(7): 43-47 Li X H, Yu X. Study on composition and functional properties of proteins vogelii[J]. Journal of The Chinese Cereals and Oils Association, 2010, 25(7): 43-47
[19]Chen P G, Andrew J C, Stuart K J. Protein quality and physicfunctionality of Australian sweet lupin (Lupinusangustifoliuscv.Gungurru)protein concentrates prepared by isoelectric precipitation or ultrafiltration[J].Food Chemistry, 2003, 83:575-583
[20]阚建全, 庞杰, 刘欣, 等. 食品化学[M]. 北京:中国农业大学出版社, 2008: 63 Kan J Q, Pang J, Liu X, et al. Food chemistry[M]. Beijing :China Agricultural University Press, 2008: 63.
Analysis of Functional Properties of Protein of Main Cultivar Kidney Beans in Heilongjiang Province
Zheng Wenbin Han Jing Wang Ying Zhang Hongwei Zhang Liping Cui Suping
(College of Food Science,Heilongjiang Bayi Agricultural University, Daqing 163319)
In order to understand the functional properties of kidney bean protein in Heilongjiang Province, the functional properties of En, Zijinghua, Baishake, Japanese red, Spain white and British red protein were analyzed by fluorescence and ultraviolet spectrophotometry. Results showed that the solubility of six kinds of kidney bean protein was the lowest with pH around 4.0; the free thiol and total sulfhydryl content of Baishake were the highest, 41.3 μmol/g and 75.2 μmol/g, respectively; En had the strongest hydrophobic property; the foaming ability of six kinds was the largest when the six kinds of kidney bean protein concentration was approximately 5%, the foaming stability was increased with the increase of protein concentration, and decreased with the extension of time ; emulsifying ability and stability were increased with the increasing of protein concentration when the six kinds of kidney bean protein concentrations were among 1%~7%; with the increase of protein concentration, water absorbing capacity of six kinds of kidney bean protein was increased, while oil-absorbing ability was also increased with the decrease of the proportion of protein; six kinds of kidney bean protein produced gel phenomenon when the concentration was 11%.The different functional properties of kidney bean protein had certain relevance.This research provided the foundation for the deep processing of kidney bean varieties in Heilongjiang Province.
kidney protein, functional property, foaming ability, emulsifying ability, oil absorbing ability
黑龙江省农垦总局科技局项目(HNK125B-13-03),“国家杂粮工程技术研究中心”组建项目(2011 FU125),黑龙江省教育厅项目(JG2012010 458)
2015-07-06
郑文彬, 男,1990年出生,硕士,粮食、油脂及植物蛋白工程
崔素萍,女,1968年出生,教授,食品生物化学和分子生物学
TS201.2
A
1003-0174(2017)02-0006-07
