高效液相色谱法测定苦檀子中β-谷甾醇的含量
——基于正交试验优化的皂化反应法△
2020-10-23孙倩男王栋周雪梅张建平内蒙古自治区药品检验研究院中蒙药标准研究实验室呼和浩特010020
孙倩男 王栋 周雪梅 张建平(内蒙古自治区药品检验研究院-中蒙药标准研究实验室呼和浩特010020)
苦檀子,豆科植物厚果崖豆藤Millettia pachycarpa Benth.的干燥成熟种子,植物多分布于福建、广西、四川、贵州、云南等地,具有攻毒止痛、消积杀虫之功效,常用于疥癣疮癞、痧气腹痛、小儿疳积。苦檀子中主要含有鱼藤酮和拟鱼藤酮,除此之外还含有β-谷甾醇(Ⅰ)、齐墩果酸(Ⅱ)、水黄皮素(Ⅲ)、厚果鸡血藤甲素(Ⅳ)等成分[1]。β-谷甾醇是植物甾醇类成分之一,存在于某些植物或种子中,具有降血脂、抗癌、抗炎症等作用,可作为苦檀子质量控制的指标。本实验用HPLC法测定苦檀子中β-谷甾醇含量,由于直接使用溶剂提取β-谷甾醇干扰物质较多,利用β-谷甾醇不发生皂化反应这一特点,通过皂化反应还原大部分干扰物质使得β-谷甾醇可以准确定量。同时通过单因素实验和正交实验对提取方法进行优化,使该法操作简便,定量准确。
1 材料与方法
1.1 材料与仪器:苦檀子(购于安国云天);β-谷甾醇标准品(纯度:97%)(中国食品药品检定研究院,批号:110851-201608);氢氧化钾(天津南开大学分校特种试剂实验厂,批号:20020410);乙醇(AR)(国药集团化学试剂有限公司,批号:20180223);甲醇(HPLC)(国药集团化学试剂有限公司,批号:WXBC6196V);乙腈(HPLC)(国药集团化学试剂有限公司,批号:WXBC6307V)。远红外鼓风干燥箱(天津市华北实验仪器有限公司);电子天平(赛多利斯科学仪器(北京)有限公司);低速大容量离心机(上海菲恰尔分析仪器有限公司);岛津LC-20A型高效液相色谱仪,配有紫外检测器。
1.2 实验方法
1.2.1 HPLC测定 β-谷甾醇的条件:Apollo C18反相色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-乙腈(体积比 60∶40),检测波长 210 nm(0~30 min),柱温 40 ℃;流速 1.2 mL·min-1,进样量 20 μL,以 50 μg·mL-1β-谷甾醇正己烷溶液进行外标法定量。
1.2.2 苦檀子中β-谷甾醇的提取:取苦檀子细粉2 g,加20 mL乙醇溶液和若干毫升50% KOH溶液,密封,剧烈振摇后在一定温度下皂化若干小时[2]。半小时内10 min振摇1次,之后每半小时振摇1次。趁热加入10 mL水,用10 mL正己烷振摇提取1次,再加正己烷振摇提取2次,每次5 mL,合并正己烷液,定容至25 mL容量瓶中,过0.45 μm有机微孔滤膜后,进行HPLC测定。
2 皂化法提取苦檀子中β-谷甾醇单因素实验及正交实验优化
苦檀子的特点是子叶占据种子的90%以上,含大量的油脂及糖类,测定β-谷甾醇干扰众多,采用皂化反应法将干扰物质反应除去。皂化反应主要影响因素为温度、时间、皂化液浓度,本研究以单因素实验及正交试验进行条件优化,得到最佳提取条件。
2.1 皂化法提取苦檀子中β-谷甾醇单因素实验
2.1.1 皂化液加入体积对β-谷甾醇提取量的影响:根据“1.2.2”在皂化温度为80℃,皂化时间为2 h时考察皂化液加入体积对β-谷甾醇提取量的影响。
2.1.2 皂化时间对β-谷甾醇提取量的影响:根据“1.2.2”在皂化温度为80℃,皂化液加入体积为10 mL时考察皂化时间对β-谷甾醇提取量的影响。
2.1.3 皂化温度对β-谷甾醇提取量的影响:根据“1.2.2”在皂化时间为2 h,皂化液加入体积为10 mL时考察皂化温度对β-谷甾醇提取量的影响。
2.2 苦檀子中β-谷甾醇提取工艺正交实验优化:选用L16(4,5)正交表对苦檀子中β-谷甾醇提取方法进行正交实验优化,正交实验因素及水平见表1。

表1 正交实验因素及水平Table 1 Orthogonal test factors and levels
3 方法学考察
3.1 线性:取 β-谷甾醇对照品溶液(50 μg·mL-1),分别进样 1 μL、2 μL、5 μL、10 μL、20 μL,以峰面积积分值为纵坐标,进样量(μg)为横坐标绘制标准曲线。β-谷甾醇对照品溶液绘制标准曲线,得到回归方程为Y=177784X+692.77,r=0.9999,表明β-谷甾醇对照品进样量在0.05~1 μg间线性关系良好。
3.2 精密度实验:取β-谷甾醇对照品溶液,按“1.2.1”项下色谱条件,连续进样6次,每次进样20 μL,记录峰面积。计算RSD值即相对标准偏差为0.51%,表明仪器误差小,精密度高。
3.3 重复性实验:取供试品粉末5份,每份2.000 g,精密称定。按照最优提取方法制备5份供试品溶液,按“1.2.1”项下色谱条件进样分析,测定β-谷甾醇峰面积,计算质量分数。计算RSD为1.10%,说明重复性好,供试品溶液制备方法可行。
3.4 稳定性试验:取按照最优提取方法制备的供试品试样液,室温放置,分别于 0 h、2 h、6 h、12 h 和 24 h 按“1.2.1”项下色谱条件进样分析,测定样品中β-谷甾醇含量的RSD值为1.70%,表明供试品在24 h内稳定。
3.5 回收率实验:按照最优提取方法,供试品样中分别加入0.5 mL、0.68 mL、0.82 mL 50 μg/mL的β-谷甾醇标准品溶液,正己烷定容至5 mL。按“1.2.1”项下色谱条件进行测定,计算苦檀子样品中的β-谷甾醇的回收率。平均回收率为118.8%,RSD为0.94%。
4 结果与讨论
4.1 HPLC测定苦檀子中β-谷甾醇含量:分别对β-谷甾醇标准品、苦檀子皂化后收集的正己烷液以及乙醇溶液直接超声提取的苦檀子样品进行HPLC测定,结果如图1所示。
由图1可知,苦檀子皂化后收集的正己烷液中β-谷甾醇(B)的保留时间(min)与β-谷甾醇标准品(A)一致,峰形对称,分离效果良好。而未经皂化反应直接用乙醇超声处理得到的苦檀子样品(C),由于干扰物质与β-谷甾醇保留时间相近,β-谷甾醇未能得到良好的分离。由此可见,利用皂化反应的原理,大部分干扰物质经皂化转化成醇和羧酸盐等水溶性物质,经过水与正己烷的萃取使得干扰物质与β-谷甾醇分离,实现了样品的净化。
4.2 皂化法提取苦檀子中β-谷甾醇单因素实验及正交试验优化
4.2.1 皂化液加入体积对β-谷甾醇提取量的影响:根据“1.2.2”,考察皂化液加入体积对β-谷甾醇提取量的影响,结果见图2。
由图2可知,随着加入皂化液的体积逐渐增大,β-谷甾醇的提取量逐渐升高。当加入的皂化液体积达到10 mL时,β-谷甾醇的提取量最大。继续加入皂化液,β-谷甾醇的提取量降低并趋于平稳。因此,选择最佳加入皂化液体积为10 mL。
4.2.2 皂化时间对β-谷甾醇提取量的影响:根据“1.2.2”,考察皂化时间对β-谷甾醇提取量的影响,结果见图3。
由图3可知,当加入皂化液的体积为10 mL,皂化温度为80℃时,随着皂化时间的延长,β-谷甾醇的提取量先升高;当皂化时间为2 h时,β-谷甾醇的提取量最大;继续延长皂化时间,β-谷甾醇提取量呈现下降趋势并趋于平稳。因此,选择最佳皂化时间为2 h。
4.2.3 皂化温度对β-谷甾醇提取量的影响:根据“1.2.2”,考察皂化温度对β-谷甾醇提取量的影响,结果见图4。
由图4可知,随着皂化温度升高,β-谷甾醇的提取量先升高后降低;当皂化温度为80℃时,皂化效果最佳,β-谷甾醇的提取量最高。因此,选择最佳皂化温度为80℃。
4.2.4 苦檀子中β-谷甾醇提取工艺正交试验优化:选用L16(4,5)正交表进行正交试验优化,正交实验结果见表2。
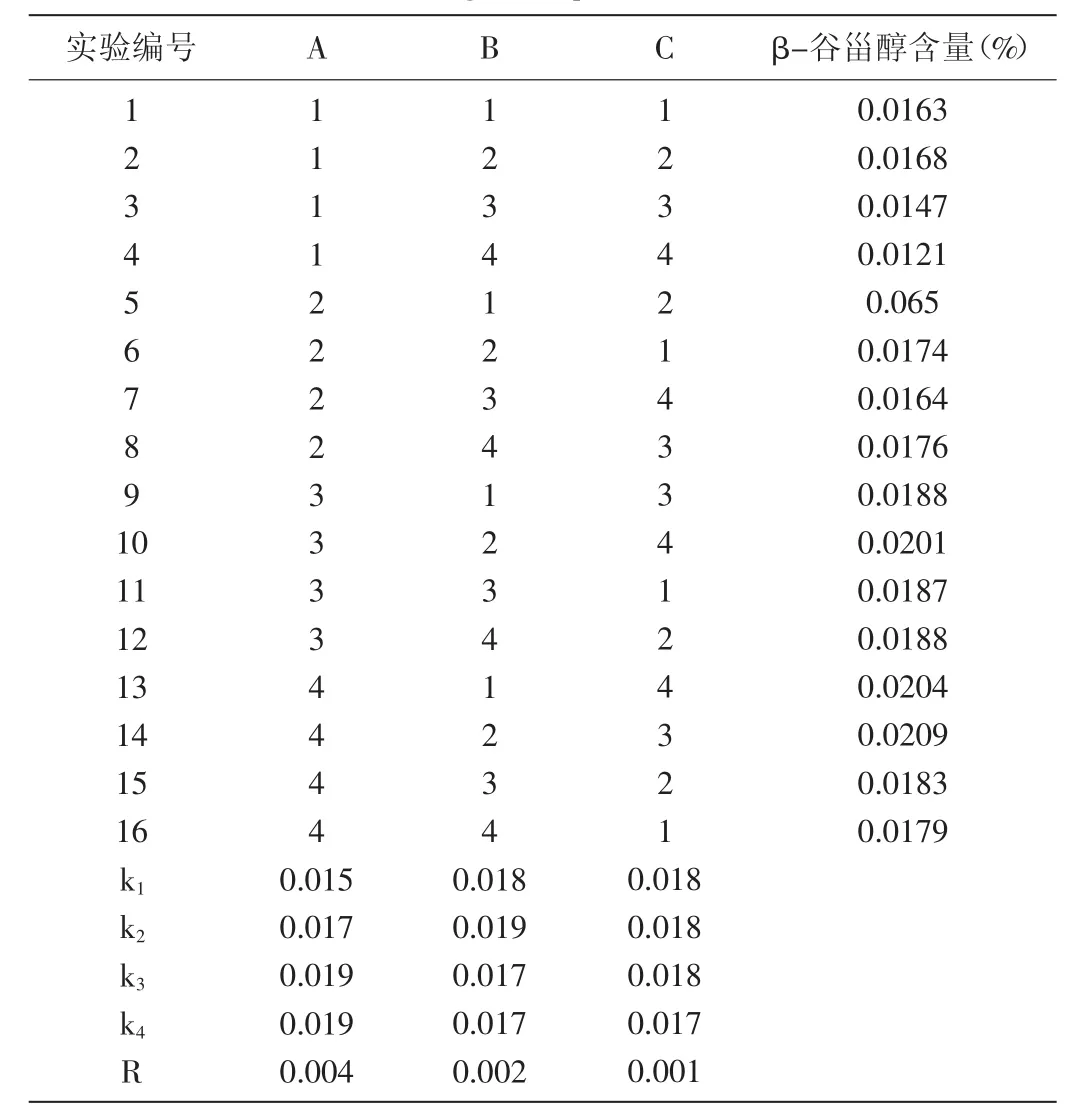
表2 正交实验结果Table 2 Orthogonal experimental results
由表2可知,RA>RB>RC,即皂化液加入体积>皂化时间>皂化温度。结合单因素实验结果优选出最佳工艺组合为A4B2C2,即最佳提取工艺条件为皂化液加入体积10 mL,皂化时间2 h,皂化温度80℃。
结合单因素实验与正交优化的结果,皂化液加入体积对β-谷甾醇提取量的影响最大,可能是由于皂化液的量直接决定皂化反应是否完全,从而最大程度除去样品中的干扰物质,使β-谷甾醇与其较好分离。而皂化时间过长会使β-谷甾醇部分氧化分解进而造成含量降低[3],所以控制皂化时间可保证β-谷甾醇在获得良好分离的基础上不发生氧化分解,保证提取量不被影响。由于皂化反应本身属于放热反应,所以只需要反应初期有一个适宜的温度加快反应,所以皂化温度对于β-谷甾醇提取量的影响最低。
5 结论
通过考察加入皂化液体积、皂化温度及皂化时间对高效液相色谱法测定苦檀子中β-谷甾醇提取量的影响,优化得到的最佳提取工艺条件为:加入10 mL皂化液,皂化时间2 h,皂化温度80℃。在最佳提取工艺条件下得到β-谷甾醇回收率为118.8%,RSD为0.94%,测得苦檀子中β-谷甾醇含量为0.020%。该方法操作简单,分离效果良好,结果准确。
