典型与不典型CIDP患者的临床与电生理特点
2017-08-07韩亚王家华卢祖能
韩亚 王家华 卢祖能
典型与不典型CIDP患者的临床与电生理特点
韩亚 王家华 卢祖能
目的 回顾性分析慢性炎性脱髓鞘性多发性神经病(CIDP)患者临床及神经电生理特点。方法 收集2012年1月~2014年12月的临床拟诊CIDP患者,对其临床和电生理资料进行回顾性分析;并按2010年EFNS/PNS指南推荐,将患者分为典型CIDP组与不典型CIDP组。结果 (1)符合纳入标准的46例患者中男27例;发病年龄12~77岁,平均年龄(52±15)岁;病程>2个月33例、≤2月13例,其中6例以急性形式起病;(2)典型CIDP患者28例(61%),不典型者18例(39%)。典型组脑脊液蛋白含量为(1.17±0.77) g/L,不典型组(0.92±0.53) g/L(t=2.39,P=0.01)。典型与不典型CIDP患者组正中、尺、胫神经的远端运动波幅分别为(5.30±3.34) mV vs (7.18±2.60) mV(t=2.14,P=0.04)、(4.74±3.00) mV vs (7.99±3.62) mV(t=3.17,P=0.003)、(2.89±2.58) mV vs (7.18±4.71) mV(t=3.20,P=0.004);正中神经感觉传导速度分别为(49.82±11.68)、(56.81±7.27) m/s(t=2.11,P=0.04);腓肠神经感觉波幅分别为(6.08±2.62)、(10.40±5.62) μV(t=2.63;P=0.01)。结论 典型CIDP仍是临床常见类型;与不典型者相比,典型CIDP患者脑脊液蛋白含量更高,运动与感觉传导速度更慢且波幅更低;这些生物学标志物可能具有一定的鉴别意义。
慢性炎性脱髓鞘性多发性神经病 临床特征 神经电生理
慢性炎性脱髓鞘性多发性神经病(chronic inflammatory demyelinating polyneuropathy,CIDP)是一种可能与免疫相关的慢性周围神经病,虽然近年来对其病理生理学机制有了进一步的认识,但其病因仍然尚不清楚。除了常见的表现形式外,其症状分布模式、疾病病程和残疾程度可呈多样性,早期以双下肢感觉障碍为主较多见,常在4 周后出现运动障碍,远端或近端肢体无力,8~10 周后感觉异常及运动障碍发展至高峰;部分患者可有颅神经受累,以面神经、舌咽神经、迷走神经受累相对较多;某些患者还可出现自主神经受累症状[1-2]。大多数情况下CIDP的自然病程不可预测,其临床过程可以是复发缓解、慢性进行性或单相型;有研究报道20%~35%的CIDP患者表现为复发型,而7%~50%的患者表现为单相型[3]。
2010年欧洲神经学联合会和周围神经协会(European Federation of Neurological Societies/Peripheral Nerve Society,EFNS/PNS)[4]指南定义了典型和不典型CIDP的临床标准;其中不典型CIDP包括纯感觉型、纯运动型、局灶性CIDP、远端获得性脱髓鞘性对称性神经病(distal acquired demyelinating symmetric neuropathy, DADS)以及多灶获得性脱髓鞘性感觉和运动神经病(multifocal acquired demyelinating sensory and motor neuropathy, MADSAMN)即Lewis-Sumner综合征等。
本研究旨在收集临床诊断的CIDP患者,对其临床与电生理特点进行回顾性分析,并对典型与不典型CIDP患者进行比较,探讨其可能存在的异同点,为临床诊疗提供依据的同时,进一步加深对疾病的认识和了解。
1 对象与方法
1.1 研究对象
收集2012年1月~2014年12月就诊于武汉大学人民医院神经内科,参照2010年EFNS/PNS[4]以及2010年中华医学会神经病学分会[5]指南的标准,临床拟诊为CIDP的患者纳入研究。
1.2 观察指标
(1)收集并整理患者的临床相关资料,包括性别、发病年龄、首诊病程、症状和体征及其分布情况、脑脊液、电生理特点、入院后初始治疗方案
(2)电生理主要分析常规神经传导检测。检测方法参照文献[6-9]。主要参数包括正中、尺、胫和腓总神经末端运动潜伏期(distal motor latency,DML)、运动传导速度(motor conduction velocity,MCV)、远端复合肌肉动作电位(distal compound muscle action potential,dCMAP)波幅;正中、尺、腓浅和腓肠神经的感觉传导速度(sensory conductionvelocity,SCV)和感觉神经动作电位(sensory nerve active potential,SNAP)波幅;正中、尺和胫神经F波的出现率和潜伏期。
(3)根据2010年EFNS/PNS 提出的CIDP指南标准[5],将患者分为典型CIDP和不典型CIDP,比较两者可能存在的异同点。
1.3 统计学处理

2 结 果
2.1 一般资料比较
3年共收集到58例临床拟诊CIDP的住院患者,排除了再次入院的12例患者(包括那些进行过免疫调节治疗、诊断有更改等)。符合本研究纳入诊断标准的患者共46例,其中男27例,女19例;发病年龄12~77岁,平均年龄(52±15)岁。
2.2 临床特点
首诊病程:5 d~72月,>2月33例、≤2月13例,其中6例以急性形式起病。
症状和体征:46例患者中四肢无力28例、双上肢无力2例、双下肢无力12例、单肢无力4例;26例有主观感觉障碍、4例肢体疼痛。体格检查显示颅神经受累11例,其中面神经麻痹5例、复视4例、吞咽困难/吐词不清2例;肌肉萎缩10例;肢体针刺觉或关节振动觉减弱/缺失10例。
腰椎穿刺脑脊液检查:46例患者中39例显示蛋白细胞分离,蛋白浓度为(1.07±0.69)(g/L)。
2.3 电生理所见
46例临床拟诊CIDP患者所测神经中异常电生理所占比例见表1。
2.4 典型及不典型CIDP比较
典型CIDP患者28例(61%);不典型者18例(39%),包括7例DADS,11例MADSAM,无1例纯运动或纯感觉亚型;2组患者临床资料的比较见表2,神经传导检测比较见表3。

表1 CIDP患者四肢神经传导检测的异常率 (n=46)[例(%)]
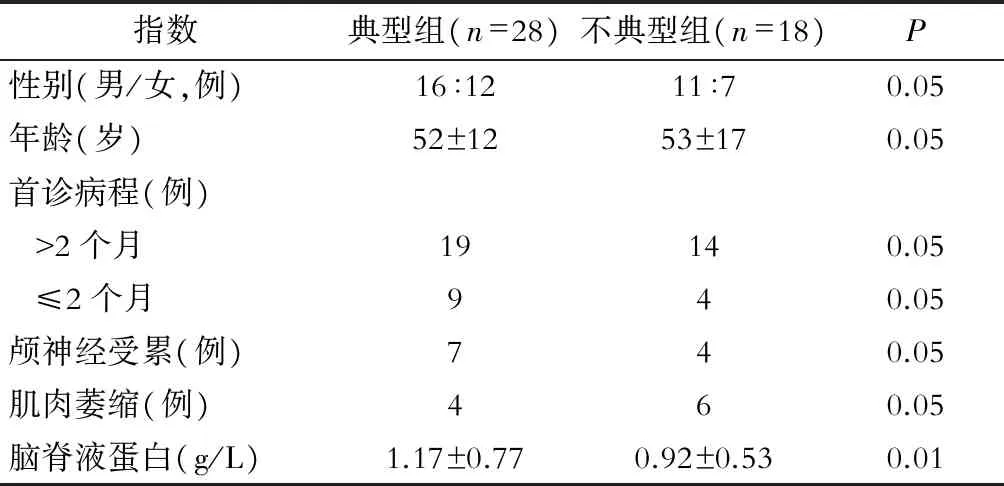
表2 典型CIDP及不典型CIDP患者临床资料比较
3 讨 论
根据2010年EFNS/PNS指南提出的CIDP临床诊断标准[4],本研究中典型CIDP占大多数(61%),不典型CIDP中无1例为纯运动或纯感觉型。来自法国的报道显示在146例CIDP患者中典型CIDP占51%、MADSAM 15%、纯感觉型35%[10];来自英国的报道显示46例CIDP患者中典型CIDP占80.4%、MADSAM 15.2%、DADS 6.5%[11];来自日本的报道显示典型CIDP占61%、MADSAM 34%、DADS 8%、纯感觉型1%[12]。可见,典型CIDP仍然是临床常见类型。本研究中不典型CIDP发病类型与国外报道相比有所不符,其原因可能为一方面,单中心样本数偏倚为可能原因;另一方面,根据目前已公布的标准,所有表现为纯运动型CIDP的患者均存在多灶运动神经病[13],而纯感觉型CIDP的定义目前仍存在争议,大部分已报道的临床上以感觉障碍为主或纯感觉障碍的患者均存在肯定的脱髓鞘性运动神经传导异常,即使首次检查结果为纯感觉型CIDP,在疾病进程中也将出现运动障碍[10, 14-15]。
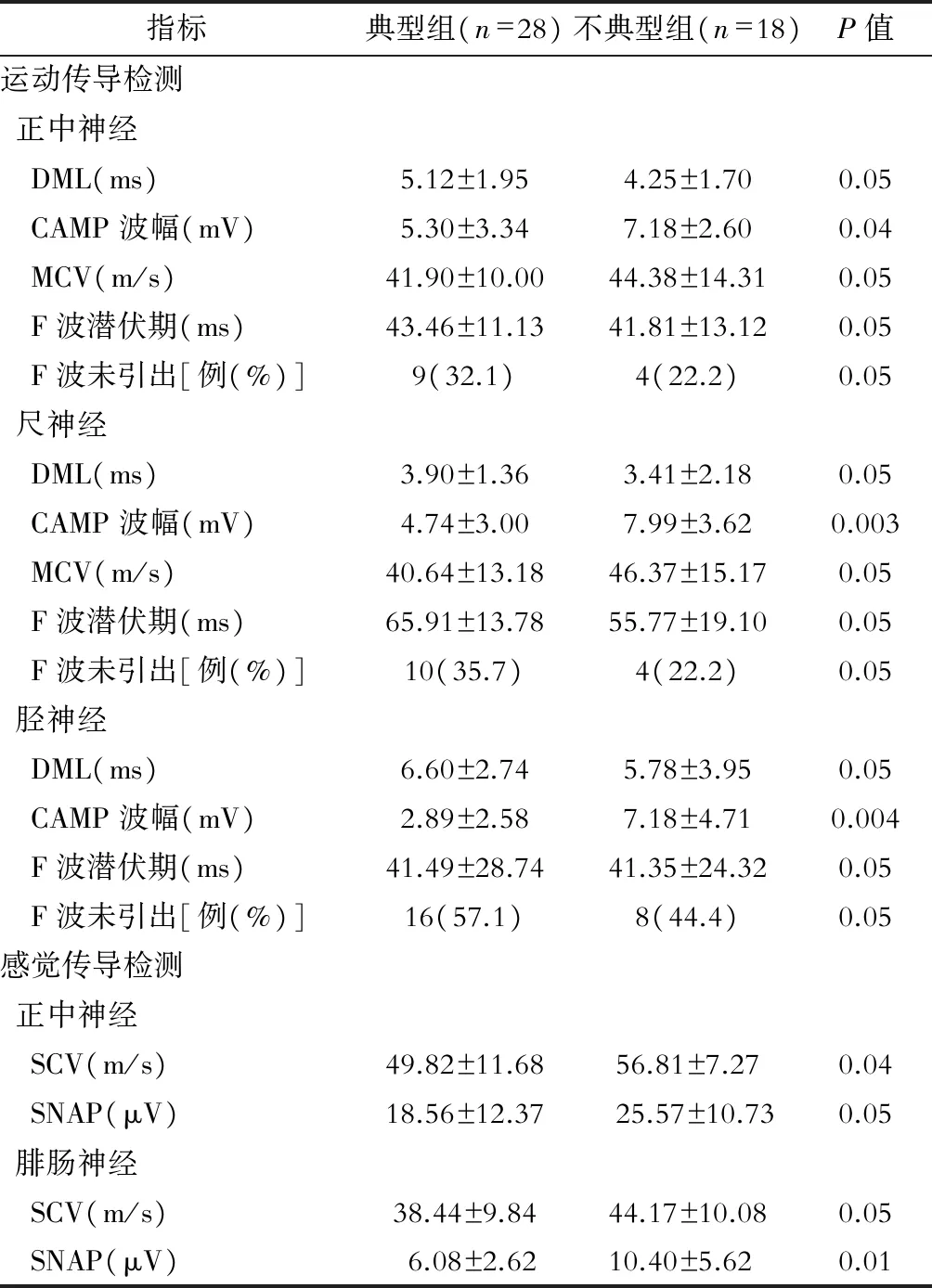
表3 典型与不典型CIDP患者的神经传导检测比较
本研究结果显示,①CIDP患者多存在明显的运动传导异常,表现为末端潜伏期延长,波幅降低及传导速度减慢,这说明存在不同程度的传导阻滞及脱髓鞘表现,并且下肢比上肢的传导异常更为明显;②感觉神经传导检测异常在下肢波幅降低和感觉传导减慢较为明显,尤其是SNAP消失明显多于上肢,这说明以下肢为主的感觉传导异常在CIDP患者中更多见;③多数患者有F波潜伏期的延长,并有较低的出现率,部分患者存在F波未引出的情况,这说明近端神经根的脱髓鞘现象更为显著。总的来说, CIDP患者周围神经运动纤维和感觉纤维受损均较明显,存在传导阻滞与脱髓鞘,且下肢较重者更多见。
本研究还发现,CIDP的两种主要表型在神经脱髓鞘分布上存在差异。与不典型CIDP对比,典型CIDP患者的正中神经、尺神经、胫神经的dCMAP波幅更低,这提示远端神经节段脱髓鞘更严重,而2组DML和MCV的差异无统计学意义,这提示运动神经dCMAP波幅在典型与不典型CIDP的鉴别方面可能具有一定意义。尽管本研究并未直接显示脱髓鞘分布模式的数据,而以往的研究显示远端神经末梢和近端神经根受累多见于吉兰巴雷综合征患者[16],但脱髓鞘神经的传导异常模式在典型CIDP患者中分布于远端神经节段占20%,同时分布于远端和中间节段约43%;相反,有65%的不典型CIDP患者脱髓鞘区域多见于中间神经节段[12]。可能的机制为远端神经末梢和神经根的血-神经屏障在解剖结构上存在先天缺陷,屏障破坏可能是由细胞粘附分子、炎症因子、基质金属蛋白酶或其他炎性物质的局部激活所致[17]。
本研究重点关注了正中神经和腓肠神经感觉传导,正中感觉神经传导研究用于评估神经最远端的部分,而腓肠神经研究用于评估中间部分。已经肯定的是,远端脱髓鞘时感觉受累更严重。本研究发现典型CIDP患者正中神经感觉传导速度更慢,腓肠神经SNAP更低,与不典型CIDP相比有显著差异;同样地,本研究中典型CIDP患者的尺神经感觉传导多数异常,而桡神经浅支感觉传导多为正常(数据未给出)。感觉神经受累的这种模式在CIDP或GBS患者中特别常见[18]。
本研究在临床特征方面并未分析出阳性意义的结果,究其原因可能是所涉样本数量少,其次由于是回顾性研究未设置对照,在现有资料的基础上没能固定随访每例患者,以至无法评估治疗反应和动态观察患者的电生理变化,不足之处还有未完善神经活检等。基于这些局限性,本研究纳入的46例患者分型中与国内外其他同行所报道的研究可能存在某些偏差。但是本研究采用两大亚型直接进行比较,尽管这两种亚型在发病机制上未更进一步说明,但结果却揭示这两型之间仍然存在各自的差异性。
总的来说,通过回顾性研究发现典型CIDP仍是临床常见的类型,与不典型CIDP的临床资料及电生理数据对比,典型CIDP患者运动与感觉传导速度更慢,波幅更低,脑脊液蛋白含量更高;提示这些生物学标志物可能具有一定的鉴别意义。最后,期待能早日发现特异性标志物的同时,希望在今后的研究中能进一步完善上述的不足之处,设计更为严谨合理的前瞻性研究,更好地为临床提供佐证。
(韩亚现在武汉市红十字会医院工作)
[1] Dyck PJ,Lais AC,Ohta M,et al.Chronic inflammatory polyradiculo-neuropathy[J].Mayo Clinic Proc,1975,50(11):621-637.
[2] Thaisetthawatkul P,Logigian EL,Herrmann DN.Dispersion of the distal compound muscle action potential as a diagnostic criterion for chronic inflammatory demyelinating polyneuropathy[J].Neurology,2002,59(10):1526-1532.
[3] Tackenberg B,Luenemann JD,Steinbrecher A,et al.Classifications and treatment responses in chronic immune-mediated demyelinating polyneuropathy[J].Neurology,2007,68(19):1622-1629.
[4] Van Den Bergh PY,Hadden RD,Bouche P,et al.European federation of neurological societies/peripheral nerve society guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy:report of a joint task force of the European federation of neurological societies and the peripheral nerve society-first revision[J].Eur J Neurol,2010,17(3):356-363.
[5] 中华医学会神经病学分会神经肌肉病学组.中华医学会神经病学分会肌电图及临床神经电生理学组,中华医学会神经病学分会神经免疫学组.中国慢性炎性脱髓鞘性多发性神经病诊疗指南[J].中华神经科杂志,2010,43(8):586-588.
[6] 中华医学会神经病学分会肌电图和临床神经电生理学组.肌电图规范化检测和临床应用共识(一)[J].中华神经科杂志,2008,41(4):279-283.
[7] 中华医学会神经病学分会肌电图和临床神经电生理学组.肌电图规范化检测和临床应用共识(二)[J].中华神经科杂志,2008,41(5):353-357.
[8] 毕娟,卢祖能,初红,等.感觉神经动作电位波幅在糖尿病神经病的诊断价值[J].中华神经科杂志,2008,41(10):657-660.
[9] 王文华,罗瑛,解燕春,等.尺/正中神经复合肌肉动作电位波幅比值在运动神经元病变中的诊断价值研究[J].中华神经科杂志,2013,46(5):304-307.
[10]Viala K,Maisonobe T,Stojkovic T,et al.A current view of the diagnosis, clinical variants, response to treatment and prognosis of chronic inflammatory demyelinating polyradiculoneuropathy[J].Journal of the Peripheral Nervous System,2010,15(1):50-56.
[11]Rajabally YA,Simpson BS,Beri S,et al.Epidemiologic variability of chronic inflammatory demyelinating polyneuropathy with different diagnostic criteria: study of a UK population[J].Muscle Nerve,2009,39(4):432-438.
[12]Kuwabara S,Isose S,Mori M,et al.Different electrophysiological profiles and treatment response in ‘typical’ and ‘atypical’chronic inflammatory demyelinating polyneuropathy[J].J Neurol Neurosurg Psychiatry,2015,86(10):1054-1059.
[13]Van Schaik IN,Leger JM,Nobile-Orazio EA,et al.European federation of neurological societies/peripheral nerve society guideline on management of multifocal motor neuropathy. report of a joint task force of the European federation of neurological societies and the peripheral nerve society - first revis[J].Journal of the Peripheral Nervous System,2010,15(4):295-301.
[14]Oh SJ,Joy JL,Kuruoglu R.Chronic sensory demyelinating neuropathy-chronic inflammatory demyelinating polyneuropathy presenting as a prue sensory neuropathy[J].J Neurol Neurosurg Psychiatry,1992,55(8):677-680.
[15]Van Dijk GW,Notermans NC,Franssen H,et al.Development of weakness in patients with chronic inflammatory demyelinating polyneuropathy and only sensory symptoms at presentation:a long-term follow-up study[J].J Neurol,1999,246(12):1134-1139.
[16]Kuwabara S,Yuki N.Axonal Guillain-Barre syndrome: concepts and controversies[J].Lancet Neurol,2013,12(12):1180-1188.
[17]Olsson Y.Microenvironment of the peripheral nervous system under normal and pathological conditions[J].Crit Rev Neurobiol,1990,5(3):265-311.
[18]Kuwabara S.The blood-nerve barrier and sensory nerve conduction[J].Clinical Neurophysiology,2007,118(9):1901-1902.
(2016-03-18收稿)
Retrospective study of clinical and electrophysiological features in patients with typical and atypical chronic inflammatory demyelinating polyneuropathy
HanYa,WangJiahua,LuZuneng.
DepartmentofNeurology,RenminHospitalofWuhanUniversity,Wuhan430060
Objective To retrospectively analyze the clinical and electrophysiological features of patients with chronic inflammatory demyelinating polyneuropathy (CIDP).Methods Fourty-six consecutive patients who were referral to Department of Neurology, Renmin Hospital of Wuhan University, from January 2012 to December 2014, with clinical probable diagnosis of CIDP, were enrolled. The patients were divided into two groups, i.e. typical and atypical CIDP, according to the recommendations of European Federation of Neurological Societies (EFNS)/Peripheral Nerve Society (PNS) guidelines in 2010. The clinical and electrophysiological data were retrospectively analyzed.Results (1) Among 46 patients who conformed with the inclusion criteria, there were 27 males and 19 females, onset aged from 12~77 (52±15) years old. There were 33 patients with illness duration of more than 2 months, and 13 cases with illness duration of 2 months or less than 2 months; in which there were 6 patients with acute-onset, i.e. A-CIDP. (2) There were 28 patients (61%) with typical and 18 cases (39%) with atypical CIDP. The protein content of cerebrospinal fluid was (1.17±0.77) g/L in the group of typical CIDP and (0.92±0.53) g/L in atypical one (t=2.39,P=0.01). In typical and atypical CIDP groups, the distal CMAP amplitude of median, ulnar and tibial nerves were (5.30±3.34) mV vs (7.18±2.60) mV (t=2.14;P=0.04), (4.74±3.00) mV vs (7.99±3.62) mV(t=3.17,P=0.003) and (2.89±2.58) mV vs (7.18±4.71) (t=3.20,P=0.004); the sensory conduction velocity of median nerve, (49.82±11.68) m/s vs (56.81±7.27) m/s (t=2.11,P=0.04); the SNAP amplitude of sural nerve, (6.08±2.62) μV vs (10.40±5.62) μV (t=2.63,P=0.01), respectively.Conclusion Typical CIDP is still the predominant type clinically. Compared with the atypical CIDP, the typical CIDP patients have higher protein content of cerebrospinal fluid, slower motor and sensory conduction velocities with lower amplitudes, in which these biomarkers may be of certain distinguishing significance.
CIDP Clinical Features Electrophysiology
湖北省卫计委重点项目(WJ2015MA007);武汉市科技局2015年应用基础研究计划项目(2015060101010047)
430060 武汉大学人民医院神经内科[韩亚(研究生) 王家华(共同第一作者,现在湖北省襄阳市第一人民医院神经内科工作) 卢祖能(通信作者)]
R745.4+4
A
1007-0478(2017)02-0126-05
10.3969/j.issn.1007-0478.2017.02.011
