零放射线技术指导特发性室性早搏的导管消融治疗
2017-07-24陶海龙龙德勇白中乐景丽娟郑志伟
陶海龙,龙德勇,白中乐,景丽娟,郑志伟,秦 奋,李 凌
1)郑州大学第一附属医院心血管内科 郑州 450052 2)首都医科大学北京安贞医院心血管内科 北京 100029
零放射线技术指导特发性室性早搏的导管消融治疗
陶海龙1)△,龙德勇2),白中乐1),景丽娟1),郑志伟1),秦 奋1),李 凌1)
1)郑州大学第一附属医院心血管内科 郑州 450052 2)首都医科大学北京安贞医院心血管内科 北京 100029
△男,1976年5月生,博士,副教授,副主任医师,研究方向:复杂心律失常的机制和介入治疗,E-mail:hailongtao@163.com
室性早搏;导管消融治疗;放射线
介入导管消融治疗可有效减少甚至预防室性早搏(室早)的发作,因此对于频发性室早,导管消融治疗已成为一种重要的临床治疗方法[1-3]。但常规术式需借助X射线来明确心腔的解剖结构并指导导管的操作,因此,在导管操作过程中,医生与患者都会接受不同程度的X射线暴露。对于房颤、室早等复杂导管消融手术,由于手术时间延长,X射线的暴露剂量常显著增加。对于特殊人群(如孕妇、儿童),尽管可对其特殊部位进行遮盖防护,但其潜在危害仍难以估计。文献[4]显示,接受60 min的射线辐射即可增加0.048%~0.100%致命性恶性肿瘤的发生率。新近应用的快速解剖映射(fast anatomic mapping,FAM)技术是心脏三维电解剖标测方法的一项新功能,可在零放射线的指导下完成快速的心腔解剖重建,且构建的心腔模型与真实的解剖结构极其接近,可为术中的导管操作提供详细的解剖参考[5-6]。作者对频发室早患者,拟采用零放射线技术进行心腔解剖重建、激动标测和导管消融,评价在该技术指导下完成室性心律失常治疗的安全性及临床应用效果。
1 临床资料
1.1 研究对象 2015年9~12月接受导管消融治疗的室早患者,入选标准为:室早频发(>15 000 个/24 h ),不合并心脏瓣膜病、心肌病、心肌梗死等器质性心脏病,术前停用所有抗心律失常药物>3个半衰期。共计24例患者满足入选条件。
1.2 室早诱发 患者术前签署知情同意书。因该研究拟采用FAM技术实现零放射线指导下的室早导管消融治疗,故常规不放置标测电极。术中患者需满足室早持续、频繁发作,室早的诱发及消融治疗后的检验,故均采用静脉滴注异丙肾上腺素(1~4 μg/min)方式诱发;如术中室早不发作或异丙肾上腺素不能诱发,需心室程序刺激辅助诱发,则退出该研究,而改用传统放射线指导下操作。术中有4例患者因室早不频发,需起搏刺激诱发改为常规放射线指导下消融治疗而退出该研究。患者年龄16~53(42.8±16.3)岁,病史4~13(27.1±21.9)个月,24 h心电图室早负荷18 211~44 358(23 383±8 461)个。
1.3 心室腔解剖重建 采用FAM技术对心室腔进行解剖重建。FAM方法与文献[5-6]一致,采用8F的4 mm盐水灌注消融电极(Biosense-Webster, Diamond Bar, CA, USA),在“Stable”模式下进行心室腔解剖建模。标测过程中常规开启呼吸门控功能,将解剖分辨率设为16。消融电极沿鞘管进入体内后,即开启FAM模式。
如需进行右室的解剖重建,先通过FAM技术将股静脉至下腔静脉的血管腔进行重建,待消融电极进入右心房后再重建三尖瓣环,特别标注希氏束的解剖位置。然后,参照三尖瓣环的解剖模型,将消融电极通过三尖瓣环进入右室腔,完成右室的解剖建模及激动标测(图1)。对于左室腔的解剖重建,首先采用消融电极在患者体外的胸骨角水平(与主动脉弓水平相平行)取点进行解剖标注。通过FAM技术将股动脉至降主动脉的血管腔进行重建,参照之前的胸骨角标注点,在明确主动脉弓的水平解剖位置后,操作消融电极打弯,完成主动脉、升主动脉的解剖重建。进而对主动脉根部(主动脉窦)进行解剖重建,使无冠窦、左冠窦及右冠窦部位的解剖结构趋于丰满、完整,进而明确主动脉瓣的解剖位置。参照重建完成的主动脉根部,将消融电极逆行通过主动脉瓣进入左室,完成左室的解剖重建及激动标测(图2)。
1.4 标测与消融 选取与临床室早心电图图形一致的室早进行激动顺序标测,以体表心电图室早形态固定、便于识别的导联QRS波顶点或底部作为参考零点,完成相应心室腔的激动顺序标测。对于疑诊左侧起源的室早,先完成主动脉窦内激动顺序标测,如有必要,再对左室进行激动顺序标测。
消融治疗方法同既往文献[3,6],对于激动顺序提前区域进行细致标测,确定最早激动点。结合起搏标测结果,选取起搏形态与临床室早心电图形态一致者,作为消融靶点。如消融放电10 s以上,室早无消失或明显减少,则停止放电,重新调整消融电极位置或再次激动标测后消融。如消融放电10 s内室早消失或明显消失,则巩固放电至30~60 s。术中持续监测患者血压、心率、指脉氧参数,术中采用经胸超声检查明确有无心脏瓣膜损伤及心包积液。
1.5 消融设置及消融终点 消融能量为35 W,43 ℃,放电10~30 s/次。以消融放电后,室早消失且在消融后30 min内重复静脉滴注异丙肾上腺素不能诱发临床室早作为消融终点。术中达到消融终点为即刻消融成功标准;消融后3个月内无临床室早发作,心电图及动态心电图检查证实无既往相同形态室早发作为消融后随访成功标准。
1.6 结果 所有患者均完成了无射线指导下心室腔的解剖重建。激动标测显示,室早起源于右室流出道13例、主动脉窦内4例、左室3例。解剖重建及激动标测耗时(35±2)min。20例均取得即刻消融成功,放射线曝光量0 mGy,消融放电(2.3±0.2)次,放电时间(93.4±2.6) s,手术时间(1.6±0.5) h。住院期间未发生严重并发症,术后随访(5±1)个月,均无复发。
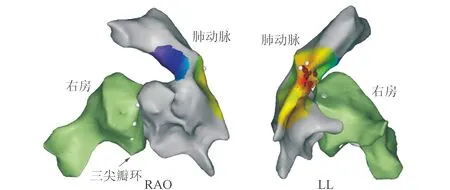
图中可见右房-三尖瓣环(白色圆点处)、右室(包括流出道)的解剖结构。红色圆点为消融靶点,可见位于右室流出道的间隔部位。RAO: 右前斜位;LL:左侧位。图1 零放射线指导下右室流出道室早的解剖重建与标测消融示意图

图中可见主动脉弓、主动脉窦及左室的解剖结构。体表参考点为消融电极在患者体外的胸骨角水平取点标注,可见其与主动脉弓水平相平齐。红色圆点为消融靶点,可见位于左窦前部。图2 零放射线指导下左冠窦内起源室早的解剖重建与标测消融示意图
2 讨论
几年来,导管射频治疗室早取得了显著进步,指南推荐对于药物治疗无效的频发室早,采用导管消融治疗。但是常规术式操作中X射线的暴露及潜在危害不容忽视,文献[7-8]显示长期、大剂量的X射线暴露可显著增加白内障、生殖系统危害及恶性肿瘤的发生率。此外,术者穿戴铅衣、铅帽等防护器具,可增加职业性腰椎、下肢等部位骨关节劳损的发生[9]。因此,美国放射学会倡导“尽可能少”原则来规范和减少心导管介入操作过程中X射线的暴露[10-12]。但对于室早、室速等复杂心律失常的导管消融治疗,常常需要不间断的X射线透视来定位心内结构(房室瓣、主动脉瓣、肺动脉瓣等),进而指导消融电极的操作,因此室早导管消融术中X射线曝光时间显著延长。
该研究显示,采用FAM技术能够在零放射线指导下完成心室腔的解剖建模,并可安全地进行射频消融操作。与传统操作相比,零放射线导管操作的手术时间会有所延长,但该技术具有以下的优势:①可实时显示导管的影像及其在心腔内的解剖位置,便于了解导管在心腔的位置和稳定性。②可以与CT等图像进行图像融合,进一步提高操作的准确性。
该研究中对于右室腔建模,采用先重建房室瓣环结构,包括希氏束等重要部位,以此为解剖背景,继而实现零射线下导管的跨瓣操作,避免了盲目操作对传导束、房室瓣环的损伤,操作安全性优于常规射线指导下操作。对于左室腔建模,该研究采用事先体外定位主动脉弓水平的方法,方便术中判断主动脉弓水平,避免推送消融电极时误入、损伤其他分支动脉。而且,主动脉根部及主动脉窦的解剖重建,有利于消融电极在主动脉瓣上进行打弯、塑形操作,顺利进入左室腔,减少了误入冠脉血管的风险。
对于部分有解剖变异,如动脉严重迂曲、主动脉畸形等情况,零放射线操作需注意自导管进入体内后即开启FAM功能,以避免血管损伤的情况。因此,如术前常规对术中可能使用的血管径路进行超声检查,对合并血管畸形、迂曲等情况进行血管的增强CT检查,则便于在术中结合增强CT的资料完成零放射线指导下的导管操作。
该研究的病例数尚少,有待更大样本的临床研究来评价该技术的应用价值;此外,作者认为如配合使用具备压力检测的消融导管,则会进一步提高对导管贴靠的判断,提高手术的安全性。
[1]CALVO N,JONGBLOED M,ZEPPENFELD K.Radiofrequency catheter ablation of idiopathic right ventricular outflow tract arrhythmias[J].Indian Pacing Electrophysiol J,2013,13(1):14
[2]TEH AW,REDDY VY,KORUTH JS,et al.Bipolar radiofrequency catheter ablation for refractory ventricular outflow tract arrhythmias[J].J Cardiovasc Electrophysiol,2014,25(10):1093
[3]陶海龙,龙德勇,张金盈,等.右室流出道室性早搏的三维电解剖标测和导管消融[J].郑州大学学报(医学版),2011,46(4):547
[4]WALTERS TE,KISTLER PM,MORTON JB,et al.Impact of collimation on radiation exposure during interventional electrophysiology[J].Europace,2012,14(11):1670
[5]ANJO N,NAKAHARA S,OKUMURA Y,et al.Impact of catheter tip-tissue contact on three-dimensional left atrial geometries: Relationship between the external structures and anatomic distortion of 3D fast anatomical mapping and high contact force guided images[J].Int J Cardiol,2016,222(11):202
[6]陶海龙,秦奋,李凌,等.快速解剖映射技术指导下主动脉窦内起源室性早搏的导管消融治疗[J].郑州大学学报(医学版),2015,50(4):546
[7]ERNST S,CASTELLANO I.Radiation exposure and safety for the electrophysiologist[J].Curr Cardiol Rep,2013,15(10):402
[8]EFSTATHOPOULOS EP,KATRITSIS DG,KOTTOU S,et al.Patient and staff radiation dosimetry during cardiac electrophysiology studies and catheter ablation procedures: a comprehensive analysis[J].Europace,2006,8(6):443
[9]KLEIN LW,TRA Y,GARRATT KN,et al.Occupational health hazards of interventional cardiologists in the current decade: Results of the 2014 SCAI membership survey[J].Catheter Cardiovasc Interv,2015,86(5):913
[10]OSEI FA,HAYMAN J,SUTTON NJ,et al.Radiation dosage during pediatric diagnostic or interventional cardiac catheterizations using the"air gap technique"and an aggressive"as low as reasonably achievable"radiation reduction protocol in patients weighing<20 kg[J].Ann Pediatr Cardiol,2016,9(1):16
[11]JUSTINO H.The ALARA concept in pediatric cardiac catheterization: techniques and tactics for managing radiation dose[J].Pediatr Radiol,2006,36(Suppl 2):146
[12]BERKHOUT WE.The ALARA-principle. Backgrounds and enforcement in dental practices[J].Ned Tijdschr Tandheelkd,2015,122(5):263
(2016-10-30收稿 责任编辑赵秋民)
10.13705/j.issn.1671-6825.2017.04.034