左西孟旦对LPS诱导的乳鼠心肌细胞损伤的保护作用*
2017-07-24穆立华张丽华蒋友旭李小威朱英丽
穆立华,张丽华#,蒋友旭,李小威,朱英丽
1)郑州大学第二附属医院心血管内科 郑州 450014 2)河南省人民医院临床药理室 郑州 450003
左西孟旦对LPS诱导的乳鼠心肌细胞损伤的保护作用*
穆立华1),张丽华1)#,蒋友旭1),李小威1),朱英丽2)
1)郑州大学第二附属医院心血管内科 郑州 450014 2)河南省人民医院临床药理室 郑州 450003
#通信作者,女,1964年3月生,硕士,教授,主任医师,研究方向:冠心病的基础与临床,E-mail:zlhxp@126.com
左西孟旦;LPS;心肌细胞;损伤;乳鼠
目的:探讨左西孟旦对LPS诱导的乳鼠心肌细胞损伤的保护作用。方法:将原代培养的SD乳鼠的心肌细胞分为3组:对照组、模型组和左西孟旦干预组。模型组和左西孟旦干预组用10 mg/L的LPS处理6 h建模,其中左西孟旦干预组于造模前用终浓度为0.30 μmol/L的左西孟旦预处理24 h。全自动生化仪检测3组细胞培养液LDH、CK含量;ELISA检测培养液TNF-α、IL-6含量;流式细胞仪检测细胞凋亡;Western blot检测凋亡相关蛋白Cleaved-Caspase-3及抗凋亡蛋白Bcl-2的表达。结果:与对照组比较,模型组细胞培养液中LDH、CK、TNF-α和IL-6含量增加,细胞凋亡率升高,凋亡蛋白Cleaved-Caspase-3表达增高,抗凋亡蛋白Bcl-2表达降低(P<0.05);与模型组比较,左西孟旦干预组细胞培养液中LDH、CK、TNF-α、IL-6含量减少,细胞凋亡率降低,Cleaved-Caspase-3表达量降低,Bcl-2表达增高(P<0.05)。结论:左西孟旦对LPS诱导的乳鼠心肌细胞损伤有保护作用,其机制可能与减少炎症因子释放,抑制Caspase-3蛋白的表达,促进Bcl-2蛋白的表达有关。
急性心力衰竭起病急,死亡率高,其中由感染性内毒素血症所致的心力衰竭由于合并感染,其预后往往更差。其感染因素50%以上源于革兰阴性菌,而细胞壁外膜的脂多糖(lipopolysaccharide,LPS)是其致病的主要成分[1]。LPS可释放入血或直接作用于多种效应细胞,引起心肌细胞损伤或直接导致心肌细胞凋亡,最终导致心力衰竭[2]。目前心力衰竭的治疗主要包括利尿、强心、扩血管三个方面。然而,左西孟旦作为新型钙离子增敏剂,为心力衰竭的治疗提供了新的途径,其除具有传统的正性肌力、扩张血管等作用外,近来研究[3]还证实其具有抗炎、抗氧化、抗心肌细胞凋亡等作用。该药虽已在临床应用,但其基础研究仍较少,对心力衰竭的保护机制仍不明确。该研究观察了左西孟旦对LPS诱导的乳鼠心肌细胞损伤的保护作用及其作用机制,报道如下。
1 材料与方法
1.1 材料 实验动物:新生1~3 d的SD乳鼠,雌雄不限,由郑州大学实验动物中心提供。试剂:左西孟旦注射液(圣诺生物制药有限公司,成都),LPS(Sigma公司,美国),Ⅱ型胶原酶(Worthington公司,美国),胰蛋白酶(Life Technologies公司,美国),DMEM培养基(索莱宝科技有限公司,北京),胎牛血清(四季青生物工程材料有限公司,杭州),Caspase-3抗体、Bcl-2抗体(万类生物科技有限公司,沈阳),GAPDH抗体(贤至生物科技有限公司,杭州),FITC山羊抗兔IgG(三箭生物技术有限公司,天津),TNF-α、IL-6 ELISA试剂盒(联科生物技术股份有限公司,杭州),Annexin V-FITC/PI细胞凋亡试剂盒(凯基生物技术股份有限公司,江苏)。仪器:超净工作台(净化设备有限公司,苏州),隔水式恒温培养箱(THZ-98A)(一恒科技有限公司,上海),离心机(TDZ5-WS)(湘仪离心机仪器有限公司,湖南),pH计(PHS-3C)(电科学仪器股份有限公司,上海),二氧化碳培养箱(赛默飞世尔科技公司,美国),激光共聚焦显微镜、荧光显微镜(尼康仪器有限公司,日本),电子天平(佑科仪器仪表有限公司,上海)。
1.2 乳鼠心肌细胞的分离、培养与分组 乳鼠心肌细胞的原代培养参考文献[4]方法并加之改进:乳鼠消毒后取出心脏置于缓冲液中,剪碎心室组织(约1 mm3)后加入5 mL 1 g/L的胰蛋白酶,置于37 ℃培养箱中消化8~10次,弃掉第1次消化后的上清液,之后的上清液吸入至含体积分数10%血清DMEM培养基中,终止消化,200目的筛网过滤,800 r/min离心5 min,弃去上层液体,加入含体积分数20%血清的DMEM培养基,最后于CO2培养箱(37 ℃,体积分数5% CO2)培养1.5 h后将未贴壁的心肌细胞悬液吸出,计数后接种于培养板,并加入0.1 mmol/L的5-溴脱氧尿嘧啶核苷抑制成纤维细胞生长,最后置于培养箱中培养。
上述细胞培养48 h后换液,之后每24 h换液1次,培养4 d后行α-action染色,鉴定是否为心肌细胞。鉴定后设空白对照组、模型组、左西孟旦干预组,每组8个复孔。左西孟旦干预组加入浓度为0.30 μmol/L(MTT预实验筛选的最佳浓度)的左西孟旦预处理24 h,其余组继续培养,之后模型组及左西孟旦干预组各加入10 mg/L的LPS处理6 h后检测以下指标。
1.3 心肌细胞培养液中LDH、CK、TNF-α、IL-6测定 收集各组细胞,用全自动生化仪测定细胞培养液中LDH及CK含量,ELISA法分别测定细胞培养液中TNF-α、IL-6含量,所有操作步骤均按仪器和试剂盒说明书进行。实验重复6次。
1.4 流式细胞仪检测心肌细胞凋亡 收集各组细胞,在细胞悬液中加入10 μL Annexin V-FITC和5 μL的PI,轻轻混匀,避光室温反应15 min,再加入300 μL Binding buffer,立即上流式细胞仪检测。实验重复3次。
1.5 Western blot测定凋亡相关蛋白的表达 收集各组细胞,加入含PMSF的细胞裂解液裂解后提取总蛋白,BCA法检测蛋白浓度,各组取等量蛋白行聚丙烯酰胺凝胶电泳,电转膜后牛奶封闭2 h,先后结合一抗(GAPDH按1:1 000稀释,Caspase-3和Bcl-2均按1:500稀释)和二抗(按1:5 000稀释),最后行胶片曝光。以目的蛋白和内参灰度值的比值作为目的蛋白的表达水平。实验重复3次。
1.6 统计学处理 用SPSS 17.0处理数据。采用单因素方差分析比较3组心肌细胞培养液中LDH、CK、TNF-α、IL-6含量和细胞凋亡率以及Cleaved-Caspase-3、Bcl-2蛋白表达水平的差异,两两比较采用LSD-t法,检验水准α=0.05。
2 结果
2.1 心肌细胞的形态变化及鉴定 在荧光显微镜下观察,发现心肌细胞刚接种时未贴壁,呈圆形或椭圆形,24 h后开始贴壁生长,形态为不规则梭形。48 h后出现自发性搏动。4~8 d细胞增殖较快,数目较多。见图1。
2.2 各组心肌细胞培养液中LDH、CK、TNF-α、IL-6含量变化 与对照组比较,模型组细胞培养液中心肌损伤指标LDH、CK,炎性指标TNF-α、IL-6含量升高;与模型组比较,左西孟旦干预组以上指标降低,见表1。
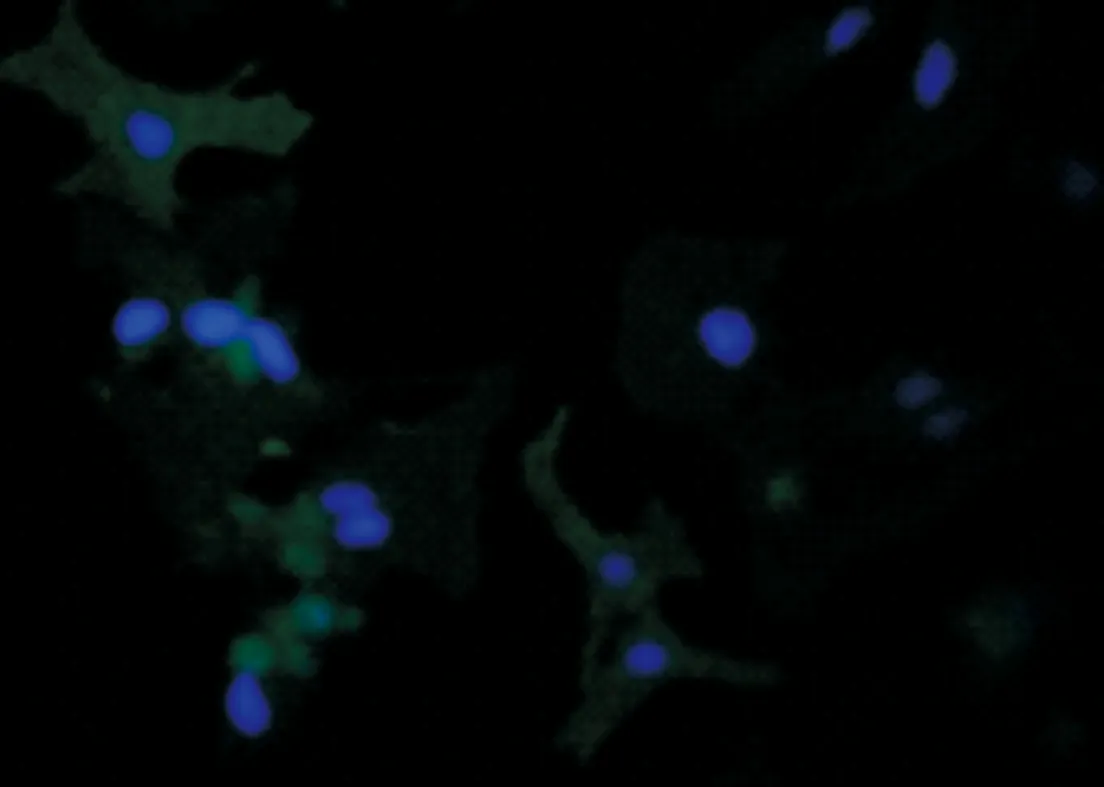
图1 心肌细胞的α-action染色(×400)
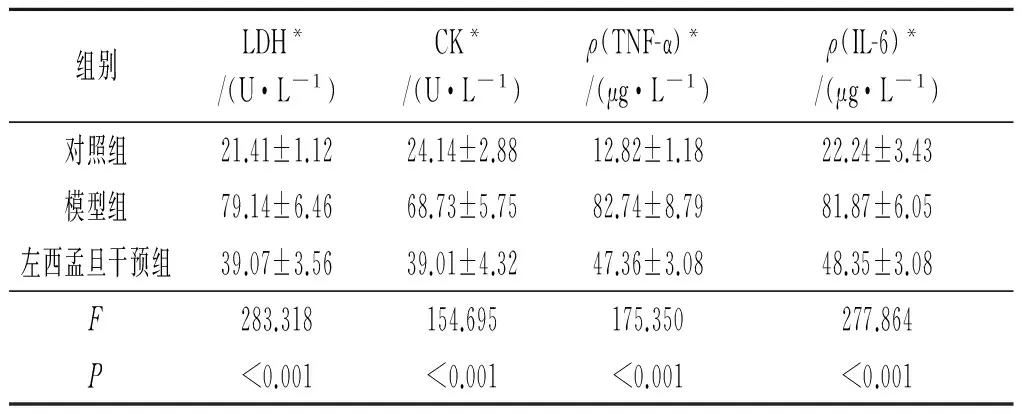
表1 各组心肌细胞培养液中LDH、CK、TNF-α、IL-6测定结果比较(n=6)
*:组间两两比较,P均<0.05。
2.3 各组心肌细胞凋亡相关蛋白的表达及细胞凋亡率比较 与对照组比较,模型组心肌细胞凋亡蛋白Cleaved-Caspase-3(Caspase-3活化形式)表达升高,抗凋亡蛋白Bcl-2表达降低,与模型组比较,左西孟旦干预组Cleaved-Caspase-3表达降低,Bcl-2表达升高;与对照组比较,模型组细胞凋亡率升高;与模型组比较,左西孟旦干预组细胞凋亡率降低,结果见图2、表2。
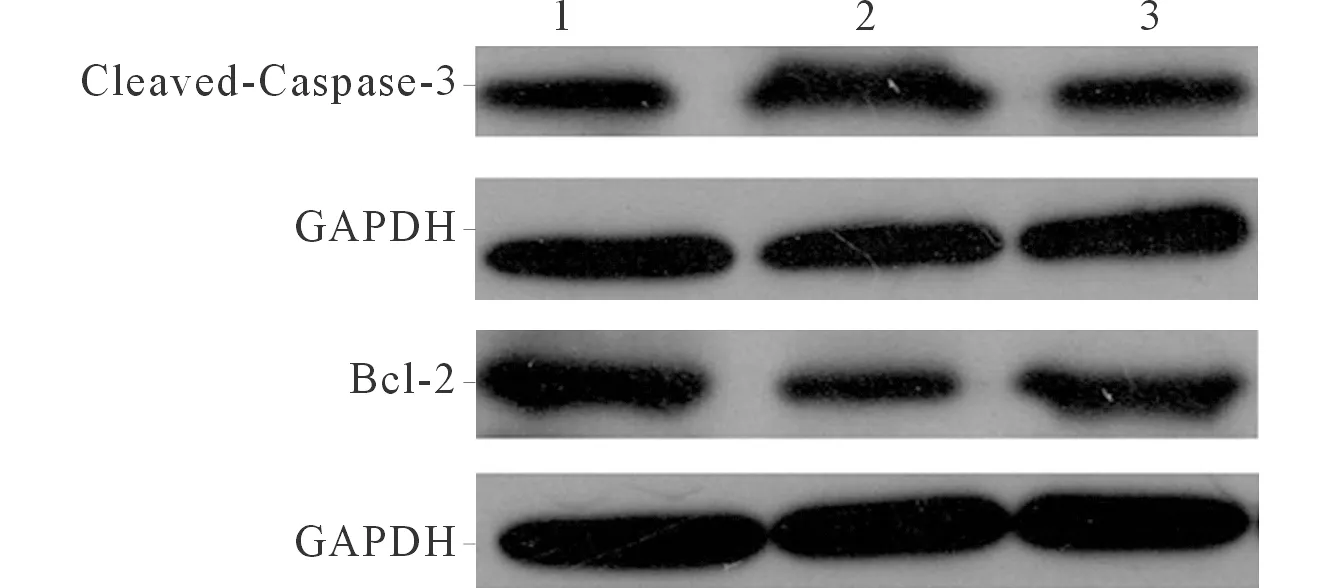
1:对照组;2:模型组;3:左西孟旦干预组。图2 各组细胞Caspase-3和Bcl-2蛋白的表达
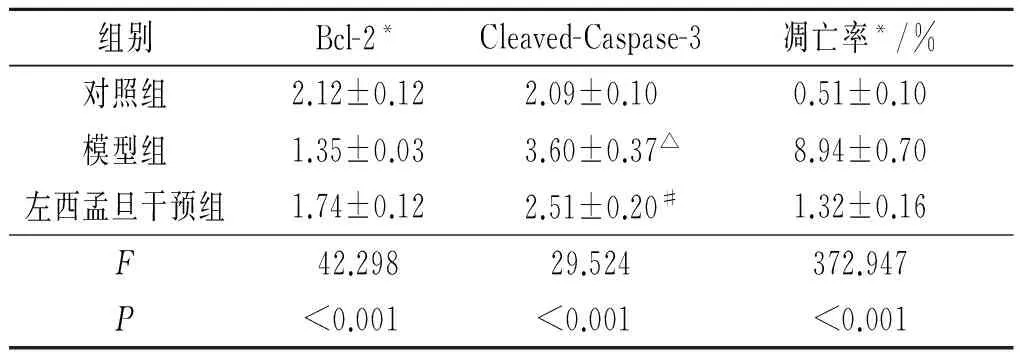
表2 各组凋亡相关蛋白表达水平及凋亡率比较(n=3)
*:组间两两比较,P均<0.05;△:与对照组比较,P<0.05;#:与模型组比较,P<0.05。
3 讨论
感染性内毒素血症相关心力衰竭是造成内毒血症患者死亡的主要原因之一[5],考虑与多种因素造成的炎症反应有关[6-10]。研究[11]表明炎性因子尤其是TNF-α、IL-6在心力衰竭病理过程中起着重要作用。TNF-α是炎性因子中重要的一员,可通过细胞凋亡途径导致心肌细胞凋亡,IL-6可导致左室心肌肥大进而引起心室重构[12]。炎性因子增多、心肌细胞凋亡以及氧化应激加重这三者在心肌重塑的过程中起着重要作用,而心肌重塑又是促进心力衰竭进一步发展的病理生理基础。该实验结果显示模型组心肌细胞培养液中炎性因子TNF-α、IL-6含量升高,证实LPS损伤可导致炎性因子增多引起心脏损伤,而左西孟旦干预组二者的水平降低,证实左西孟旦能减少心力衰竭时炎性因子TNF-α、IL-6的释放,从而起到抗炎作用,最终改善心功能。
内毒血症心肌组织可产生大量的活性氧损害线粒体膜,引起Caspase-3活化,其活化后可切割变为Cleaved-Caspase-3,从而启动凋亡程序,导致心肌细胞损伤,心肌细胞损伤时LDH及CK释放增多。而Caspase-3是凋亡的最终执行者,在凋亡级联反应中处于核心地位[13]。该实验结果显示模型组心肌细胞培养液中心肌损伤指标LDH、CK释放增多,凋亡蛋白Cleaved-Caspase-3表达及细胞凋亡率升高,抗凋亡蛋白Bcl-2的表达降低,证实LPS可导致心肌细胞凋亡,引起心肌损伤,最终导致心力衰竭。而左西孟旦干预组心肌损伤指标LDH、CK,Cleaved-Caspase-3蛋白表达及细胞凋亡率降低,Bcl-2蛋白的表达升高,表明左西孟旦可能通过抑制凋亡蛋白Cleaved-Caspase-3的表达,促进抗凋亡蛋白Bcl-2的表达减少心肌细胞的凋亡,从而减轻心肌损伤达到改善心功能的目的。
综上所述,左西孟旦对LPS诱导的乳鼠心肌细胞损伤具有保护作用,其机制可能与减少心肌细胞炎症因子释放,抑制Caspase-3蛋白的表达,促进Bcl-2蛋白的表达有关。
[1]宋丽娟,韩彬.血必净对LPS诱导血管内皮细胞NO产生和iNOS及核转录因子κB蛋白表达的影响[J].吉林大学学报(医学版),2014,40(5):997
[2]KOCH C,WOLFF M,HENRICH M,et al.Cardiac effects of echinocandins in endotoxemic rats[J].Antimicrob Agents Chemother,2015,60(1):301
[3]杜贺,史承勇.左西孟旦的研究新进展[J].中国循环杂志,2014,29(7):555
[4]LIU D,HE M,YI B,et al.Pim-3 protects against cardiomyocyte apoptosis in anoxia/reoxygenation injury via p38-mediated signal pathway[J].Int J Biochem Cell Biol,2009,41(11):2315
[5]COURT O,KUMAR A,PARRILLO JE,et al.Clinical review:myocardial depression in sepsis and septic shock[J].Crit Care,2002,6(6):500
[6]MERX MW,WEBER C.Sepsis and the heart[J].Circulation,2007,116(7):793
[7]杨乐,邹晓静,李树生,等.脓毒症心肌抑制研究进展[J].内科急危重症杂志,2010,16(1):46
[8]朱颖,严静.钙平衡失调在脓毒症心肌损伤中的作用[J].心脑血管病防治,2014,14(2):149
[9]杨国杰,都瑾,李运伟,等.脂多糖诱导的内皮细胞凋亡对家兔再灌注心肌无复流的影响[J].郑州大学学报(医学版),2007,42(6):1153
[10]WAGNER S,SCHÜRMANN S,HEIN S,et al.Septic cardiomyopathy in rat LPS-induced endotoxemia: relative contribution of cellular diastolic Ca2+removal pathways, myofibrillar biomechanics properties and action of the cardiotonic drug levosimendan[J].Basic Res Cardiol,2015,110(5):507
[11]黄锦达.胰岛素对脂多糖诱导的H9C2心肌细胞损伤的保护作用及其机制[D].广州:南方医科大学,2016.
[12]JIN H,FUJITA T,JIN M,et al.Epac activation inhibits IL-6-induced cardiac myocyte dysfunction[J].J Physiol Sci,2016.doi:10.1007/s12576-016-0509-5
(2016-09-22收稿 责任编辑徐春燕)
Protective effect of simdax on LPS-induced neonatal rat cardiomyocyte injury
MULihua1),ZHANGLihua1),JIANGYouxu1),LIXiaowei1),ZHUYingli2)
1)DepartmentofVasculocardiology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014 2)DepartmentofClinicalPharmacology,HenanProvincialPeople'sHospital,Zhengzhou450003
simdax;LPS;cardiomyocyte;injury;neonatal rat
Aim: To investigate the protective effect of simdax on lipopolysaccharide(LPS)-induced neonatal rat cardiomyocyte injury.Methods: The neonatal rat cardiomyocytes were allocated into 3 groups: control group, LPS group and LPS+simdax group. The cells in LPS+simdax group were pretreated with simdax(0.30 μmol/L) for 24 h. The cells in LPS group and LPS+simdax group were incubated with LPS(10 mg/L) for 6 h. The contents of LDH and CK in the culture medium were tested by automatic biochemistry analyzer,and those of TNF-α and IL-6 were evaluated by ELISA; the apoptosis was determined by flow cytometry; the expressions of Cleaved-Caspase-3 and Bcl-2 were measured by Western blot.Results: Compared with control group,the contents of LDH, CK, TNF-α and IL-6 as well as the apoptosis rate in LPS group were elevated significantly; the expression of Cleaved-Caspase-3 was increased apparently while that of Bcl-2 was reduced significantly(P<0.05). However, compared with LPS group, the contents of LDK, CK, TNF-α and IL-6 and the apoptosis rate in LPS+simdax group were significantly decreased, the expression of Cleaved-Caspase-3 was reduced, and that of Bcl-2 was increased(P<0.05).Conclusion: Simdax may inhibit the LPS-induced neonatal rat cardiomyocyte injury via decreasing the production of proinflammatory cytokines, down-regulating the expression of Caspase-3 and up-regulating the expression of Bcl-2.
10.13705/j.issn.1671-6825.2017.04.013
*河南省医学科技攻关计划普通项目 201602103
R542.2