α-细辛醚对Eca-109细胞凋亡及XIAP、caspase-3表达的影响*
2017-07-24韩倩倩王白燕朱艳琴
张 妍,何 航,韩倩倩,王白燕,朱艳琴
河南中医药大学基础医学院 郑州 450046
α-细辛醚对Eca-109细胞凋亡及XIAP、caspase-3表达的影响*
张 妍,何 航,韩倩倩,王白燕,朱艳琴#
河南中医药大学基础医学院 郑州 450046
#通信作者,女, 1956年11月生,硕士, 教授,研究方向:中药抗肿瘤,E-mail:jc.zyqin@hactcm.edu.cn
α-细辛醚;X连锁凋亡抑制蛋白;caspase-3;凋亡;Eca-109细胞
目的:观察α-细辛醚对人食管癌Eca-109细胞凋亡的影响及XIAP、caspase-3表达的变化,探讨α-细辛醚的可能作用机制。方法:Eca-109 细胞分为5组,分别给予5-氟尿嘧啶(阳性对照组),25、50、100 mg/L α-细辛醚(α-细辛醚低、中、高剂量组)处理,或仅给予等体积的培养液(空白对照组)。培养48 h后,行AO/EB染色,荧光倒置显微镜下观察细胞形态,用MTT法、Annexin-V-PI法分别检测细胞增殖和凋亡,用Western blot、实时荧光定量PCR分别检测空白对照组、α-细辛醚中剂量组及高剂量组XIAP、caspase-3 mRNA及蛋白的表达水平。结果:与空白对照组比较,α-细辛醚低、中、高剂量组及阳性对照组细胞的增殖率降低、凋亡率升高(P均<0.05)。与空白对照组比较,α-细辛醚中、高剂量组XIAP mRNA及蛋白的表达均降低,caspase-3 mRNA及蛋白的表达均升高(P均<0.05)。结论:α-细辛醚可下调XIAP的表达、上调caspase-3的表达,从而抑制Eca-109细胞增殖、促进其凋亡。
食管癌是常见恶性肿瘤,其发生发展是多因素联合作用的结果。近来研究[1]表明,凋亡逃避在食管癌的发生发展中起重要作用,细胞凋亡减少可导致大量细胞堆积,细胞周期延长,引起恶性肿瘤的发生和化疗药物耐药性的形成。X 连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)是凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族中的一员,XIAP可阻断caspase诱导的细胞凋亡,使细胞发生凋亡逃避,得以永生化,形成肿瘤细胞,这也是食管癌等恶性肿瘤发生化疗抵抗的重要原因,因而XIAP抑制剂的开发和应用成为当前肿瘤治疗的热点[2]。α-细辛醚是一种高效、低毒、价廉的中药提取物。作者观察了α-细辛醚对体外培养的人食管癌细胞 Eca-109增殖和凋亡的影响,同时检测XIAP和caspase-3的表达情况,初步探讨α-细辛醚的凋亡诱导机制,从而为α-细辛醚的临床应用提供实验依据。
1 材料与方法
1.1 材料 细胞:Eca-109购于南京凯基生物科技发展有限公司,批号KG189。主要试剂:α-细辛醚(山西普德药业股份有限公司,规格2 mg/支);5-氟尿嘧啶(5-FU,上海旭东海普药业有限公司,规格2 g/L、10 mL/支);二甲基亚砜(DMSO,天津科密欧化学试剂公司);四甲基偶氮唑蓝(MTT,Amresco公司); 胎牛血清(杭州四季青公司);BCA蛋白浓度检测试剂盒(上海索莱宝生物科技有限公司);Annexin-V-FITC 凋亡检测试剂盒(北京宝赛生物试剂有限公司);XIAP、Caspase-3兔抗人单克隆抗体(美国Abcam公司);HRP标记的羊抗兔二抗工作液(北京中杉金桥生物技术有限公司);实时荧光定量PCR试剂盒(日本TaKaRa公司)。主要仪器和设备:CO2恒温培养箱(美国Reveo公司),荧光倒置显微镜(日本Olympus公司XDS-1B型),PCR 扩增仪(德国Eppendorf Biophotometer公司),流式细胞仪(美国BD公司),垂直电泳仪、转膜仪(美国 Savant公司),酶标仪(美国Bio-Rad公司)。
1.2 细胞培养与分组 Eca-109细胞常规复苏后,以含体积分数10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的RPMI 1640培养液于37 ℃、体积分数5%CO2、相对湿度95%条件下培养,待细胞贴壁,取对数生长期细胞进行实验。细胞分为5组,分别给予5-FU(阳性对照组)和25、50、100 mg/L α-细辛醚(α-细辛醚低、中、高剂量组)处理,空白对照组只加入等体积的培养液,不加药物。各组细胞培养48 h后行以下检测。
1.3 MTT法检测细胞增殖能力 取1.2中分组培养48 h的Eca-109细胞,一部分用于AO/EB染色,在荧光倒置显微镜下观察细胞的生长情况和形态学变化。一部分消化成单细胞悬液,调整细胞密度至1×104mL-1,接种于96孔板,每孔200 μL,设6个复孔,48 h后,加入20 μL 5.00 g/L的MTT,继续培养4 h,吸去上清,加入150 μL的 DMSO,充分振荡,使蓝紫色颗粒完全溶解,酶标仪检测490 nm处的光密度值。实验重复3次。
1.4 Annexin-V-PI法检测细胞凋亡 取1.2中分组培养48 h的细胞,PBS洗涤后,用2.5 g/L胰蛋白酶消化,转移至离心管中,加入培养液,吹打混匀后,4 ℃、1 000 r/min离心5 min,用预冷PBS重悬细胞,2 000 r/min离心10 min,洗涤细胞,加入500 μL Binding Buffer 悬浮,加入5 μL Annexin-V-FITC混匀后,避光4 ℃孵育 10 min,上机前5 min加入5 μL PI,补加200 μL的Binding Buffer,流式细胞仪检测细胞凋亡。实验重复3次。
1.5 Western blot检测XIAP、Caspase-3蛋白表达提取1.2中培养48 h的空白对照组,α-细辛醚中、高剂量组细胞总蛋白(前期实验提示中、高剂量α-细辛醚诱导凋亡效果更佳),BCA法测定蛋白浓度,取30 μg蛋白进行SDS-PAGE电泳,将蛋白转移到PVDF膜上,室温封闭2 h,分别加入内参β-actin和兔抗人一抗(按1:2 000稀释),4 ℃反应过夜,洗膜,加入HRP标记羊抗兔二抗(按1:1 000稀释),室温振摇反应1 h,洗膜,加入ECL超敏发光液,室温孵育3 min,曝光照相,使用Quantityone分析条带灰度值,以目的条带与内参条带灰度值的比值代表目的蛋白的表达水平。实验重复3次。
1.6 实时荧光定量PCR法检测XIAP、caspase-3 mRNA的相对表达量 取1.2中培养48 h的空白对照组,α-细辛醚中、高剂量组细胞,按Trizol抽提法提取总RNA,反转录得cDNA,进行PCR,检测XIAP、caspase-3 mRNA的表达,引物由北京市理化分析测试中心合成。引物序列如下:β-actin 上游引物序列5’-CCGTCTTCCCCTCCATCG-3’,下游引物序列5’-GTCCCAGTTGGTGACGATGC-3’,扩增片段长度155 bp;XIAP上游引物序列5’-CCGTGCGGTGCTT TAGTTGT-3’,下 游 引 物 序 列5’-TTCCTCGGG TATATGGTGTCTGAT-3’,扩增片段长度292 bp;caspase-3上游引物序列5’-CAGTGGAGGCCGACT TCTTG-3’,下 游 引 物 序 列5’-TGGCA CAAAGCGACTGGAT-3’,扩增片段长度101 bp。PCR反应条件: 95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火/延伸1 min,共40个循环。以β-actin为内参,根据 2-ΔΔCT法计算目的基因的相对表达量。实验重复3次。
1.7 统计学处理 应用SPSS 19.0处理数据。采用单因素方差分析比较5组间细胞增殖情况和凋亡率以及空白对照组及α-细辛醚中、高剂量组XIAP、caspase-3 mRNA与蛋白表达水平的差异,两两比较采用LSD-t法,检验水准α=0.05。
2 结果
2.1 α-细辛醚对Eca-109细胞形态的影响 AO/EB染色后荧光倒置显微镜下可见空白对照组核染色质被染成绿色且显现正常结构;α-细辛醚处理后,部分细胞核染色质呈凝结状,被染成绿色,另有部分细胞核染色质被染成橘红色,同时可见部分细胞呈半月形。见图 1。
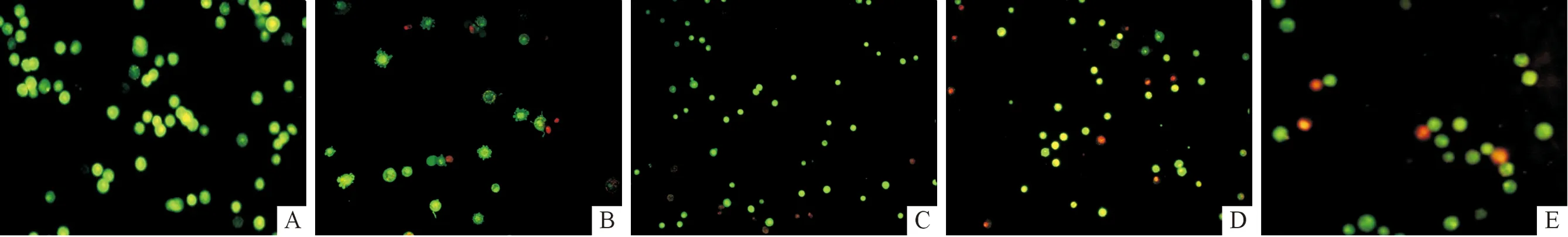
A:空白对照组;B:5-FU组;C:α-细辛醚低剂量组;D:α-细辛醚中剂量组;E:α-细辛醚高剂量组。图1 5组Eca-109细胞形态观察(AO/EB,×200)
2.2 α-细辛醚对 Eca-109 细胞增殖能力和凋亡的影响 与空白对照组比较,5-FU和不同剂量的α-细辛醚均可抑制 Eca-109细胞增殖,促进其凋亡,结果见表1。

表1 各组光密度值和细胞凋亡率的比较(n=3)
*:与空白对照组比较,P<0.05;△:与α-细辛醚高剂量组比较,P<0.05;#:组间两两比较,P均<0.05。
2.3 α-细辛醚对 Eca-109 细胞XIAP、Caspase-3蛋白表达的影响 与空白对照组比较,α-细辛醚处理Eca-109 细胞48 h后,XIAP蛋白表达降低、Caspase-3蛋白表达升高,结果见图2、表2。

1:空白对照组;2:α-细辛醚中剂量组;3:α-细辛醚高剂量组。图2 3组Eca-109细胞中XIAP、Caspase-3蛋白的表达

表2 3组细胞XIAP、Caspase-3蛋白表达的比较(n=3)
#:组间两两比较,P均<0.05。
2.4 α-细辛醚对 Eca-109 细胞XIAP、caspase-3 mRNA表达的影响 与空白对照组比较,α-细辛醚处理Eca-109 细胞48 h后,XIAP mRNA表达降低、caspase-3 mRNA表达升高,结果见表3。
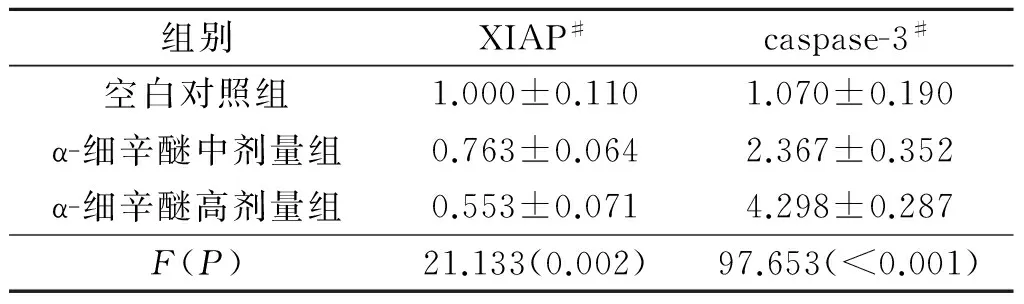
表3 3组细胞XIAP、caspase-3 mRNA表达的比较(n=3)
#:组间两两比较,P均<0.05。
3 讨论
细胞凋亡是一个由基因调控的、主动的、程序化死亡过程[3],各种凋亡信号通过线粒体、死亡受体、内质网信号途径传递信息,诱导细胞内caspase 活化,最终导致细胞凋亡[4]。与细胞凋亡抑制相关的信号分子或基因有很多,XIAP就是其中之一。XIAP是凋亡抑制蛋白IAP家族中的一员,具有IAP家族特征性的结构——BIR结构域。BIR结构域约由70个氨基酸组成,位于IAP氨基端,是IAP家族执行细胞凋亡抑制功能的必需氨基酸序列,是IAP与caspase、Smac结合的结构基础[5]。XIAP定位于Xp25,包含N端的BIR 1~3三个结构域和C 端的RNG锌指结构域[6]。XIAP在人体的多种组织中表达,在正常组织中低水平表达,而在多种恶性肿瘤中表达明显升高[7],提示XIAP可促进肿瘤的发生发展。
XIAP可通过以下3个途径抑制细胞凋亡。一是XIAP直接与caspase-3结合抑制凋亡。凋亡相关的caspase按其生化特征和功能可分为起始caspase(上游caspase)和效应caspase(下游caspase),起始caspase包括caspase-2、8、9、10,效应caspase包括caspase-3、6、7,其中caspase-3是一个关键调控点,可能是整个细胞凋亡级联反应中的必经之路[8]。研究[9]表明,XIAP分别通过BIR 1、BIR 2结构域与效应caspase-3、7结合,通过BIR 3-RING锌指结构与凋亡起始分子caspase-9的活性部位相结合,从而抑制细胞凋亡。二是通过 NF-κB途径抑制细胞凋亡[10]。三是通过参与MAPK 等信号转导途径抑制细胞凋亡[11]。XIAP的凋亡抑制功能受多种因素的调节,其中Smac是最重要的,Smac可以与XIAP的BIR 1、BIR 2结合,从而破坏BIR 3与上游caspase-9之间的结合,并破坏Linker-BIR 2与caspase-3、7之间的相互作用,从而解除XIAP对caspase的抑制,促进细胞凋亡[12],可以说Smac是天然的XIAP抑制剂。在前期研究[13]中,作者发现α-细辛醚可激活线粒体通路,导致Smac因子释放,促进Eca-109细胞凋亡。该研究显示,与空白对照组比较,α-细辛醚组细胞凋亡率升高,而XIAP蛋白及mRNA表达显著降低,这表明α-细辛醚可下调XIAP表达,从而诱导Eca-109细胞凋亡。
caspase-3是caspase家族中的重要成员。研究[14]表明,触发细胞凋亡的多数因素均需要通过caspase-3介导执行,细胞凋亡的某些特征性标志,如DNA片段化和染色体凝聚等,也与caspase-3有着直接的关系。该研究显示,与空白对照组比较,caspase-3 mRNA及蛋白表达升高,这表明α-细辛醚可上调caspase-3的表达,从而诱导Eca-109细胞凋亡。
鉴于多种信号分子或基因参与凋亡抑制或者逃避,促进了肿瘤的发生、发展及化疗药物耐药性的形成,因而针对诸如XIAP等抑制剂的研发成为肿瘤治疗新的热点,如XIAP反义寡核苷酸抑制剂、XIAP小分子抑制剂等[15],然限于技术难度、不良反应以及价格高昂等问题,进展缓慢,未在临床普及应用。中药具有高效、低毒、价廉等优点。该研究显示,α-细辛醚可充当天然的XIAP抑制剂,发挥化疗药的功效,然其作用分子机制仍不甚明了,尚需深入的研究与探索。
[1]VANDEN BERGHE T,KAISER WJ,BERTRAND MJ,et al.Molecular crosstalk between apoptosis, necroptosis, and survival signaling[J].Mol Cell Oncol,2016,2(4):e975093
[2]CHAUDHARY AK,YADAV N,BHAT TA,et al.A potential role of X-linked inhibitor of apoptosis protein in mitochondrial membrane permeabilization and its implication in cancer therapy[J].Drug Discov Today,2016,21(1):38
[3]高薇,侯微,李伟,等.细胞凋亡机制研究进展[J].中国畜牧兽医,2014,41(10):150
[4]MORATA G,BALLESTEROS-ARIAS L.Cell competition, apoptosis and tumour development[J].Int J Dev Biol,2015,59(1/3):79
[5]VASUDEVAN D,RYOO HD.Regulation of cell death by IAPs and their antagonists[J].Curr Top Dev Biol,2015,114:185
[6]WERNER TA,TAMKAN-ÖLCEK Y,DIZDAR L,et al.Survivin and XIAP:two valuable biomarkers in medullary thyroid carcinoma[J].Br J Cancer,2016,114(4):427
[7]陈雷,尚培中.Xiap、Smac与消化系肿瘤的研究进展[J].中国现代普通外科进展,2016,19(4):300
[8]WU W,WAN OW,CHUNG KK.S-nitrosylation of XIAP at Cys 213 of BIR2 domain impairs XIAP′s anti-caspase 3 activity and anti-apoptotic function[J].Apoptosis,2015,20(4):491
[9]JIN Z,YAN W,JIN H,et al.Psoralidin inhibits proliferation and enhances apoptosis of human esophageal carcinoma cells via NF-κB and PI3K/Akt signaling pathways[J].Oncol Lett,2016,12(2):971
[10]XU CL,ZHENG B,PEI JH,et al.Embelin induces apoptosis of human gastric carcinoma through inhibition of p38 MAPK and NF-κB signaling pathways[J].Mol Med Rep,2016,14(1):307
[11]ELSAWY MA,TIKHONOVA IG,MARTIN L,et al.Smac-derived Aza-peptide as an aminopeptidase-resistant XIAP BIR3 antagonist[J].Protein Pept Lett,2015,22(9):836
[12]MIRZAYANS R,ANDRAIS B,KUMAR P,et al.The growing complexity of cancer cell response to DNA-damaging agents:Caspase 3 mediates cell death or survival? [J].Int J Mol Sci,2016,17(5):pii:E708
[13]张妍,何航,王丽,等. α-细辛醚调控GADD153 和Smac mRNA 表达诱导人食管癌细胞株Eca-109 凋亡研究[J]. 医学研究生学报,2016,29(10):1046
[14]郭艳丽,李颖霞,陈奎生,等.食管鳞状细胞癌组织中USP22、C-myc和Caspase-3蛋白的表达[J].郑州大学学报(医学版), 2014,49(4):452
[15]FU X,PANG X,QI H,et al.XIAP inhibitor Embelin inhibits bladder cancer survival and invasioninvitro[J].Clin Transl Oncol,2016,18(3):277
(2016-08-05收稿 责任编辑徐春燕)
Effect of α-asarone on apoptosis of Eca-109 cells and expressions of XIAP and caspase-3
ZHANGYan,HEHang,HANQianqian,WANGBaiyan,ZHUYanqin
SchoolofBasicMedicine,HenanUniversityofTraditionalChineseMedicine,Zhengzhou450046
α-asarone;X-linked inhibitor of apoptosis protein;caspase-3;apoptosis;Eca-109 cell
Aim: To observe the apoptosis-inducing effect of α-asarone on esophageal carcinoma Eca-109 cells and changes of the expressions of XIAP and caspase-3, and explore the underlying mechanism. Methods: Eca-109 cells were allocated into 5 groups, and treated with 5-FU(positive control group), 25,50,100 mg/L α-asarone(low-,medium-,and high- dose α-asarone groups) and culture medium(blank control group),respectively. After 48 h, morphologic changes were observed under inverted fluorescence microscope after AO/EB staining. MTT and Annexin-V/PI method were used to detect cell proliferation and apoptosis. Western blot and real-time quantitative PCR were adopted to detect XIAP and caspase-3 mRNA and protein expressions in blank control group,medium-dose α-asarone group and high-dose α-asarone group. Results: Compared with blank control group, cell proliferation rate in different doses of α-asarone groups and positive control group decreased significantly, while cell apoptosis rate increased significantly(P<0.05).In contrast with blank control group,the expressions of XIAP mRNA and protein decreased significantly, while those of caspase-3 increased significantly in medium- and high- dose α-asarone groups(P<0.05).Conclusion: α-asarone could inhibit Eca-109 cells proliferation and induce cell apoptosis by down-regulating XIAP expression and up-regulating caspase-3 expression.
10.13705/j.issn.1671-6825.2017.04.001
*河南省基础与前沿技术研究项目 072300450030;河南省科学技术研究重点项目 13A310612;郑州市科技攻关项目 121PCXTD520;河南省教育厅高等学校重点科研项目 16A310021
R735.1