染料木黄酮对去势抵抗前列腺癌22RV1细胞增殖的影响*
2017-07-24朱彦锋陈静瑶贺易琼余小平
李 飞,朱彦锋,陈静瑶,周 杰,贺易琼,余小平
成都医学院公共卫生系卫生学教研室 成都 610500
染料木黄酮对去势抵抗前列腺癌22RV1细胞增殖的影响*
李 飞,朱彦锋,陈静瑶,周 杰,贺易琼,余小平#
成都医学院公共卫生系卫生学教研室 成都 610500
#通信作者,男,1970年10月生,博士,教授,研究方向:植物化学物质抗肿瘤分子机制,E-mail:cyggwsyxp@sina.com
染料木黄酮;去势抵抗前列腺癌;增殖;22RV1细胞
目的:探讨大豆异黄酮对去势抵抗前列腺癌细胞增殖的抑制作用及可能机制。方法:以不同浓度[0.0、12.5、25.0、50.0、100.0和(或)200.0 μmol/L]的染料木黄酮处理去势抵抗前列腺癌细胞22RV1,在24、48、72 h采用CCK-8法测定细胞增殖情况,流式细胞术检测细胞周期,免疫细胞化学法检测Ki-67表达水平,Western blot法检测PSA、P53、CyclinD1、PCNA及AR表达水平。结果:染料木黄酮对22RV1细胞具有抑制作用。流式细胞术结果显示,染料木黄酮阻滞细胞周期于G2/M期(P<0.05)。免疫细胞化学法检测结果显示,染料木黄酮能够抑制细胞中Ki-67的表达(P<0.05)。Western blot结果显示染料木黄酮处理后细胞中CyclinD1、PCNA、PSA、AR的表达下降,P53的表达上调(P<0.05)。结论:染料木黄酮能够抑制22RV1细胞的增殖,其作用机制可能与阻滞细胞G2/M期及下调周期蛋白CyclinD1表达有关。
前列腺癌是男性最常见的恶性肿瘤[1],在我国发病率高达11.0/10万[2]。前列腺癌是一种雄激素依赖性肿瘤,雄激素剥夺治疗是主要治疗方法,但剥夺治疗1~2 a后,大多数患者逐渐发展成为雄激素非依赖前列腺癌,即去势抵抗前列腺癌。新近有研究[3-5]提示,大豆异黄酮能够降低罹患前列腺癌的风险,且能通过非性激素途径抑制前列腺癌的发生与发展[6-7],但大豆异黄酮对去势抵抗前列腺癌的作用尚不明确。该研究旨在探讨大豆异黄酮活性成分之一染料木黄酮对去势抵抗前列腺癌22RV1细胞的抑制作用及作用机制。
1 材料与方法
1.1 细胞及主要试剂 22RV1细胞株(中国科学院上海细胞库),RPMI 1640培养基、CCK-8试剂盒(南京凯基公司),胎牛血清(Millipore公司),BCA蛋白定量试剂盒、细胞周期与细胞凋亡检测试剂盒(江苏碧云天公司),HE染色试剂盒(南京建成公司),PSA、CyclinD1、PCNA、P53、Ki-67兔抗人单克隆抗体(Abcam公司),山羊抗兔二抗Alexa Fluor 488(Abcam公司),AR鼠抗人单克隆抗体(Santa Cruz公司),β-actin单克隆抗体、GAPDH单克隆抗体、山羊抗兔二抗及山羊抗鼠二抗(北京中杉金桥生物技术有限公司),染料木黄酮和溶剂DMSO(Sigma公司)。
1.2 细胞生长情况的CCK-8法检测 取对数生长期的22RV1细胞接种于96孔板,5 000个/孔。37 ℃、体积分数5%CO2、饱和湿度条件下培养24 h,暴露于0.0、12.5、25.0、50.0、100.0、200.0 μmol/L的染料木黄酮,每组设5个复孔。培养24、48、72 h,分别加入含CCK-8的培养基100 μL孵育4 h。采用酶标仪测定每孔吸光度(OD),波长设为450 nm,绘制细胞生长曲线并计算IC50及细胞活性,细胞活性=(OD加药-OD空白)/(OD对照-OD空白)×100%。
1.3 细胞形态的观察 制作22RV1细胞爬片,给予0.0、12.5、25.0、50.0、100.0、200.0 μmol/L的染料木黄酮处理72 h,40 g/L多聚甲醛固定30 min,HE染色后在显微镜下观察并拍照。
1.4 细胞周期的流式细胞仪检测 22RV1细胞给予0.0、12.5、25.0、50.0、100.0、200.0 μmol/L染料木黄酮处理72 h,收集细胞,1 000×g离心5 min,加入预冷PBS重悬细胞,1 000×g离心5 min,体积分数70%乙醇固定过夜,1 000×g离心5 min,去除乙醇,加入碘化丙啶缓慢重悬细胞,37 ℃避光温浴30 min,采用流式细胞仪检测细胞周期。实验重复3次。
1.5 Ki-67表达的免疫细胞化学法检测 将22RV1细胞接种于6孔板,20 000个/孔。37 ℃、体积分数5%CO2及饱和湿度条件下培养24 h,给予0.0、12.5、25.0、50.0、100.0、200.0 μmol/L的染料木黄酮处理细胞72 h,40 g/L多聚甲醛固定,体积分数0.5%Triton-100通透,体积分数5%BSA常温下封闭1 h。加入一抗兔抗人Ki-67单克隆抗体,4 ℃孵育过夜, TBST洗涤,加入二抗Alexa Fluor 488,常温下避光孵育1 h,用DAPI复染,在荧光显微镜下观察、拍照,并采用Image-Pro Plus进行定量分析。实验重复3次。
1.6 PSA、AR、P53、CyclinD1、PCNA蛋白表达的Western blot法检测 0.0、12.5、25.0、50.0、100.0 μmol/L染料木黄酮处理22RV1细胞72 h,用PBS清洗后加入裂解液和蛋白酶抑制剂的混合物,冰上裂解30 min,收集细胞于EP管。4 ℃下12 000×g离心20 min,取上清。BCA法蛋白定量,定量后分装保存于-80 ℃待用。制备SDS-聚丙烯酰胺凝胶并以80 V跑过浓缩胶,120 V 1 h进行蛋白分离电泳,100 V恒压湿转1.5 h,PVDF浸入体积分数5%的脱脂牛奶中封闭,室温缓慢振荡1 h;TBST洗膜3次,每次5 min;加入一抗(兔抗人PSA、 CyclinD1、 PCNA、 P53单克隆抗体,鼠抗人AR、β-actin、GAPDH单克隆抗体;除鼠抗人AR单克隆抗体按1:200稀释外,余均按1:1 000稀释),4 ℃摇床孵育过夜;TBST洗膜3次,每次5 min;加入二抗(按1:4 000稀释)室温孵育1.5 h;TBST洗膜3次,每次10 min;凝胶成像仪曝光成像,利用Image J软件进行灰度分析,以目的条带灰度值和β-actin、GAPDH条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.7 统计学处理 采用SPSS 21.0进行数据分析。不同组间细胞周期、Ki-67、P53、PCNA、CyclinD1、PSA及AR蛋白相对表达量的比较均采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1 染料木黄酮对22RV1细胞增殖的抑制作用 结果见图1。由图1可知,染料木黄酮能有效抑制22RV1细胞的增殖,且染料木黄酮处理48 h 的IC50为90.5 μmol/L。
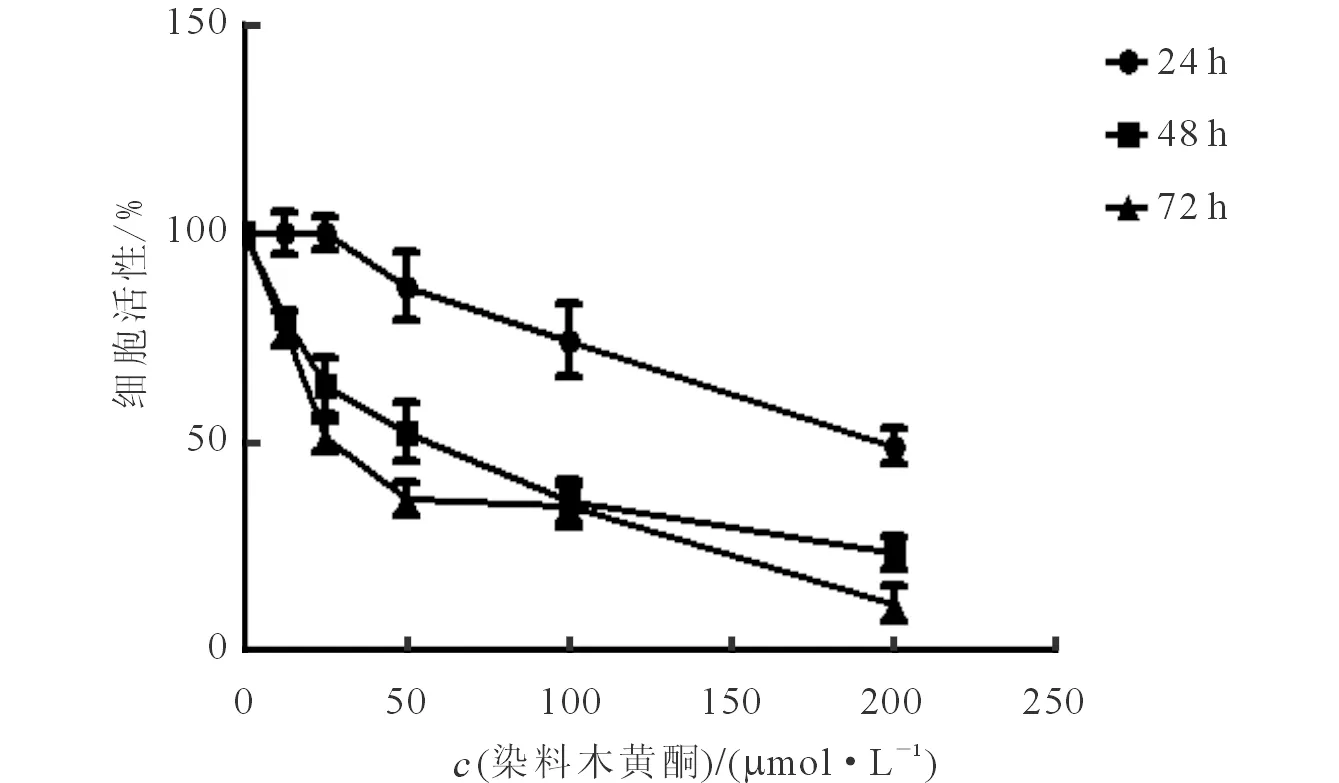
图1 22RV1细胞生长曲线
2.2 染料木黄酮对22RV1细胞形态的影响 结果见图2。由图2可知,与对照相比,随着染料木黄酮浓度的增加,22RV1细胞体积缩小,且呈单个分布,胞质致密,嗜酸性染色增强,核染加深。
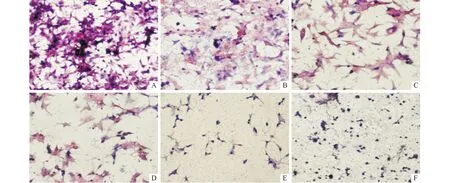
A:0.0 μmol/L组;B:12.5 μmol/L组;C:25.0 μmol/L组;D:50.0 μmol/L组;E:100.0 μmol/L组;F:200.0 μmol/L组。图2 染料木黄酮对22RV1 细胞形态的影响(HE,×400)
2.3 染料木黄酮对22RV1细胞Ki-67表达的抑制作用 染料木黄酮作用于22RV1细胞72 h后,Ki-67的表达随着染料木黄酮浓度的增加而减弱。见图3、表1。
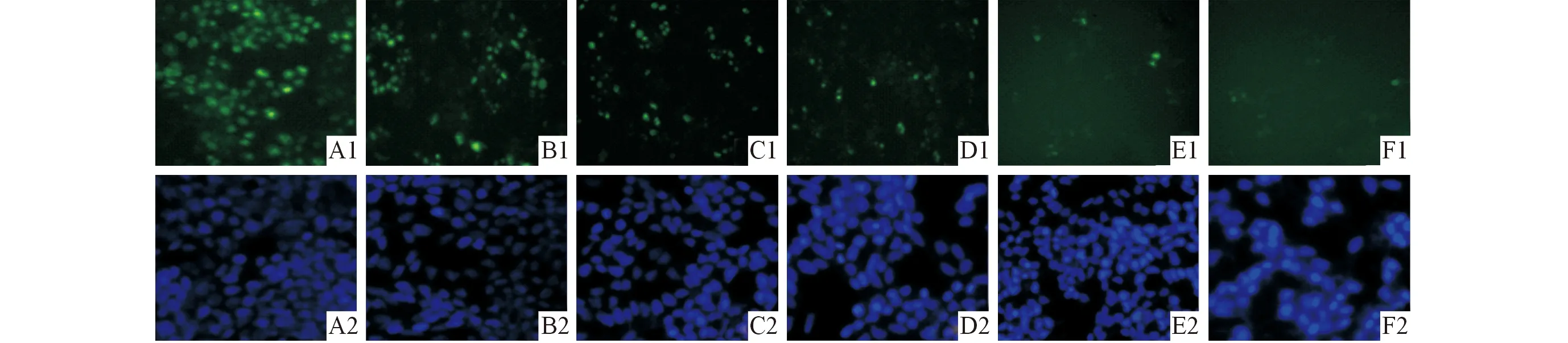
1:Ki-67;2:DAPI;A:0.0 μmol/L组;B:12.5 μmol/L组;C:25.0 μmol/L组;D:50.0 μmol/L组;E:100.0 μmol/L组;F:200.0 μmol/L组。图3 染料木黄酮对22RV1细胞Ki-67表达的影响(免疫荧光,×200)

表1 各组22RV1细胞Ki-67相对表达量比较(n=3)
F=1 041.636,P<0.001;*:与0.0 μmol/L组比较,P<0.05;#:与12.5 μmol/L组比较,P<0.05;△:与25.0 μmol/L组比较,P<0.05;▲:与50.0 μmol/L组比较,P<0.05。
2.4 染料木黄酮对22RV1细胞周期的影响 染料木黄酮处理22RV1细胞72 h后,G2/M期细胞随着染料木黄酮浓度的增加而增多,而G1/G0期及S期的细胞减少(表2)。
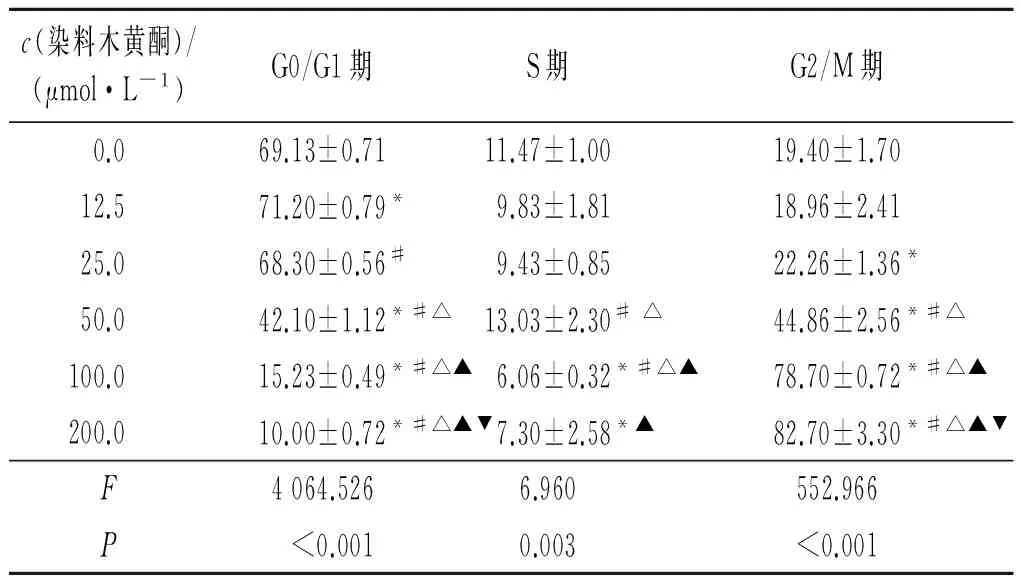
表2 不同浓度染料木黄酮对22RV1细胞周期的影响(n=3) %
*:与0.0 μmol/L组比较,P<0.05;#:与12.5 μmol/L组比较,P<0.05;△:与25.0 μmol/L组比较,P<0.05;▲:与50.0 μmol/L组比较,P<0.05;▼:与100.0 μmol/L组比较,P<0.05。
2.5 染料木黄酮对22RV1细胞中P53、PCNA、CyclinD1、PSA及AR表达的影响 染料木黄酮处理22RV1细胞72 h后,22RV1细胞内CyclinD1、PCNA、PSA及AR的表达水平随着染料木黄酮浓度的增高而逐渐降低,而P53的表达水平随着染料木黄酮浓度的增高而逐渐上升。见图4、5和表3。
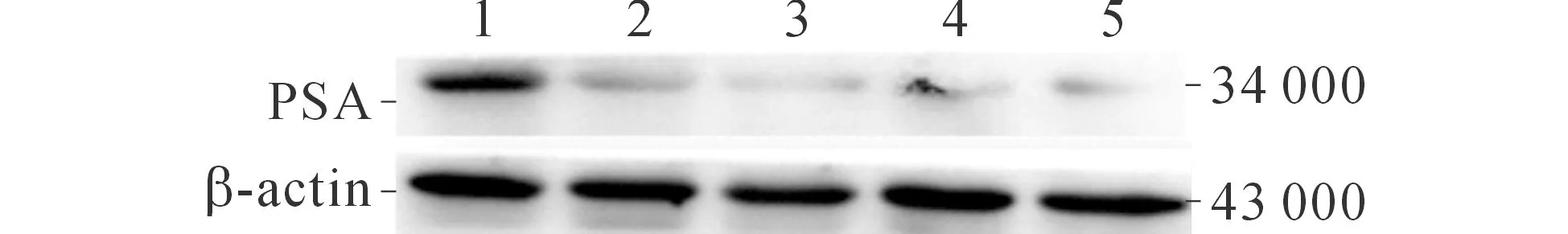
1~5:分别为0.0、12.5、25.0、50.0、100.0 μmol/L组。图4 染料木黄酮对22RV1细胞PSA表达的影响
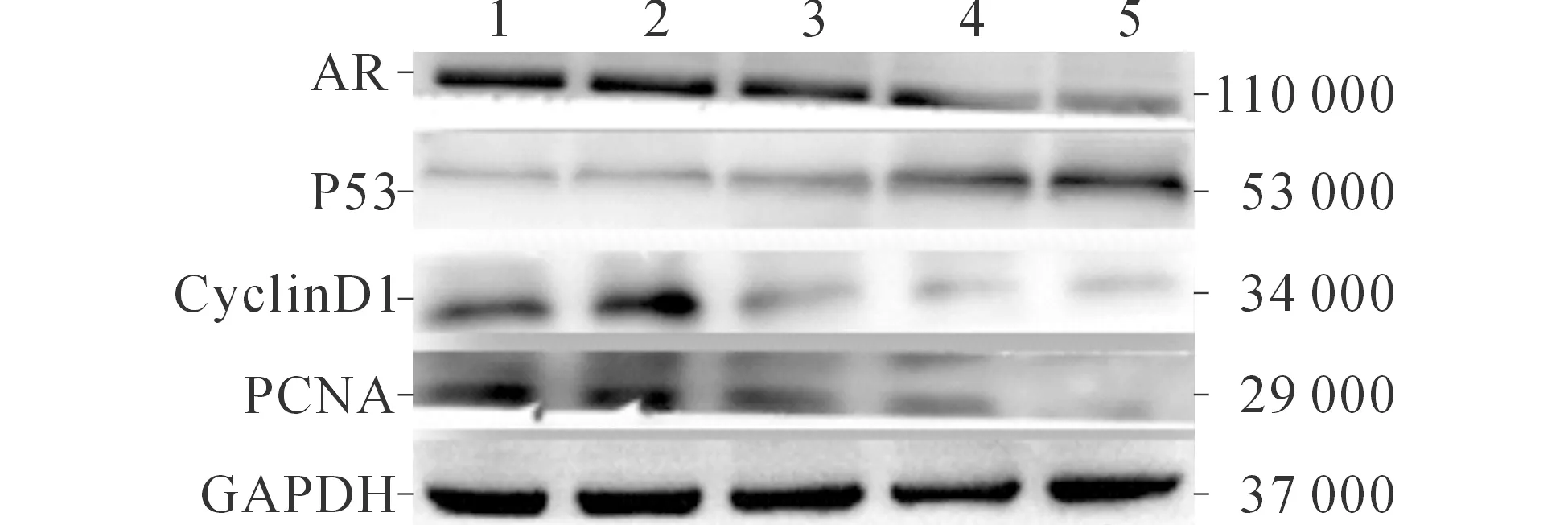
1~5:分别为0.0、12.5、25.0、50.0、100.0 μmol/L组。图5 染料木黄酮对22RV1细胞AR、P53、CyclinD1、PCNA表达的影响
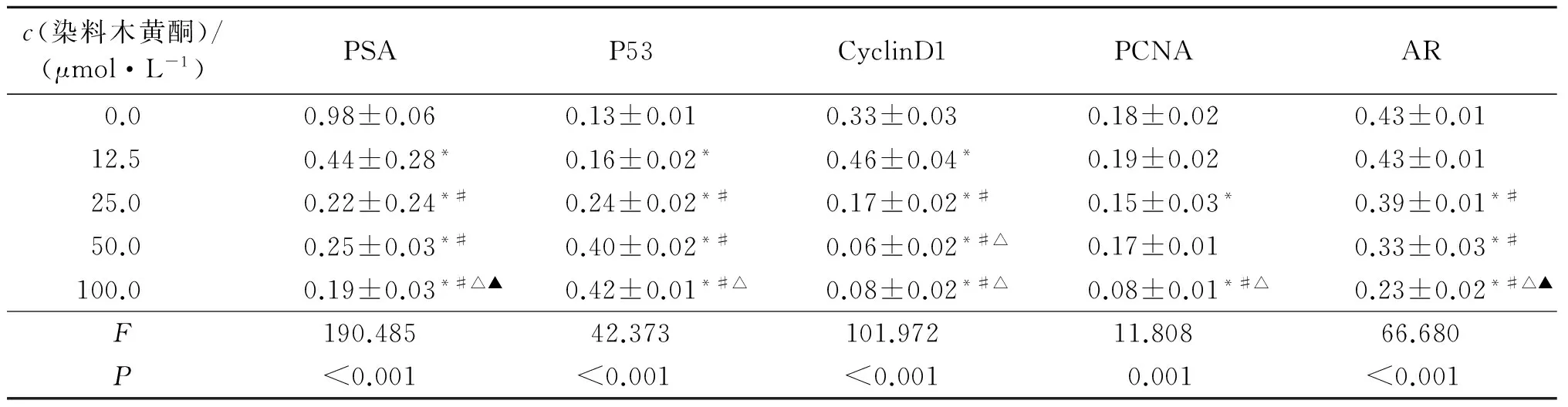
表3 各组22RV1细胞PSA、P53、CyclinD1、PCNA及AR蛋白相对表达量比较(n=3)
*:与0.0 mol/L组比较,P<0.05;#:与12.5 μmol/L组比较,P<0.05;△:与25.0 μmol/L组比较,P<0.05;▲:与50.0 μmol/L组比较,P<0.05。
3 讨论
大豆异黄酮是一类广泛存在于豆类中的天然黄酮类化合物,具有多种生物活性,包括缓解更年期综合征,预防女性骨质疏松,调节脂代谢,降低乳腺癌及前列腺癌发病风险等[8]。近年来,大豆异黄酮抗前列腺癌功能受到广泛关注[9-11]。已有资料[12]显示,大豆异黄酮可通过诱导前列腺癌细胞凋亡、抑制增殖、增敏化疗药物效果、拮抗雄激素介导的信号通路等途径抗前列腺癌。该研究结果显示,大豆异黄酮的主要活性单体染料木黄酮能显著抑制22RV1细胞增殖。
染料木黄酮处理22RV1细胞48 h 时IC50为90.5 μmol/L,与ZHANG等[13]的研究结果略有差异,这种差异可能是22RV1细胞对染料木黄酮敏感性较低造成的。HE染色结果显示,在高浓度时,22RV1细胞具有凋亡趋势,这与DONG等[14]发现染料木黄酮能诱导LNCaP细胞凋亡相符。Ki-67常用于检测恶性肿瘤细胞增殖状态,Ki-67表达增加说明肿瘤细胞增殖活跃[15]。该研究发现,染料木黄酮作用后,22RV1细胞中Ki-67的表达明显减弱,进一步证实染料木黄酮对22RV1细胞的增殖具有抑制作用。
细胞周期调控异常可能导致细胞的异常增殖,形成永生性细胞从而导致肿瘤。该研究发现,染料木黄酮可使22RV1细胞阻滞于G2/M期。而有研究[16]发现,染料木黄酮在10.0和25.0 μmol/L时可使乳腺癌细胞MCF-7 阻滞于G1/G0期; SHEN等[17]研究发现染料木黄酮(<25.0 μmol/L)可阻滞LNCaP细胞于G1/G0期,这种差异可能与染料木黄酮的浓度有关。而ZHANG等[18]研究发现,染料木黄酮在浓度为50.0~100.0 μmol/L时对HCT-116/SW-480细胞的G2/M期具有明显的阻滞作用。KANG等[19]研究发现,低浓度的染料木黄酮可增强LNCaP细胞对低剂量放疗的敏感性,使G2/M期细胞的比例增加。以上说明染料木黄酮能够通过阻滞G2/M期来抑制22RV1细胞的增殖。
PSA是前列腺癌特异性标志物,其表达升高可较敏感地提示肿瘤的进展转移等。前列腺癌患者接受去雄激素治疗后PSA水平下降,但转为去势抵抗前列腺癌后血清中PSA水平回升。作者发现染料木黄酮能降低22RV1细胞中PSA的表达,说明染料木黄酮可通过抑制PSA表达发挥抗去势抵抗前列腺癌的作用。另一方面PSA也是临床相关的AR反应性基因,其常用于监测前列腺癌患者的治疗反应、预后和进展[20]。AR通过在PSA的启动子区域中结合AR响应元件来调节PSA转录[21]。该研究结果显示,染料木黄酮能够下调22RV1细胞中AR的表达,这提示染料木黄酮有可能作用于AR信号通路进而抑制22RV1细胞PSA的表达,其机制还需进一步研究。
PCNA是DNA聚合酶δ的辅助因子,PCNA的合成和表达与细胞的增殖状态有关。cyclinD1是一种原癌基因,是细胞周期的正调节因子,与细胞周期蛋白依赖性激酶结合后,可以促进细胞从G1期顺利进入S期,继而发生分裂与增殖,其过度表达可致细胞增殖失控而恶性化。研究[22]发现染料木黄酮能够抑制DU145细胞中CyclinD1的表达。该研究中作者发现染料木黄酮能抑制PCNA和CyclinD1的表达,说明染料木黄酮抑制22RV1细胞增殖可能是通过下调PCNA和CyclinD1的表达来实现。p53是一种抑癌基因,前列腺癌细胞中P53表达普遍降低,作者发现染料木黄酮能上调P53表达,说明染料木黄酮能通过上调P53表达来抑制22RV1细胞增殖。ZHAO等[23]研究发现染料木黄酮在10.0 μmol/L时能上调P53的表达来阻滞LNCaP细胞于G2/M期,与该研究中的作用浓度基本相符。
去势抵抗前列腺癌是前列腺癌发展的后期阶段,内分泌治疗是去势抵抗前列腺癌治疗的主流方法之一,但如何提升内分泌治疗的效果是当前临床应用的主要问题。该研究发现染料木黄酮能够通过阻滞细胞G2/M期及调节相关周期蛋白来抑制22RV1细胞的增殖及PSA表达,为去势抵抗前列腺癌的内分泌治疗提供了新的思路。
[1]SIEGEL RL,MILLER KD,JEMAL A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7
[2]韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330
[3]YAN L,SPITANAGEL EL.Soy consumption and prostate cancer risk in men:a revisit of a meta-analysis[J].Am J Clin Nutr,2009,89(4):1155
[4]AUFDERKLAMM S,MILLER F,GALASSO A,et al.Chemoprevention of prostate cancer by isoflavonoids[J].Recent Results Cancer Res,2014,202:101
[5]李飞,朱彦锋,余小平.大豆异黄酮防治前列腺癌的研究进展[J].食品工业科技,2016,37(1):396
[6]LAZAREVIC B,BOEZELIJN G,DIEP LM,et al.Efficacy and safety of short-term genistein intervention in patients with localized prostate cancer prior to radical prostatectomy:a randomized,placebo-controlled,double-blind phase 2 clinical trial[J].Nutr Cancer,2011,63(6):889
[7]VAN DIE MD,BONE KM,WILLIAMS SG,et al.Soy and soy isoflavones in prostate cancer: a systematic review and meta-analysis of randomized controlled trials[J].BJU Int,2014,113(5b):E119
[8]ADJAKLY M,NGOLLO M,DAGDEMIR A,et al.Prostate cancer:the main risk and protective factors.Epigenetic modifications[J].Ann Endocrinol(Paris),2015,76(1):25
[9]MAHMOUD AM,YANG W,BOSLAND MC.Soy isoflavones and prostate cancer:a review of molecular mechanisms[J].J Steroid Biochem Mol Biol,2014,140:116
[10]SAKAI M,MARTINEZ-ARGUELLES DB,APRIKIAN AG,et al.De novo steroid biosynthesis in human prostate cell lines and biopsies[J].Prostate,2016,76(6):575
[11]AHMAD A,BIERSACK B,LI Y,et al.Perspectives on the role of isoflavones in prostate cancer[J].AAPS J,2013,15(4):991
[12]D′ADAMO CR,SAHIN A.Soy foods and supplementation:a review of commonly perceived health benefits and risks[J].Altern Ther Health Med,2014,20(Suppl 1):39
[13]ZHANG SM,WANG YR,CHEN ZJ,et al.Genistein enhances the efficacy of cabazitaxel chemotherapy in metastatic castration-resistant prostate cancer cells[J].Prostate,2013,73(15):1681
[14]DONG X,XU W,SIKES RA,et al.Apoptotic effects of cooked andinvitrodigested soy on human prostate cancer cells[J].Food Chem,2012,135(3):1643
[15]INWALD EC,KLINKHAMMER-SCHALKE M,HOFSTD-TER F,et al.Ki-67 is a prognostic parameter in breast cancer patients:results of a large population-based cohort of a cancer registry[J].Breast Cancer Res Treat,2013,139(2):539
[16]TSUBOY MS,MARCARINI JC,DE SOUZA AO,et al.Genistein at maximal physiologic serum levels induces G0/G1 arrestin MCF-7 and HB4a cells,but not apoptosis[J].J Med Food,2014,17(2):218
[17]SHEN JC,KLEIN RD,WEI Q,et al.Low-dose genistein induces cyclin-dependent kinase inhibitors and G1cell-cycle arrest in human prostate cancer cells[J].Mol Carcinog,2000,29(2):92
[18]ZHANG ZY,WANG CZ,DU GJ,et al.Genistein induces G2/M cell cycle arrest and apoptosis via ATM/p53-dependent pathway in human colon cancer cells[J].Int J Oncol,2013,43(1):289
[19]KANG NH,SHIN HC,OH S,et al.Soy milk digestion extract inhibits progression of prostate cancer cell growth via regulation of prostate cancer-specific antigen and cell cy-cle-regulatory genes in human LNCaP cancer cells[J].Mol Med Rep,2016,14(2):1809 [20]MIZOKAMI A,IZUMI K,KONAKA H,et al.Understanding prostate-specific antigen dynamics in monitoring metastatic castration-resistant prostate cancer: implications for clinical practice[J].Asian J Androl,2017,19(2):143
[21]任凯,丁岩,成凡,等.鞘脂激活蛋白C通过上调雄激素受体的表达与活性促进LNCaP细胞的增殖[J].西安交通大学学报(医学版),2013,34(5):619
[22]AGARWAL R.Cell signaling and regulators of cell cycle as molecular targets for prostate cancer prevention by dietary agents[J].Biochem Pharmacol,2000,60(8):1051
[23]ZHAO R,XIANG N,DOMANN FE,et al.Effects of selenite and genistein on G2/M cell cycle arrest and apoptosis in human prostate cancer cells[J].Nutr Cancer,2009,61(3):397
(2016-11-04收稿 责任编辑姜春霞)
Effects of genistein on proliferation of castrate-resistant prostate cancer 22RV1 cells
LIFei,ZHUYanfeng,CHENJingyao,ZHOUJie,HEYiqiong,YUXiaoping
DepartmentofHygiene,DivisionofPublicHealth,ChengduMedicalCollege,Chengdu610500
genistein;castrate-resistant prostate cancer;proliferation;22RV1 cell
Aim: To explore the effect of soy isoflavones,genistein on the proliferation of castration-resistant prostate cancer 22RV1 cells and its potential mechanism. Methods: 22RV1 cells were treated with genistein at 0.0, 12.5, 25.0, 50.0, 100.0, and/or 200.0 μmol/L for 24, 48, 72 hours followed by determination of their proliferation by CCK-8 assay, and their cell cycle by flow cytometry. The expression of Ki-67 was detected by immunocytochemistry. The expressions of PSA, CyclinD1, PCNA, P53 and AR protein were detected by Western blot. Results: Genistein had inhibitory effect on 22RV1 cells. Flow cytometry results showed that the cell cycle in the genistein treated groups was arrested at G2/M phase(P<0.05). The expression of Ki-67 in the genistein-treated groups was significantly lower than that in the control group(P<0.05). The results of Western blot showed that genistein could reduce CyclinD1, PCNA, PSA, and AR expressions,and increase P53 expression(P<0.05). Conclusion: Genistein could inhibit the proliferation of 22RV1 cells via arresting the cell cycle and reducing the expression of CyclinD1.
10.13705/j.issn.1671-6825.2017.04.005
*国家自然科学基金资助项目 81402678,81573154;四川省青年科技创新研究团队项目 2014TD0021;成都医学院大学生创新实验项目 201513705027
R737.25