miRNA-182对细胞内钠离子通道蛋白Nav1.7表达的影响*
2017-07-24蔡伟华邵金平王剑南苏松雪臧卫东
李 鸣,蔡伟华,邵金平,王剑南,苏松雪,李 磊,曹 靖,臧卫东
郑州大学基础医学院人体解剖学教研室 郑州 450001
miRNA-182对细胞内钠离子通道蛋白Nav1.7表达的影响*
李 鸣,蔡伟华,邵金平,王剑南,苏松雪,李 磊,曹 靖#,臧卫东#
郑州大学基础医学院人体解剖学教研室 郑州 450001
#通信作者,曹靖,女,1973年3月生,博士,副教授,研究方向:慢性疼痛的分子学机制,E-mail:caojing73@126.com;臧卫东,男,1965年1月生,博士,教授,研究方向:慢性疼痛的分子学机制,E-mail:zwd@zzu.edu.cn
钠离子通道1.7;miRNA-182
目的:探索miRNA-182对细胞中电压门控钠离子通道1.7(Nav1.7)表达的影响及可能机制。方法:构建重组SCN9A 3’UTR双荧光素酶报告基因载体并与miRNA-182抑制物、类似物或scramble共转染HEK293细胞,通过荧光素酶活性检测观察miRNA-182和SCN9A表达的变化。用谷氨酸钠刺激PC12细胞并转染miRNA-182类似物或抑制物,利用原位杂交、免疫荧光共检测以及蛋白免疫印迹方法检测细胞中miRNA-182和Nav1.7蛋白的表达。结果:miRNA-182能抑制SCN9A 3’UTR在HEK293细胞中的表达。 Nav1.7和miRNA-182在PC12细胞共表达。 谷氨酸钠可使PC12细胞中Nav1.7表达增高,miRNA-182的表达降低(P<0.05);miRNA-182类似物能拮抗谷氨酸钠的刺激作用。结论:miRNA-182可负调控细胞内Nav1.7蛋白的表达。
电压门控钠离子通道1.7(sodium channel protein 1.7,Nav1.7)由SCN9A基因编码。原发性红斑肢痛症[1]、阵发性剧痛症[2]、先天性无痛症[3]的发生都与SCN9A基因突变有关。在疼痛机制研究方面,Nav1.7备受关注[4],Nav1.7表达的调控机制成为目前研究的热点。 miRNA是一类长度为19~25个核苷酸的内源性非编码单链RNA分子,参与调控基因转录后表达[5-6]。miRNA与靶基因信使 RNA的3’端非编码区(3’UTR)相结合,可以抑制靶基因的表达。经Targetscan软件预测,miRNA-182与SCN9A 3’UTR有7个碱基的相互配对。既往研究[7-9]证明谷氨酸钠刺激后PC12细胞内Nav1.7表达显著升高,但机制尚不明确。因此该研究拟利用双荧光素酶报告基因以及原位杂交、免疫印迹、免疫荧光等方法,探究miRNA-182对细胞内Nav1.7表达的调控作用。
1 材料与方法
1.1 细胞、主要试剂与仪器 PC12细胞和HEK293细胞由郑州大学基础医学院人体解剖学教研室储存。试剂和仪器:谷氨酸钠(美国Amresco公司),DMEM(美国Hyclone公司),胰蛋白酶(北京Solarbio公司),灭活胎牛血清(美国GIBCO公司),兔抗大鼠 Nav1.7 单克隆抗体(美国Abcam公司),山羊抗兔结合CY3二抗(美国Jackson公司),lipofectamine2000(美国Invitrogen公司),双荧光素酶报告基因检测试剂盒 (美国Promega公司),BCA蛋白定量检测试剂盒(中国康为世纪公司),SDS-PAGE凝胶配制试剂盒(中国威奥公司),激光共聚焦显微镜(德国蔡司公司)。miRNA-182类似物、抑制物及scramble,重组野生型和突变型SCN9A 3’UTR双荧光素酶报告基因载体的构建均由上海吉玛生物公司完成。
1.2 miRNA-182对SCN9A 3’UTR表达的影响
1.2.1 实验分组 将HEK293细胞以每孔2×105个接种24孔板,细胞密度达50%时进行转染,转染前3 h用不含血清和双抗的培养基代替原有的培养基。实验分5组。WT组HEK293细胞用脂质体转染法转染野生型SCN9A 3’UTR质粒;WT+miRNA-182类似物、WT+miRNA-182抑制物组细胞共转染野生型SCN9A 3’UTR质粒和miRNA-182类似物(100 pmol/L)、miRNA-182抑制物(100 pmol/L);MUT+miRNA-182类似物组细胞共转染突变型SCN9A 3’UTR质粒和miRNA-182类似物(100 pmol/L);WT+scramble组细胞共转染野生型SCN9A 3’UTR质粒和miRNA-182 scramble。培养6 h后换含体积分数10%胎牛血清和抗生素的DMEM培养基培养。
1.2.2 荧光素酶活性检测 5组HEK293细胞用含血清培养基培养30 h后,吸去原有培养基,1×PBS冲洗细胞,用裂解液裂解,吹打15 min,收集细胞裂解液,12 000 r/min离心5 min,取上清20 μL测定荧光素酶活性。采用不透光的96孔白板,分别向各孔加入20 μL细胞裂解液,每个样本3个复孔,上机读取荧光强度,计算萤火虫荧光素/海肾素荧光强度的比值,即为荧光素酶活性。
1.3 miRNA-182对谷氨酸钠刺激的PC12细胞Nav1.7表达的影响
1.3.1 实验分组 PC12细胞在完全培养基中(包括高糖DMEM培养基、体积分数10%胎牛血清,青霉素和链霉素浓度分别为100 kU/L 和100 μg /L)于37 ℃、体积分数5% CO2培养箱中培养,隔天换液,待细胞密度达到70%~80%时,用2.5 g/L胰蛋白酶消化,继而传代培养,4 h后分组处理。空白对照组:PC12细胞继续在正常高糖DMEM培养基中培养。Glu组:在PC12细胞培养液中加入终浓度为20 nmol/L的谷氨酸钠[7]。Glu+miRNA-182类似物组:PC12细胞转染miRNA-182 类似物 4 h后加入终浓度为20 nmol/L谷氨酸钠继续培养。miRNA-182抑制物组:PC12细胞转染miRNA-182 抑制物后用正常DMEM高糖培养基培养。分组培养48 h后,进行相应指标的检测。
1.3.2 miRNA-182和Nav1.7共检测 首先采用原位杂交法检测miRNA-182,然后采用免疫荧光法检测Nav1.7。将细胞以5×104mL-1接种于24孔板,制备细胞爬片;滴加体积分数 30%H2O2与纯甲醇体积比为1:50的混合液室温放置30 min,用蒸馏水快速洗涤3次;滴加胃蛋白酶室温消化2 min,PBS洗涤5 min×3次;滴加预杂交液(20 μL/片),在38~42 ℃中放置3 h后甩去切片表面液体,勿洗;滴加杂交液(20 μL/片),在38~42 ℃环境中放置过夜;梯度SSC洗涤,封闭,37 ℃ 30 min杂交,洗涤,完成原位杂交。接着,滴加封闭液于之前完成原位杂交的切片上,室温封闭1~2 h后甩除表面液体,勿洗;随后加兔抗大鼠 Nav1.7 单克隆抗体(按1:150稀释) 20 μL/片4 ℃过夜,PBS洗5 min×3次;加山羊抗兔结合CY3二抗(按1:200稀释)室温孵育2 h,PBS洗,同上封片。切片于荧光显微镜下观察并采集图片,采用Image J软件处理,记录荧光强度。
1.3.3 Nav1.7的半定量检测 PC12细胞除去培养基,1×PBS洗涤,加入蛋白裂解液80 μL后将细胞刮下收于EP管中,冰上静置0.5~1 h,4 ℃条件下1 500 r/min离心15~30 min。取上清,BCA法测蛋白浓度。配制60 g/L分离胶,等蛋白量上样,电泳(80 V 30 min,120 V 90 min),转膜,50 g/L脱脂奶封闭2 h,TBS洗5 min×3次,加兔抗大鼠 Nav1.7 单克隆抗体(按1:150稀释)4 ℃ 过夜,PBS洗5 min×3次,加山羊抗兔结合CY3二抗(按1:1 000稀释)室温孵育2 h,ECL显色。以β-actin为内对照,每组实验重复3 次。以目的条带与β-actin 条带光密度的比值表示目的蛋白表达水平。
1.4 统计学处理 采用SPSS 20.0进行统计学分析。各指标的组间比较采用单因素方差分析及LSD-t检验,检验水准α=0.05。
2 结果
2.1 miRNA-182干预后细胞中SCN9A 3’UTR的表达 见表1。表1显示,miRNA-182 scramble对细胞中野生型SCN9A 3’UTR的表达无影响,miRNA-182类似物可以显著降低细胞中野生型SCN9A 3’UTR的表达,但对突变型SCN9A 3’UTR的表达无影响。WT+miRNA-182抑制物组SCN9A 3’UTR的表达虽较WT组降低,但高于WT+ miRNA-182类似物组。

表1 荧光素酶活性测定结果比较
F=49.683,P<0.001;*:与WT组比较,P<0.05;#:与WT+ miRNA-182类似物组比较,P<0.05;△:WT+miRNA-182抑制物组比较,P<0.05。
2.2 miRNA-182干预后谷氨酸钠刺激的PC12细胞中Nav1.7的表达 原位杂交和免疫荧光共染色结果见图1,Western blot结果见图2,定量结果见表2。
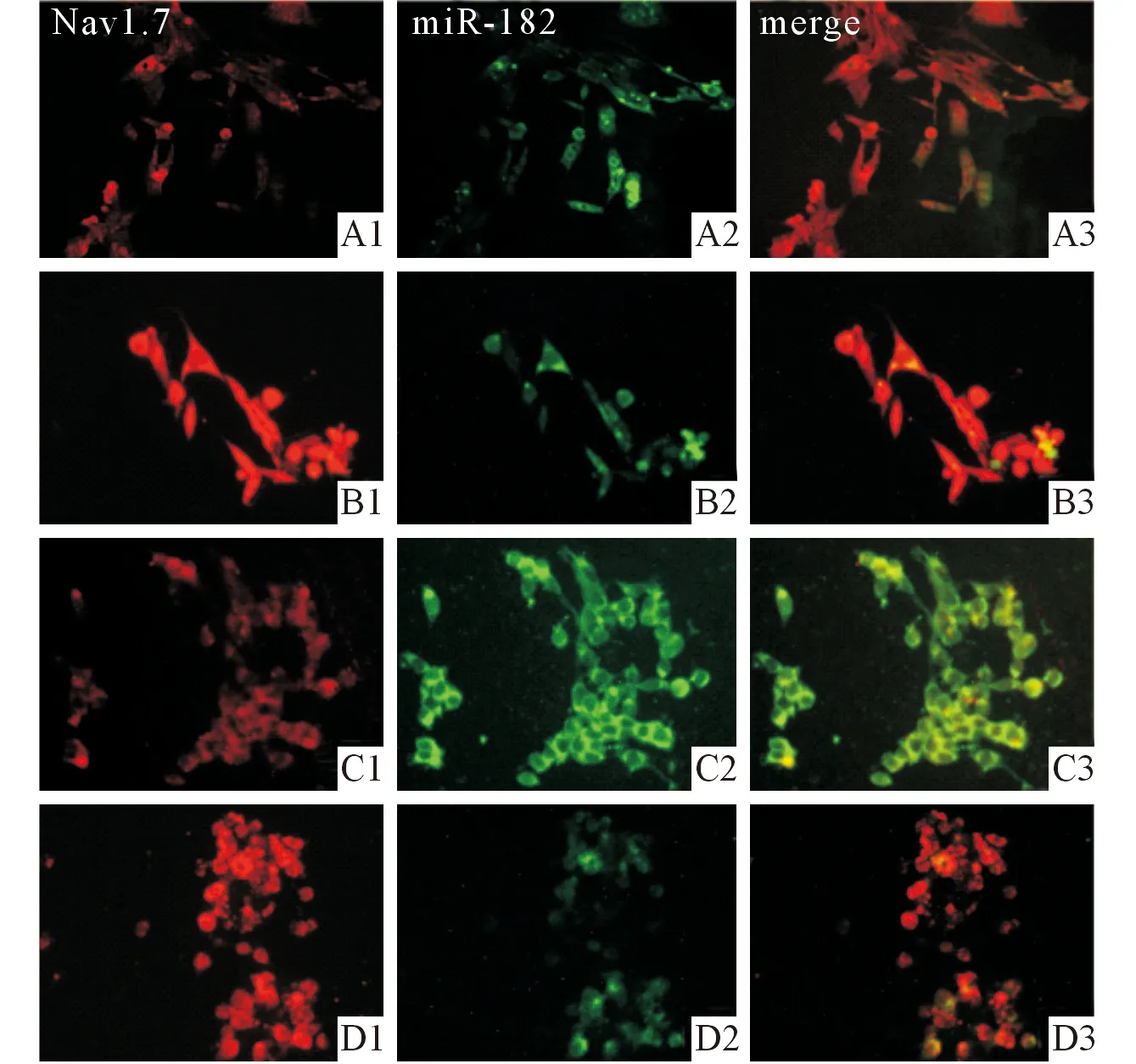
A:空白对照组; B:Glu组; C:Glu+miRNA-182类似物组;D:miRNA-182抑制物组;1:免疫荧光(红色);2:原位杂交(绿色);3:融合图片。图1 共染色结果(×200)

A:空白对照组;B:Glu组;C:Glu+ miRNA-182类似物组;D:miRNA-182抑制物组。图2 Western blot结果

表2 各组PC12 细胞miRNA-182、Nav1.7表达量比较
*:与空白对照组比较,P<0.05;#:与Glu+ miRNA-182类似物组比较,P<0.05。
从图1可以看出,miRNA-182(绿色)和Nav1.7(红色)均在PC12细胞中表达。从表2可以看出,与空白对照组比较,Glu组和miRNA-182抑制物组细胞中miRNA-182荧光强度低,Nav1.7荧光强度和蛋白表达水平高;与Glu组相比较,Glu+miRNA-182类似物组细胞中miRNA-182荧光强度显著增强且远强于空白对照组,而Nav1.7荧光强度和蛋白表达水平下降并达到空白对照组水平。
3 讨论
电压门控依赖性钠离子通道是分布于细胞膜上的一类重要的离子通道,主要由α亚基和β亚基构成,其中α亚基为功能亚单位,包含4个相同的跨越细胞膜的结构域,每个结构域均为6次跨膜螺旋,是介导钠离子出入的孔道,与神经细胞的兴奋性密切相关[8]。现已发现的功能性电压门控钠离子通道有9种亚型(Nav1.1至Nav1.9),其中Nav1.7主要表达于周围脊神经节和交感神经节,由SCN9A基因编码,该基因突变可导致多种先天性痛觉异常疾病[10]。因此Nav1.7成为疼痛研究的重要靶点,科学家们力图研发出特异性抑制或调节Nav1.7的药物用于镇痛[11]。由于对Nav1.7调控神经病理性疼痛的具体机制尚不明确,所有研究进展比较缓慢。尽管如此,有研究[10,12]显示,在单一应用非选择性钠离子通道阻滞剂治疗遗传性红斑性肢痛症和用卡马西平治疗阵发性剧痛症的研究中,小分子RNA可以通过抑制或调节Nav1.7的表达而降低脊根节神经元活性并达到缓解疼痛的目的。
疼痛的发生发展中有较多miRNAs的参与[5,13-14]。miRNA可以通过完全或不完全结合mRNA的方式,起到调控靶基因的作用[9,15]。miRNA-96可通过抑制Nav1.3的表达,从而起到缓解CCI模型大鼠的疼痛[16]。鞘内注射miRNA-21抑制剂可有效缓解因周围神经损伤造成的大鼠神经性疼痛[17]。基于Nav1.7在疼痛中的重要作用[11,18],该研究试图寻求能够调控SCN9A的miRNA,探索Nav1.7调控机制并探寻镇痛的新方法。
首先,为了筛选与SCN9A 基因相关的miRNAs,作者利用Targetscan发现miRNA-182与SCN9A 存在着密切的相关性,通过构建重组SCN9A 3’UTR双荧光素酶报告基因载体,进一步证实了miRNA-182与SCN9A之间确实存在密切的靶标关系。然后,作者用谷氨酸钠刺激PC12细胞观察Nav1.7蛋白和miRNA-182表达的变化,结果显示,Nav1.7蛋白表达增高的同时,miRNA-182的表达下调。分别将miRNA-182类似物和抑制物剂转染谷氨酸钠刺激组和正常PC12细胞,发现过表达miRNA-182可以逆转谷氨酸钠刺激的Nav1.7蛋白高表达,而正常PC12细胞转染miRNA-182抑制剂后Nav1.7的表达增加,蛋白免疫印迹方法也证实了Nav1.7表达的上述变化。研究结果提示,miRNA-182 能够抑制Nav1.7蛋白的表达,使Nav1.7保持稳态。
该研究在细胞水平证实了miRNA-182对Nav1.7的负调控作用,这为疼痛的基础研究提供了新的方向,同时为疼痛的治疗提供了新的靶点,下一步将在在体实验观察应用miRNA-182调控Nav1.7的表达是否可以缓解神经病理性疼痛。
[1]MCDONNELL A,SCHULMAN B,ALI Z,et al.Inherited erythromelalgia due to mutations in SCN9A: natural history, clinical phenotype and somatosensory profile[J].Brain,2016,139(Pt 4):1052
[2]KIM DT,ROSSIGNOL E,NAJEM K,et al.Bilateral congenital corneal anesthesia in a patient with SCN9A mutation,confirmed primary erythromelalgia, and paroxysmal extreme pain disorder[J].J AAPOS,2015,19(5):478
[3]COX JJ,SHEYNIN J,SHORER Z,et al.Congenital insensitivity to pain: novel SCN9A missense and in-frame deletion mutations[J].Hum Mutat,2010,31(9):E1670
[4]刘慧丽,李萍,李民. 电压门控性钠离子通道Nav1.7与疼痛的研究进展[J].基础医学与临床,2012,32(12):1484
[5]NIEDERBERGER E,KYNAST K,LÖTSCH J,et al.MicroRNAs as new players in the pain game[J].Pain,2011,152(7):1455
[6]SUN Y,LI XQ,SAHBAIE P,et al.miR-203 regulates nociceptive sensitization after incision by controlling phospholipase A2 activating protein expression[J].Anesthesiology,2012,117(3):626
[7]潘帧婕,曹靖,李鸣,等.谷氨酸钠对 PC12细胞钠离子通道蛋白1.7表达的影响[J].郑州大学学报(医学版),2013,48(5):591
[8]EBERHARDT MJ,LEFFLER A.Pain and analgesia:mutations of voltage-gated sodium channels[J].Schmerz,2017,31(1):14
[9]WANG H,SUN H,DELLA PENNA K,et al.Chronic neuropathic pain is accompanied by global changes in gene expression and shares pathobiology with neurodegenerative diseases[J].Neuroscience,2002,114(3):529
[10]FISCHER TZ,GILMORE ES,ESTACION M,et al.A novel Nav1.7 mutation producing carbamazepine-responsive erythromelalgia[J].Ann Neurol,2009,65(6):733
[11]DIB-HAJJ SD,YANG Y,BLACK JA,et al.The Na(V)1.7 sodium channel:from molecule to man[J].Nat Rev Neurosci,2013,14(1):49
[12]CHOI JS,ZHANG L,DIB-HAJJ SD,et al.Mexiletine-responsive erythromelalgia due to a new Na(v)1.7 mutation showing use-dependent current fall-off[J].Exp Neurol,2009,216(2):383
[13]LEINDERS M,ÜÇEYLER N,PRITCHARD RA,et al.Increased miR-132-3p expression is associated with chronic neuropathic pain[J].Exp Neurol,2016,283(Pt A):276
[14]NEUMANN E,BRANDENBURGER T,SANTANA-VARELA S,et al.MicroRNA-1-associated effects of neuron-specific brain-derived neurotrophic factor gene deletion in dorsal root ganglia[J].Mol Cell Neurosci,2016,75:36
[15]LI H,SHEN L,MA C,et al.Differential expression of miRNAs in the nervous system of a rat model of bilateral sciatic nerve chronic constriction injury[J].Int J Mol Med,2013,32(1):219
[16]CHEN HP,ZHOU W,KANG LM,et al.Intrathecal miR-96 inhibits Nav1.3 expression and alleviates neuropathic pain in rat following chronic construction injury[J].Neurochem Res,2014,39(1):76
[17]SAKAI A,SUZUKI H.Nerve injury-induced upregulation of miR-21 in the primary sensory neurons contributes to neuropathic pain in rats[J].Biochem Biophys Res Commun,2013,435(2):176
[18]TAMURA R,NEMOTO T,MARUTA T,et al.Up-regulation of NaV1.7 Sodium channels expression by tumor necrosis factor-α in cultured bovine adrenal chromaffin cells and rat dorsal root ganglion neurons[J].Anesth Analg,2014,118(2):318
(2016-10-18收稿 责任编辑王 曼)
Effect of miRNA-182 on Nav1.7 expression in cells
LIMing,CAIWeihua,SHAOJinping,WANGJiannan,SUSongxue,LILei,CAOJing,ZANGWeidong
DepartmentofHumanAnatomy,SchoolofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou450001
sodium channel protein 1.7;miRNA-182
Aim: To investigate the effect of miRNA-182 on the expression of voltage-gated sodium channel 1.7(Nav1.7) in cells and its possible mechanism.Methods: Recombinant double luciferase reporter vector carrying SCN9A 3′UTR was constructed and transfected into HEK293 cells binding with miRNA-182 agomir, antagomir or scramble, and the expressions of miRNA-182 and SCN9A were detected by luciferase assay system. Immunofluorescence,insituhybridization, and western blot were used to detect Nav1.7 and miRNA-182 in PC12 cells treated by glutamate and after transfected with miRNA-182 agomir or antagomir.Results: miRNA-182 could inhibit the expression of SCN9A 3′UTR in HEK293 cells. Nav1.7 and miRNA-182 were co-expressed in PC12 cells. The expression of Nav1.7 in PC12 cells with glutamate stimulation was significantly increased, while that of miRNA-182 was significantly decreased(P<0.05), miRNA-182 agomir could reverse the high expression of Nav1.7 protein in PC12 cells induced by glutamate.Conclusion: miRNA-182 could inhibit the expression of Nav1.7 protein in cells.
10.13705/j.issn.1671-6825.2017.04.004
*国家自然科学基金资助项目 81671091,81471144
Q789