苍术酮对急性肺损伤小鼠血清细胞因子和TLR7信号通路的影响*
2017-07-18陈天阳薛建华侯天禄平键胡毅翔成扬陈建杰
陈天阳薛建华侯天禄平键胡毅翔成扬△陈建杰
(1.上海市浦东新区传染病医院,上海201299;2.上海中医药大学附属曙光医院,上海201203;3.浙江省医学科学院,浙江省实验动物与安全性研究重点实验室,浙江杭州310013)
·研究报告·
苍术酮对急性肺损伤小鼠血清细胞因子和TLR7信号通路的影响*
陈天阳1,2薛建华1侯天禄2平键2胡毅翔3成扬1,2△陈建杰1,2
(1.上海市浦东新区传染病医院,上海201299;2.上海中医药大学附属曙光医院,上海201203;3.浙江省医学科学院,浙江省实验动物与安全性研究重点实验室,浙江杭州310013)
目的观察苍术酮对急性肺损伤(ALI)小鼠血清细胞因子和TRL7信号通路的影响。方法通过呼吸道感染甲型流感病毒,诱导小鼠ALI模型。将144只雄性SPF级ICR小鼠,随机分为正常组24只,模型组120只。模型组在乙醚麻醉下通过鼻内接种IAV诱导感染,这种病毒在小鼠中引起肺炎,然后随机平均分为5组,每组24只,分别为模型对照组,利巴韦林治疗组,苍术酮低剂量、中剂量和高剂量治疗组。在造模2 h后,阳性药物组给予利巴韦林50 mg/kg灌胃给药,苍术酮高、中、低剂量治疗组分别给予苍术酮40 mg/kg、20 mg/kg、10 mg/kg灌胃给药,每日1次,连续5 d。5 d后处死动物,采集血清以及肺组织样本。采用酶联免疫吸附试验(ELISA)检测血清中IFN-β、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)水平;PCR法测定小鼠肺组织中TLR-7、MyD88、TRAF6、IFN-β mRNA表达水平;Western blot法检测NF-κB p65蛋白表达水平。结果与正常组比较,模型组小鼠血清中IFN-β、IL-6、TNF-α、IL-1β水平显著升高(P<0.01)。与模型对照组比较,利巴韦林组和苍术酮组IL-6、TNF-α、IL-1β炎症因子水平均显著下降,而IFN-β水平显著升高(P<0.01),苍术酮高、低剂量组差异有统计学意义(P<0.05)。与模型对照组相比,苍术酮治疗组TLR7及其下游基因MyD88,TRAF6和IFN-β的mRNA表达显著上调(P<0.01)。此外,Western印迹分析结果显示,模型对照组的核因子κB(NF-κB)p65蛋白表达水平与正常组相比显著增加(P<0.01);与模型组相比,利巴韦林及苍术酮各剂量组的蛋白表达显着减少(P<0.01)。结论苍术酮能够明显减轻ALI小鼠的肺部炎症,其作用机制依赖于TLR7信号通路的激活,诱导I型干扰素的产生和对NF-κB p65表达的抑制。
苍术酮急性肺损伤细胞因子TRL7
急性肺损伤(ALI)是机体在经历严重创伤、感染等打击后全身炎症反应综合征在肺部的表现,可进一步发展为呼吸衰竭。其病情凶险,临床治疗困难,并且死亡率较高[1]。ALI是流感病毒感染哺乳动物的主要症状之一,但是其确切的发病机制还不是很清楚[2]。苍术酮是从苍术中提取和分离出来的。相关研究表明,苍术酮具有抗流感病毒的作用[3]。本研究以甲型流感病毒感染小鼠,复制小鼠ALI模型,并观察苍术酮对ALI小鼠血清细胞因子和TLR7信号通路的影响,探讨其作用机制,为进一步开发安全有效的新药提供基础。现报告如下。
1 材料与方法
1.1 动物与药物雄性SPF级ICR小鼠,体质量(22.00± 2.00)g,由浙江省实验动物中心提供,实验动物生产许可证号SCXK(浙)2014-0001。中药苍术购自华东药业公司,由浙江中医药大学鉴定。标本(编号y20141022)存放在浙江医学院药学系。苍术酮的分离与提取:采用HA121的超临界液体萃取仪(华安仪器厂)进行超临界二氧化碳萃取。取苍术饮片100 g粉碎成粉末,置于萃取釜内,在350 bar压力、温度50℃动态提取时间持续60 min,乙醇(99.9%)作为改性剂,流速为5 mL/min。超临界二氧化碳流速设定为15g/min,静态萃取时间设定为30 min。去除溶剂,得到的产物为5.8%。用于体外研究的超临界二氧化碳萃取物溶于磷酸盐缓冲液,浓度为1 mg/mL。将超临界CO2萃取物(50 g)用于硅胶柱,使用石油醚(沸点60~90℃)和乙酸乙酯(30∶1→1∶1,V/V)进行分离。首先制备色谱柱:称取硅胶40 g,将硅胶与洗脱剂按比例混合(20∶1),搅拌除去空气泡,徐徐倾入色谱柱中,不能留有气泡,然后加入石油醚将附着在管壁的硅胶洗下,使色谱柱面平整,平衡1 h后加入供试品进行洗脱。将萃取物溶于石油醚中,沿着色谱柱管壁缓慢加入,当液面下降至与柱表面相平时,即从色谱柱顶端缓慢加入洗脱剂石油醚。将洗脱剂石油醚沿管壁缓慢加入,打开底阀,缓慢滴加,控制流速为l mL/min,当流过色谱柱的一个空体积后即用标号的试剂瓶开始收集,得到化合物4(6 mg)、化合物3(2 mg)、化合物5(50 mg)、化合物6(4 mg)、化合物1(10 mg)和化合物2(13 mg)。采用紫外光谱、质谱分析、1H和13C核磁共振光谱鉴定,上述化合物分别为苍术内酯Ⅰ(10 mg)、苍术内酯Ⅲ(13 mg)、苍术醇(2 mg)、α-姜黄烯(6 mg)、苍术酮(50 mg)、苍术呋喃烃(4 mg),得到苍术酮,低温(-18℃)、避光保存,备用。
1.2 试剂与仪器流感A/PR/8/34病毒(H1N1亚型)和A/深圳/203/2001(H3N2亚型)由浙江省疾病预防控制中心(中国浙江省)保存。血清IFN-β白细介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)酶联免疫吸附检测试剂盒购自Biovol技术公司。Trizol裂解和提取试剂盒购自上海Biotechnology公司。cDNA合成试剂盒购自大连Takara公司。BCA试剂盒购自碧云天生物公司。NF-κB p65抗体和βactin抗体购自康成生物。Odyssey IRDye 680 conjugated山羊抗兔IgG、Odyssey Blocking Buffer均产自美国Li-Cor公司。Nonidet P40产于美国SIGMAALDRICH公司,PMSF购自美国Fluka公司。完全性蛋白酶抑制剂混合物为德国Roche公司产品;40% Acrylamide/bis Solution[N,N’-Methylenbis-acrylamid,Mix,Ratio 37.5∶1(2.6%C)]和Tween-20购自美国Bio-Rad公司。预染蛋白标准品产于加拿大Fermentas公司。硝酸纤维薄膜、甘氨酸、Tris、TEMED、EDTA、SDS为美国Amresco产品。异丙醇、溴酚蓝购自上海试剂三厂。过硫酸铵、甲醇、浓盐酸均为分析纯,购自中国国药集团化学试剂有限公司。Odyssey红外扫描系统为Li-Cor公司产品。
1.3 造模与给药将144只雄性SPF级ICR小鼠随机分为正常组24只,模型组120只。模型组在乙醚麻醉下通过鼻内接种IAV诱导感染,这种病毒在小鼠中引起肺炎,然后随机平均分为5组,每组24只,分别为模型组,利巴韦林组,苍术酮低、中、高剂量治疗组。在造模2 h后,苍术酮治疗组分别给予低、中、高剂量为10 mg/kg、20 mg/kg、40 mg/kg,利巴韦林组给予50 mg/kg采用灌胃给药,每日1次,共5 d。模型组以及正常组小鼠,在相同的时间间隔给予0.9%氯化钠注射液。
1.4 采集与检测1)血清炎症细胞因子检测。经过5 d的治疗,测定动物体质量后处死动物。采集血标本,离心3000×g共20 min分离血清,储存于4℃待检。血清IFN-β、IL-6、TNF-α、IL-1β采用酶联免疫吸附试验(ELISA)检测。2)肺组织TLR7信号通路蛋白的测定。小鼠肺组织采用Trizol试剂进行匀浆和提取总RNA(Biotechnology Co.Ltd.)。根据试剂盒提供的操作说明,合成cDNA(Takara公司)。本研究使用的特异性引物(TLR-7、MyD88、TRAF6、IFN-β和18sRNA)见表1,由上海生工公司合成。选择真核细胞的18S rRNA作为研究对象的看家基因。扩增反应体系含有2 μL cDNA、0.5 μL正向和反向引物(终浓度每0.5μM)、12.5 μL 2×SYBR Green,无核酸酶的水,反应体积为25 μL。扩增反应的条件为:95℃1 min,然后40个循环,95℃变性10 s,55℃退火25 s,64℃延长25 s,然后64℃延长25 s采集荧光数据。使用2-ΔCt×106方法计算基因的相对表达水平[4]。3)Western blot检测[5-6]。采用RIPA试剂分离肺组织总蛋白,BCA试剂盒测定蛋白浓度。10%SDS聚丙烯酰胺凝胶电泳,将凝胶中蛋白电转移至硝酸纤维素膜上,加Odyssey blocking buffer封闭,加入1抗(NF-κB p65,工作浓度1∶1000),4℃下摇床振荡过夜,洗涤后加入2抗反应。洗涤后将膜置于Odyssey仪器上扫描、分析,使用内参照β-actin校正目标蛋白表达量。

表1 RFQ-PCR检测引物序列
1.5 统计学处理应用SPSS11.0统计软件。计量资料以(±s)表示,多样本均数间比较使用ANOVA分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠血清细胞因子水平比较见表2。与正常组比较,模型组小鼠血清中IFN-β、IL-6、TNF-α、IL-1β水平显著升高(P<0.01)。与模型对照组比较,利巴韦林组和苍术酮各组IL-6、TNF-α、IL-1β炎症因子水平均显著下降,而IFN-β水平显著升高(P<0.01)。苍术酮高、低剂量组差异有统计学意义(P<0.05)。
表2 各组小鼠血清细胞因子水平比较(pg/mL,±s)

表2 各组小鼠血清细胞因子水平比较(pg/mL,±s)
与模型组比较,*P<0.05,**P<0.01。下同。
组别n正常组24模型对照组24利巴韦林组24 IFN-βIL-6TNF-αIL-1β 22.9±2.7513.6±1.21**8.64±1.09**9.15±0.38**24.5±2.5229.8±2.6618.9±1.3721.3±2.06 23.3±2.7918.5±5.99**13.4±1.54**21.6±3.36苍术酮高剂量组2430.8±3.31**12.8±1.16**9.20±0.77**13.4±0.74**苍术酮中剂量组2429.4±3.27*17.4±1.11**11.8±1.94**16.5±1.17**苍术酮低剂量组2425.8±2.8719.5±2.76**16.2±2.27*17.2±1.35**
2.2 各组小鼠肺组织TLR7信号通路蛋白的表达水平见表3,表4,图1。与模型组相比,苍术酮各组TLR7及其下游基因MyD88,TRAF6和IFN-β的mRNA表达显著上调(P<0.01),这表明上述途径被激活。此外,Western印迹分析结果显示,模型组的核因子κB(NF-κB)p65蛋白表达水平较正常组显著增加(P<0.01);
表3 各组小鼠肺组织中TRL7、MyD88、TRAF6和IFN-β mRNA表达水平比较(±s)
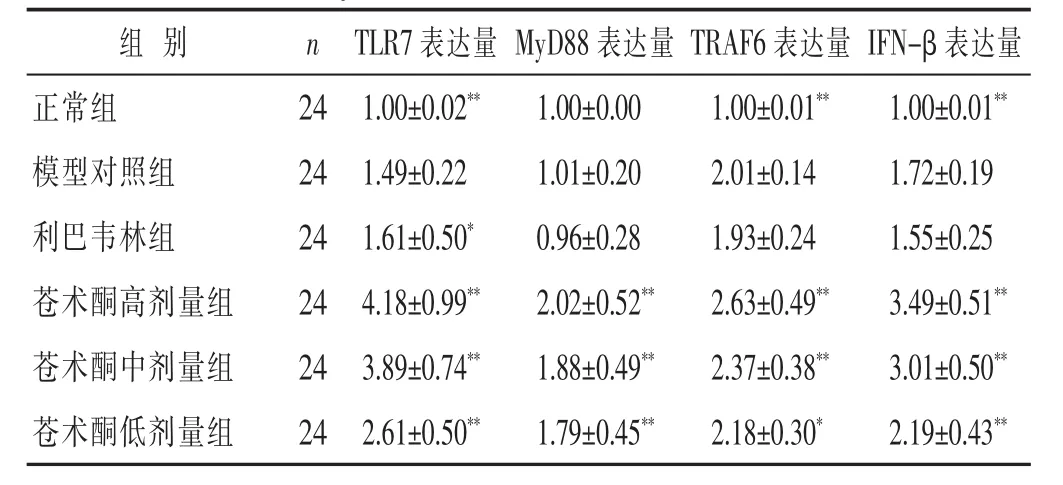
表3 各组小鼠肺组织中TRL7、MyD88、TRAF6和IFN-β mRNA表达水平比较(±s)
组别n正常组24模型对照组24利巴韦林组24 TLR7表达量MyD88表达量TRAF6表达量IFN-β表达量1.00±0.02**1.00±0.001.00±0.01**1.00±0.01**1.49±0.221.01±0.202.01±0.141.72±0.19 1.61±0.50*0.96±0.281.93±0.241.55±0.25苍术酮高剂量组244.18±0.99**2.02±0.52**2.63±0.49**3.49±0.51**苍术酮中剂量组243.89±0.74**1.88±0.49**2.37±0.38**3.01±0.50**苍术酮低剂量组242.61±0.50**1.79±0.45**2.18±0.30*2.19±0.43**
表4 各组小鼠NF-κB p65蛋白表达水平比较(±s)
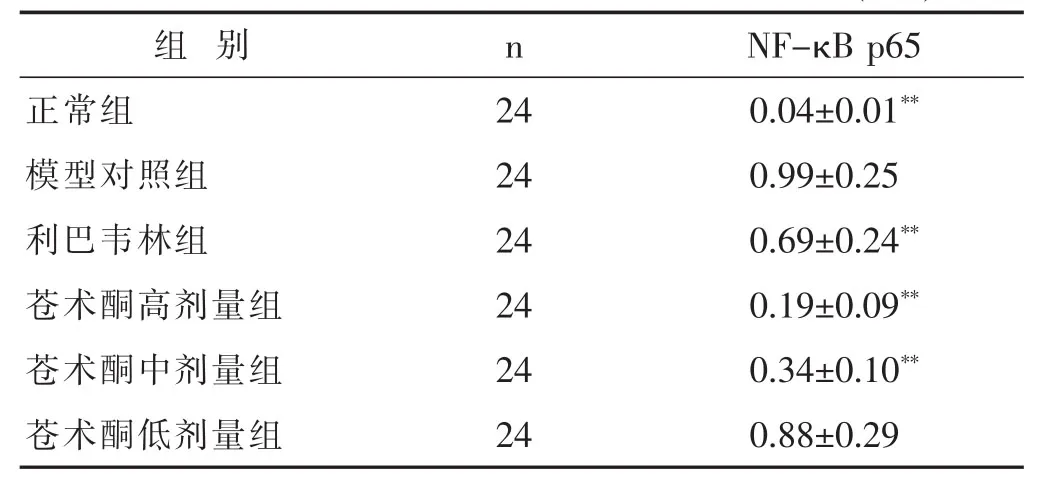
表4 各组小鼠NF-κB p65蛋白表达水平比较(±s)

苍术酮对急性肺损伤小鼠组织TLR7信号通路的调节作用(表3)。RFQ-PCR检测TLR7、MyD88、TRAF6和IFN-β mRNA表达水平(图4,图1)。Western bolt检测NF-κB p65(依次为正常对照组、模型对照组、利巴韦林组、苍术酮低、中、高治疗组),检测值采用内参照(18S rRNA或者β-actin)进行校正。
图1苍术酮对急性肺损伤小鼠肺组织TLR7信号通路的调节作用与模型组相比,利巴韦林组及苍术酮各治疗组的蛋白表达显著减少(P<0.01)。
3 讨论
ALI是机体释放出大量炎症介质的同时,还能释放出大量的抗炎症介质,如果炎症介质和抗炎症介质失调,就会导致机体内环境失去稳定,造成机体器官损害[7]。本研究发现,苍术酮显著增加IFN-β的水平,而降低其他促炎性细胞因子的水平(IL-6、TNF-α和IL-1β)。基因检测结果发现TLR7及其下游MyD88、TRAF6和IFN-β基因表达显著上调,这表明上述信号途径被激活。Western blot分析结果显示,苍术酮治疗后,TLR7下游因子中最重要的炎症蛋白NF-κB p65蛋白表达明显减少。
TNF-α、IL-6、IL-1β是ALI早期的炎症因子,可加剧炎症细胞的浸润和黏附,并刺激巨噬细胞释放更多的促炎因子[8-10]。干扰素具有抗流感病毒的作用,正常情况下,机体干扰素水平较低,当有病毒入侵后启动干扰素调控基因的表达,生成多种蛋白质和酶作用于病毒,起到抗病毒作用[11-12]。本研究结果表明,在正常小鼠感染病毒后,干扰素-β水平呈现上升趋势,在苍术酮干预后,其血清水平明显升高,说明苍术酮抗病毒作用与提高IFN-β水平有关。Toll受体家族是一类介导细胞固有免疫的细胞膜受体家族,可以识别多种病原体,并通过不同的信号通路启动固有免疫反应,病毒入侵后可促进免疫基因的表达,在抗病毒免疫反应、致病机制、疫苗和药物研究中有非常重要的意义[13]。TLR7作为Toll受体家族的成员之一,在机体许多组织中广泛表达,在抵御病原体入侵过程中发挥重要作用[14]。TLR7的信息转导与MyD88依赖性和非MyD88依赖性都有关,2条途径均可促进干扰素的活化和释放。MyD88分子是TLR7信号转导中的接头分子,活化后的MyD88可促进肿瘤坏死因子受体相关因子-6(TRAF-6)的活化,TRAF-6在细胞内与下游分子相互作用,最终引起NF-κB的活化来诱导细胞因子(TNF-α、IL-6、IL-1β)的表达,参与免疫与炎症反应[12,15-17]。在本研究中,笔者发现在甲型流感病毒诱导的小鼠ALI中NF-κB广泛表达。应用苍术酮干预后,NF-κB的表达明显减少。由此可推断苍术酮对ALI的治疗作用可能是通过增强TLR7、MyD88、TRAF-6和IFN-β mRNA的表达,抑制核因子NF-κB p65蛋白表达,进而减轻肺部炎症反应。
综上所述,苍术酮能够明显减轻ALI小鼠的肺部炎症,其作用依赖于TLR7信号通路的激活,诱导I型干扰素的产生和对NF-κB p65表达的抑制,可用于制备治疗的有效药物,具有良好的应用前景和应用价值。
[1]Sadowitz B,Roy S,Gatto LA,et al.Lung injury induced by sepsis:lessons learned from large animal models and future directions for treatment[J].Expert Review of Anticancer Therapy,2011,9(12):1169-1178.
[2]魏东,刘英,贾宁,等.H9N2亚型猪流感病毒诱导小鼠急性肺损伤中TNF-α、IL-1β、IL-6和IL-10的变化和作用[J].中国实验动物学报,2013,21(2):72-74.
[3]石书江,秦臻,孔松芝,等.苍术抗流感病毒有效成分的筛选[J].时珍国医国药,2012,23(3):565-566.
[4]Cheng Y,Mai JY,Wang MF,et al.Antifibrotic effect of total flavonoids of Astmgali Radix on dimethylnitrosamine-induced liver cirrhosis in rats[J].Chin J Integr Med,2017,23(1):48-54.
[5]Cheng Y,Mai J,Hou T,et al.MicroRNA-421 induces hepatic mitochondrial dysfunction in non-alcoholic fatty liver disease mice by inhibiting sirtuin 3[J].Biochemical&Biophysical Research Communications,2016,474(1):57-63.
[6]Cheng Y,Hou T,Ping J,et al.Quantitative succinylome analysis in the liver of non-alcoholic fatty liver disease rat model[J].Proteome science,2016,14(1):1-11.
[7]关岚,涂家红,李天水,等.白细胞介素在急性肺损伤大鼠中的作用[J].中国急救复苏与灾害医学杂志,2008,3(12):728-730.
[8]潘永利.黄芩苷对急性肺损伤大鼠的保护作用[J].中国实验方剂学杂志,2013,19(3):238-240.
[9]肖燕,崔社怀,沈渝菊,等.急性肺损伤发病过程中IL-6与肺表面活性蛋白SP-A、SP-B的关系研究[J].军事医学,2008,32(3):261-263.
[10]Dou W,Zhang J,Sun A,et al.Protective effect of naringenin against experimental colitis via suppression of Toll-like receptor 4/NF-κB signalling[J].Br J Nutr,2013,110(4):599-608.
[11]Diebold SS,Kaisho T,Hemmi H,et al.Innate antiviral responses by means of TLR7-mediated recognition of singlestranded RNA[J].Science,2004,303(5663):1529-1531.
[12]刘蓉,苟玲,于柳,等.桂枝挥发油与桂皮醛对病毒性肺炎小鼠死亡保护作用及TLR/IFN信号机制研究[J].中药药理与临床,2013,29(4):33-36.
[13]杨永峰,申焕君,姜泓,等.Toll样受体4介导的抗病毒固有免疫研究进展[J].细胞与分子免疫学杂志,2016,32(6):854-858.
[14]王晓月,赵鹏翔,马雪梅.Toll样受体7的研究进展[J].细胞与分子免疫学杂志,2016,32(9):1267-1271.
[15]罗兵,李涛,徐元宏.Toll样受体的信号转导及抗感染免疫研究进展[J].免疫学杂志,2011,27(2):165-169.
[16]李影,陈镜宇,张玲玲,等.肿瘤坏死因子受体相关因子参与炎症免疫调节的研究进展[J].中国药理学通报,2015,31(9):1206-1211.
[17]张艰,李圣青,李焕章,等.NF-κB在大鼠急性肺损伤模型肺组织中的表达及N-乙酰半胱氨酸的影响[J].细胞与分子免疫学杂志,2004,20(6):712-715.
Effect of Atractylon on Serum Cytokines and TLR7 Signaling Pathway in Mice with Acute Lung Injury
CHEN Tianyang,XUE Jianhua,HOU Tianlu,et al.Infectious Disease Hospital of Pudong,Shanghai 201299,China.
Objective:To observe the effect of atractylon on serum cytokines and TRL7 signaling pathway in mice with acute lung injury.Methods:The acute lung injury model of mice was induced by infecting influenza A virus in the respiratory tract.A total of 144 male SPF grade ICR mice were randomly divided into the normal control group(n=24)and the model group(n=120).In the model group,IAV was induced by intranasal administration under ether anesthesia.This virus caused pneumonia in mice,and then the mice were randomly divided into 5 groups,24 rats in each:the control group,the ribavirin treatment group,atractylon low dose,middle dose and high dose treatment groups.The positive drug group was treated with 50 mg/kg of ribavirin,and the atractylon of low,medium and high dose treatment groups were given 10 mg/kg,20 mg/kg,40 mg/kg intragastric administration,once per day,for 5 days.After 5 days,the animals were killed and the serum and lung tissue samples were collected.The levels of IFN-β,IL-6,TNF-α and IL-1β in serum were measured by enzyme-linked immunosorbent assay(ELISA).The expression of TLR-7,MyD88,TRAF6 and IFN-β mRNA in lung tissue of mice was determined by PCR.The expression of NF-κB p65 protein was detected by Western blot.Results:Compared withthe normal group,the levels of IFN-β,IL-6,TNF-α and IL-1β in the serum of the model group were significantly increased(P<0.01).Compared with the model group,the level of IL-6,TNF-α and IL-1βin the ribavirin group and the atractylon group decreased significantly,while IFN-β level increased significantly(P<0.01).There was significant difference between high and low dose groups(P<0.05).Compared with model control group,the mRNA expression of TLR7 and its downstream genes MyD88,TRAF6 and IFN-β were significantly up-regulated(P<0.01).In addition,Western blot analysis showed that the expression level of NF-κB p65 protein in model control group was significantly higher than that in normal control group(P<0.01).Compared with model group,the protein expression of the group was significantly decreased(P<0.01).Conclusion:Atractylon can significantly relieve lung inflammation in mice with acute lung injury.The mechanism depends on the activation of TLR7 signaling pathway,the production of type I interferon and the inhibition of NF-κB p65 expression.
Atractylon;Acute lung injury;Cytokines;TRL7
R285.5
A
1004-745X(2017)06-0952-04
10.3969/j.issn.1004-745X.2017.06.004
2016-12-18)
上海市中医药三年行动计划项目(ZY3-JSFC-1-1011);上海市浦东新区卫生系统领先人才项目(PWRL2016-01);上海市中医药领军人才学术共同体项目(ZY3-RCPY-1-1001);上海市浦东新区卫生系统优秀青年医学人才培养计划(PWRq2016-01)
△通信作者(电子邮箱:drchengyang@126.com)
