化学-酶法不对称氢化柠檬醛合成(R)-香茅醛
2017-07-05应向贤孟淑敏余世华
应向贤,孟淑敏,程 峰,余世华,张 洁,汪 钊
(浙江工业大学 生物工程学院,浙江 杭州 310014)
化学-酶法不对称氢化柠檬醛合成(R)-香茅醛
应向贤,孟淑敏,程 峰,余世华,张 洁,汪 钊
(浙江工业大学 生物工程学院,浙江 杭州 310014)
烯醇还原酶OYE2催化(E)-或(Z)-柠檬醛不对称氢化时,其氢化产物的手性是互补的.因而,以(E/Z)-柠檬醛为底物时产物e.e.值往往很低.拟将酶法不对称氢化反应与氨基酸催化的底物异构化反应相偶联,从而提高产物(R)-香茅醛的e.e.值.对氨基酸催化的异构化反应进行了条件优化,最优氨基酸为甘氨酸,最优添加浓度为1.0 mol/L,最优pH为7.0.在优化条件下反应11 h,偶联底物异构化反应时的(R)-香茅醛e.e.值和得率分别为75.06%和91.84%,比对照分别提高了27.62%和23.90%.
烯醇还原酶;柠檬醛;不对称氢化;顺反异构;甘氨酸;(R)-香茅醛
香茅醛是一种多用途的香料,具有(R)-和(S)-香茅醛两种光学异构体.其中,(R)-香茅醛具有较高的工业价值,能用于合成赋香剂L-薄荷醇[1-5]、胃酸分泌抑制剂[6]和雄性大蜡蛾性信息素[7]等.此外,最新的研究表明(R)-香茅醛能够选择性杀死乳腺癌细胞,而对正常细胞的毒害作用较小[8].化学法或酶法催化柠檬醛不对称氢化是(R)-香茅醛最直接的合成路径.化学法以手性贵金属铑配合物为催化剂,催化(Z)-柠檬醛或(E)-柠檬醛得到(R)-香茅醛[9],但该路线成本高,产物光学纯度低.相对而言,酶法以烯醇还原酶为催化剂,通过不对称氢化柠檬醛生成(R)-香茅醛,此法具有条件温和、绿色环保、立体选择性高、工艺简单和副产物少等优点.
本课题组前期研究采用来自于Saccharomycescerevisiae的烯醇还原酶OYE2为催化剂,以源自CandidaboidiniiATCC 32195的甲酸脱氢酶FDHCB作为辅酶循环驱动力,构建了酶法不对称还原柠檬醛合成(R)-香茅醛的催化工艺,但获得的产物光学纯度只有60%左右[10].OYE2催化(E/Z)-柠檬醛的不对称氢化时,反应产物(R)-香茅醛主要来自(E)-柠檬醛,(S)-香茅醛主要来自(Z)-柠檬醛,并且还原(E)-柠檬醛时的速率远远大于还原(Z)-柠檬醛时的速率.Wolken等[11]发现氨基酸能催化柠檬醛的顺反异构化反应,以(Z)-柠檬醛或(E)-柠檬醛为底物,经氨基酸催化达到平衡后,异构化产物中(Z)-柠檬醛与(E)-柠檬醛的比例约为60∶40.基于OYE2的催化特性,笔者拟将酶法不对称氢化反应与氨基酸催化的底物顺反异构反应进行偶联,使部分(Z)-柠檬醛异构化为(E)-柠檬醛,并基于(E)-柠檬醛与(R)-香茅醛的对应关系提高(R)-香茅醛的光学纯度.在构建的催化反应中,分别考察了氨基酸种类、氨基酸浓度和pH等对产物e.e.值和得率的影响,并进而建立了最优的催化体系.
1 材料与方法
1.1 材 料
1.1.1 基因工程菌
表达OYE2的基因工程菌E.coliBL21/pEASY-E1-oye2和表达FDHCB的基因工程菌E.coliBL21/pET28a-fdhcb均为实验室保存菌株.
1.1.2 试 剂
酵母粉和蛋白胨购自索莱尔博奥生物技术有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、卡纳霉素(Kan)、氨苄青霉素(Amp)和辅酶NAD+购自生工生物工程(上海)股份有限公司;蛋白纯化镍柱填料ProfinityTMIMAC Ni-Charged Resin、蛋白质浓度测定试剂盒(Protein assay)购自Bio-Rad公司;蛋白Marker购自大连TaKaRa公司;(Z)-柠檬醛(香叶醛)和(E)-柠檬醛(橙花醛)由实验室自行制备;其余化学试剂购自阿拉丁化学试剂公司,试剂均为分析纯.
1.1.3 培养基
LB培养基:10 g/L蛋白胨,5 g/L酵母膏,10 g/L NaCl,蒸馏水溶解,pH为7.0.固体培养基中加入20 g/L琼脂粉.121 ℃灭菌20 min.
LB/Amp培养基:灭菌后的LB培养基中添加Amp至终质量浓度为100 μg/mL.
LB/Kan培养基:灭菌后的LB培养基中添加Kan至终质量浓度为100 μg/mL.
1.2 方 法
1.2.1 烯醇还原酶OYE2和甲酸脱氢酶FDHCB的表达和分离纯化
基因工程菌E.coliBL21/pEASY-E1-oye2经IPTG低温诱导,离心收集菌体;菌体经超声破碎,离心获得上清粗酶液;粗酶液经Ni-NTA亲和层析分离纯化获得烯醇还原酶OYE2,具体操作流程参见相关文献[12].除了培养基因工程菌所用的抗生素是Kan外,甲酸脱氢酶FDHCB的表达和分离纯化流程与上述流程一致.
1.2.2 (E)-柠檬醛和(Z)-柠檬醛的制备
参照Tsuboi等[13]实验方法制备(E)-柠檬醛和(Z)-柠檬醛.与真空仪匹配的50 mL三颈烧瓶内加入1.15 g活性MnO2固体和一颗磁珠,橡皮塞密封后抽真空并充入N2,用注射器从橡皮塞处加入16 mL混有100 mg香叶醇或橙花醇的环己烷,剧烈振荡30 s,使反应物充分混合均匀,磁力搅拌器设定300 r/min,0 ℃下反应6 h,反应液经滤纸过滤后于45 ℃下抽真空旋蒸,产物(E)-柠檬醛或(Z)-柠檬醛取5 μL溶于500 μL乙酸乙酯进行气相检测.
1.2.3 不对称氢化反应偶联异构化反应的反应体系优化
标准催化体系为1 mL,分别含20 mmol/L柠檬醛,0.42 mg/mL OYE2纯酶,0.2 U/mL FDHCB纯酶,0.5 mmol/L NAD+,100 mmol/L甲酸钠,不加或加入1 mol/L氨基酸及50 mmol/L PIPES缓冲液(pH 7.0).30 ℃,200 r/min下反应6 h.
在标准反应体系中,通过分别替换15种氨基酸考察氨基酸种类对产物e.e.值的影响;以甘氨酸为催化剂,在0.3~1.5 mol/L下考察氨基酸浓度对产物e.e.值的影响;在pH 6.0~9.0下考察反应pH对产物e.e.值的影响.在优选的反应体系中,在0~6 h内考察反应进程,以1 h间隔定时取样.
1.2.4 气相色谱分析
反应液经乙酸乙酸萃取,利用气相色谱法测定产物的e.e.值和得率.色谱条件如下:Agilent 6890N手性柱BGB-174(30 m×250 μm×0.25 μm);检测器FID 250 ℃;载气N2;载气流量2.0 mL/min;分流比1∶49;柱温程序为初始温度75 ℃,保持3 min,4 ℃/min升至120 ℃保持3 min,20 ℃/min升至180 ℃,保持3 min;进样量1 μL;进口温度250 ℃.在上述色谱条件下,(Z)-柠檬醛(橙花醛)、(E)-柠檬醛(香叶醛)、(S)-香茅醛和(R)-香茅醛出峰时间分别为19.628,20.282,16.862,16.986 min.
2 结果与讨论
2.1 烯醇还原酶OYE2和甲酸脱氢酶FDHCB表达和分离纯化
按照实验室前期研究建立的操作流程[10],基因工程菌E.coliBL21/pEASY-E1-oye2和E.coliBL21/pET28a-fdhcb经低温诱导表达、菌体离心收集、超声破碎以及离心去除细胞碎片后获得粗酶液.粗酶液经Ni-NTA亲和层析分离纯化分别获得了纯度较高的目的蛋白OYE2和FDHCB.重组OYE2与FDHCB经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析计算得相对分子质量分别为40.5,39.0 kD,与理论预期值相符(图1).

M—Protein marker;1—未诱导菌液;2—纯化后OYE2;3—纯化后FDHCB图1 纯化后OYE2与FDHCB的SDS-PAGE分析Fig.1 SDS-PAGE analysis of purified OYE2 and FDHCB
2.2 氨基酸种类对(E/Z)-柠檬醛不对称氢化产物e.e.值的影响
在不对称氢化反应偶联底物异构化反应的体系中,考察15种氨基酸对产物(R)-香茅醛e.e.值的影响,并以不添加氨基酸的反应作为对照.氨基酸催化的顺反异构反应与烯醇还原酶催化的柠檬醛不对称还原反应相偶联合成(R)-香茅醛的途径为

其中:OYE2为源自S.cerevisiae的烯醇还原酶;FDHCB为源自C.boidiniiATCC 32195的甲酸脱氢酶.
试验中氨基酸浓度均为1 mol/L.添加酸性氨基酸(L-天冬氨酸和L-谷氨酸)、碱性氨基酸L-赖氨酸以及DL-色氨酸时,检测不到反应产物,推测是反应体系pH的改变或高浓度的氨基酸抑制了烯醇还原酶或甲酸脱氢酶的催化活力.与对照相比,添加L-酪氨酸使产物e.e.值降低,添加DL-甲硫氨酸使产物e.e.值略有升高,而甘氨酸、DL-谷氨酰胺、DL-缬氨酸、DL-苯丙氨酸、L-丝氨酸、L-苏氨酸、L-丙氨酸和L-脯氨酸等氨基酸的添加显著提高产物e.e.值(图2).当以甘氨酸为催化剂催化底物异构化反应时,产物(R)-香茅醛的e.e.值最高,达到60%,因此,在后续研究中选择甘氨酸作为底物异构化反应的催化剂.

图2 氨基酸种类对(E/Z)-柠檬醛不对称氢化产物e.e.值的影响 Fig.2 Effect of different amino acids on the e.e.value in the asymmetric hydrogenation of (E/Z)-citral
2.3 甘氨酸浓度对(E/Z)-柠檬醛不对称氢化产物e.e.值的影响
进一步考察不同浓度的甘氨酸对产物(R)-香茅醛e.e.值的影响,以不加甘氨酸为对照.甘氨酸浓度分别为0.3,0.6,0.9,1.0,1.2,1.5 mol/L.图3结果表明:添加不同浓度的甘氨酸,产物e.e.值均大于70%,在0~1 mol/L时,随着甘氨酸浓度的增加产物得率略有增加;当甘氨酸浓度达到1.0 mol/L时,产物e.e.值达75.25 %,得率为61.67 %;当甘氨酸浓度大于1 mol/L时,随着甘氨酸浓度的增加得率有所降低.因此,选择甘氨酸浓度为1 mol/L.

图3 甘氨酸浓度对(E/Z)-柠檬醛不对称氢化产物e.e.值的影响Fig.3 Effect of glycine concentration on the e.e. value in the asymmetric hydrogenation of (E/Z)-citral
2.4 反应pH对(E/Z)-柠檬醛不对称氢化产物e.e.值的影响
在pH 6.0~9.0下考察了不同反应pH对(R)-香茅醛e.e.值的影响.图4结果表明:在不同的pH条件下,(R)-香茅醛e.e.值均为75%左右,而且产物得率除了pH 6.0时略低外变动并不大.综合产物e.e.值和得率,选择反应pH为7.0.

图4 反应pH对(E/Z)-柠檬醛不对称氢化产物e.e.值的影响Fig.4 Effect of reaction pH on the e.e. value in the asymmetric hydrogenation of (E/Z)-citral
2.5 不对称氢化反应偶联底物异构化反应的反应进程
在优化的反应体系下,在0~6 h内间隔1 h取样,建立(E/Z)-柠檬醛不对称氢化合成(R)-香茅醛的反应时间进程,并以不加入甘氨酸的反应进程作为对照.图5结果表明:在添加甘氨酸的情况下,产物e.e.值维持在约75%的水平,而产物得率随着反应的进行而增加;在对照中,随着反应的进行,产物得率增高而e.e.值呈下降趋势.由于OYE2对(E)-柠檬醛的催化速率远高于(Z)-柠檬醛,在不添加氨基酸时,反应前期利用的底物以(E)-柠檬醛为主,产物(R)-香茅醛e.e.值较高,反应后期利用的底物以(Z)-柠檬醛为主,因而导致(R)-香茅醛e.e.值的降低.当添加氨基酸时,随着(E)-柠檬醛的利用,一部分(Z)-柠檬醛通过异构化反应转变为(E)-柠檬醛,从而使(R)-香茅醛e.e.值维持在较高的水平.
为了验证上述推测,分别以(E)-柠檬醛和(Z)-柠檬醛为底物进行不对称氢化反应,并且反应时间延长至11 h以期进一步提高产物得率.与对照相比,以(Z)-柠檬醛为底物时产物得率从70.35%提高至97.23%(表1),产物e.e.值从66.08%(S)反转为61.07%(R),产物得率和e.e.值的提高表明一部分(Z)-柠檬醛通过异构化反应转化为(E)-柠檬醛.当以(E)-柠檬醛为底物时,与对照相比产物得率和e.e.值没有明显变化,表明OYE2对(E)-柠檬醛的催化速率远高于异构化反应的速率.当以(E/Z)-柠檬醛为底物反应11 h后,产物得率和e.e.值分别为91.84%和75.06%,比对照分别提高了23.90%和27.62%.
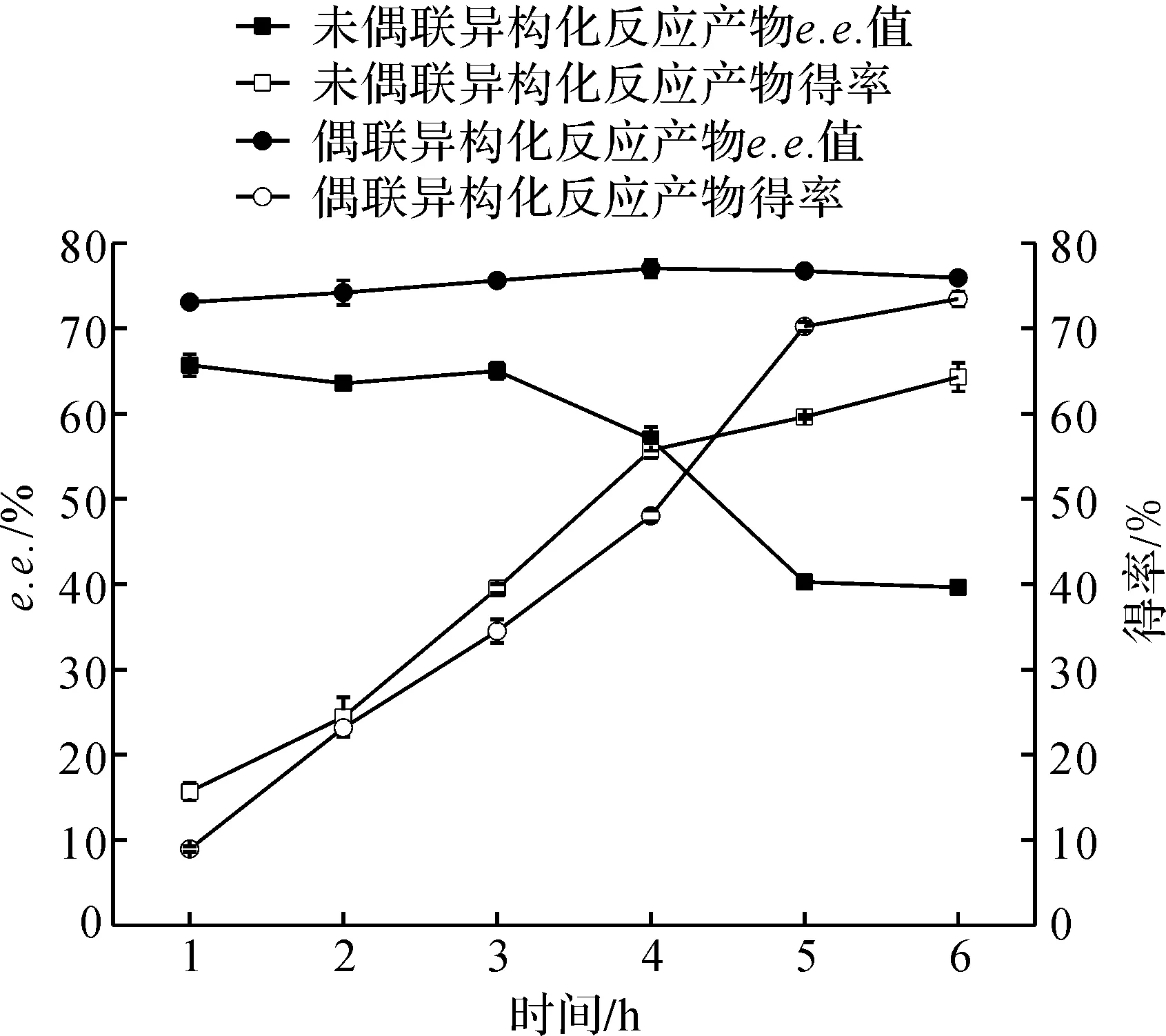
图5 不对称氢化反应偶联底物异构化反应合成(R)-香茅醛的反应进程Fig.5 The time course of (R)-citronellal synthesis through asymmetric hydrogenation of (E/Z)-citral coupled with cis-trans isomerization
表1 不对称氢化反应偶联底物异构化反应 合成(R)-香茅醛的得率及e.e.值
Table 1 Thee.e. value and yield of (R)-citronellal in the asymmetric hydrogenation of (E/Z)-citral coupled withcis-transisomerization %

底物不偶联底物顺反异构化反应得率e.e.偶联底物顺反异构化反应得率/%e.e.(E/Z)⁃柠檬醛67.9447.44(R)91.8475.06(R)(Z)⁃柠檬醛70.3566.08(S)97.2361.07(R)(E)⁃柠檬醛89.6489.70(R)90.3289.75(R)
3 结 论
利用源自S.cerevisiae的烯醇还原酶OYE2和源自C.boidiniiATCC 32195重组甲酸脱氢酶FDHCB构建辅酶循环体系,并进一步偶联甘氨酸催化的柠檬醛顺反异构反应,使部分(Z)-柠檬醛经异构化反应转化为(E)-柠檬醛,从而提高了(R)-香茅醛的得率和e.e.值.当以(E/Z)-柠檬醛为底物时,11 h反应后反应产物得率达到91.84%,比不偶联顺反异构反应时提高了23.90%;(R)-香茅醛的e.e.值达75.06%,比不偶联顺反异构反应时提高了27.62%.后续研究可对烯醇还原酶OYE2进行蛋白质改造改善其催化特性,从而进一步提高(E/Z)-柠檬醛不对称氢化反应的产物光学纯度.
[1] PLOESSER J, LUCAS M, CLAUS P. Highly selective menthol synthesis by one-pot transformation of citronellal using Ru/H-BEA catalysts[J]. Journal of catalysis, 2014, 320: 189-197.
[2] TRASARTI A F, MARCHI A J, APESTEGUA C R. Highly selective synthesis of menthols from citral in a one-step process[J]. Journal of catalysis, 2004, 224(2): 484-488.
[3] TRASARTI A F, MARCHI A J, APESTEGUA C R. Synthesis of menthols from citral on Ni/SiO2-Al2O3catalysts[J]. Catalysis communications, 2013, 32(5): 62-66.
[4] ITOH H, MAEDA H, YAMADA S, et al. Kinetic resolution of citronellal by chiral aluminum catalysts: L-menthol synthesis from citral[J]. Organic chemistry frontiers, 2014, 1(9): 1107-1115.
[5] JACOB R G, PERIN G, LOI L, et al. Green synthesis of (-)-isopulegol from (+)-citronellal: application to essential oil of citronella[J]. Tetrahedron letters, 2003, 44(18): 3605-3608.
[6] JACOB R G, PERIN G, BOTTESELLE G V, et al. Clean and atom-economic synthesis of octahydroacridines: application to essential oil of citronella[J]. Tetrahedron letters 2003, 44: 6809-6812.
[7] MORI K, AKASAKA K. Pheromone synthesis. Part 256: synthesis of the four stereoisomers of 5,11-dimethylpentacosane, a new sex pheromone component of the maleGalleriamellonella(L.), with high stereochemical purities as determined by the derivatization-HPLC analysis of the eight stereoisomers of 5,11-dimethyl-8-pentacosanolq[J]. Tetrahedron, 2015, 71: 4102-4115.
[9] 张万斌, 张振锋, 陈建中, 等. 一种由柠檬醛不对称催化氢化制备手性香茅醛的方法: CN105218335[P]. 2016-01-06.
[10] 应向贤, 胡宝军, 周宇杭, 等. 老黄酶和甲酸脱氢酶催化柠檬醛不对称还原生成香茅醛的条件优化[J]. 发酵科技通讯, 2016, 45(2): 70-74.
[11] WOLKEN W A M, TEN HAVE R, VAN DER WERF M J. Amino acid-catalyzed conversion of citral:cis-transisomerization and its conversion into 6-methyl-5-hepten-2-one and acetaldehyde[J]. Journal of agriculture and food chemistry, 2000, 48(11): 5401-5405.
[12] 应向贤, 李国四, 范雅君, 等. 蜡样芽孢杆菌烯醇还原酶的克隆、表达和酶学性质研究[J]. 发酵科技通讯, 2015, 44(1): 4-8.
[13] TSUBOI S, ISHII N, SAKAI T, et al. Oxidation of alcohols with electrolytic manganese dioxide. Its application for the synthesis of insect pheromonese[J]. Bulletin of the chemical society of Japan, 1990, 63: 1888-1883.
(责任编辑:朱小惠)
Chemo-enzymatic synthesis of (R)-citronellal through asymmetric hydrogenation of (E/Z)-citral
YING Xiangxian, MENG Shumin, CHENG Feng, YU Shihua, ZHANG Jie, WANG Zhao
(College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China)
The enoate reductase OYE2 catalyzes the asymmetric hydrogenation of (E)- or (Z)-citral, with chiral product complementary, resulting in lowe.e. value of (R)-citronellal. The study aims to improve thee.e. value of (R)-citronellal through coupling of enzymatic asymmetric hydrogenation and amino acid-catalyzed substrate isomerization. Glycine was selected with a concentration of 1 mol/L for the substrate isomerization and the pH was adjusted at 7.0. The asymmetric hydrogenation of (E/Z)-citral under optimized substrate isomerization condition resulted in 75.06%e.e. and 91.84% yield of (R)-citronellal, which were 27.62% and 23.90% higher than the control.
enoate reductase; citral; asymmetric hydrogenation;cis-transisomerization; glycine; (R)-citronellal
2017-04-05
浙江省自然科学基金资助项目(LY17B020012)
应向贤(1975—),男,浙江永康人,副教授,研究方向为生物催化,E-mail:yingxx@zjut.edu.cn.
TQ03
A
1674-2214(2017)02-0065-05
