MCL-1及其抑制剂在血液恶性肿瘤靶向治疗中的研究进展
2017-07-01孙蓓综述叶因涛审校
孙蓓 综述 叶因涛 审校
MCL-1及其抑制剂在血液恶性肿瘤靶向治疗中的研究进展
孙蓓 综述 叶因涛 审校
MCL-1(myeloid cell leukemia-1)蛋白是BCL-2(B-cell lymphoma-2)蛋白家族中重要的抗凋亡蛋白之一。MCL-1过表达不仅与肿瘤发生发展密切相关,而且与靶向治疗和传统化疗药物耐药密切相关,然而研发适用于临床的靶向MCL-1的小分子抑制剂目前尚具挑战性。近十几年对MCL-1及其抑制剂进行了大量深入的研究,其中MCL-1内源性配体BH3的小分子类似物的开发取得了重大突破。本文对MCL-1及其抑制剂在血液肿瘤中的研究进展做一综述。
MCL-1 凋亡 BH3类似物 血液恶性肿瘤 靶向治疗
细胞凋亡是为维持内环境稳定,由基因控制的细胞自主有序的死亡,而凋亡过程发生紊乱则会引发多种疾病。细胞凋亡紊乱在肿瘤的发生、发展中起到重要的作用,是肿瘤对化疗药物产生耐受的机制之一。因此,本文对细胞凋亡的调控机制进行了较为深入的研究。查阅近几年文献发现,BCL-2家族的抗凋亡蛋白MCL-1在诸多肿瘤组织中过度表达,对肿瘤细胞的生存起到关键的保护作用,有研究利用MCL-1的反义寡核甘酸可引起表达MCL-1的肿瘤细胞的凋亡[1-2]。另外有研究显示,MCL-1的高表达与化疗药物耐药性和肿瘤复发相关,MCL-1高表达的肿瘤组织对其他抗凋亡蛋白的抑制剂产生耐药性[3-5],提示阻断MCL-1的信号途径能有效地诱导或促进肿瘤细胞凋亡,增加肿瘤组织对化疗药物的敏感性。因此,靶向MCL-1抗凋亡蛋白抑制剂的研发对肿瘤的治疗具有独特的意义,已经成为抗肿瘤药物研究的热点之一。
1 MCL-1的生物学功能
MCL-1是BCL-2家族的抗凋亡蛋白成员之一,至少含有一种BCL-2同源的BH结构域,是线粒体凋亡途径的关键调节剂,而含有多BH结构域的效应子BAX、BAK和BOK以及仅BH3蛋白如BIM和BAD则具有促凋亡功能。定位于线粒体外膜的MCL-1蛋白能够通过阻止BAX和BAK的活化从而防止细胞死亡,其功能类似于其他抗凋亡BCL-2家庭成员。MCL-1可以直接结合BH3家族成员,如BIM,将它们与促凋亡效应物BAX或BAK隔离开;MCL-1也有可能直接结合BAX和BAK,使其处于非活性构象,从而维持线粒体膜稳定,抑制线粒体释放细胞色素C,达到促进细胞的生存,阻止细胞凋亡的作用(图1)[6-7]。位于线粒体基质的MCL-1蛋白并没有抗凋亡的作用,而是促进正常的线粒体生理和能量代谢。在线粒体输入期间,全长MCL-1的氨基末端被蛋白水解截短,截短的MCL-1进入线粒体基质驻留于线粒体内膜,其功能主要是保持线粒体嵴的超微结构,促进电子的聚集运输链复合物转化为超级复合物(super complex,SC),并促进ATP合成酶复合物组装成二聚体和寡聚体[7]。因此位于线粒体外膜和基质的MCL-1可协同抑制细胞死亡和促进细胞增殖。对于肿瘤细胞来说,除了要逃避凋亡还需要大量的能量来维持快速增殖,有研究认为MCL-1的基质功能对肿瘤细胞的快速增殖是必需的。
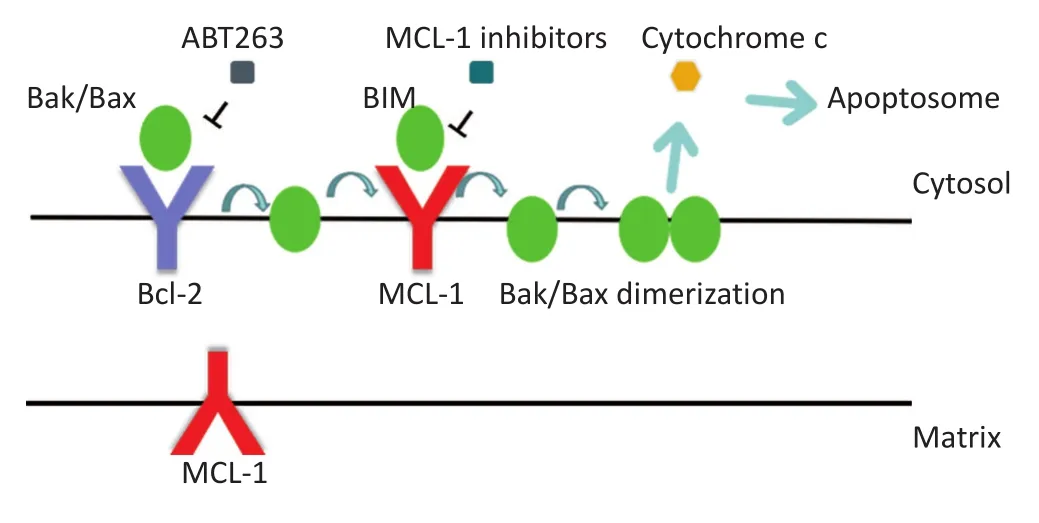
图1 线粒体凋亡途径Figure 1 Mitochondrial apoptosis pathway
此外,MCL-1含有增殖细胞核抗原(proliferating cell nuclear antigen,PNCA)结合结构,其过度表达能明显抑制细胞周期向S期进展,而缺少PCNA结合结构的MCL-1对细胞周期的抑制作用明显减低,因此认为MCL-1通过与PCNA结合对细胞周期进程也起到调控作用[8]。
虽然MCL-1是BCL-2的家族成员,有着相似的结构和功能,但是MCL-1在此家族中具有其独特性,首先MCL-1寿命很短,被认为是凋亡调控的上游信号,其表达受到多种生长因子和葡萄糖信号级联的调控,MCL-1的泛素化降解可被去泛素化酶USP9X抵抗,导致MCL-1的稳定表达从而发挥抗凋亡作用,因此面对细胞应激时,MCL-1可以快速地做出反应[7]。另外,MCL-1在促生存BCL-2蛋白方面也是独特的,因为MCL-1对早期胚胎发育[9]以及包括淋巴细胞在内的多种细胞谱系[10-11]、造血干细胞[12]、嗜中性粒细胞[13]和神经元[14]的生存是必不可少的,而其他抗凋亡分子的內源水平不足以在不存在MCL-1的情况下促进存活。
2 MCL-1与血液恶性肿瘤
肿瘤的发生是由于细胞增殖、分化和细胞凋亡失衡综合作用的结果,MCL-1作为抗凋亡蛋白家族中的一员,其表达与调节的异常与肿瘤的发生发展有密切的关系。研究表明MCL-1是很多肿瘤细胞生存的必须,其在多发性骨髓瘤(multiple myeloma,MM)、淋巴瘤和白血病中的表达水平明显升高,并且其表达水平与肿瘤分级和患者预后密切相关。
Wuillème-Toumi等[5]发现在 52%的 MM 患者和81%的MM复发患者中MCL-1出现过表达,MCL-1的表达水平越高MM患者的生存期越短。Le等[15]和Zhang等[16]也发现MCL-1对维持MM细胞生存的重要作用,同时降低MCL-1的表达能够引起MM细胞的凋亡[17-18]。有研究发现MCL-1小分子抑制剂A1210477能够诱导骨髓瘤细胞的凋亡[19]。Gupta等[20]发现IL-6能够诱导BCL-2/BCL-xL依赖性肿瘤细胞产生MCL-1依赖,阻断IL-6或下游信号恢复BCL-2/BCL-xL依赖性可能增强BCL-2抑制剂的活性。
MCL-1过表达显著加速Myc诱导的淋巴瘤发生,研究显示MCL-1过表达使得造血细胞难以修复许多细胞毒性损伤,扰乱淋巴细胞生成并促进造血干细胞和祖细胞的恶性转化[21]。而Grabow等[22]研究又发现在Myc淋巴瘤模型中,MCL-1的丧失特异性地影响了淋巴瘤的存活,可能是通过引发前B细胞在应答致癌应激时提高BIM水平来增敏凋亡的。同时Grabow等[23]通过使用floxed等位基因使MCL-1遗传损失,在Myc诱导的B细胞淋巴瘤中也观察到了类似的数据。另外,来自249例弥漫大B细胞淋巴瘤(dif⁃fuse large B-cell lymphoma,DLBCL)患者的基因表达谱显示活化的B细胞中MCL-1水平明显增加,这种变化由复发性染色体的获得和异常的STAT3信号传导引起[24]。而在这些DLBCL中敲除MCL-1会导致细胞死亡和增加对化学治疗的敏感性。此外,MCL-1和BCL-XL蛋白水平的伴随增加常常暗示了对BH3类似物诱导的凋亡有耐受性的DLBCL的复发[25]。Khoury等[26]使用蛋白印迹分析发现在套细胞淋巴瘤(mantle cell lymphoma,MCL)细胞系和5个冰冻MCL肿瘤组织中都可以检测到MCL-1的表达,并且在blastoid/大细胞型中MCL-1的表达水平最高。对于MCL,Müller等[27]研究证实,即使药理学靶向阻断BCL-2/BCL-XL,源自该淋巴瘤亚型的细胞系仍然对细胞凋亡有抗性。值得注意的是,在RNA干扰介导下敲除或化学阻断MCL-1后,该抗性被逆转,并且使用多激酶抑制剂NVPBEZ235能进一步增强该逆转。
MCL-1在白血病细胞中也有相似的表现,Aich⁃berger等[28]发现MCL-1在原发性慢性粒细胞白血病(chronic myeloid leukemia,CML)细胞中表达,并且应用MCL-1小干扰RNA(siRNA)和MCL-1反义寡核苷酸在CML来源的细胞系中观察到MCL-1表达下调和细胞生存能力下降。Glaser等[29]和 Xiang等[30]发现MCL-1对急性骨髓性白血病(acute myeloid leukemia,AML)的发生发展起到重要的作用,即便在其他抗凋亡家族蛋白内源性表达的前提下,MCL-1的遗传缺失也能够引起肿瘤细胞的死亡,这提示其他抗凋亡蛋白的内源性表达水平不足以促进细胞存活。研究发现MCL-1在慢性淋巴细胞白血病(chronic lympho⁃cytic leukemia,CLL)中表达上调,并与预后不良标记物和治疗耐药相关,其表达水平能够预示患者的临床结果,而沉默MCL-1则能诱导肿瘤细胞凋亡[31-34]。
3 MCL-1抑制剂靶向治疗的研究进展
现有抑制MCL-1表达的药物能够协同其他化疗药物以及BCL-2抑制剂(ABT-737等)发挥促凋亡和抗肿瘤的作用,然而由于绝大部分都不是直接或特异的MCL-1抑制剂,在患者身上表现出明显的毒性[35]。对于抗凋亡蛋白MCL-1表达水平增高的恶性血液肿瘤,靶向阻断MCL-1可能是个性化治疗的关键步骤[36]。由于小分子BH3类似物通过与MCL-1的BH3结合槽结合释放BIM等BH3家族蛋白,进而起到促凋亡抗肿瘤的作用,小分子BH3类似物的开发和成功评价成为治疗MCL-1依赖性恶性肿瘤的里程碑(图1)[37]。由于MCL-1的疏水性结合槽和内源性配体(仅BH3蛋白)的高亲和力,抑制MCL-1活性的BH3类似物的鉴定较为困难。之前最有前景的BH3类似物有ABT-199(venetoclax)和ABT-737及其衍生物 ABT-263(Navitoclax)等[38-41],其中 ABT-263 已经进入到Ⅰ、Ⅱ期临床研究[40,42],ABT-199已被美国食品药品监督管理局(FDA)批准用于特定染色体异常患者的慢性淋巴细胞性白血病[41-42],但都是靶向BCL-2和BCL-XL蛋白的。最近发现靶向MCL-1的BH3类似物中比较有前景的有A-1210477及相关类似物和S63845,因其与MCL-1的高亲和力和低毒性备受瞩目。
3.1 A1210477
A-1210477及其类似物是通过高通量筛选和结构指导设计制备出的吲哚-2-羧酸核心衍生物,其和MCL-1的亲和力(0.45 nM)比吲哚-2-羧酸高100倍,且对MCL-1表现出很好的选择性[43-44]。A-1210477和几种相关类似物能够解离活细胞中MCL-1与BIM或NOXA的相互作用[45]。在被证明依赖于MCL-1存活的MM和非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞系中,化合物A-1210477和相关类似物能够触发线粒体胱天蛋白酶依赖性细胞凋亡的标志物。经过对作用机制的彻底分析,证明A-1210477和相关化合物通过直接作用于其靶点MCL-1来诱导BAX/BAK依赖性细胞死亡。研究证明A-1210477通过与BCL-2/BCL-XL抑制剂ABT-263的协同作用,在多种癌细胞系中诱导凋亡。总之,A-1210477及其类似物是在癌细胞中表现出明确靶向活性的第一种MCL-1选择性的、可靠的BH3模拟物[46],但是还需要更多的体内体外试验评价其药效和安全性。
3.2 S63845
S63845是基于NMR片段筛选和随后结构指导发现的一种高选择性和有效的MCL-1抑制剂。研究显示S63845与MCL-1的亲和性很高(0.19 nM),是之前发表的MCL-1抑制剂A-1210477的20倍。与以前发表的BH3类似物相似,S63845的共晶结构与MCL-1的BH3的结合槽结合,其羧酸盐部分与典型的促生存BCL-2家族成员抑制剂锚点Arg263有很强的相互作用,其芳香支架嵌入到疏水口袋P2中,而末端三氟甲基部分延伸到P4[47]。免疫共沉淀实验证实S63845选择性靶向MCL-1,实验显示S63845破坏了HeLa细胞中BAK和BAX与MCL-1的结合,而对这些促凋亡蛋白与BCL-XL或BCL-2的相互作用没有影响。研究者还发现BAX-和BAK缺陷的H929细胞对S63845具有抗性,进一步表明S63845通过靶向活性杀死癌细胞,即通过直接抑制MCL-1激活BAX/BAK依赖性线粒体凋亡途径。
有研究提示,在25个MM细胞系中仅2个细胞系对S63845不敏感,而且对BCL-2抑制剂药效受限的细胞系对S63845也有敏感性,提示MCL-1抑制剂可能对那些标准治疗药物耐受的情况有效[47]。在异体移植人MM大鼠模型中,S63845表现出剂量依赖性,并且在AMO1模型组8只大鼠中7只在100 d治疗(25 mg/kg,iv)之后完全复原,在实验过程中大鼠表现出良好的耐受性,没有观察到明显的体质量降低。在11个代表性淋巴瘤和慢性髓性白血病细胞系中,仅有3个细胞系对S63845不敏感,7个c-myc诱导的人霍奇金淋巴瘤全部表现出明显的敏感性[47]。在肿瘤组织和正常组织都表达鼠MCL-1蛋白的c-myc诱导的霍奇金淋巴瘤大鼠中,连续5 d静脉注射25 mg/kg的S63845能够治愈70%的霍奇金淋巴瘤大鼠,而对正常组织无不良反应。接下来研究者又评价了S63845对8个急性淋巴细胞白血病(acute lympho⁃blastic leukemia,ALL)细胞系的作用,结果所有细胞系均对S63845敏感,同时在急性髓细胞白血病(acute myeloid leukemia,AML)动物模型中也得到相同的结果,并且不会杀死正常的造血祖细胞[46]。
实验证实S63845是一个高度有效和选择性的MCL-1抑制剂,在已知依赖MCL-1的肿瘤衍生细胞系中表现出较好的体内体外抗肿瘤活性,而且正常组织对其有效浓度能够耐受。目前S63845的临床前研究表现优异,有待于临床研究的进一步验证[48-49]。
4 展望
MCL-1在很多肿瘤的发生发展和生存中均起到关键的作用,对血液系统肿瘤也起到重要作用。随着研究的进一步发展,MCL-1的生理病理机制都进一步被展示,极大地促进了靶向MCL-1抑制剂的开发。MCL-1的抑制剂S63845在抗肿瘤活性方面表现优异,耐受性良好,与之前在MCL-1基因敲除动物模型中出现严重不良反应不同。这可能是因为间歇性药理学阻断MCL-1与完全缺失MCL-1基因不同,也可能是因为MCL-1抗凋亡以外的功能并不能被药理学抑制剂阻断而能被基因敲除阻断。综上所述,靶向MCL-1的BH3类似物可以达到强大的抗肿瘤活性也能找到合适的治疗窗,是抗肿瘤药物研发的新靶点。
[1] Michels J,O`Neill JW,Dallman CL,et al.Mcl-1 is required for Akata6B-lymphoma cell survival and is converted to a cell death molecule by efficient caspase-mediated cleavage[J].Oncogene,2004,23(28):4818-4827.
[2] Derenne S,Monia B,Dean NM,et al.Antisense strategy shows that Mcl-1 rather than Bcl-2 or Bcl-x(L)is an essential survival protein of human myeloma cells[J].Blood,2002,100(1):194-199.
[3] Leverson JD,Zhang H,Chen J,et al.Potent and selective small-molecule MCL-1 inhibitors demonstrate on-target cancer cell killing activity as single agents and in combination with ABT-263(navitoclax)[J].Cell Death Dis,2015,6(1):e1590.
[4] Lin KH,Winter PS,Xie A,et al.Targeting MCL-1/BCL-XL forestalls the acquisition of resistance to ABT-199 in acute myeloid leukemia[J].Sci Rep,2016,10(6):27696.
[5] Wuillème-Toumi S,Robillard N,Gomez P,et al.Mcl-1 is overexpressed in multiple myeloma and associated with relapse and shorter survival[J].Leukemia,2005,19(7):1248-1252.
[6] Cuconati A,Mukherjee C,Perez D,et al.DNA damage response and MCL-1 destruction initiate apoptosis in adenovirus-infected cells[J].Genes Dev,2003,17(23):2922-2932.
[7] Perciavalle RM,Opferman JT.Delving deeper:MCL-1's contributions to normal and cancer biology[J].Trends Cell Biol,2013,23(1):22-29.
[8] Fujise K,Zhang D,Liu J,et al.Regulation of apoptosis and cell cycle progression by MCL-1.Differential role of proliferating cell nuclear antigen[J].J Biol Chem,2000,275(50):39458-39465.
[9] Rinkenberger JL,Horning S,Klocke B,et al.Mcl-1 deficiency results in peri-implantation embryonic lethality[J].Genes Dev,2000,14(1):23-27.
[10]Opferman JT,Letai A,Beard C,et al.Development and maintenance of B and T lymphocytes requires antiapoptotic MCL-1[J].Nature,2003,426(6967):671-676.
[11]Dzhagalov I,Dunkle A,He YW.The anti-apoptotic Bcl-2 family member Mcl-1 promotes T lymphocyte survival at multiple stages[J].J Immunol,2008,181(1):521-528.
[12]Opferman JT,Iwasaki H,Ong CC.Obligate role of anti-apoptotic MCL-1 in the survival of hematopoietic stem cells[J].Science,2005,307(5712):1101-1104.
[13]Dzhagalov I,St John A,He YW.The antiapoptotic protein Mcl-1 is essential for the survival of neutrophils but not macrophages[J].Blood,2007,109(4):1620-1626.
[14]Arbour N,Vanderluit JL,Le Grand JN.Mcl-1 is a key regulator of apoptosis during CNS development and after DNA damage[J].J Neurosci,2008,28(24):6068-7608.
[15]Le GS,Podar K,Amiot M,et al.VEGF induces Mcl-1 up-regulation and protects multiple myeloma cells against apoptosis[J].Blood,2004,104(9):2886-2892.
[16]Zhang B,Gojo I,Fenton RG.Myeloid cell factor-1 is a critical survival factor for multiple myeloma[J].Blood,2002,99(6):1885-1893.
[17]Zhang YK,Wang H,Leng Y,et al.Overexpression of microRNA-29b induces apoptosis of multiple myeloma cells through down regulating Mcl-1[J].Bioche Bio Res Communic,2011,414(1):233-239.
[18]Follinarbelet V,Torgersen ML,Naderi EH,et al.Death of multiple myeloma cells induced by cAMP-signaling involves downregulation of Mcl-1 via the JAK/STAT pathway[J].Cancer Letters,2013,335(2):323-331.
[19]Besbes S,Billard C.First MCL-1-selective BH3 mimetics as potential therapeutics for targeted treatment of cancer[J].Cell Death Dis,2015,6(7):e1810.
[20]Gupta VA,Matulis SM,Conagepough JE,et al.Bone marrow microenvironment derived signals induce Mcl-1 dependence in multiple myeloma[J].Blood,2017,129(14):1969-1979.
[21]Campbell KJ,Bath ML,Turner ML,et al.Elevated Mcl-1 perturbs lymphopoiesis,promotes transformation ofhematopoietic stem/progenitor cells,and enhances drug resistance[J].Blood,2010,116(17):3197-3207.
[22]Grabow S,Delbridge AR,Aubrey BJ,et al.Loss of a single Mcl-1 allele inhibits MYC-driven lymphomagenesis by sensitizing pro-B cells to apoptosis[J].Cell Rep.2016,14(10):2337-2347.
[23]Grabow S,Kelly GL,Delbridge AR,et al.Critical B-lymphoid cell intrinsic role of endogenous MCL-1 in c-MYC-induced lymphomagenesis[J].Cell Death Dis,2016,7(3):e2132.
[24]Wenzel SS,Grau M,Mavis C,et al.MCL1 is deregulated in subgroups of diffuse large B-cell lymphoma[J].Leukemia,2013,27(6):1381-1390.
[25]Choudhary GS,Alharbi S,Mazumder S,et al.MCL-1 and BCL-xL-dependent resistance to the BCL-2 inhibitor ABT-199 can be overcome by preventing PI3K/AKT/mTOR activation in lymphoid malignancies[J].Cell Death Dis,2015,6(1):e1593.
[26]Khoury JD,Medeiros LJ,Rassidakis GZ,et al.Expression of Mcl-1 in mantle cell lymphoma is associated with high-grade morphology,ahigh proliferative state,and p53 overexpression[J].J Pathol,2003,199(1):90-97.
[27]Müller A,Zang C,Chumduri C,et al.Concurrent inhibition of PI3K and mTORC1/mTORC2 overcomes resistance to rapamycin induced apoptosis by down-regulation of Mcl-1 in mantle cell lymphoma[J].Int J Cancer,2013,133(8):1813-1824.
[28]Aichberger KJ,Mayerhofer M,Krauth MT,et al.Identification of mcl-1 as a BCR/ABL-dependent target in chronic myeloid leukemia(CML):evidence for cooperative antileukemic effects of imatinib and mcl-1 antisense oligonucleotides[J].Blood,2005,105(8):3303-3311.
[29]Glaser SP,Lee EF,Trounson E,et al.Anti-apoptotic Mcl-1 is essential for the development and sustained growth ofacute myeloid leukemia[J].Genes Dev,2012,26(2):120-125.
[30]Xiang Z,Luo H,Payton JE,et al.Mcl1 haploinsufficiency protectsmice from Myc-induced acute myeloid leukemia[J].J Clin Invest,2010,120(6):2109-2118.
[31]Awan FT,Kay NE,Savies ME,et al.Mcl-1 expression predicts progression-free survival in chronic lymphocytic leukemia patients treated with pentostatin,cyclophosphamide,and rituximab[J].Blood,2009,133(3):535-537.
[32]Pepper C,Lin TT,Pratt G,et al.Mcl-1expression has in vitro and in vivo signi fi cance in chronic lymphocyticleukemia and is associated with other poor prognosticmarkers[J].Blood,2008,112(9):3807-3817.
[33]Hussain SR,Cheney CM,Johnson AJ,et al.Mcl-1 is a relevant therapeutic target in acute and chronic lymphoidmalignancies:downregulation enhances rituximab-mediated apoptosis andcomplement-dependent cytotoxicity[J].Clin Cancer Res,2007,13(7):2144-2150.
[34]Kitada S,Andersen MJ,Akar S,et al.Expression of apoptosis-regulating proteins in chronic lymphocyticleukemia:correlations with in vitro and in vivo chemoresponses[J].Blood,1998,91(9):3379-3389.
[35]Del V,Moore G,Schlis KD,et al.BCL-2 dependence and ABT-737 sensitivity in acute lymphoblasticleukemia BCL-2 dependence and ABT-737 sensitivity in acute lymphoblastic leukemia[J].Leukemia,2008,111(2):2300-2309.
[36]Del GMV,Letai A.BH3 profiling-measuring integrated function of the mitochondrial apoptotic pathway to predict cell fate decisions[J].Cancer Lett,2013,332(2):202-205.
[37]Besbes S,Mirshahi M,Pocard M,et al.New dimension in therapeutic targeting of BCL-2 family proteins[J].Oncotarget,2015,6(15):12862-12871.
[38]Kline MP,Rajkumar SV,Timm MM,et al.ABT-737,an inhibitor of Bcl-2 family proteins,is a potentinducer of apoptosis in multiple myeloma cells[J].Leukemia,2007,21(7):1549-1560.
[39]Tse C,Shoemaker AR,Adickes J,et al.ABT-263:a potent and orally bioavailable Bcl-2 family inhibitor[J].Cancer Res,2008,68(9):3421-3428.
[40]Souers AJ,Leverson JD,Boghaert ER,et al.ABT-199,a potent and selective BCL-2 inhibitor,achievesantitumor activity while sparing platelets[J].Nat Med,2013,19(2):202-208.
[41]Wilson WH,O'Connor OA,Czuczman MS,et al.Navitoclax,a targeted high-affinity inhibitor of BCL-2 in lymphoid malignancies:a phase 1 dose-escalation study of safety,pharmacokinetics,pharmacodynamics,and antitumor activity[J].Lancet Oncol,2010,11(12):1149-1159.
[42]Rudin CM,Hann CL,Garon EB,et al.PhaseⅡstudy of single-agent navitoclax(ABT-263)andbiomarker correlates in patients with relapsed small cell lung cancer[J].Clin Cancer Res,2012,18(11):3163-3169.
[43]Bruncko M,Wang L,Sheppard GS,et al.Structure-guided design of a series of MCL-1 inhibitors with high affinity andselectivity[J].J Med Chem,2015,58(5):2180-2194.
[44]Friberg A,Vigil D,Zhao B,et al.Discovery of potent myeloid cell leukemia 1(MCL-1)inhibitors usingfragment-based methods and structure-based design[J].J Med Chem,2012,56(1):15-30.
[45]Leverson JD,Zhang H,Chen J,et al.Potent and selective small-molecule MCL-1 inhibitors demonstrate on-targetcancer cell killing activity as single agents and in combination with ABT-263(navitoclax)[J].Cell Death Dis,2015,6(1):e1590.
[46]Besbes S,Pocard M,Mirshahi M.The first MCL-1-selective BH3 mimetics have therapeutic potential for chronic lymphocytic leukemia[J].Crit Rev Oncol Hematol,2016,100(1):32-36.
[47]Kotschy A,Szlavik Z,Murray J,et al.The MCL1 inhibitor S63845 is tolerable and effective in diverse cancer models[J].Nature,2016,538(7626):477-482.
[48]Letai A.S63845,an MCL-1 Selective BH3 mimetic:another arrow in our quiver[J].Cancer Cell,2016,30(6):834-835.
[49]Flemming A.Anticancer drugs:breaking up a pro-survival interaction[J].Nat Rev Drug Discov,2016,15(12):820-821.
(2017-03-15收稿)
(2017-04-18修回)
(编辑:孙喜佳 校对:杨红欣)
Research progress on MCL-1 and its inhibitors in hematological malignancies
Bei SUN,Yintao YE
Bei SUN;E-mail:sunpei003@sina.com
Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer,Tianjin 300060,China;Tianjin 300060,China
Myeloid cell leukemia-1(MCL-1)protein is one of the key antiapoptotic protein members of the B-cell lymphoma-2 protein family.Overexpression of MCL-1 is closely related to not only tumor progression but also resistance to targeted therapy and traditional chemotherapeutic drug.MCL-1 and its inhibitors have been studied in recent years.The mimetics of MCL-1 endogenous ligand BH3 have resulted in significant breakthroughs.In this study,the research progress on MCL-1 and its inhibitors in hematological malignancies is reviewed.
MCL-1,apoptosis,BH3 mimetics,hematological malignancies,targeted therapy

10.3969/j.issn.1000-8179.2017.11.301
天津医科大学肿瘤医院门诊办公室,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060)
孙蓓 sunpei003@sina.com
孙蓓 专业方向为肿瘤药理学。
E-mail:sunpei003@sina.com
