阿霉素通过激活Notch信号通路促进骨肉瘤细胞干性特性*
2017-07-01余铃高天张政佩陶春杰郭卫春方志伟樊征夫
余铃 高天 张政佩 陶春杰 郭卫春 方志伟 樊征夫
·基础研究·
阿霉素通过激活Notch信号通路促进骨肉瘤细胞干性特性*
余铃①高天②张政佩①陶春杰①郭卫春①方志伟②樊征夫②
目的:骨肉瘤干细胞具有化疗耐药性。本文拟探讨耐阿霉素细胞干细胞样特性的改变,以及Notch通路在其中的调控作用。方法:采用2 μM的阿霉素处理骨肉瘤细胞143B 24 h,去药继续培养5 d,检测干细胞样特性的改变,包括形态学的改变、Stro-1+/CD117+双阳性细胞比例、干细胞相关基因表达、悬浮成球的能力、EMT特性。qPCR及Western blot检测Notch通路受体及靶基因表达情况。利用Notch抑制剂DAPT预处理,检测其对耐阿霉素骨肉瘤细胞的干细胞样特性的影响。构建裸鼠移植瘤模型,检测Notch抑制剂对体内成瘤的影响。结果:耐阿霉素骨肉瘤细胞中Stro-1+/CD117+比例增高,干细胞相关基因Oct4、Sox2表达量增加,悬浮成球能力增强,EMT特性上调。qPCR及Western blot结果显示阿霉素耐药的骨肉瘤细胞中Notch受体胞内段NICD1及靶基因Hes1、Hey1等表达量上调。Notch信号抑制剂能够增强骨肉瘤对阿霉素的化疗敏感性,抑制体外阿霉素对骨肉瘤干细胞的富集作用。动物实验表明,Notch抑制剂DAPT能够抑制体内成瘤。结论:阿霉素能够富集骨肉瘤干细胞,Notch信号通路参与其中调控机制,抑制Notch通路能够靶向杀伤骨肉瘤细胞,增加化疗药物敏感性。
阿霉素 骨肉瘤 Notch信号通路 肿瘤干细胞
骨肉瘤是最常见的原发恶性骨肿瘤,好发于青少年。辅助和新辅助化疗很大程度上改善了骨肉瘤患者的长期生存率,但化疗耐药和复发仍然多见[1-2]。阿霉素是一种有效的一线抗肿瘤药物,对实体肿瘤有着广泛的活性谱[3]。阿霉素主要是通过诱导DNA链内相邻嘌呤的交联发挥其抗肿瘤效应。有些患者出现原发或获得性阿霉素耐药,导致复发和转移。
肿瘤干细胞是指能够自我更新和具有多向分化潜能的肿瘤细胞,在肿瘤的发生、转移和耐药中扮演重要角色[4]。Sicilari等[5]最先发现骨肉瘤中存在一小群细胞能够在低黏附无血清环境下形成悬浮球,且具有自我更新能力以及高表达胚胎干细胞标记OCT4和Nanog。Notch信号通路在进化上高度保守,参与调控细胞增殖、生存、凋亡以及分化[6]。Notch信号通路的功能障碍将阻碍细胞分化并导致恶变[7-8],许多报道发现骨肉瘤中存在Notch信号异常[9]。但Notch信号在骨肉瘤干细胞及化疗反应中的作用尚未完全阐明。本文拟探讨耐阿霉素细胞干细胞样特性的改变,以及Notch通路在其中的调控作用。
1 材料与方法
1.1 材料
人骨肉瘤细胞系143B来自中国典型培养物保藏中心(CCTCC)(武汉)。1.2 方法
1.2.1 细胞培养 骨肉瘤细胞培养于含10%胎牛血清(FBS)及1%抗生素(青霉素100 U/mL,链霉素100 μg/mL)的MEM培养基中。细胞在37℃、CO2含量为5%、湿度100%的环境中进行培养。细胞活力用台盼蓝染色检测,培养基每3天更换一次。
1.2.2 细胞增殖和细胞毒性试验 每孔细胞含100 μL培养基,加入10 μL CCK-8试剂,在37℃下孵育2 h。在450 nm波长下用酶标仪测定每孔光密度(OD)。
1.2.3 肿瘤悬浮成球实验 将5 000个/mL细胞接种于添加B27、20 ng/mL人表皮生长因子及20 ng/mL人碱性成纤维细胞生长因子的RPMI 1640培养基的低黏附培养皿中。培养2周以后,直径>50 μm的克隆集落为悬浮球,并用倒置相差显微镜量化计数。
1.2.4 流式细胞分析 细胞消化并重悬于70%乙醇中,然后在4℃下固定30 min。PBS洗涤后,4℃下在荧光标记的抗体(STRO-1和CD117)或同种型对照IgG中孵育30 min。再次洗涤后用BD流式细胞仪(BD Biosciences)检测,荧光强度用 Cell Quest Soft⁃ware(BD Biosciences)检测。
1.2.5 荧光素酶实验 细胞用Notch pGreenFire-CBF1报告基因(Systembio)和CMV-Renilla荧光素酶报告基因转染。质粒与脂质体2 000以3:1比例在OptiMEM中孵育15 min,然后将混合物加入培养基48 h。将细胞裂解后根据试剂盒说明用Dual-Glo Lu⁃ciferase检测系统检测冷光,以海参荧光素酶为内参。
1.2.6 动物移植瘤 从武汉大学动物实验中心购入4周大小的BALB/C裸鼠12只。将裸鼠随机分为2组:对照组与DAPT处理组。DAPT溶于二甲基亚砜(DMSO)中,每天腹腔注射(10 mg/kg/d),持续2周。对照组腹腔注射同等体积DMSO。观察6周,每周记录肿瘤生长情况。
1.2.7 实时荧光定量PCR 总RNA用RNeasy Plus Mini Kit试剂盒提取,浓度和纯度由ND-1000分光光度计测定。反转录参照TaqMan荧光定量反转录试剂说明进行。实时定量PCR反应采用SYBR Green PCR Master Mix,在7900PCR仪中进行。基因表达水平用2-ΔΔCt法计算,以β-actin为内参进行标准化。
1.2.8 蛋白印记分析 蛋白用蛋白质裂解液萃取。裂解后混合液在4℃下10 000 g离心10 min,取上清液。用BCA蛋白浓度试剂盒测定蛋白浓度。含40 μg蛋白的细胞裂解液在SDS-PAGE胶中进行电泳分离并用转膜仪转至聚偏氟乙烯(PVDF)膜上。膜在含0.05%Tween和5%脱脂奶粉的Tris缓冲盐溶液中室温封闭1 h。4℃下一抗孵育过夜。一抗使用抗-Hes1(1:500)、抗-Hey1(1:500)和抗-β-actin(1:2000)。辣根过氧化酶标记的二抗(1:3 000)室温下孵育2 h。最后,使用增强化学发光底物使膜显影。
1.3 统计学分析
使用SPSS 13.0软件进行统计学分析。所有数据以x±s表示。t检验用于比较两组之间的均值,三组以上均值的比较及组间比较使用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 耐阿霉素骨肉瘤细胞的富集
研究表明骨肉瘤干细胞具有耐药性,推测化疗可以富集骨肉瘤干细胞。为了筛选足以诱导DNA损伤的阿霉素亚致死剂量,实验首先测试了阿霉素对骨肉瘤细胞系的细胞毒性。将骨肉瘤细胞系143B用不同浓度的阿霉素处理24 h,CCK8分析实验分析细胞毒性作用,测定的 IC50为 2.46 μM(95%CI:0.87~5.52,图1A)。为了诱导DNA损伤反应又不至于引起显著的细胞死亡,后续试验均用2 μM阿霉素处理24 h。随后细胞的生长情况被连续记录9 d。如图1B所示,在这段时间里,细胞经历了一段短暂的抑制时期,第6 d后生长随即恢复正常。搜集第5 d时仍存活的143B细胞,测定所得的半数抑制浓度为8.48 μM(95%CI:5.47~16.52),较其亲代细胞显著增高(P<0.05,图1C)。上述结果证实小剂量的阿霉素可以富集耐药细胞。
2.2 耐阿霉素的骨肉瘤细胞具有干细胞样特性
为证实亚致死计量的阿霉素是否能够富集骨肉瘤干细胞,检测了去药后第5 d的骨肉瘤细胞的干细胞样特性。如图2A所示,流式细胞术结果显示耐阿霉素骨肉瘤细胞中Stro-1/CD117双阳性细胞较对照组显著增多。qPCR及Western blot结果证实耐阿霉素骨肉瘤细胞中干细胞相关基因Oct4及Sox2表达上调(图2B,2C)。悬浮成球实验结果显示耐阿霉素骨肉瘤细胞的成球率显著增高(图2D)。这些结果表明耐阿霉素细胞显示出增强的干细胞样特性。
上皮间质样变(epithelial mesenchymal transition,EMT)与肿瘤干细胞密切相关,实验也检测了阿霉素处理是否能诱导产生EMT。免疫荧光显示N-钙黏蛋白在耐阿霉素细胞中表达量增高(图2E),且qPCR结果发现耐阿霉素细胞中EMT特异性启动子Snail和Slug也出现过表达(图2F)。
2.3 Notch信号调控耐阿霉素细胞
研究证实Notch信号通路调控成骨细胞谱系的增殖和分化,为探究Notch信号通路是否参与调控阿霉素富集的骨肉瘤干细胞,本研究首先采用CBF1报告系统检测了Notch转录活性,结果证实耐阿霉素骨肉瘤干细胞较对照细胞具有更强的荧光素酶活性(图3A)。通过qPCR测定了Notch通路靶基因的表达,包括Hes1、Hes5和Hey1均出现表达量上调(图3B)。与mRNA的表达一致,Western blot结果也证实Notch1的胞内段NICD1和靶基因Hes1的蛋白水平也显著上调(图3C)。提示Notch1的激活可能在阿霉素诱导的骨肉瘤干细胞富集中扮演重要的角色。
2.4 抑制Notch信号可增加药物敏感性并能抑制肿瘤生长
为了研究靶向抑制Notch信号通路能否逆转阿霉素耐药并减少骨肉瘤干细胞,实验利用γ-分泌酶抑制剂(GSIs)处理细胞。RO4929097(20 μM)预处理增加了骨肉瘤细胞的化疗敏感性(图4A)。对于耐阿霉素的骨肉瘤干细胞,RO4929097能够显著抑制其悬浮肿瘤球的形成率(图4B)。进一步构建移植瘤动物模型,评估了RO4929097的体内抗肿瘤效果,结果证实RO4929097处理组肿瘤生长时间延迟,且肿瘤体积显著小于对照组(图4C)。
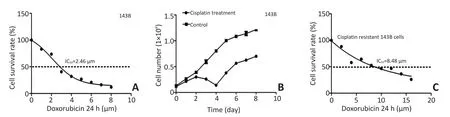
图1 耐阿霉素骨肉瘤细胞的富集Figure 1 Selection of doxorubicin-resistant osteosarcoma cells
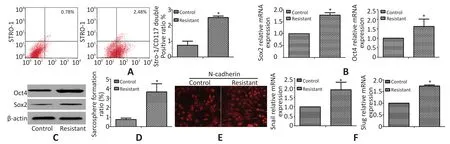
图2 耐阿霉素的骨肉瘤细胞具有干细胞样特性Figure 2 Chemoresistant osteosarcoma cells possessing traits of cancer stem cells

图3 Notch信号调控耐阿霉素CSCsFigure 3 Notch signaling participates in doxorubicin-resistant CSCs
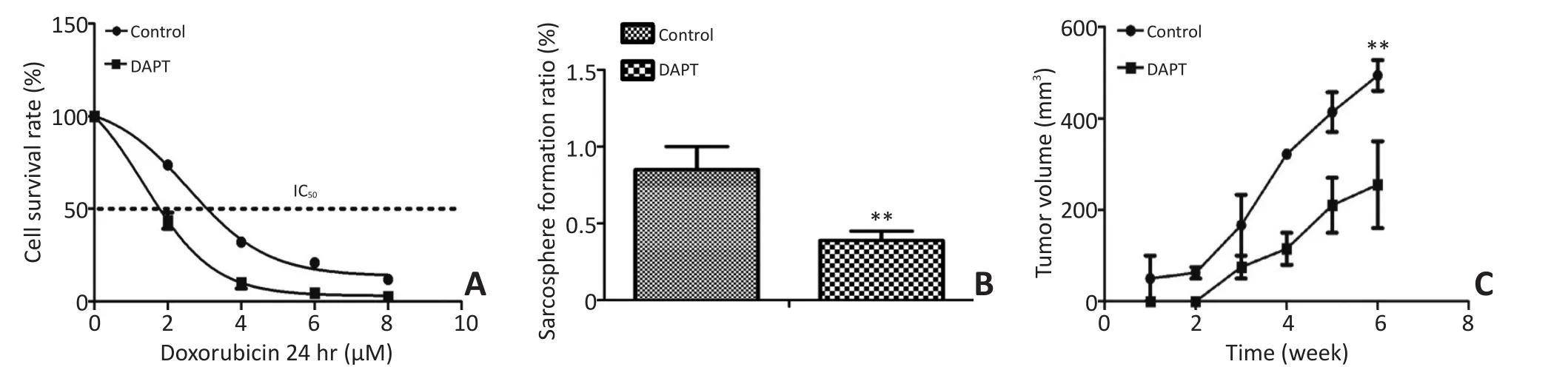
图4 抑制Notch信号可增加药物敏感性并能抑制肿瘤生长Figure 4 Inhibition of Notch increases drug resistance and suppresses tumor growth
3 讨论
阿霉素暴露可以同时诱发促生存和促凋亡信号,最终的结果取决于DNA受损程度以及细胞所处环境[10-11]。阿霉素耐药是影响骨肉瘤疗效的重要因素之一。迄今为止,阿霉素耐药的具体机制尚不明确。本研究筛选出骨肉瘤中耐阿霉素的一个细胞亚群。通过对细胞存活情况的分析,结果表明经过低剂量短时间阿霉素处理的细胞会经历一段短暂的生长抑制时期,随即进入恢复期。
研究表明,肿瘤干细胞较分化的肿瘤细胞对标准癌症化疗方案更耐药[12]。本文结果证实耐阿霉素骨肉瘤细胞具备干细胞样特性。表现为以下几点:1)耐阿霉素骨肉瘤细胞高表达干细胞表面标记Stro-1/CD117;2)耐阿霉素骨肉瘤细胞中干细胞性相关基因Oct4、Sox2表达量显著增高;3)耐阿霉素骨肉瘤细胞的悬浮克隆成球能力显著增高。
最近有研究报道EMT和干细胞样特性的关系[13-14]。例如,在乳腺癌中,EMT状态与肿瘤干细胞特性具有诸多相似性,包括干细胞表面分子标记CD44+/CD24-的表达,自我更新能力和对传统治疗方法的抵抗[15]。前期研究发现间质来源的骨肉瘤不表达上皮性标记,然而,骨肉瘤干细胞表达更多间质性标记并表现出更强的运动性[16]。与之一致,本研究也发现耐药细胞表达EMT标记N-钙黏素且EMT特异性启动子表达量增高。
本研究还表明Notch信号参与阿霉素诱导的肿瘤干细胞富集。Notch是一个保守的信号通路,在正常干细胞和早期祖细胞中维持组织动态平衡[17]。近期有研究发现骨肉瘤中Notch通路功能异常[18]。本研究发现Notch受体的细胞内段NICD1在耐药细胞中表达量增多。γ分泌酶抑制剂能够靶向抑制Notch通路,在本研究中,当Notch通路被阻断后,悬浮成球数量显著减少,且对阿霉素的敏感性增高。动物实验也证实,抑制Notch通路可抑制骨肉瘤体内生长。这些结果提示Notch的激活参与调节骨肉瘤干细胞和阿霉素耐药。
阿霉素暴露与Notch信号之间的关系尚不明确。有研究表明Notch通过抑制ATM激酶负性调节DNA损伤反应[19],提示阿霉素可筛选出耐阿霉素的Notch阳性细胞。也有研究发现p53能够直接调节Notch信号通路,然后通过影响FOXO3活性介导p53依赖的抗DNA损伤功能[20],这些结果支持p53可能是阿霉素和Notch信号通路活化之间的一个中介分子。
综上所述,本研究表明阿霉素耐药的骨肉瘤细胞具有干细胞样特性,且Notch信号通路与之密切相关,抑制Notch通路能够靶向杀伤骨肉瘤干细胞和克服阿霉素耐药。
[1] Hattinger CM,Fanelli M,Tavanti E,et al.Doxorubicin-resistant osteosarcoma:novel therapeutic approaches in sight[J]?Future Oncol,2017,13(8):673-677.
[2] O'Kane GM,Cadoo KA,Walsh EM,et al.Perioperative chemotherapy in the treatment of osteosarcoma:a 26-year single institution review[J].Clin Sarcoma Res,2015,5:17
[3] Li DL,Wang ZV,Ding G,et al.Doxorubicin blocks cardiomyocyte autophagic flux by inhibiting lysosome acidification[J].Circulation,2016,133(17):1668-1687.
[4] Martinez-Barbera JP,Andoniadou CL.Concise Review:Paracrine Role of Stem Cells in Pituitary Tumors:A Focus on Adamantinomatous Craniopharyngioma[J].Stem Cells,2016,34(2):268-276.
[5] Siclari VA,Qin L.Targeting the osteosarcoma cancer stem cell[J].J Orthop Surg Res,2010,5:78.
[6] Previs RA,Coleman RL,Harris AL,et al.Molecular pathways:translational and therapeutic implications of the Notch signaling pathway in cancer[J].Clin Cancer Res,2015,21(5):955-961.
[7] Kranenburg O.Prometastatic Notch signaling in colon cancer[J].Cancer Discov,2015,5(2):115-117.
[8] Hu Y,Su H,Li X,et al.The NOTCH ligand JAGGED2 promotes pancreatic cancer metastasis independent of NOTCH signaling activation[J].Mol Cancer Ther,2015,14(1):289-297.
[9] Tanaka M,Setoguchi T,Hirotsu M,et al.Inhibition of Notch pathway prevents osteosarcoma growth by cell cycle regulation[J].Br J Cancer,2009,100(12):1957-1965.
[10]Izadyar A,Farhadian N,Chenarani N.Molecular dynamics simulation of doxorubicin adsorption on a bundle of functionalized CNT[J].J Biomol Struct Dyn,2016,34(8):1797-1805.
[11]Szwed M,Laroche-Clary A,Robert J,et al.Efficacy of doxorubicintransferrin conjugate in apoptosis induction in human leukemia cells through reactive oxygen species generation[J].Cell Oncol(Dordr),2016,39(2):107-118.
[12]Fitzgerald TL,McCubrey JA.Pancreatic cancer stem cells:association with cell surface markers,prognosis,resistance,metastasis and treatment[J].Adv Biol Regul,2014,56:45-50.
[13]Donnenberg VS,Donnenberg AD.Stem cell state and the epithelialto-mesenchymal transition:Implications for cancer therapy[J].J Clin Pharmacol,2015,55(6):603-619.
[14]Zhang X,Zhao X,Shao S,et al.Notch1 induces epithelial-mesenchymal transition and the cancer stem cell phenotype in breast cancer cells and STAT3 plays a key role[J].Int J Oncol,2015,46(3):1141-1148.
[15]Park SY,Kim MJ,Park SA,et al.Combinatorial TGF-beta attenuation with paclitaxel inhibits the epithelial-to-mesenchymal transition and breast cancer stem-like cells[J].Oncotarget,2015,6(35):37526-37543.
[16]Yu L,Liu S,Zhang C,et al.Enrichment of human osteosarcoma stem cells based on hTERT transcriptional activity[J].Oncotarget,2013,4(12):2326-2338
[17]Ntziachristos P,Lim JS,Sage J,et al.From fly wings to targeted cancer therapies:a centennial for notch signaling[J].Cancer Cell,2014,25(3):318-334.
[18]Tao J,Jiang MM,Jiang L,et al.Notch activation as a driver of osteogenic sarcoma[J].Cancer Cell,2014,26(3):390-401
[19]Vermezovic J,Adamowicz M,Santarpia L,et al.Notch is a direct negative regulator of the DNA-damage response[J].Nat Struct Mol Biol,2015,22(5):417-424.
[20]Mandinova A,Lefort K,Tommasi di Vignano A,et al.The FoxO3a gene is a key negative target of canonical Notch signalling in the keratinocyte UVB response[J].EMBO J,2008,27(8):1243-1254.
(2017-03-15收稿)
(2017-05-08修回)
(编辑:郑莉 校对:武斌)
Doxorubicin induces enrichment of stem-like cells in osteosarcoma by activating Notch signaling
Ling YU1,Tian GAO2,Zhengpei ZHANG1,Chunjie TAO1,Weichun GUO1,Zhiwei FANG2,Zhengfu FAN2
Zhengfu FAN;E-mail:zhengfufan@126.com
1Department of Orthopedics,Renmin Hospital of Wuhan University,Wuhan 430060,China;2Department of Orthopedic Oncology,Key Laboratory of Carcinogenesis and Translational Research,Ministry of Education,Peking University Cancer Hospital and Institute,Beijing 100142,China
This work was supported by the National Natural Science Foundation of China(No.81502575)and the Fundamental Research Funds for the Central Universities(No.2042015kf0069)
Objective:Cancer stem cells(CSCs)are resistant to chemotherapy.Our study aimed to investigate the stem cell-like properties of doxorubicin-resistant osteosarcoma cell line 143B and its correlation with Notch signaling.Methods:We generated doxorubicinresistant osteosarcoma cells by treating them with 2 μm doxorubicin.Stem cell-like properties such as morphology change,Stro-1/CD117 double positive ratio,stem cell-related gene expression,sphere formation efficiency,and EMT character were assessed on day 5 after doxorubicin withdrawal.Notch receptor and its target genes were examined using qPCR and Western blot analysis.The stem cell-like properties of doxorubicin-resistant osteosarcoma cells were assessed when pretreated with Notch inhibitor or vehicle.The anti-tumor effect of Notch inhibitor was tested using a xenograft model.Results:Doxorubicin-resistant osteosarcoma cells were enriched in Stro-1+/CD117+cells,which showed obvious increased expression of stem cell-related genes,and exhibited enhanced spheroid formation and evident mesenchymal characteristics unlike doxorubicin-sensitive cells.qPCR and Western blot assays showed that Notch intracellular domain 1(NICD1)and target genes Hes1 and Hey1 were upregulated in doxorubicin-resistant osteosarcoma stem cells compared with those in vehicle cells.Furthermore,pretreatment with a γ-secretase inhibitor(GSI)to prevent Notch signaling enhanced chemo-sensitivity and inhibited doxorubicin-enriched osteosarcoma stem cell activity in vitro.Finally,the Notch inhibitor prevented tumor growth in mice xenograft models.Conclusion:Doxorubicin induced the enrichment of osteosarcoma stem-like cells through Notch signaling,and inactivation of Notch could be useful for overcoming drug resistance and eliminating osteosarcoma.
doxorubicin,osteosarcoma,Notch pathway,cancer stem cell

10.3969/j.issn.1000-8179.2017.11.268
余铃 专业方向为骨与软组织肿瘤基础和临床研究。E-mail:scaling@whu.edu.cn
①武汉大学人民医院骨1科(武汉市430060);②北京大学肿瘤医院暨北京市肿瘤防治研究所骨与软组织肿瘤科,恶性肿瘤发病机制及转化研究教育部重点实验室
*本文课题受国家自然科学基金(编号:81502575)和中央高校基本科研业务费专项资金(编号:2042015kf0069)资助
樊征夫 zhengfufan@126.com
