L-色氨酸发酵过程偶联膜分离提取工艺研究
2017-06-09刘镇瑜刘子强蔡萌萌陈宁徐庆阳
刘镇瑜,刘子强,蔡萌萌,陈宁,徐庆阳
代谢控制发酵技术国家地方联合工程实验室,天津市氨基酸高效绿色制造工程实验室,天津科技大学 生物工程学院,天津 300457
L-色氨酸发酵过程偶联膜分离提取工艺研究
刘镇瑜,刘子强,蔡萌萌,陈宁,徐庆阳
代谢控制发酵技术国家地方联合工程实验室,天津市氨基酸高效绿色制造工程实验室,天津科技大学 生物工程学院,天津 300457
目的:将发酵过程与膜分离提取过程相偶联,解决现有产酸周期短、乙酸积累较为严重等问题,以提高目的产物的产量,降低代谢抑制物质的积累量。方法:将发酵罐与陶瓷膜分离装置相偶联,在发酵时长21 h、乙酸积累量达到5 g/L时开始膜过滤浓缩菌液,结束后补加透析培养基继续发酵。结果:采用膜偶联发酵技术,与传统发酵工艺相比,菌体生物量提高3.4%,谷氨酸积累量下降54.34%,乙酸积累量下降55.36%。整个发酵过程产酸周期延长了12 h,发酵过程中糖酸转化率提高6.9%。结论:采用膜偶联发酵技术发酵生产色氨酸,可以显著提高色氨酸产量,降低代谢副产物的积累量,延长产酸周期,提高糖酸转化率。
L-色氨酸;膜偶联发酵工艺;乙酸;糖酸转化率
[Key words]L-tryptophan;membrane coupled fermentation technology;acetic acid;glucose conversion rate
L-色氨酸是人体必需的八种氨基酸之一,在人和动物的生长发育、新陈代谢等方面有重要作用,又被称为第二必需氨基酸,广泛应用于食品、医药和卫生行业[1-4]。迄今,L-色氨酸的生产方法主要有酶法、微生物转化法和微生物发酵法[5],其中微生物发酵法由于具有独特的发展优势而被广泛采用。微生物发酵法生产L-色氨酸的过程中,菌种改造和发酵过程控制优化一直是提高L-色氨酸产量的两个主要研究方向。截至目前,通过菌种改造与发酵过程控制优化等手段,L-色氨酸的产量可以达到54.5 g/L[6]。但是现有发酵过程中,由于乙酸逐渐积累,产酸周期难以延长,细胞活力在中后期也逐渐下降。为了进一步提高L-色氨酸的产量,可以对发酵过程中的生物反应器进行一定的改造。
随着生物反应器技术的发展,将发酵罐与生物分离装置相偶联,发酵罐内的发酵液经过生物分离装置分离之后,浓缩的细胞部分再打回发酵罐内,以保持发酵罐内细胞的高活性状态,可以显著提高发酵生产率[7]。本实验是在L-色氨酸的发酵过程中,将发酵罐与陶瓷膜相偶联,发酵到一定时间之后开始进行膜过滤分离。分离后的发酵清液进入提取工序,浓缩菌液进入发酵罐后补加透析培养基继续发酵。本研究分析了L-色氨酸发酵过程偶联膜分离提取工艺对发酵过程中色氨酸的产率、转化率、谷氨酸积累量、乙酸积累量与碳代谢流变化的影响。
1 材料与方法
1.1 材料
大肠杆菌TRTH株由天津科技大学工业微生物菌种保藏室提供;5 L和30 L自动控制发酵罐购自上海保兴生物设备工程有限公司;陶瓷膜浓缩分离系统购自上海戈瑞环境生物工程有限公司;78-1电热恒温培养箱购自湖北省黄石医疗器材厂;P200Ⅱ型或P230高压恒流泵、UV200Ⅱ紫外可见波长监测器、氨基酸专用色谱工作站、ZW型色谱柱恒温箱购自美国Laballiance设备公司;氨基酸专用色谱柱(C18,5μm,250 mm×4.6 mm)购自大连依利特分析仪器公司。
1.2 培养基
①活化斜面培养基(g/L):葡萄糖1,蛋白胨10,牛肉膏5,酵母粉5,NaCl 2.5,琼脂条20,pH7.0~7.2;②种子培养基(g/L):葡萄糖40,酵母粉1,(NH4)2SO41.2,K2HPO45.6,MgSO4·7H2O 2.0,FeSO4·7H2O 2.8 mg/L,MnSO4·H2O 1.2 mg/L,VB13.9 mg/L,VH0.3 mg/L;③发酵培养基(g/L):葡萄糖0.75,酵母粉1,柠檬酸钠2,K2HPO47.5,Mg-SO4·7H2O 2,FeSO4·7H2O 75.6 mg/L,微量元素1 mL,pH7.0~7.2,消泡剂1 mL/L;④透析培养基(g/ L):KH2PO42,MgSO4·7H2O 0.33,KCl 2,CTT 0.5,微量元素6 mL;⑤微量元素溶液(mg/L):钼酸铵0.28,硼酸5,CoCl2·6H2O 1.4,MnSO4·H2O 0.5,CuSO4·7H2O 0.5,ZnSO4·7H2O 0.6。
1.3 培养方法
1.3.1 斜面活化培养 取斜面保藏菌种1环,划线接种于活化斜面,37℃恒温培养20~24 h。
1.3.2 种子培养 用无菌水冲洗活化斜面5支,并以火焰接种方式接入5 L种子罐,初始通气量1 L/min,搅拌转速200 r/min,温度36℃,自动流加氨水控制pH为7.0,以泡敌消泡,种子培养12 h。
1.3.3 发酵培养 以10%的接种量将种子液接种于装有发酵培养基的30 L发酵罐中进行发酵。培养温度36℃,通过调节搅拌转速、通气量与葡萄糖流加速率保持溶氧水平为20%~30%。通过自动流加氨水将pH值维持在7.0(0~20 h)、6.7(20~40 h)。
1.3.4 膜偶联发酵工艺 膜偶联发酵工艺可以降低发酵过程中副产物的浓度,减少抑制作用[8]。发酵过程中实时检测乙酸浓度,在乙酸产量大于5 g/L时进行膜过滤。整个分离装置在开启前1 h采用0.1 MPa蒸汽灭菌,灭菌后通入无菌空气保持正压。分离后的发酵清液进入提取工序,浓缩菌液进入发酵罐后补加透析培养基继续发酵。分离过程中停止发酵,维持条件为温度32℃、pH7.0,不流加葡萄糖,分离时间1.5 h(该时间不计入发酵时间)。L-色氨酸发酵过程偶联膜分离提取装置如图1所示。
1.4 分析方法
pH值、菌体浓度、L-色氨酸浓度、葡萄糖浓度及谷氨酸浓度测定参见文献[9],溶氧水平、乙酸含量测定参见文献[10]。
1.5 代谢流平衡平衡模型的建立
代谢流平衡模型的建立参见文献[11],L-色氨酸的代谢网络如图2所示,反应速率方程与各步的反应计量化学方程式见附录。
2 结果
2.1 膜偶联发酵工艺对菌体生物量及L-色氨酸产量的影响
色氨酸是细胞代谢产生的初级代谢产物,其产量与细胞数有着密切关系[12],增加菌体生物量的浓度可以提高色氨酸的产量。采用膜偶联发酵工艺,实时监测乙酸和L-色氨酸的浓度,当发酵时长达到21 h、乙酸浓度接近5.0 g/L、色氨酸浓度达到32.5 g/L时进行过滤,菌体生物量浓度与色氨酸产量如图3所示。可以看出,采用膜偶联发酵工艺,可以明显提高菌体生物量浓度。膜过滤开始后,发酵罐内抑制性底物与副产物浓度都有所下降,低的抑制性物质浓度,使得细胞得以继续生长。采用膜偶联发酵工艺,菌体生物量浓度由52.4 g/L提高到54.2 g/L,相对于普通发酵而言提高了3.4%。采用膜偶联发酵工艺,在21 h开始膜过滤后,由于抑制作用解除,细胞酶活得到恢复,细胞的产酸速率几乎与初始发酵一致。产酸周期延长至44 h,相比普通发酵而言,整个发酵过程产酸周期延长了12 h。
2.2 膜偶联发酵工艺对乙酸及谷氨酸积累的影响
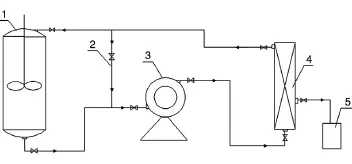
图1 L-色氨酸发酵过程偶联膜分离提取装置

图2 L-色氨酸生物合成代谢网络

图3 膜偶联发酵工艺对生物量及L-色氨酸产量的影响
用膜偶联发酵工艺发酵生产L-色氨酸,乙酸积累量和谷氨酸积累量如图4所示,在整个发酵生产过程中,乙酸积累量与谷氨酸积累量都明显下降。常规单一发酵过程中产生的乙酸很难排出发酵罐,发酵21 h左右乙酸积累达5.6 g/L,严重抑制了色氨酸的继续生产,在后续发酵过程中乙酸的积累量逐渐加大,最大达11.2 g/L,并且发酵液逐渐变黑。而采用膜偶联发酵工艺,在21 h乙酸积累量达到5 g/L时进行膜过滤,发酵液中的乙酸随透析液逐渐被清除出发酵罐。随着发酵透析培养基的加入,乙酸进一步得到稀释。整个发酵过程中,乙酸的积累量都控制在5 g/L以下,为提高色氨酸的转化率提供了一定的条件。由于采用了膜偶联发酵工艺,谷氨酸的积累也得到了一定的抑制。整个发酵过程中,谷氨酸的积累量最高达到2.1 g/L,相比于普通发酵而言下降了54.34%。
2.3 膜偶联发酵工艺对糖酸转化率的影响
采用膜偶联发酵工艺,发酵过程中的糖酸转化率如图5所示,一直维持在较高水平。在21 h开始透析后,由于抑制物质的解除和菌体生物量的增加,细胞合成色氨酸的速率得到提高,总的色氨酸的量也得到相应提高。在整个发酵过程中采用膜偶联发酵工艺,糖酸转化率为18.5%,而普通发酵的糖酸转化率为17.3%,相比而言糖酸转化率提高了6.9%。
2.4 膜过滤前后的代谢流量变化
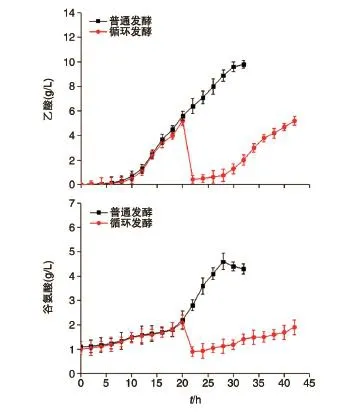
图4 膜偶联发酵工艺对乙酸及谷氨酸积累量的影响
分别测定膜过滤前4 h即16~20 h(阶段1)与膜过滤后4 h即38~42 h(阶段2)内的葡萄糖消耗速率,以及胞外色氨酸、乳酸、乙酸、丙氨酸、苯丙氨酸及酪氨酸的浓度,结果见表1。然后以葡萄糖摩尔消耗速率为100 mmol/(L·h),分别计算各自的消耗或积累速率。运用Metatool软件线性规划计算得到相应的代谢流分布,结果见表2。
色氨酸生物合成的前体物分别是磷酸烯醇式丙酮酸(PEP)和4-磷酸赤藓糖(E4P),大肠杆菌摄取葡萄糖后经糖酵解(EMP)途径与磷酸戊糖(HMP)途径生成PEP与E4P。色氨酸的合成有几个关键节点,如Glc6P节点和PEP节点。Glc6P节点主要控制着碳架形成X5P和E4P的多少,而PEP节点则决定着流向PEP与形成分支酸的代谢流量变化。由表2可知,在膜过滤之前(阶段1),有87.42%的碳架进入EMP(r2)途径,28%的碳架由F6P和GAP通过转酮酶催化生成X5P和E4P进入HMP途径(r16)。同时,流向分支酸的代谢流量为34.1%(r17)。而在膜过滤后(阶段2),有86.34%的碳架进入EMP(r2)途径,而27.3%的碳架由F6P和GAP通过转酮酶催化生成X5P和E4P进入HMP途径(r16)。流向分支酸的代谢流量为33.3%(r17)。膜过滤前后L-色氨酸的代谢流量分别为31%、30.2%。这表明采用膜偶联发酵工艺,膜过滤后与膜过滤前流向色氨酸的代谢流变化不大,细胞能保持较高的色氨酸生产速率。

图5 膜偶联发酵工艺对糖酸转化率的影响
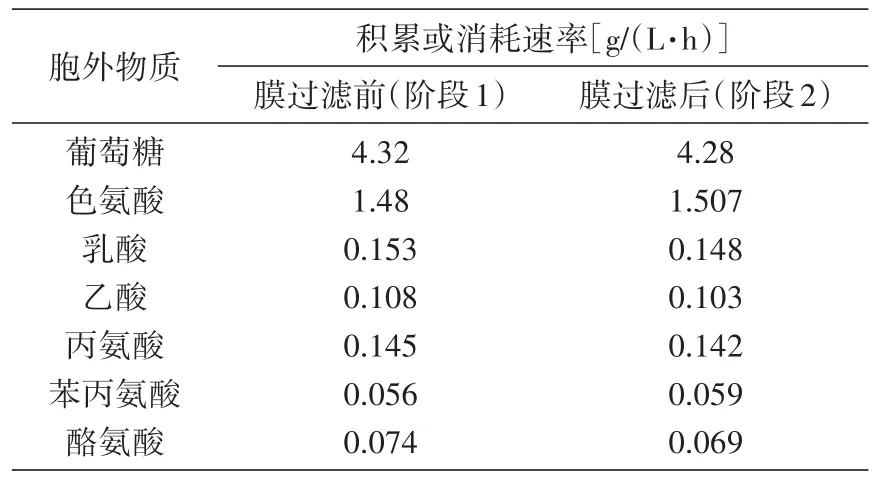
表1 膜过滤前(阶段1)与膜过滤后(阶段2)物质浓度及其变化规律

表2 L-色氨酸生物合成代谢流分布
3 讨论
传统的发酵生产色氨酸的技术,不能解决发酵中后期乙酸积累的问题。采用膜偶联发酵工艺,可以解决底物与代谢副产物的抑制问题,提高目的产物的产量。目前,膜偶联发酵技术已经得到广泛应用[13]。例如在琥珀酸发酵生产过程中,发酵的同时采用外部纤维过滤器分离细胞,解决了产物琥珀酸的反馈抑制作用,得到了高细胞密度,并且提高了琥珀酸的产量[14]。
本实验采用膜偶联发酵工艺,在发酵罐内乙酸积累量达到抑制水平时开始透析,之后补加透析培养基继续进行发酵,可以显著降低发酵罐内乙酸与谷氨酸的积累量。采用膜偶联发酵工艺,整个发酵过程中流向色氨酸的代谢流一直保持在发酵中期较高水平,菌体生物量提高了3.4%,产酸周期延长了12 h,糖酸转化率提高了6.9%。本实验是在单一发酵罐中进行的,实际上可以连接二级、三级发酵罐,依次进行连续发酵,这有待于进一步的研究。
[1]Leuchtenberger W,Huthmacher K,Drauz K.Biotechnological production of amino acids and derivatives:current status and prospects[J].Appl Microbiol Biotechnol,2005,69(1):1-8.
[2]翁辉廉,周路德.L-色氨酸的临床应用[J].临床用药, 1990,3(3):492-501.
[3]Bongaerts J,Kramer M,Muller U,et al.Metabolic engineering for microbial production of aromatic amino acids and derived compounds[J].Metab Eng,2001,3 (4):289-300.
[4]赵厚裕,常正踪,曹明丽.L-色氨酸治疗抑郁症[J].新医药与临床,1991,10(3):1392-1411.
[5]韦平和,吴梧桐,王晣.色氨酸生物工程研究进展[J].药物生物技术,1998,5(3):180-183.
[6]廖韦红,褚宏,纪衍英.大肠杆菌发酵生产L-色氨酸工艺简析[J].生物技术世界,2016,(4):11-12.
[7]Kwon S G,Park S W,Oh D K.Increase of xylitol productivity by cell-recycle fermentation of Candida tropicalis using submerged membrane bioreactor[J]J Biosci Bioeng,2006,101(1):13-18.
[8]Sarks C,Jin M,Sato T K,et al.Studying the rapid bioconversion of lignocellulosic sugars into ethanol using high cell density fermentations with cell recycle[J]. Biotechnol Biofuels,2014,7(1):1-12.
[9]黄静.L-色氨酸高产菌菌种改造及发酵工艺研究[D].天津:天津轻工业学院,2001.
[10]程立坤.L-色氨酸发酵过程控制优化[D].天津:天津科技大学,2014.
[11]赵春光.L-色氨酸发酵工艺研究[D].天津:天津科技大学,2009.
[12]Cheng H C,Wang F S.Optimal process/solvent design for ethanol extractive fermentation with cell recycling[J].Biochem Eng J,2008,41(3):258-265.
[13]Spira W M,Fedorkacray P J.Enterotoxin production by Vibrio cholerae and Vibrio mimicus grown in continuous culture with microbial cell recycle[J].Appl Environ Microbiol,1983,46(3):704-709.
[14]Krige A,Nicol W.Continuous succinic acid fermentation by Escherichia coli KJ122 with cell recycle[J].Process Biochem,2015,50(12):2004-2011.
Study on the L-Tryptophan Fermentation Progress Coupled with the Membrance Separation and Extraction Progress Technology
LIU Zhen-Yu,LIU Zi-Qiang,CAI Meng-Meng,CHEN Ning,XU Qing-Yang*
National and Local United Engineering Lab of Metabolic Control Fermentation Technology;Tianjin Engineering Lab of Efficient and Green Amino Acid Manufacture;College of Biotechnology,Tianjin University of Science and Technology;Tianjin 300457,China
Objective:To couple the fermentation process with the membrane separation and extraction process, so as to prolong the the whole L-tryptophan production period and reduce the accumulation of acetic acid and increase the production of target product and reduce the accumulation of the repressor.Methods:The membrane separation and extraction process was started when the amount of acetic acid reached 5 g/L and the fermentation time lastet for 21 h.The fermentation was continued when the dialysis medium was added.Results:With the application of membrane coupled fermentation technology,the biomass increased by 3.4%,and the accumulation of glutamic acid decreased by 54.34%,and the accumulation of acetic acid decreased by 55.36%.The whole acid production period extended 12 h,and the glucose conversion rate improved 6.9%.Conclusion:The application of membrane coupled fermentation technology can significantly increase the production of tryptophan and reduced the accumulation of the repressor.The whole L-tryptophan production period was prolongated,and the glucose conversion rate has improved.

附表1 化学计量平衡式

附表2 代谢节点反应速率方程

附表3 缩写说明表
Q935
A
1009-0002(2017)03-0313-06
10.3969/j.issn.1009-0002.2017.03.014
2016-12-19
天津市科技支撑计划重点项目(14ZCZDSY00015);天津市科技特派员项目(15JCTPJC57000)
刘镇瑜(1990-),男,硕士研究生,(E-mail)1905302718@qq.com
徐庆阳,(E-mail)xuqingyang@tust.edu.cn
*Corresponding author,E-mail:xuqingyang@tust.edu.cn
