胸腺素α1二聚体蛋白的初步毒理学研究
2017-06-09牛东武都都高凯丽王昭维张存张英起张伟李维娜
牛东,武都都,高凯丽,王昭维,张存,张英起,张伟,李维娜
1.肿瘤生物学国家重点实验室;
2.第四军医大学 a.药学系生物制药学教研室;b.学员一旅二营八连;陕西 西安 710032
胸腺素α1二聚体蛋白的初步毒理学研究
牛东1,2a,2b,武都都1,2a,2b,高凯丽1,2a,王昭维1,2a,张存1,2a,张英起1,2a,张伟1,2a,李维娜1,2a
1.肿瘤生物学国家重点实验室;
2.第四军医大学 a.药学系生物制药学教研室;b.学员一旅二营八连;陕西 西安 710032
目的:对胸腺素α1二聚体蛋白开展初步的毒理学研究,为后续系统地进行临床前研究提供依据。方法:将BALB/c小鼠随机分为生理盐水对照组和胸腺素α1二聚体蛋白高、中、低剂量组,观察胸腺素α1二聚体蛋白给药后小鼠的一般行为,进行血液生化学指征及组织病理学检测。结果:动物未见明显的中毒症状和死亡,与对照组相比,高、中、低各剂量胸腺素α1二聚体蛋白注射组的动物行为、活动、体重、进食量等与对照组无显著差异,血液生化指标与主要脏器组织形态学检查也均未见异常。结论:未发现胸腺素α1二聚体对小鼠有明显的毒性作用。
胸腺素α1;二聚体;毒理学;小鼠
胸腺素α1(thymosinα1,Tα1)是一种胸腺来源的酸性多肽,由28个氨基酸残基组成,是重要的生物调节剂,可以显著提高生物体的免疫应答能力[1],临床上已广泛用于治疗各种原发性或继发性T细胞缺陷病、某些自身免疫性疾病、乙型肝炎、丙型肝炎以及辅助治疗肿瘤[2-6]。其临床疗效确切,毒副作用轻微,具有广阔的应用前景。
为克服市场上同类药品存在的纯度低、价格昂贵等问题,我们实验室前期构建和表达了Tα1二聚体(Tα1②)蛋白,实现了Tα1以二聚体的形式在大肠杆菌中高效表达,并用简便廉价的纯化工艺获得了高产量、高活性的纯化产物。细胞学实验证实Tα1②可以促进小鼠脾淋巴细胞的增值,具有比化学合成单体更高的生物学活性[7]。
为了进行系统的临床前研究,我们对Tα1②进行了初步毒理学检测。通过观察不同剂量Tα1②给药对小鼠的进食、体重等一般状况的影响,检测血清生化学指标、重要脏器相对重量、组织病理学情况,考察Tα1②的安全性,为进一步系统性进行Tα1②的临床前研究提供参考依据。
1 材料与方法
1.1 材料
BALB/c小鼠(雌性,16~18 g)购自第四军医大学实验动物中心;日达仙(SciClone公司);IPTG(Solon公司);4℃高速离心机、全自动生化分析仪(贝克曼公司);HE染色试剂盒(博士德公司)。
1.2 小鼠的饲养与给药
BALB/c小鼠饲养环境为温度24~26℃,相对湿度40%~70%,自然通风,光照/黑暗各12 h,自由摄食、饮水。40只小鼠按体重随机分为生理盐水对照组及低浓度(80μg/只)、中浓度(160μg/只)、高浓度(320μg/只)Tα1②实验组,每组10只。分别于腹腔内注射生理盐水或Tα1②,每周2次,连续给药6周,给药后检测各项指标。
1.3 小鼠的一般情况
给药后每日观察小鼠一般状况,包括体貌、毛色、活动、摄食、饮水、对刺激的反应等。观察各组是否出现竖尾、躁动、惊厥等兴奋现象,或嗜睡、蜷缩、弓背等抑制现象。观察各组粪、尿情况,是否有腹泻、便血、黑便、尿血等现象,如有异常则进行记录。每周称取小鼠空腹体重并测定饲料消耗量1次,共计6周。
1.4 生化指标测定
小鼠最后一次给药次日摘眼球取血,取血前禁食过夜。血液静置30 min使其充分凝固,3000~4000 r/min离心分离血清,采用全自动生化分析仪进行血清生化学检测。
1.5 重要脏器形态学与组织学观察
迅速脱颈处死小鼠,进行系统解剖,观察各主要脏器形态大小差异,同时称重,与小鼠体重比较,求得各脏器系数(g/100 g)。摘取心、肝、肺、肾及脑新鲜组织,用多聚甲醛固定;固定后的组织经修块取材,常规石蜡包埋,滑动切片机5 μm切片;切片脱水脱蜡,苏木素-伊红(HE)染色,光镜下对各组织进行病理学检测。
1.6 统计学分析
采用SPSS17.0软件,组间t检验和单因素方差分析,计量结果以x±s表示,P<0.05为有显著性差异。
2 结果
2.1 小鼠的一般情况检测
高、中、低剂量Tα1②组及生理盐水对照组注射给药期间,各组动物一般状况良好,没有出现死亡;各组一般生理活动及二便未见异常;小鼠皮毛光泽,皮肤黏膜无异常,眼、耳、鼻、口及肛门等无异常分泌物;未见呼吸困难或呼吸频率、幅度等发生异常变化;摄食、饮水正常,未见呕吐、腹泻等胃肠道反应。
小鼠按体重随机分组,入组时各组体重无统计学差异。于给药第1、2、3、4、5、6周各称量体重一次,观察各组小鼠体重是否有变化,结果如表1及图1,各组小鼠体重呈缓慢上升趋势,给药组体重变化与对照组比较无显著性差异。
小鼠入组时各组摄食量无统计学差异。于给药第1、2、3、4、5、6周各计算摄食量一次,给药组与对照组比较无显著差异(表2、图2)。

表1 胸腺素α1二聚体对小鼠体重的影响(g,x±s,n=10)
2.2 血清生化学检测结果
给药6周后进行血清生化学分析,结果见表3。高剂量给药组总胆红素(TBIL)和血糖(GLU)水平与对照组比较略升高(P<0.05),低剂量给药组的白蛋白(ALB)水平低于对照组(P<0.01),但上述变化均在BALB/c小鼠的正常值范围内;其他各项血清生化指标与对照组比较无显著差异。
2.3 脏器组织病理学结果
解剖小鼠,肉眼观察各主要脏器均颜色鲜活,位置、大小无异常。称重并计算各脏器数(表4),给药组与对照组相比较无显著差异。各组织用多聚甲醛固定后,包埋蜡块切片进行HE染色(图3),各剂量组小鼠心、肝、肺、肾没有发现明显病变,与生理盐水对照组相比无差异。
3 讨论
作为一种重要的生物学应答调节物,Tα1对调节免疫功能、维持人体内动态免疫平衡具有重要作用。Tα1可以促进T细胞增殖及对抗原刺激的反应性[8],增强T细胞介导同种或自身淋巴细胞反应的能力[9],并且通过延迟自由基的产生和减少谷胱甘肽的消耗,拮抗淋巴细胞成熟过程中的凋亡[10]。Tα1能够活化巨噬细胞,促进其胞饮、胞吞及抗原提呈能力[11]。Tα1对树突状细胞(DCs)也具有促进成熟、分化的作用,能促使DCs分泌巨噬细胞激活因子从而增强机体免疫应答功能[12]。Ta1还有双向性免疫调节效应,具有保护免疫功能和调节神经内分泌细胞因子网络的作用,从而减轻细胞因子所致炎性损害,改善感染导致的高代谢状态[13]。
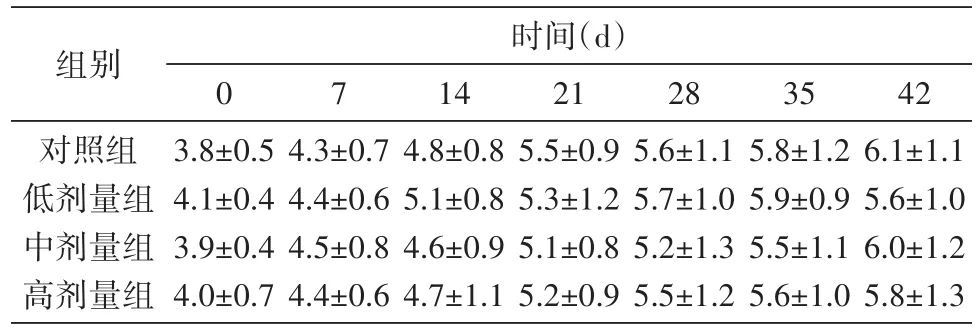
表2 胸腺素α1二聚体对小鼠摄食量的影响(g,x±s,n=10)

图1 小鼠给药期间的体重变化

图2 小鼠给药期间的摄食量变化

图3 各组小鼠重要脏器的HE染色图

表3 胸腺素α1二聚体对小鼠血清生化指标的影响(x±s,n=10)
Tα1已广泛应用于各种原发性或继发性免疫缺陷病、自身免疫病、病毒及微生物感染、肿瘤等的治疗中。单独应用或联合其他药物,临床疗效确切,不良反应极其轻微,且大剂量使用时无发热及过敏反应,有广阔的应用前景。但是,目前市售的Tα1多为化学合成或生物提取。前者制备成本高、售价昂贵,且生产工艺对环境有很大污染;后者从小牛等动物胸腺组织中提取获得,产量和纯度低,易引起患者的过敏反应。而Tα1序列过短,因此难于用基因工程方法直接获得。为解决这一难题,我们构建表达了有生物学活性的Tα1②,获得了高产量、低成本、高活性的纯化产物,具有比化学合成单体更高的生物学活性[7]。
我们以小鼠为试验对象,对Tα1②进行了初步毒理学研究,以评价其安全性。Tα1②给药后未引起动物死亡及出现明显的中毒症状,对小鼠的生长发育和血液生化指标等均没有不良影响。Tα1②给药后动物的行为、活动、体重、进食量等与对照组无显著差异。文献报道Tα1主要通过肾脏排泄[14],实验结果显示与对照组相比,肾功能检测指标与肾脏外观大小、脏器系数及组织病理学等指标均未发现异常,其他主要脏器组织形态学检查也均未见异常。综上所述,未发现Tα 1②对小鼠有明显的毒性作用,为进一步系统性进行Tα1②的临床前研究提供了参考依据。

表4 胸腺素α1二聚体对小鼠脏器系数的影响(g/100g,x±s)
[1]Low T L,Goldstein A L.The chemistry and biology of thymosin.II.Amino acid sequence analysis of thymosin alpha1 and polypeptide beta11[J].J Biol Chem, 1979,254(3):987-995.
[2]Romani L,Bistoni F,Montagnoli C,et al.Thymosin alpha1:an endogenous regulator of inflammation,immunity,and tolerance[J].Ann N Y Acad Sci,2007, 1112(10):326-338.
[3]Kim B H,Lee Y J,Kim W,et al.Efficacy of thymosinα-1 plus peginterferonα-2a combination therapy compared with peginterferon α-2a monotherapy in HBeAg-positive chronic hepatitis B:a prospective, multicenter,randomized,open-label study[J].Scand J Gastroenterol,2012,47(8-9):1048-1055.
[4]Maio M,Mackiewicz A,Testori A,et al.Large randomized study of thymosin α1,interferon α,or both in combination with dacarbazine in patients with metastatic melanoma[J].J Clin Oncol,2010,28(10):1780-1787.
[5]Shuqun C,Mengchao W,Han C,et al.Antiviral therapy using lamivudine and thymosinα1 for hepatocellular carcinoma coexisting with chronic hepatitis B infection[J].Hepatogastroenterology,2006,53(68):249-252.
[6]Rustgi V.Combination therapy of thymalfasin(thymosinα1)and peginterferon α-2a in patients with chronic hepatitis C virus infection who are non-responders to standard treatment[J].J Gastroenterol Hepatol,2004,19 (12):S76-S78.
[7]李维娜,吴守振,张露,等.胸腺素α1二聚体蛋白的克隆、表达、纯化及其生物学活性检测[J].第四军医大学学报,2009,30(8):676-678.
[8]Maini M K,Boni C,Lee C K,et al.The role of virus-specific CD8 cells in liver damage and virual control during persistent hepatitis B virus infection[J].J Exp Med,2002,191(6):1269-1280.
[9]Stefanini G F,Foschi F G,Castelli E,et al.α1-thymosin and transcatheter arterial chemoembolization in hepatocellular carcinoma patients:a preliminary experience[J].Hepatogastroenterology,1998,45(19):209-215.
[10]Baumann C A,Badamchian M,Goldstein A L.Thymosinα1 antagonizes dexamethasone and CD3-induced apoptosis of CD4+CD8+thymocytes through the activation of cAMP and protein kinase C dependent second messenger pathways[J].Mech Ageing Dev,1997,94(1-3):85-101.
[11]Shrivastava P,Singh S M,Singh N.Activation of tumor-associated macrophages by thymosinα1[J].Int J Immunopathol Pharmacol,2004,17(1):39-47.
[12]Shrivastava P,Singh SM,Singh N.Antitumor activation of peritoneal macrophages by thymosinα1[J].Cancer Invest,2005,23(4):316-322.
[13]姜军,李宁,黎介寿.胸腺肽α1对严重腹腔感染大鼠蛋白质代谢和细胞因子的影响[J].肠外与肠内营养, 2005,12(3):1652-1691.
[14]Ancell C D,Phipps J,Young L.Thymosinα1[J].Am J Health Syst Pharm,2001,58(10):879-885.
Toxicity Study of Thymosinα1 Concatemer in BALB/c M ice
NIU Dong1,2,WU Du-Du1,2,GAO Kai-Li1,2,WANG Zhao-Wei1,2, ZHANG Cun1,2,ZHANG Ying-Qi1,2,ZHANG Wei1,2,LIWei-Na1,2*
1.State Key Laboratory of Cancer Biology;2.Department of Biopharmaceutics,School of Pharmacy,Fourth Military Medical University;Xi'an 710032,China
*Corresponding author,E-mail:liweina@fmmu.edu.cn
Objective:A primary safety study of recombinant human thymosinα1 concatemer protein was conducted to support the following design of preclinical trial.Methods:The BALB/c mice were injected intraperitoneally with saline or thymosinα1 concatemer protein.The parameters of standard toxicology were evaluated systematically.Results:Visible changes were not found on general signs,body weight,food consumption,clinical chemistry and necropsy analysis of main organ between thymosinα1 concatemer administrated group and normal saline control group.Conclusion:In conclusion,primary toxicology study showed that recombinant human thymosinα1 concatemer was well tolerated and had no significant adverse effect on mice.
thymosinα1;concatemer;toxicology;mice
R99
A
1009-0002(2017)03-0338-04
10.3969/j.issn.1009-0002.2017.03.019
2017-01-06
国家自然科学基金(81301785,81472649,81672800)
牛东(1995-),男,本科生,(E-mail)88488031@qq.com
李维娜,(E-mail)liweina@fmmu.edu.cn
