慢性镉暴露对斑马鱼卵巢组织的氧化损伤和子代发育的母源影响
2017-06-09刘洋王兰孙敏
刘洋,王兰,孙敏
山西大学 生命科学学院,山西 太原 030006
慢性镉暴露对斑马鱼卵巢组织的氧化损伤和子代发育的母源影响
刘洋,王兰,孙敏
山西大学 生命科学学院,山西 太原 030006
目的:采用半静态毒性实验方法,研究慢性镉暴露对性成熟斑马鱼卵巢组织抗氧化酶活性、脂质过氧化水平的影响及其母源传递毒性效应。方法:依据前期测定的96 hLC50,参考国家渔业标准,设置5个镉处理组(0.058、0.116、0.232、0.580、1.160 mg/L)和1个对照组,镉暴露21 d后,对卵巢组织超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)活性及脂质过氧化物丙二醛(MDA)含量进行测定,并对其受精率、F1代胚胎孵化率及96 hpf幼鱼体长进行统计分析。结果:不同浓度镉暴露均导致卵巢组织SOD、CAT和GPx活性显著降低、MDA含量显著升高并呈浓度依赖效应。子代母源毒性分析显示,与对照组相比,0.232和0.580 mg/L浓度组受精率均显著下降,0.232 mg/L浓度组F1代胚胎孵化率显著降低;各浓度组受精后96 h幼鱼体长与对照组相比有显著性差异,且随着镉浓度的增加体长显著变短。结论:慢性镉暴露导致斑马鱼卵巢组织抗氧化酶活性受到显著抑制,对组织和细胞造成严重氧化损伤,并通过母源传递导致子代发育的毒性效应。
斑马鱼;卵巢;氧化损伤;母源毒性;镉
工业废水、城市污水的大量排放,导致水环境重金属污染问题日益凸显,使动物和人类的生存、健康受到严峻挑战[1]。重金属镉(cadmium,Cd)是工业上使用广泛、具高毒性的环境污染物之一,其半衰期长,可在生物体内富集[2],并可通过不同途径和方式对生殖、消化、神经等系统造成毒害,导致不同组织器官严重损伤[3-4]。
水生动物是水环境中的重要指示生物。对鱼类而言,镉是一种致毒快,损害重的毒物[5]。镉毒性机制的研究表明,镉进入机体诱导组织和细胞产生大量自由基和活性氧(reactive oxygen species,ROS),从而导致氧化损伤[6]。ROS水平的升高直接引发脂质过氧化、细胞膜损伤并影响多种酶的活力,对生物体造成威胁。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)等抗氧化酶能够清除ROS和多种自由基,在体内抗氧化防御过程中发挥重要作用,已成为水生动物毒理学中毒性机制研究的重要指标[7]。研究发现,急性镉暴露导致斑马鱼(Danio rerio)幼鱼GPx活性显著降低,丙二醛(malonyldialdehyde,MDA)含量显著增加,造成氧化损伤[8];Qu等[9]、Jancsó等[10]认为,镉胁迫鲤科鱼类(鲤和鲫)导致多种组织MDA含量及SOD、CAT、GPx等抗氧化酶发生变化。急、慢性镉胁迫食蚊鱼(Gambusia holbrooki)的研究表明,CAT活性的变化可作为肝脏和鳃组织氧化损伤的指标[11]。
性腺是镉积累的重要靶器官之一[12]。近年来,镉暴露对雄性生殖系统的影响多有研究,但是镉对雌性生殖系统特别是母源传递毒性效应知之甚少。已有研究报道,重金属铀、镉暴露后会对母本斑马鱼产生毒性效应,导致其生殖能力的改变,且会通过母本将毒性效应传递到子代,从而间接对子代生长和发育产生影响[13-14]。
已有文献报道,急性镉暴露导致稀有鮈鲫(Gobiocypris rarus)生精细胞排列紊乱、发育停止、精子数量减少等组织病理学变化[15]。镉暴露导致罗非鱼(Sarotherodon malenotheron)性腺分化发生紊乱[16],引起青鳉(Oryzias latipes)、鲦鱼(Pimephales promelas)及斑马鱼生精细胞紊乱、精子数量减少[17]、卵巢萎缩等损伤。急性镉暴露(72 h)导致斑马鱼生殖能力受阻,造成子代发育延缓的毒性效应[13],但镉暴露导致各种毒性效应的阈值及其毒性效应机制仍待进一步研究。
目前,镉对雌鱼生殖毒性的研究主要集中在急性暴露实验,而慢性低浓度镉暴露更能反映环境条件下的真实状态,慢性镉暴露对雌鱼的生殖功能及其母源传递的毒性效应及机制仍待探讨。鉴于此,我们以模式生物斑马鱼为材料,开展慢性低浓度镉暴露对雌性斑马鱼卵巢抗氧化系统的影响和子代母源毒性研究,为进一步探讨慢性镉胁迫对鱼类卵巢生殖功能和母源传递[13]的毒性效应机制奠定基础。
1 材料与方法
1.1 材料
斑马鱼水循环系统养殖达性成熟的雌性斑马鱼,光照周期为14 h光照∶10 h黑暗,温度27.0±1℃,每天喂食2次活体丰年虫。斑马鱼平均体重0.76±0.10 g,平均体长3.6±0.2 cm。
氯化镉(CdCl2·2.5H2O)(分析纯,购自天津市博迪化工有限公司,实验前用蒸馏水配成20000 mg/L的母液);氯化钠(NaCl)(分析纯,购自天津市东丽区天大化学试剂厂);SOD、CAT、GPx、MDA含量和蛋白含量测定试剂盒(购自南京建成生物工程研究所);多功能酶标仪(美国MD公司,SpectraMax M5);冷冻离心机(德国Eppendorf公司,5804R);电动匀浆仪(德国FLUKO公司,F6/ 10);体视显微镜(日本SZX16+DP71+IPP);恒温光照培养箱(上海一恒科学仪器有限公司,MGC-450BP)。
1.2 实验方法
根据前期镉对斑马鱼96 hLC50为5.8 mg/L以及《渔业水质标准》(GB11607-89)水中镉浓度须低于0.005 mg/L的要求,设定6个浓度组:对照组、1/100 LC50组、1/50 LC50组、1/25 LC50组、1/10 LC50组和1/5 LC50组,其对应的Cd2+浓度分别为0、0.058、0.116、0.232、0.580和1.160 mg/L。每个浓度组设3个平行,每个平行组8尾鱼,试验溶液体积2 L,镉暴露21 d,按半静态毒性试验法,每24 h更换1次试验溶液,试验期间每天喂食2次。
1.2.1 样品制备及酶活性测定 于21 d,每组随机选取斑马鱼并迅速取出卵巢,每2尾于1管,称重后液氮速冻,置-80℃冰箱保存。按组织质量∶体积1∶4加入0.75%NaCl溶液,电动匀浆器制备20%的组织匀浆液,4℃、2500 r/min离心10 min,取上清待用。采用黄嘌呤氧化酶法测定SOD,钼酸铵法测定CAT,DNTB法测定GPx,硫代巴比妥酸(TBA)法测定MDA含量,考马斯亮蓝法测定蛋白质含量。采用南京建成生物工程研究所提供的测定试剂盒,用美国MD公司SpectraMax M5酶标仪进行活力与含量的检测。
1.2.2 繁殖试验 镉暴露21 d后,每组随机选取4条雌鱼转置清水,与健康性成熟雄鱼分别按雌雄1∶2的比例放入产卵缸(每个浓度组设3个平行),进行7 d繁殖实验[18]。通过控制昼夜节律,使雌性斑马鱼于每日上午8:00~12:00产卵。每隔半小时,收集胚胎,清洗残余物,记录产卵时间并放入恒温培养箱孵化,光照周期为14∶10。记录斑马鱼受精及孵化情况,受精后96 h(96 hpf)在体式显微镜下拍照并测量斑马鱼幼鱼体长,每个浓度选20条测量。
1.3 数据处理
对实验数据,采用SPSS 17.0软件进行单因素方差分析(One-Way ANOVA),显著性检验通过LSD法比较,所得结果均为x±s。P<0.05为显著性差异,P<0.01为极显著性差异。
2 结果
2.1 镉对斑马鱼卵巢组织的氧化损伤
抗氧化酶SOD是体内清除氧自由基的第一道防线,在抗氧化防御中发挥重要作用。不同浓度镉暴露21 d后,斑马鱼卵巢组织SOD活性发生明显变化。由图1A可知,与对照组相比,各浓度组卵巢组织SOD活性随镉浓度的增加呈极显著降低,0.580 mg/L镉浓度对SOD活性影响最严重。

图1 镉暴露对斑马鱼卵巢组织SOD(A)、CAT(B)、GPx(C)活性和MDA(D)含量的影响(n=4)
由图1B可见,镉暴露21 d后,斑马鱼卵巢组织抗氧化酶CAT活性受到抑制。在0.058 mg/L低浓度组卵巢组织CAT活性即出现极显著差异,且随镉浓度的升高CAT活性显著下降。
观察图1C得知,不同浓度镉暴露21 d后,斑马鱼卵巢抗氧化酶GPx活性发生显著变化,0.058 mg/L低浓度组GPx活性受到极显著抑制。卵巢GPx活性随镉浓度的增大而显著降低,各浓度组与对照组相比均有极显著差异。
脂质过氧化水平的变化被认为是细胞氧化损伤机制的主要标志之一。由图1D可见,与对照组相比,镉暴露21 d后,斑马鱼卵巢MDA含量都显著高于对照组,并随镉浓度的增加呈逐渐升高的趋势;0.580和1.160 mg/L镉浓度组的MDA含量达最高。
2.2 镉暴露对斑马鱼的母源毒性效应
2.2.1 镉对斑马鱼受精率的影响 为研究慢性镉暴露对斑马鱼生殖能力的影响,21 d镉暴露结束后,开展7 d繁殖实验,并对受精率进行统计分析。镉胁迫后,最高浓度组(1.160 mg/L)雌性斑马鱼出现不育,其他浓度组斑马鱼受精率随镉浓度的升高呈逐渐下降的趋势,如图2所示,2个低浓度组(0.058和0.116 mg/L)未出现显著性变化,但0.232和0.580 mg/L浓度组与对照组相比差异极显著。
2.2.2 镉对斑马鱼F1代胚胎孵化率的影响 进一步对镉暴露后斑马鱼母源毒性效应进行分析,结果表明,0.580 mg/L浓度组的F1代胚胎在24 hpf全部死亡,其他浓度组镉暴露21 d后,F1代孵化率明显下降。由图3可见,与对照组相比,0.232 mg/L浓度组F1代孵化率出现显著差异。
2.2.3 镉对斑马鱼F1代96 hpf幼鱼体长的影响
镉胁迫21 d,各处理组F1代96 hpf幼鱼体长均发生显著变化,如图4所示,F1代的体长随镉浓度的增加呈逐渐下降的趋势。与对照组相比,0.058 mg/L低浓度组F1代幼鱼体长出现极显著差异。
3 讨论
3.1 慢性镉暴露对斑马鱼卵巢组织的氧化损伤
氧化普遍存在于生物体的新陈代谢过程中,机体通过一系列的抗氧化酶维持平衡,当受到环境污染物胁迫时,体内抗氧化防御系统和活性氧生成之间失衡,导致抗氧化防御系统被破坏,引起组织和细胞发生氧化损伤[19],最终造成永久性毒害[20]。
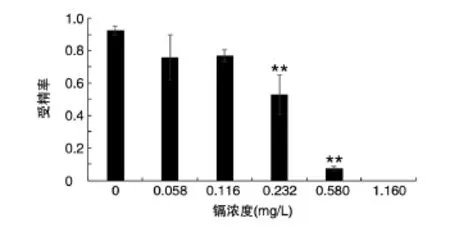
图2 镉暴露对斑马鱼受精率的影响(n=20)

图3 镉暴露对斑马鱼子代胚胎孵化率的影响(n=20)

图4 镉暴露对斑马鱼子代96 hpf幼鱼体长的影响(n=20)
诸多研究表明,镉可以诱导生物体产生活性氧,干扰机体氧化与抗氧化之间的平衡,从而导致机体内抗氧化酶活性和脂质过氧化物含量发生变化[21-23]。SOD主要分布在胞浆和线粒体的基质内[24],是生物体抗氧化防御系统中重要的抗氧化酶之一,也是清除超氧阴离子自由基O2-的专一性酶。SOD在生物体内最先与O2-作用,将其分解为O2和H2O2[25],保持体内自由基代谢平衡,从而保护细胞免受损伤。镉是SOD强有力的抑制剂[26]。文献报道显示,低浓度镉(0.112 mg/L)可诱导SOD活性升高,而高浓度镉(1.120 mg/L)抑制SOD活性[8],可能是低浓度镉在短时间内引起大量积累,从而诱导机体SOD活性增强来清除,防止细胞膜系统过氧化作用的发生;而镉浓度过高,可能置换出SOD中的金属离子,导致SOD活力下降或消失。与多数急性镉暴露对性腺组织SOD活性先诱导后抑制的影响不同[27-28],本研究在21 d镉暴露后,各浓度组卵巢组织SOD活性均受到极显著抑制(图1)。这可能与暴露时间有关,随着暴露时间的延长,卵巢中镉积累量增加,机体对于SOD的诱导跟不上体内O2-增加的速度,同时随着体内镉的增加,改变了SOD原有的分子构象或抑制其基因表达,导致SOD因消耗而活性降低或丧失。如果细化镉暴露时间,可能在较短时间内会检测到SOD活性被诱导的时间点,但进一步结论有待后续研究。
CAT和GPx是继SOD之后,生物体氧化防御系统中抵抗氧化损伤的第二道防线[28],CAT能进一步将SOD产生的H2O2转化为H2O和O2,具有保护酶的作用;GPx催化H2O2的还原反应,对由ROS诱发的脂质过氧化物及过氧化氢有极强的清除能力。文献报道,CAT和GPx协同作用,共同清除由SOD催化超氧阴离子产生的H2O2,从而保护生物膜结构和生物大分子免受氧化损伤[29]。CAT活力对重金属离子引发的氧化损伤极其敏感。本研究显示,在低浓度(0.058 mg/L)镉暴露下,CAT活性极显著降低,并随镉浓度的升高呈显著差异,这可能是由于镉暴露时间较长,CAT活性受到过量活性氧的抑制,并由此改变了CAT亚单位的装配[27]或抑制CAT分子的合成。GPx的活性中心硒代半胱氨酸可以结合Cd2+,使生物体内Cd2+浓度降低,从而消减镉的毒性。但是GPx与Cd2+的结合会导致Se-Cys结构遭到破坏而使GPx失去生物活性[30]。已有文献报道,在急性镉暴露下,7.25 mg/L镉浓度组GPx合成途径被激活,酶活力增强;但随着镉浓度的增大,镉的累积毒性增加,原有GPx活性中心遭到严重破坏,同时新的GPx难以合成[26],致使116 mg/L镉浓度组GPx活力显著低于对照组。在本研究慢性镉暴露中,随着镉暴露时间的延长,镉在体内积累量增加,导致0.058 mg/L低浓度组卵巢组织GPx活性被显著抑制,与急性高浓度镉暴露结果相似。
MDA是脂质过氧化反应的终产物,能交联脂类、蛋白质、核酸等生物大分子,破坏膜的结构。研究显示,MDA的含量与膜结构的损伤程度呈正相关[28],因此,MDA含量的变化可以间接反映重金属对机体氧化损伤的程度,常作为环境污染胁迫的标志物[27]。本研究中卵巢在镉暴露21 d后,从0.058 mg/L的低浓度组到1.160 mg/L的高浓度组,MDA含量均极显著升高。推测可能是由于镉暴露时间较长,镉在体内缓慢而持续积累,导致抗氧化酶活性或酶结构遭到破坏甚至丧失,使得体内自由基浓度迅速升高,造成细胞膜结构破坏而引起。
急性镉暴露结果显示[31],1 mg/L镉暴露24 h,斑马鱼卵巢SOD、CAT活性及MDA含量没有发生显著变化,但SOD基因的表达量显著升高;而镉暴露96 h,斑马鱼卵巢SOD活性及其基因表达量、MDA含量均未发生显著变化,但CAT活性及其基因表达量显著升高。这与本研究1.160 mg/L慢性镉胁迫后SOD、CAT活性及MDA含量的变化明显不同。研究表明,急、慢性镉暴露均可引起斑马鱼卵巢抗氧化酶活性及MDA含量发生变化,但慢性镉暴露导致斑马鱼卵巢抗氧化酶活性受到显著抑制,有关其基因表达情况仍待探讨。
3.2 慢性镉暴露引起斑马鱼生殖毒性和母源传递毒性
鱼类的繁殖对重金属暴露非常敏感[32],其受精率、孵化率是研究生殖毒理的重要指标[19]。Sellin等[33]揭示了镉胁迫严重影响鲦鱼的生殖能力,使其受精率显著降低。Bourrachot等[34]认为20~250μg/L重金属铀暴露14 d,斑马鱼的生殖能力受到显著影响。本研究表明,斑马鱼在不同浓度镉暴露21 d后其受精率呈下降趋势,并呈浓度依赖效应,0.058和0.116 mg/L浓度组受精率没有发生显著性变化。与此结果相似,Sellin等[35]对繁殖前的鲦鱼开展21 d镉暴露,结果显示,同样50μg/L镉暴露后其排卵量和受精率等均没有受到明显影响。导致此类结果的原因可能是由于在繁殖前结束镉暴露,且随后清水中21 d的繁殖过程使得鱼体内镉逐渐被清除,从而降低了镉的毒性作用。
基于之前的报道[36],本实验进一步证明母源镉积累通过卵巢传递到胚胎,导致子代胚胎孵化率显著下降,该结果与急性(72 h)镉及重金属铀暴露斑马鱼的母源毒性效应一致[13-14]。此外,镉的母源毒性导致子代胚胎发育严重畸形,体长缩短,这一结果与35.6μmol/L即3.98 mg/L急性镉暴露以及氟化物——全氟辛烷磺酸(PFOS)暴露斑马鱼胚胎的研究结果相互佐证[37-38]。这些现象可能是由于镉暴露的母源毒性,导致胚胎凋亡细胞明显增多,子代发育相关基因的表达量发生变化[39],进而引起幼鱼出现畸形且体型变短,其相关机制有待深入研究。
因此,我们推测可能是由于镉暴露引起组织氧化胁迫,导致卵巢和卵母细胞结构功能受到损伤,卵巢抗氧化酶及子代发育相关基因表达量发生变化,进而造成斑马鱼卵巢生殖毒性和子代发育的母源毒性,即镉对斑马鱼的毒性影响从卵巢传递到了子代。本研究为进一步探讨镉对鱼类卵巢生殖功能的毒性效应及机制研究提供了科学依据。
[1]Siu E R,Mruk D D,Porto C S.Cadmium-induced testicular injury[J].Toxicol Appl Pharmacol,2009,238 (3):240-249.
[2]张翠,翟毓秀,宁劲松,等.镉在水生动物体内的研究概况[J].水产科学,2007,26(8):465-470.
[3]Elsayed Y S,Elgazzar A M,Elnahas A F,et al.Vitamin C modulates cadmium-induced hepatic antioxidants'gene transcripts and toxicopathic changes in Nile tilapia,Oreochromis niloticus[J].Environ Sci Pollut Res,2014,23(2):1-7.
[4]Annabi A,Said K,Messaoudi I.Heavy metal levels in gonad and liver tissues-effects on the reproductive parameters of natural populations of Aphanius facsiatus [J].Environ Sci Pollut Res,2013,20(10):7309-7319.
[5]Gill T S,Tewari H,Pande J.In vivo and in vitro effects of cadmium on selected enzymes in different organs of the fish Barbus conchonius ham(Rosy Barb) [J].Comp Biochem Physiol C,1991,100(3):501-505.
[6]Xie H,Wang J,Jiang L,et al.ROS-dependent HMGA2 upregulation mediates Cd-induced proliferation in MRC-5 cells[J].Toxicol In Vitro,2016,34:146-152.
[7]Lushchak V I.Environmentally induced oxidative stress in aquatic animals[J].Aquat Toxicol,2011,101(1):13-30.
[8]Jin Y,Liu Z,Fang L,et al.Embryonic exposure to cadmium(II)and chromium(VI)induce behavioral alterations,oxidative stress and immunotoxicity in zebrafish (Danio rerio)[J].Neurotoxicol Teratol,2015,48:9-17.
[9]Qu R,Wang X,Wang Z,et al.Metal accumulation and antioxidant defenses in the freshwater fish Carassius auratus,in response to single and combined exposure to cadmium and hydroxylated multi-walled carbon nanotubes[J].J Hazard Mater,2014,275(2):89-98.
[10]JancsóZ,Hermesz E.Impact of acute arsenic and cadmium exposure on the expression of two haeme oxygenase genes and other antioxidant markers in common carp(Cyprinus carpio)[J].J Appl Toxicol,2014,35 (3):310-318.
[11]Nunes B,Caldeira C,Pereira J L,et al.Perturbations in ROS-related processes of the fish Gambusia holbrooki after acute and chronic exposures to the metals copper and cadmium[J].Environ Sci Pollut Res, 2015,22(5):3756-3765.
[12]马丹旦,雷雯雯,吴昊,等.急性镉染毒对河南华溪蟹精子质量的影响[J].环境科学学报,2013,33(7):2044-2049.
[13]Wu S M,Tsai P J,Chou M Y,et al.Effects of maternal cadmium exposure on female reproductive functions,gamete quality,and offspring development in zebrafish(Danio rerio)[J].Arch Environ Contam Toxicol, 2013,65(3):521-536.
[14]Simon O,Floc'H E,Geffroy B,et al.Exploring ecotoxicological fish bioassay for the evaluation of uranium reprotoxicity[J]. Environ Toxicol Chem, 2014,33(8): 1817-1824.
[15]刘燕.水体中镉暴露对稀有鮈鲫氧化应激及组织学影响[D].重庆:西南大学,2014:17-25.
[16]Adeogun A O,Onibonoje K,Ibor O R,et al.Endocrine-disruptor molecular responses,occurrence of intersex and gonado-histopathological changes in tilapia species from a tropical freshwater dam(Awba Dam)in Ibadan,Nigeria[J].Aquat Toxicol,2016,174:10-21.
[17]Chouchene L,Banni M,Kerkeni A,et al.Cadmium-induced ovarian pathophysiology is mediated by change in gene expression pattern of zinc transporters in zebrafish(Danio rerio)[J].Chem Biol Interact,2011, 193(2):172-179.
[18]Wang Y X,Ferrari M C O,Hoover Z,et al.The effects of chronic exposure to environmentally relevant levels of waterborne cadmium on reproductive capacity and behaviour in fathead minnows[J].Arch Environ Contam Toxicol,2014,67(2):181-191.
[19]Young I S,Woodside J V.Antioxidants in health and disease[M].Lambert Academic Publishing,2013:176-186.
[20]Kusch R C,Krone P H,Chivers D P.Chronic exposure to low concentrations of waterborne cadmium during embryonic and larval development results in the long-term hindrance of antipredator behavior in zebrafish[J].Environ Toxicol Chem,2008,27(3):705-710.
[21]Vaziri N D,Lin C Y,Farmand F,et al.Superoxide dismutase,catalase,glutathione peroxidase and NADPH oxidase in lead-induced hypertension[J].Kidney Int, 2003,63(1):186-194.
[22]Roméo M,Bennani N,Gnassia-Barelli M,et al.Cadmium and copper display different responses towards oxidative stress in the kidney of the sea bass Dicentrarchus labrax[J].Aquat Toxicol,2000,48(2-3):185-194.
[23]Banni M,Chouchene L,Said K,et al.Mechanisms underlying the protective effect of zinc and selenium against cadmium-induced oxidative stress in zebrafish Danio rerio[J].Biometals,2011,24(6):981-992.
[24]李文英,刘荣,蒋园,等.DBP对斑马鱼肝脏和鳃SOD及ATPase酶活性的影响[J].水生态学杂志,2007,27(4): 15-18.
[25]熊道文,方涛,陈旭东,等.纳米材料对斑马鱼的氧化损伤及应激效应研究[J].环境科学,2010,31(5):1320-1327.
[26]闫博,王兰,李涌泉,等.镉对长江华溪蟹肝胰腺抗氧化酶活力的影响[J].动物学报,2007,53(6):1121-1128.
[27]马京津,徐团,轩瑞晶,等.铅对河南华溪蟹卵巢抗氧化酶活力和脂质过氧化水平的影响[J].环境科学学报, 2012,32(9):2346-2352.
[28]徐团,李颖君,金芬芬.镉对长江华溪蟹精巢抗氧化酶活性及脂质过氧化的影响[J].四川动物,2011,30(5): 762-764.
[29]刘娜,闫博,李涌泉,等.Cd2+对长江华溪蟹谷胱甘肽系统的影响[J].环境科学,2008,29(8):2302-2307.
[30]Iszard M B,Liu J,Klaassen C D.Effect of several metallothionein inducers on oxidative stress defense mechanisms in rats[J].Toxicology,1995,104(1-3):25-33.
[31]Zheng J L,Yuan S S,Wu C W,et al.Acute exposure to waterborne cadmium induced oxidative stress and immunotoxicity in the brain,ovary and liver of zebrafish(Danio rerio)[J].Aquat Toxicol,2016,180:36-44.
[32]Su M W,Pei R T,Yan C J.Maternal cadmium exposure induces mt2,and smtB,mRNA expression in zebrafish(Danio rerio) females and their offspring[J]. Comp Biochem Physiol Cy,2012,156(156):1-6.
[33]Sellin M K,Kolok A S.Cadmium exposures during early development:Do they lead to reproductive impairment in fathead minnows[J]?Environ Toxicol Chem, 2006b,25(11):2957-2963.
[34]Bourrachot S,Brion F,Pereira S,et al.Effects of depleted uranium on the reproductive success and F1 generation survival of zebrafish(Danio rerio)[J].Aquat Toxicol,2014,154(1):1-11.
[35]Sellin M K,Eidem T M,Kolok A S.Cadmium exposures in fathead minnows:are there sex-specific differences in mortality,reproductive success,and Cd accumulation[J]?Arch Environ Contam Toxicol,2007,52(4): 535-540.
[36]Sellin M K,Kolok A S.Cd exposures in fathead minnows:effects on adult spawning success and reproductive physiology[J]. Arch Environ Contam Toxicol, 2006a,51(4):594-599.
[37]Shi X,Du Y,Lam P K S,et al.Developmental toxicity and alteration of gene expression in zebrafish embryos exposed to PFOS[J].Toxicol Appl Pharmacol, 2008,230(1):23-32.
[38]鲁疆,王占洋,袁玉婷,等.氯化镉对斑马鱼胚胎的发育毒性[J].生态毒理学报,2013,8(3):381-388.
[39]Zhu B,Lei L,Li D L,et al.Developmental toxicity in rare minnow(Gobiocypris rarus)embryos exposed to Cu,Zn and Cd[J].Ecotoxicol Environ Safety,2014, 104C(1):269-277.
Oxidative Damage on Ovary of Mature Zebrafish and Maternal Toxicity Effects on Their Embryos After Chronic Cadmium Exposure
LIU Yang,WANG Lan*,SUN Min*
School of Life Science,Shanxi University,Taiyuan 030006,China
Objective:The effects of chronic cadium(Cd)exposure on the activities of antioxidant enzymes and the level of lipid peroxidation in ovaries of mature zebrafish,as well as the maternal toxicity effects on offspring were studied by using semi-static toxic test method.Methods:According to 96 hLC50values and the National Fisheries Standards of China,we set five Cd treatment groups(0.058,0.116,0.232,0.580,1.160 mg/L)and one control group without Cd.After Cd exposure for 21 d,the activities of superoxide dismutase(SOD),catalase(CAT)and glutathione peroxidase(GPx),and the level of malonyldialdehyde(MDA)in zebrafish ovaries were investigated. Moreover,the fertilization success rate,hatching rate and 96 hpf-body length of their offspring(F1larvae)were studied.Results:Compared with those in the control group,the activities of antioxidant enzymes SOD,CAT and GPx were decreased significantly,and the content of MDA was increased significantly in each Cd-treated groupwith a concentration-dependent manner.The fertilization success rates were reduced significantly in the 0.232 and 0.580 mg/L Cd-treated groups and the larvae hatching rate was decreased significantly in the 0.232 mg/L Cd-treated group compared with that in the control group.The body length was shorter in each Cd-treated group compared with that in the control group.Conclusion:These data indicated that the activities of antioxidant enzymes were significantly inhibited after Cd exposure for 21 d,resulting in severe oxidative damage in ovary of mature zebrafish.The exposure history of mothers caused toxic effects on the fertilization and hatching as well as growth of the next non-exposed generation of embryos and larvae.
zebrafish;ovary;oxidative damage;maternal toxicity;cadmium
Q492
A
1009-0002(2017)03-0301-07
10.3969/j.issn.1009-0002.2017.03.012
2016-12-19
教育部高等学校博士学科点专项科研基金(20131401120009)
刘洋(1991-),女,硕士研究生,(E-mail)1530354168@qq.com
王兰,(E-mail)lanwang@sxu.edu.cn;孙敏,(E-mail)sunm1112@163.com
*Co-corresponding authors,WANG Lan,E-mail:lanwang@sxu.edu.cn;SUN Min,E-mail:sunm1112@163.com
