7.0T磁共振扩散张量成像在实验性自身免疫性脑脊髓炎大脑皮层及胼胝体病变中的应用
2017-06-05周津如ZHOUJinru
周津如 ZHOU Jinru
李咏梅 LI Yongmei
时晓清 SHI Xiaoqing
尹 平 YIN Ping
7.0T磁共振扩散张量成像在实验性自身免疫性脑脊髓炎大脑皮层及胼胝体病变中的应用
周津如 ZHOU Jinru
李咏梅 LI Yongmei
时晓清 SHI Xiaoqing
尹 平 YIN Ping
目的大脑白质是多发性硬化(MS)的常见发病部位,MS皮层及胼胝体病变逐渐受到关注。本文使用7.0T磁共振扩散张量成像(DTI)技术,以实验性自身免疫性脑脊髓炎(EAE)模型研究MS大脑皮层病变及胼胝体病变。材料与方法实验准备SPF级6~8周龄健康雌性C57BL/6小鼠20只, 其中MOG35-55诱导制备实验组10只、健康对照组10只。造模后20 d,对实验组和对照组行头颅T2WI和DTI扫描,比较两组感兴趣区(双侧前额皮层、双侧扣带回、胼胝体)的DTI量化指标各向异性分数(FA)、平均扩散率(MD)、轴向扩散系数λ∥、径向扩散系数λ⊥的差异。结果两组T2WI均未发现明显病变。实验组FA图显示的胼胝体左侧完整性受到破坏。实验组双侧前额皮层FA、MD、λ∥、λ⊥与对照组比较差异均有统计学意义(P<0.05);胼胝体FA、MD、λ∥、λ⊥与对照组比较,差异有统计学意义(P<0.05);双侧扣带回λ⊥的升高较对照组差异有统计学意义(P<0.05)。HE染色结果显示,实验组皮层及皮层下血管周围有炎症细胞聚集。LFB染色显示实验组染色较对照组浅淡,胼胝体呈斑片状髓鞘脱失。结论7.0T磁共振DTI能够检测常规MRI序列不能发现的皮层及胼胝体病变,可以为研究MS皮层及胼胝体病变提供影像证据。
脑脊髓炎,自身免疫性,实验性;磁共振成像;扩散张量成像;脱髓鞘疾病;疾病模型,动物
多发性硬化(multiple sclerosis,MS)是一种慢性特发性炎性脱髓鞘疾病,为年轻人非创伤性致残最常见的原因之一[1]。MS患者常存在认知功能障碍,这些认知障碍不能用常规白质病灶负荷进行解释,可能与皮层灰质及胼胝体的损害有关[2]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型发病过程和病理基础与MS相似,是目前研究MS应用最广泛的动物模型[3]。扩散张量成像(DTI)是在扩散加权成像基础上发展的MRI新技术,通过检测微结构体系中水分子扩散的高度敏感性揭示显微结构的异常[4]。本研究利用DTI对EAE模型大脑皮层及胼胝体进行定量分析,为MS提供皮层及胼胝体病变的影像学证据。
1 材料与方法
1.1 实验动物 SPF级6~8周龄健康雌性C57BL/6小鼠20只(重庆医科大学实验动物中心提供),采用随机数字表法分成两组,其中实验组、对照组各10只。所有动物饲养于重庆医科大学独立通气实验动物中心,维持光/暗12 h循环交替,保持24℃室温,给予洁净饮水和充足的食料,饲养1周用于实验。动物使用过程符合《关于善待实验动物的指导性意见》。
1.2 主要试剂 髓鞘少树突胶质细胞糖蛋白(MOG35-55多肽片段,上海吉尔生化有限公司)、完全弗氏佐剂(complete Freund adjuvant,CFA) 和 百 日 咳 毒 素(pertussis toxin,PTX)(美国Sigma公司)、含结核杆菌活菌的卡介苗粉末(河北开创生物有限公司)、PBS缓冲液(重庆鼎国生物技术有限公司)。
1.3 EAE模型的制备 将MOG35-55粉末200 μg溶于PBS液1.0 ml,再与含有10 μg卡介苗粉末的1.0 ml CFA充分混合,用1.0 ml注射器反复抽打至油包水乳剂(抽打约3 h),即免疫抗原乳剂。以上操作均在低温无菌条件下进行。用3.5%水合氯醛腹腔麻醉小鼠,小鼠四肢周围局部消毒后,实验组小鼠四肢皮下分别注射0.05 ml免疫抗原乳剂,对照组小鼠于同样位置皮下注射等量CFA。免疫当天及48 h实验组小鼠腹腔注射0.02 ml PTX(500 ng/只),对照组小鼠腹腔注射等量生理盐水。实验组免疫当天记为第0天(D0),顺次为D1、D2、D3......。
1.4 仪器及参数 发病高峰期(D20),实验组和对照组行头颅MRI检查。所有检查均采用第三军医大学附属大坪医院7.0T小动物磁共振(Bruker BioSpec USR 70/20,德国),Paravision 6.0操作系统,小鼠四通道头部线圈。扫描过程中小鼠采用头先进、俯卧位固定,并用小动物生命检测仪监测其生命体征,小鼠使用异氟烷持续吸入麻醉。扫描前用对照组小鼠进行序列优化,T2序列:TR 3000 ms、TE 35 ms,视野(FOV)20 mm×20 mm,激励次数4,矩阵 256×256,层厚 1.0 mm,层间距为0,层面 15;DTI序列:TR 3000 ms、TE 25 ms,FOV 20 mm×20 mm ,激励次数4,矩阵 128×128,层厚1.0 mm,持续时间 4.5 ms,梯度分离时间 10.5 ms,b值分别为0和1000 s/mm2,取30个不同扩散方向。实验组和对照组扫描方法和参数完全相同。
1.5 MRI后处理 DTI目前常用的量化指标包括各向异性分数(fractional anisotropy,FA)、平均扩散率(mean diffusivity,MD)、轴向扩散系数λ∥、径向扩散系数λ⊥。DTI序列扫描后经Paravision 6.0操作系统软件后处理得到FA图、λ1图、λ2图、λ3图。选取双侧前额皮层、双侧扣带回、胼胝体作为感兴趣区(ROI),每个ROI测量3次取平均值。在FA图、λ1图、λ2图、λ3图上测量各ROI的FA值、λ1值、λ2值、λ3值。然后利用以上数据计算DTI各项指标。

1.6 病理学检查 MRI检查完毕后,实验组和对照组小鼠深度麻醉后,开胸剪开右心耳经左心室灌注4℃PBS缓冲液(加肝素)及4%多聚甲醛缓冲液内固定。随后剥开颅骨,取下完整的脑组织,放入4℃多聚甲醛中固定,24 h后梯度乙醇脱水,石蜡包埋。以胼胝体为中心制备6 μm厚小鼠脑冠状位切片,行HE染色和LFB染色。
1.7 统计学方法 采用SPSS 21.0软件,计量资料均以±s表示。实验组和对照组DTI各项指标(FA、MD、λ∥、λ⊥)采用两独立样本t检验进行比较,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况比较 实验组小鼠表现为体重下降、尾部无力、行动迟缓、精神萎靡、毛发无光等症状(图1A);对照组小鼠各项指标良好。
2.2 超高场MRI检查 所有MR图像经2位有5年以上诊断经验的放射科医师共同诊断。在两组小鼠脑内,T2WI均未发现明显病变(图1B)。
实验组各感兴趣区FA值呈下降趋势,尤以双侧前额皮层、胼胝体最为显著,差异有统计学意义(P<0.05);双侧扣带回稍下降,但与对照组相比差异无统计学意义(P>0.05)。同时,对照组的FA图显示胼胝体呈对称高信号(图1C);实验组小鼠的胼胝体左侧膝部完整性受到破坏,较右侧变细,信号减低,右侧胼胝体远端信号完整性失常(图1D)。实验组小鼠双侧前额皮层、胼胝体MD值升高,差异有统计学意义(P<0.05);左侧扣带回较对照组下降,但差异无统计学意义(P>0.05);右侧扣带回稍升高,但较对照组差异无统计学意义(P>0.05)。λ∥在双侧前额皮层和胼胝体降低,差异有统计学意义(P<0.05),双侧扣带回与对照组差异无统计学意义(P>0.05)。λ⊥各感兴趣区的升高差异均有统计学意义(P<0.05);且与对照组比较,双侧前额皮层、胼胝体差异有统计学意义(P<0.01)。见表1。

图1 小鼠大体及影像学表现。实验组小鼠发病后行为学改变,表现为尾部和双后肢无力(A);实验组小鼠常规T2WI未发现明显异常,表明T2WI并非发现MS的敏感序列(B);对照组小鼠FA图,双侧胼胝体呈对称高信号,提示髓鞘结构对称完整(C);实验组小鼠FA图,左侧胼胝体膝部较右侧变细,信号减低,提示髓鞘完整性遭到破坏(箭,D)
表1 实验组和对照组小鼠不同部位各项DTI量化指标的比较(±s)
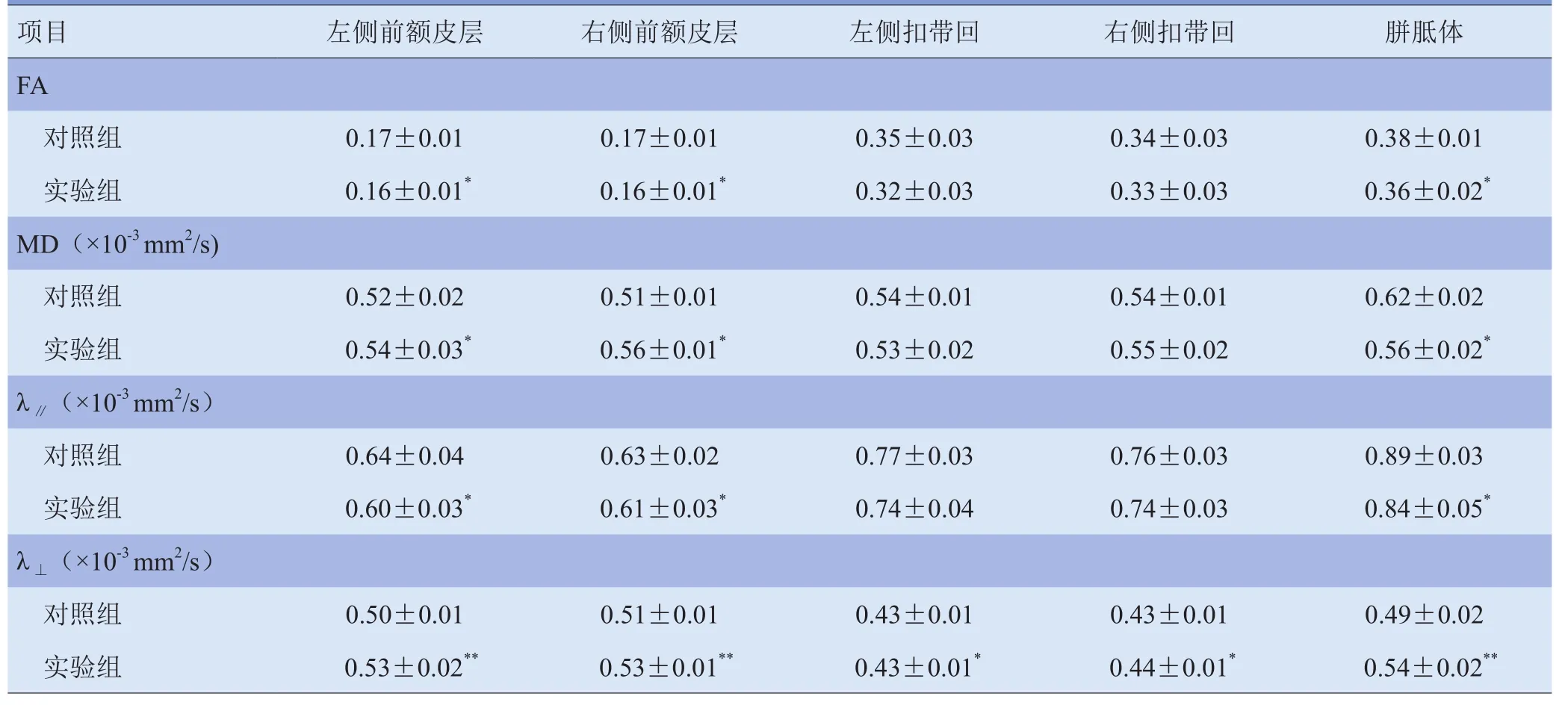
表1 实验组和对照组小鼠不同部位各项DTI量化指标的比较(±s)
注:与对照组比较,*P<0.05,**P<0.01
?
2.3 病理学检查 实验组HE染色可见炎症细胞聚集在皮层及皮层下血管周围,形成血管袖套样改变;对照组未出现病理改变。LFB染色髓鞘被染为蓝色,实验组染色较对照组浅淡,并有斑片状髓鞘脱失,以胼胝体区最明显(图2)。
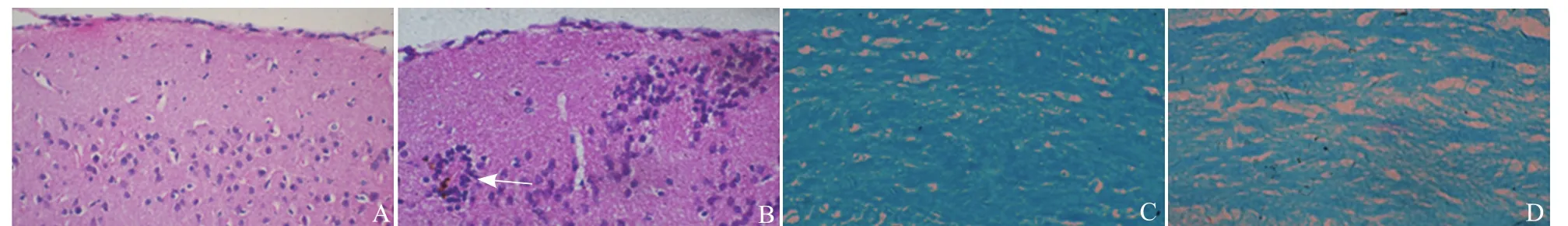
图2 小鼠病理学表现。对照组小鼠皮层细胞形态规则,层次清晰(HE,×400,A);实验组小鼠皮层下见大量炎症细胞聚集、血管袖套样改变(箭,HE,×400,B);对照组小鼠胼胝体(LFB,×400,C);实验组小鼠胼胝体,髓鞘呈斑片状脱失(LFB,×400,D)
3 讨论
MS是发生在中枢神经系统白质的播散性脱髓鞘病变。目前在MS患者大脑皮层也发现了脱髓鞘病灶,皮质脱髓鞘可能是病情加重的基础,并且与不可逆的残疾、精神疾病和认知功能障碍有重要的病理关联[2,5]。胼胝体在大脑半球之间的交流中具有至关重要的作用,MS患者胼胝体萎缩与残疾程度及认知障碍有一定的相关性[3]。据报道,45%~60%的MS患者存在认知功能障碍[6]。在复发缓解型MS患者中,具有认知功能障碍的患者皮层病变相对更加严重,且萎缩也较明显;同时合并精神疾病的风险更大[5]。因此,本研究利用EAE模型模拟MS发病过程研究大脑皮层及胼胝体病变。
3.1 DTI技术的优势 在传统影像检查层面,多种皮层病变仍不能精确检出。病理学检查虽然可以区别急性轴索损伤和永久性的轴索丢失,但病理标本往往获取较困难。最近对于皮层损害的检出倾向于使用VBM方法进行皮层厚度及容积分析[7]。DTI通过测量水分子的扩散反映感兴趣区微观结构组织,继而推断髓鞘结构异常,也是非侵入性检测皮层病变的新技术[8]。脑组织中水分子因细胞膜和髓鞘的阻碍存在自由扩散受限。当髓鞘丢失或轴突损伤时,水分子的各向扩散出现异常[4]。既往研究表明,灰质皮层受损后会出现注意力涣散、记忆力下降、逻辑推理能力降低、情绪波动等认知功能障碍症状[3]。因此,本研究利用DTI的量化指标(FA、MD、λ∥、λ⊥)来检测EAE模型前额皮层、扣带回、胼胝体髓鞘的完整性,进而为认知功能障碍提供理论证据。
3.2 DTI数据分析 本研究中观察到实验组在双侧前额皮层、胼胝体、双侧扣带回FA值比对照组降低,其中双侧前额皮层和胼胝体降低差异有统计学意义。FA值广泛用于检测白质中纤维束的密集程度,组织FA值减低常见于脱髓鞘、胶质细胞增生、炎症、水肿[8]。Peng等[9]使用电阻治疗抑郁症患者时,发现在额叶、扣带皮层、胼胝体的FA值降低,推断上述部位在情绪调节中起重要作用。因此,在上述区域FA值的减低提示“束相关性”减少,并且与MS患者罹患精神疾病可能相关。
越来越多的动物实验结果表明,λ∥和λ⊥有望成为轴突损伤和脱髓鞘疾病的生物标志物。λ∥测量水平方向水分子沿纤维束的扩散,而λ⊥测量的水分子扩散则垂直于纤维束。λ∥减少提示轴突损伤,λ⊥增加是脱髓鞘和髓鞘形成障碍的无创标志物[10]。本研究结果显示,实验组λ∥值双侧前额皮层和胼胝体降低,较对照组差异有统计学意义;λ⊥呈整体上升趋势。这些改变可能是由于占主导地位的细胞类型的变化,轴索外的髓鞘被替换成星形胶质细胞和(或)小胶质细胞,导致轴向扩散减少和径向扩散增加[11]。
MD反映分子扩散水平和扩散阻力的整体情况,主要与细胞密度、大小、软组织的通透性相关,而与扩散的方向无关。MD值增加也可反映神经分支及细胞外间隙增宽,这将促进大脑相应区域细胞外水的扩散以及胶质细胞增生[11]。本研究显示,实验组小鼠MD值在双侧前额皮层和胼胝体高于对照组小鼠。这些区域MD值升高预示着比膜面(膜区域中单位体积内所具有的膜面积)降低,组织损伤后的变性常导致MD升高[12]。既往研究报道,实验组小鼠的左侧扣带回MD值稍降低可能反映了该部位神经活动连通性增多[8],但具体机制有待进一步研究。
3.3 病理学分析 本研究以胼胝体为中心做小鼠脑冠状切片,HE染色发现除脑室旁白质的炎性浸润外,实验组小鼠的前额皮层也见到较多的炎症病灶,特别是脑膜下皮层。Skaper等[13]研究表明,持续的炎症会导致各种脑细胞特异性神经元和少突胶质细胞凋亡,以及小胶质细胞代偿增生。激活的小胶质细胞又会产生和释放神经毒性分子及促炎性细胞因子,导致轴索丢失。本研究中皮层炎症比较重,然而脱髓鞘以胼胝体区域较明显,故推测该现象与病程相关,皮层脱髓鞘处于早期阶段。同时,本研究中LFB染色结果显示实验组髓鞘染色较对照组浅淡,胼胝体区有斑片状髓鞘脱失。胼胝体是两侧大脑皮层之间最大的连合纤维,在双侧大脑半球沟通联络中起着核心作用,其纤维束中断与疲劳、运动障碍和认知的变换有密切关系[14]。
总之,通过DTI技术对实验组小鼠和对照组小鼠的双侧额叶皮层、双侧扣带回、胼胝体的比较分析以及病理染色证实皮层炎症和胼胝体脱髓鞘改变,推测MS患者既存在白质病变,也存在皮层病变,并且可能是导致认知功能障碍的因素之一。本研究的局限性在于只侧重DTI各项参数的分析比较。后续研究中将运用纤维追踪技术分析各脑区连接的异常。当MS患者出现认知功能障碍时,可借助DTI检测常规MR不能发现的隐匿性皮层病变;运用DTI各种扩散指标进一步探究MS患者认知功能障碍与皮层病变的关系。
[1] 尹平, 曾春, 王静杰, 等. 复发缓解型多发性硬化患者脑内病灶动态对比增强MRI灌注及渗透特点. 中华放射学杂志, 2015, 49(10): 731-735.
[2] Popescu BF, Lucchinetti CF. Meningeal and cortical grey matter pathology in multiple sclerosis. BMC Neurol, 2012, 12: 11.
[3] Mangiardi M, Crawford DK, Xia X, et al. An animal model of cortical and callosal pathology in multiple sclerosis. Brain Pathol, 2011, 21(3): 263-278.
[4] Alexander AL, Lee JE, Lazar M, et al. Diffusion tensor imaging of the brain. Neurotherapeutics, 2007, 4(3): 316-329.
[5] Calabrese M, Agosta F, Rinaldi F, et al. Cortical lesions and atrophy associated with cognitive impairment in relapsing-remitting multiple sclerosis. Arch Neurol, 2009, 66(9): 1144-1150.
[6] Tur C, Ciccarelli O. An overview of the association between gray matter damage and cognitive impairment in multiple sclerosis. Neurodegenerative Disease Management, 2012, 2(5): 503-515.
[7] 刘义, 李咏梅, 曾春, 等. 单纯脊髓受累型多发性硬化患者脑结构和脑功能的MRI研究. 中国医学影像学杂志, 2015, 23(10): 725-729.
[8] Hemanth Kumar BS, Mishra SK, Trivedi R, et al. Demyelinating evidences in CMS rat model of depression: a DTI study at 7 T. Neuroscience, 2014, 275: 12-21.
[9] Peng HJ, Zheng HR, Ning YP, et al. Abnormalities of corticallimbic-cerebellar white matter networks may contribute to treatment-resistant depression: a diffusion tensor imaging study. BMC Psychiatry, 2013, 13: 72.
[10] Song SK, Yoshino J, Le TQ, et al. Demyelination increases radial diffusivity in corpus callosum of mouse brain. Neuroimage, 2005, 26(1): 132-140.
[11] Newcombe V, Chatfield D, Outtrim J, et al. Mapping traumatic axonal injury using diffusion tensor imaging: correlations with functional outcome. PLoS One, 2011, 6(5): e19214.
[12] Concha L, Gross DW, Wheatley BM, et al. Diffusion tensor imaging of time-dependent axonal and myelin degradation after corpus callosotomy in epilepsy patients. Neuroimage, 2006, 32(3): 1090-1099.
[13] Skaper SD, Facci L, Culbert AA, et al. P2X(7) receptors on microglial cells mediate injury to cortical neurons in vitro. Glia, 2006, 54(3): 234-242.
[14] Bonzano L, Tacchino A, Roccatagliata L, et al. Callosal contributions to simultaneous bimanual finger movements. J Neurosci, 2008, 28(12): 3227-3233.
(本文编辑 闻 浩)
Diffusion Tensor Imaging of 7.0T Magnetic Resonance on Cerebral Cortex and Corpus Callosum Lesions in Experimental Autoimmune Encephalomyelitis
PurposeCortex is one of the frequently involved sites of multiple sclerosis (MS), and the cortex and corpus callosum lesions of MS are gradually concerned. The study aims to observe the changes of cerebral cortex and corpus callosum of MS in experimental autoimmune encephalomyelitis (EAE) model by using 7.0T MRI diffusion tensor imaging (DTI).Materials and MethodsTwenty female C57BL/6 mice of 6-8 week old were enrolled in the study, 10 of which were induced by MOG35-55to make EAE models and the rest 10 of which were taken as control group. On the 20 days after model establishment, the head T2WI and DTI were performed on both control and EAE mice. DTI quantitative indicators such as fractional anisotropy (FA), mean diffusivity (MD), axial dispersion coefficient λ∥, and radial dispersion coefficient λ⊥in region of interest including bilateral prefrontal cortex, bilateral cingulate cortex and corpus callosum were compared between the two groups.ResultsNo obvious lesions were observed on the T2WI in both control and EAE groups. In the experimental group, the FA mapping suggested the integrity of the left side of the corpus callosum was destroyed. The FA, MD, λ∥, λ⊥of bilateral prefrontal cortex and corpus callosum showed significant difference between experimental group and control group (P<0.05); the increase of λ⊥in bilateral cingulate was significantly different from that in the control group. Meanwhile, HE staining in the experimental group showed that inflammatory cells gathered around the cortical and subcortical vessels. The LFB staining in experimental group showed a bit paler than that in the control group, and the corpus callosum showed patchy demyelination.ConclusionThe technique of 7.0T MRI DTI sequence can detect cortex and corpus callosum lesions which cannot be found by conventional MRI, so that it provides radiological evidence for the study of MS with cortex and corpus callosum lesions.
Encephalomyelitis, autoimmune, experimental; Magnetic resonance imaging; Diffusion tensor imaging; Demyelinating diseases; Disease models, animal
重庆医科大学附属第一医院放射科 重庆400016
李咏梅
Department of Radiology, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
Address Correspondence to: LI Yongmei
E-mail: lymzhang70@aliyun.com
国家自然科学基金资助项目(81371523);重庆市卫生局资助项目(2011-1-031,2012-1-017);国家临床重点专科建设项目([2013]544)。
R445.2;R744.3
2016-11-28
: 2017-01-04
中国医学影像学杂志
2017年 第25卷 第3期:169-173
Chinese Journal of Medical Imaging
2017 Volume 25 (3): 169-173
10.3969/j.issn.1005-5185.2017.03.003
