磁共振扩散峰度成像在前列腺癌中的研究现状
2017-06-05综述叶慧义审校
钟 燕(综述) 叶慧义(审校)
磁共振扩散峰度成像在前列腺癌中的研究现状
钟 燕(综述) 叶慧义(审校)
前列腺肿瘤;磁共振成像;扩散加权成像;扩散峰值成像;综述
前列腺癌在不同国家和地区的发病率和死亡率不同,在亚洲总体发病率和死亡率较低[1],但在中国其发病率和死亡率呈逐年上升趋势[2]。扩散加权成像(DWI)是一种无创的、检查活体组织内水分子扩散情况的功能MRI,是多参数MRI扫描前列腺最有效的方法之一。既往研究表明,DWI诊断前列腺癌具有较高的灵敏度和特异度[3-7]。DWI序列已经写入第2版前列腺影像报告和数据系统(prostate imaging-reporting and data system,PI-RADS)指南[8],并指出外周带疾病评分以DWI结果为主。扩散峰度成像(diffusion kurtosis imaging,DKI)是DWI的扩展,通过评估每个体素内的非高斯扩散进一步量化水扩散,能更准确地评估组织微观结构的复杂性[9]。鉴于DKI的临床可行性和坚实的理论框架,其已经大量应用于临床研究。近年来,DKI在前列腺成像中的应用受到越来越多的关注[10-14]。本文就DKI的原理及在前列腺癌中的研究现状进行阐述。
1 DKI的原理
传统的DWI基于水分子扩散呈高斯分布,即水分子不受任何限制自由扩散。因此,扩散加权的MR信号随着b值的增加呈单指数衰减。然而,在活体组织内,特别是在肿瘤中水分子的扩散受到细胞膜和细胞内细胞器等屏障的限制,导致水分子的非自由扩散,即非高斯扩散。Jensen等[15]于2005年提出了非高斯扩散加权模型,称为DKI。该模型包括峰度和扩散系数的计算。峰度量化组织扩散与高斯模型的偏差;扩散系数是非高斯偏差校正的扩散系数。由于组织扩散与高斯模型的偏差取决于水扩散的组织的复杂性,因此扩散峰度可以作为评价组织微观结构复杂性的客观指标。DKI信号衰减方程见公式(1)。
S=S0×exp(-b×D+b2·D2×K/6) (1)
其中,S是特定b值的DWI信号;S0是没有扩散加权的基线信号;K是无量纲的表观扩散峰度,K=0时为一个完美的高斯曲线,K值越大表示扩散与完美高斯模型的偏差越大;D是被校正后的表观扩散系数。
2 体部DKI采集
DKI采用与传统DWI相同类型的脉冲序列(自旋回波平面成像),但采集至少需要3个不同的b值,而且至少包括b值在1000 s/mm2以上和以下的各1个,以成功拟合非高斯信号衰减曲线。关于最小b值的选择,有文献报道当使用低b值时K值可能受体素内不相干运动灌注和组织结构的影响[16-17],只使用高b值(>200 s/mm2)K值主要取决于组织结构[10],因此选择较高的小b值应大于200 s/mm2[16]。与脑组织相比,在体部随着b值的增加组织信号衰减更快,同时T2衰减也更快,因此最大b值的最佳选择应低于脑组织的最大b值(2000~3000 s/mm2),推荐体部DKI最大b值在1500~2000 s/mm2。在体部DKI扩散敏感梯度场施加的方向与中枢神经系统不同,只需3个方向即可[15-16]。
3 DKI在前列腺癌诊断和鉴别诊断中的应用
大多数研究发现,与传统DWI相比,DKI可以更好地鉴别前列腺癌和正常前列腺组织及良性前列腺组织[10-12,18]。Rosenkrantz等[10]评价DKI检出前列腺外周带癌的可行性,发现癌灶的K值明显大于良性外周带(0.96±0.24比0.57±0.07,P<0.001);相对于ADC值和D值,K值区分外周带前列腺癌与良性外周带的敏感度更高(93.3%比78.5%和83.5%,P<0.001),而特异度相同(95.7%,P>0.99)。初步研究结果表明,DKI对前列腺癌的诊断价值明显高于DWI。Quentin等[11]评估DKI在前列腺MRI常规临床应用中的可行性,前瞻性纳入21例前列腺癌患者和10例无任何前列腺病史的志愿者,结果发现前列腺癌的轴向峰度和平均峰度显著高于正常外周带(P<0.001)(图1)、中央腺体(P=0.01)和前列腺炎(P=0.03);而中央腺体的轴向峰度和平均峰度(1.40±0.12、1.44±0.17)与前列腺炎(1.50±0.17、1.41±0.19)之间无显著差异。该结果表明,DKI可用于前列腺MRI常规临床中,尽管有一些重叠,但DKI参数可区分前列腺癌与中心腺体或正常外周带。Suo等[12]研究发现,与ADC值比较,良性外周带和前列腺癌的D值和K值重叠较少。Tamura等[18]报道前列腺癌和基质良性前列腺增生(benign prostatic hyperplasia,BPH)的K值显著高于良性外周带(1.19±0.24比0.99±0.28,P<0.001;1.19±0.24比 0.63±0.23,P<0.001)。受试者工作特性曲线分析发现前列腺癌和良性外周带的K值和ADC值的曲线下面积无显著差异,然而K值在3个参数中灵敏度最高。尽管前列腺癌和基质BPH之间的K值差异无统计学意义(P=0.051),但是前列腺癌的K值总体趋势大于基质BPH。这一结果可能具有一定的临床价值,因为用常规MRI区分移行带BPH与前列腺癌比较困难,而DKI可以提供区分前列腺癌与BPH的额外信息。特别是对经直肠超声引导穿刺活检为阴性而前列腺特异性抗原升高者,DKI可能是检出前列腺癌的有用工具。然而,仍然需要进一步增加样本量来证实这一结果。Roethke等[13]研究得出不同的结论,该研究结果表明DKI和ADC值鉴别前列腺癌和良性前列腺组织无显著差异。
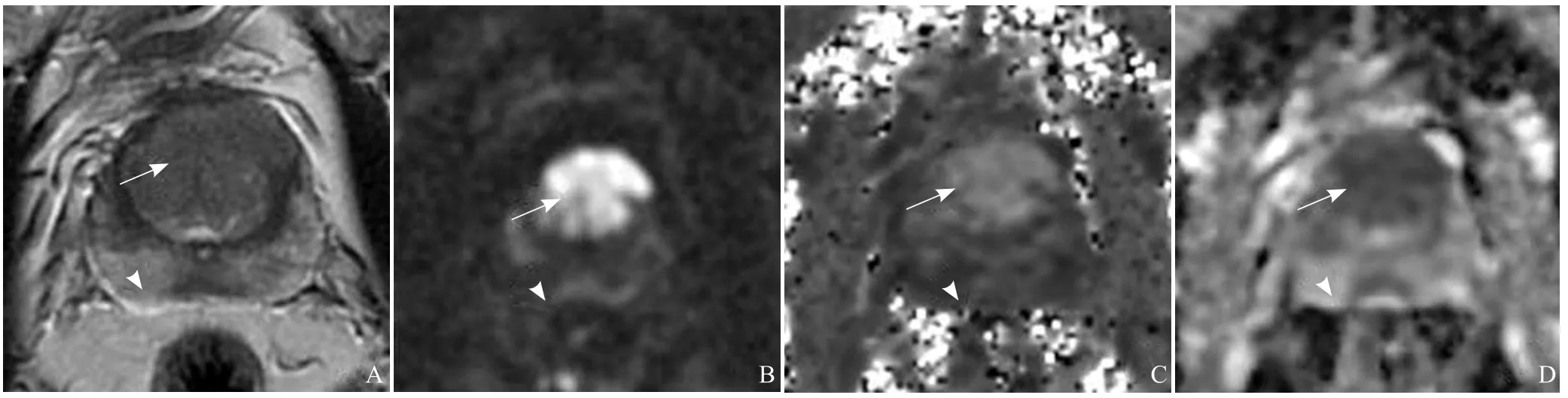
图1 男,74岁,移行带前列腺癌,Gleason评分7分。T2WI癌灶呈低信号(箭),正常外周带呈高信号(箭头,A);DWI图示癌灶扩散受限呈高信号(箭),正常外周带呈低信号(箭头,B);癌灶K值为0.976(箭),正常外周带K值为0.527(箭头,C);癌灶D值为0.959×10-3mm2/s(箭),正常外周带D值为1.800×10-3mm2/s(箭头,D)
4 DKI在评价前列腺癌侵袭性方面的应用
既往研究证实,Gleason评分是预测前列腺癌生物侵袭性和预后的最有用的指标之一。然而,根据有创的活检作出的Gleason评分通常不能反映整个前列腺的病理特征。因此需要一种非侵入性的方法来准确作出治疗之前的Gleason评分。既往神经胶质瘤研究中,DKI在预测肿瘤级别方面比标准ADC值更准确[19],即肿瘤级别越高,其微结构异质性越不均匀。鉴于前列腺癌复杂的组织学构成,其包含不同比例的良性和恶性基质、上皮和腺体成分,DKI同样也可能作为一种更有效的模型评估前列腺癌。Rosenkrantz等[10]研究发现,外周带癌Gleason评分高的K值高于Gleason评分低者(1.05±0.26比0.89±0.20,P<0.001),区别高级别与低级别前列腺癌K值的曲线下面积明显高于ADC值(0.70比0.62,P=0.010)。K值在区分高级别与低级别前列腺癌时敏感度显著高于ADC值与D值(68.6%比51.0%和49.0%,P<0.004),但特异度有所减低(70.0%比81.4%和82.9%,P<0.023)。Suo等[12]报道K值在Gleason评分6分、7分和≥8分的肿瘤中显著不同(P=0.001),K值与Gleason评分呈正相关(r=0.729,P<0.001)。Wang等[20]采用DKI直方图回顾性分析49个低级别癌灶和79个高级别癌灶,发现第90百分位数的K值可以更好地鉴别诊断低级别和高级别前列腺癌;随着前列腺癌Gleason评分的增加,D值显著减低,K值明显升高。研究结果表明,采用DKI直方图区别前列腺癌病理级别是可行的。Quentin等[11]指出轴向峰度与Gleason评分之间呈弱相关(r=0.19)。Roethke等[13]评估和验证DKI用于前列腺癌Gleason分级,结果发现评估前列腺癌侵袭性的DKI(D、K)和ADC值的亚组分析提示鉴别高级别与低级别前列腺癌有显著差异(P<0.05)。然而,这项研究结果表明与标准ADC值相比,DKI对外周带前列腺癌的检出和分级无显著益处。对于临床常规应用,DWI单指数拟合的ADC值仍然是表征前列腺外周带癌的标准。
5 DKI各参数与组织病理学的相关性
既往研究结果表明,K值和肿瘤侵袭性之间存在相关性[10,12,20],然而未分析DKI的生物物理基础与前列腺癌中组织成分变化的相关性。Lawrence等[21]研究发现,与正常组织相比,外周带肿瘤的细胞结构增加(P<0.0001),纤维肌性基质(P<0.05)和管腔间隙减少(P<0.0001)。与肿瘤Gleason评分≤3+4分相比,Gleason评分≥4+3分肿瘤细胞结构显著增加,而纤维肌性基质显著减少(P<0.05)。肿瘤K值中位数和细胞结构呈正相关(ρ=0.50),与纤维肌性基质呈负相关(ρ=-0.45)。正常组织D值中位数与管腔间隙呈正相关(ρ=0.65),与细胞结构呈负相关(ρ=-0.49)。肿瘤和正常组织之间的K值和D值中位数显著不同(P<0.0001),但仅K值中位数在Gleason评分≤3+4分和≥4+3分之间有差异(P<0.05)。结果表明,外周带肿瘤细胞的异质性增加由平均K值反映,而正常前列腺更均匀的管腔间隙和细胞结构由D值反映。该研究结果为低级别和高级别外周带肿瘤之间的K值中位数的差异提供了可能的生物学基础。K值与肿瘤组织的相关性和D值与正常组织的相关性之间的差异可以通过水扩散的生物物理性质来解释。研究结果支持DKI在探测肿瘤组织的异质性的假说。
6 DKI在低风险前列腺癌患者主动监测中的应用
主动监测是低风险前列腺癌患者早期积极根治的一种替代方法。最近的英国国家卫生与保健优化研究所(NICE)推荐[22]规定,做出主动监测的初步决定后应该用MRI而非常规活检来发现疾病的进展。既往研究表明,测量以主动监测候选人为基线的前列腺肿瘤的ADC值降低与重复活检和选择推迟干预的肿瘤升级相关[22-23]。Rosenkrantz等[24]纳入58例前列腺癌主动监测候选人,以根治性前列腺术标本为参考,前列腺切除术后进展病理特征使用2种不同严格性的方案定义,比较2种方案中前列腺根治术后病理结果有进展患者和无进展患者D值、K值和ADC值的差异,结果2种方案中病理结果有进展组的D值显著低于病理结果无进展组;在更严格方案中尽管有进展的患者K值趋向较无进展者高,但差异无统计学意义(P=0.072);而2种方案中两组ADC值差异均无统计学意义,不严格方案K值差异也无统计学意义。尽管受试者工作特性曲线分析使用任何一种方案各参数预测最终进展病理结果的曲线下面积无显著差异,但是D值的曲线下面积(0.691~0.743)大于ADC值(0.569~0.655)或K值(0.617~0.714)。初步研究结果表明,与标准DWI比较,DKI在主动监测候选者危险分层中具有更大的作用。
综上所述,DKI是一种新的DWI模型,可以量化非高斯水扩散,能更好地反映组织微观结构的复杂性。采用DKI区分前列腺癌和正常前列腺组织及良性前列腺组织、评估前列腺癌的侵袭性及确定主动监测是可行的,并具有一定的优势。DKI可以帮助侵袭性增加或组织异质性的区域直接采样,因此有助于未来评估疾病的组织病理学。然而关于Gleason评分与DKI各参数之间的相关性的定量组织学、主动监测的研究尚少,未见DKI参数评估新生血管的存在以及评估前列腺癌治疗效果的研究,因此DKI具有广阔的研究前景。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer, 2015, 136(5): E359-E386.
[2] 齐金蕾, 王黎君, 周脉耕, 等. 1990-2013年中国男性前列腺癌疾病负担分析. 中华流行病学杂志, 2016, 37(6): 778-782.
[3] Sato C, Naganawa S, Nakamura T, et al. Differentiation of noncancerous tissue and cancer lesions by apparent diffusion coefficient values in transition and peripheral zones of the prostate. J Magn Reson Imaging, 2005, 21(3): 258-262.
[4] Tanimoto A, Nakashima J, Kohno H, et al. Prostate cancer screening: the clinical value of diffusion-weighted imaging and dynamic MR imaging in combination with T2-weighted imaging. J Magn Reson Imaging, 2007, 25(1): 146-152.
[5] Reinsberg SA, Payne GS, Riches SF, et al. Combined use of diffusion-weighted MRI and 1H MR spectroscopy to increase accuracy in prostate cancer detection. Am J Roentgenol, 2007, 188(1): 91-98.
[6] Yoshimitsu K, Kiyoshima K, Irie H, et al. Usefulness of apparent diffusion coefficient map in diagnosing prostate carcinoma: correlation with stepwise histopathology. J Magn Reson Imaging, 2008, 27(1): 132-139.
[7] Tan CH, Wei W, Johnson V, et al. Diffusion-weighted MRI in the detection of prostate cancer: meta-analysis. Am J Roentgenol, 2012, 199(4): 822-829.
[8] Weinreb JC, Barentsz JO, Choyke PL, et al. PI-RADS prostate imaging-reporting and data system: 2015, version 2. Eur Urol, 2016, 69(1): 16-40.
[9] Jensen JH, Helpern JA. MRI quantification of non-Gaussian water diffusion by kurtosis analysis. NMR Biomed, 2010, 23(7): 698-710.
[10] Rosenkrantz AB, Sigmund EE, Johnson G, et al. Prostate cancer: feasibility and preliminary experience of a diffusional kurtosis model for detection and assessment of aggressiveness of peripheral zone cancer. Radiology, 2012, 264(1): 126-135.
[11] Quentin M, Pentang G, Schimmöller L, et al. Feasibility of diffusional kurtosis tensor imaging in prostate MRI for the assessment of prostate cancer: preliminary results. Magn Reson Imaging, 2014, 32(7): 880-885.
[12] Suo S, Chen X, Wu L, et al. Non-Gaussian water diffusion kurtosis imaging of prostate cancer. Magn Reson Imaging, 2014, 32(5): 421-427.
[13] Roethke MC, Kuder TA, Kuru TH, et al. Evaluation of diffusion kurtosis imaging versus standard diffusion imaging for detection and grading of peripheral zone prostate cancer. Invest Radiol, 2015, 50(8): 483-489.
[14] Jambor I, Merisaari H, Taimen P, et al. Evaluation of different mathematical models for diffusion-weighted imaging of normal prostate and prostate cancer using high b-values: a repeatability study. Magn Reson Med, 2015, 73(5): 1988-1998.
[15] Jensen JH, Helpern JA, Ramani A, et al. Diffusional kurtosis imaging: the quantification of non-gaussian water diffusion by means of magnetic resonance imaging. Magn Reson Med, 2005, 53(6): 1432-1440.
[16] Rosenkrantz AB, Padhani AR, Chenevert TL, et al. Body diffusion kurtosis imaging: basic principles, applications, and considerations for clinical practice. J Magn Reson Imaging, 2015, 42(5): 1190-1202.
[17] Mazzoni LN, Lucarini S, Chiti S, et al. Diffusion-weighted signal models in healthy and cancerous peripheral prostate tissues: comparison of outcomes obtained at different b-values. J Magn Reson Imaging, 2014, 39(3): 512-518.
[18] Tamura C, Shinmoto H, Soga S, et al. Diffusion kurtosis imaging study of prostate cancer: preliminary findings. J Magn Reson Imaging, 2014, 40(3): 723-729.
[19] Raab P, Hattingen E, Franz K, et al. Cerebral gliomas: diffusional kurtosis imaging analysis of microstructural differences. Radiology, 2010, 254(3): 876-881.
[20] Wang Q, Li H, Yan X, et al. Histogram analysis of diffusion kurtosis magnetic resonance imaging in differentiation of pathologic Gleason grade of prostate cancer. Urol Oncol, 2015, 33(8): 337.e15-337.e24.
[21] Lawrence EM, Warren AY, Priest AN, et al. Evaluating prostate cancer using fractional tissue composition of radical prostatectomy specimens and pre-operative diffusional kurtosis magnetic resonance imaging. PLoS One, 2016, 11(7): e0159652.
[22] Giles SL, Morgan VA, Riches SF, et al. Apparent diffusion coefficient as a predictive biomarker of prostate cancer progression: value of fast and slow diffusion components. Am J Roentgenol, 2011, 196(3): 586-591.
[23] van As NJ, de Souza NM, Riches SF, et al. A study of diffusionweighted magnetic resonance imaging in men with untreated localised prostate cancer on active surveillance. Eur Urol, 2009, 56(6): 981-987.
[24] Rosenkrantz AB, Prabhu V, Sigmund EE, et al. Utility of diffusional kurtosis imaging as a marker of adverse pathologic outcomes among prostate cancer active surveillance candidates undergoing radical prostatectomy. Am J Roentgenol, 2013, 201(4): 840-846.
R735.7;R730.42
2016-12-21
2017-02-18
(本文编辑 张春辉)
解放军总医院放射科 北京 100853
叶慧义 E-mail: 13701100368@163.com
10.3969/j.issn.1005-5185.2017.03.018
