成人Still病的18F-FDG PET/CT表现
2017-06-05赵倩倩ZHAOQianqian
赵倩倩ZHAO Qianqian
关志伟2GUAN Zhiwei
冀肖健1JI Xiaojian
张 颖1ZHANG Ying
杨金水1YANG Jinshui
朱 剑1ZHU Jian
黄 烽1HUANG Feng
张江林1ZHANG Jianglin
成人Still病的18F-FDG PET/CT表现
赵倩倩1ZHAO Qianqian
关志伟2GUAN Zhiwei
冀肖健1JI Xiaojian
张 颖1ZHANG Ying
杨金水1YANG Jinshui
朱 剑1ZHU Jian
黄 烽1HUANG Feng
张江林1ZHANG Jianglin
目的成人Still病(AOSD)因缺乏特征性临床表现易导致诊断困难,本文总结AOSD的18F-脱氧葡萄糖(FDG)PET/CT表现,探讨PET/CT在AOSD诊断及鉴别诊断中的应用价值。资料与方法选取确诊为AOSD并行18F-FDG PET/CT检查的患者54例,收集其临床特点、实验室检查及肝、脾、骨髓、淋巴结等部位最大标准化摄取值(SUVmax)的相关资料,分析AOSD的主要PET/CT表现、SUVmax的影响因素及其与实验室指标之间的相关性。结果AOSD的FDG摄取主要发生于骨髓(88.89%,SUVmax:3.91±1.16)、脾(79.63%,SUVmax:3.24±0.89)及淋巴结(77.78%,SUVmax:3.83±1.97),此外FDG摄取还可发生于关节、腮腺、颌下腺、胸膜等部位。与不用糖皮质激素(GC)组相比,用GC仍发热组和用GC不发热组脾、骨髓、淋巴结SUVmax显著降低(P<0.05),而用GC两组肝、脾、骨髓、淋巴结SUVmax相比差异均无统计学意义(P>0.05)。是否使用改善病情抗风湿药两组肝、脾、骨髓、淋巴结SUVmax差异均无统计学意义(P>0.05)。相关性分析显示,脾SUVmax与乳酸脱氢酶、骨髓SUVmax与C反应蛋白呈弱性相关(r=0.33、0.30,P<0.05)。结论AOSD在18F-FDG PET/CT上主要表现为脾、骨髓及淋巴结的FDG高摄取,GC治疗可降低各器官SUVmax。18F-FDG PET/CT可帮助排除恶性肿瘤、指导活检并协助确诊AOSD。
Still病,成年型;正电子发射断层显像术;体层摄影术,X线计算机;氟脱氧葡萄糖F18
成人Still病(adult onset Still's disease,AOSD)是一种病因及发病机制未明的系统性炎症性疾病,其主要临床表现为高热、特征性皮疹、关节炎/关节痛三联征[1]。本病的诊断建立在临床基础上,需满足分类标准并排除恶性肿瘤、感染及其他风湿性疾病。因AOSD发病率低,临床表现多样且缺乏特异性实验室检查,常导致其诊断困难。全身18F-脱氧葡萄糖(fluorodeoxyglueose,FDG)PET/CT在肿瘤方面的应用价值已得到公认[2],近年来PET/CT也逐渐用于其他领域,如感染[3]、自身免疫/自身炎症性疾病[4-5]等。关于AOSD的PET/CT表现多是个案报道,另有2篇样本量分别为7例和26例的回顾性分析[6-7],本研究共纳入AOSD患者54例,回顾性分析AOSD患者的PET/CT表现及应用价值。
1 资料与方法
1.1 研究对象 收集2009年1月—2015年9月于解放军总医院诊断为AOSD并行PET/CT检查的患者54例,其中男16例,女38例;年龄16~62岁,平均(36.3±13.4)岁;病程中位时间1.5个月。所有患者常见临床表现均为发热,最高体温(40.14±0.77)℃;皮疹(85.2%),关节痛或关节炎(87.0%)。其他还可见咽痛(77.8%)、肌痛(79.6%)、肌无力(11.1%)、体重下降(50%),脾肿(48.1%)及浅表淋巴结肿大(48.1%)。AOSD患者实验室检查结果见表1。部分患者在PET/CT检查前已使用糖皮质激素(glucocorticoid,GC)治疗3 d以上,以此将患者分为用GC组与不用GC组,其中不用GC组患者PET/CT检查前体温均高于38.3℃,用GC组部分患者体温降至正常3 d以上行PET/CT检查者为用GC不发热组,其余为用GC仍发热组。部分患者同时使用抗风湿药(disease-modifying antirheumatic drugs,DMARDs)。所有患者均处于病情活动期且符合Cush标准或Yamaguchi标准[8-9],用药前均签署知情同意书。对患者进行随访1年以上,平均随访(2.85±1.49)年,排除进展为其他风湿性疾病或恶性肿瘤者。
1.2 仪器与方法 采用GE Discovery VET及Siemens Biograph 64 PET/CT显像仪,18F-FDG为解放军总医院核医学中心生产,放化纯度>95%。检查前患者禁食>6 h,血糖<6.5 mmol/L,体温<38.0℃,对于不满足体温要求的患者给予口服洛索洛芬钠或肌内注射地塞米松磷酸钠注射液,待体温<38.0℃后再行PET/CT检查。平静状态下按5.55 MBq/kg静脉注射18F-FDG,休息60 min后行PET/CT检查,扫查范围由颅顶至双股中部。
1.3 图像分析 所有患者PET/CT图像由同一位核医学副主任医师阅片,图像分析采用视觉法和半定量分析法。视觉法即阅片者凭经验观察肝、脾、骨髓、淋巴结、关节、腺体等部位有无FDG摄取增高情况。半定量分析法即在PET图像上对肝、脾、脊柱及异常FDG摄取区勾画感兴趣区(ROI),由工作站自动计算最大标准化摄取值(maximum standard uptake value,SUVmax),并在对应CT图像上得到肝右叶最大斜径、脾周肋单元数及淋巴结短轴最大直径。脾和骨髓SUVmax大于肝即认为存在FDG高摄取。在CT图像上观察淋巴结有无融合、钙化等异常情况,淋巴结仅表现为增大而无FDG高摄取时不纳入分析。
1.4 统计学方法 采用SPSS 17.0软件,计量资料用±s表示,组间比较采用t检验及方差分析。非正态分布资料用中位数表示,组间比较采用秩和检验。计数资料用率或构成比表示。相关性采用Pearson相关和Spearman等级相关分析。P<0.05表示差异有统计学意义。
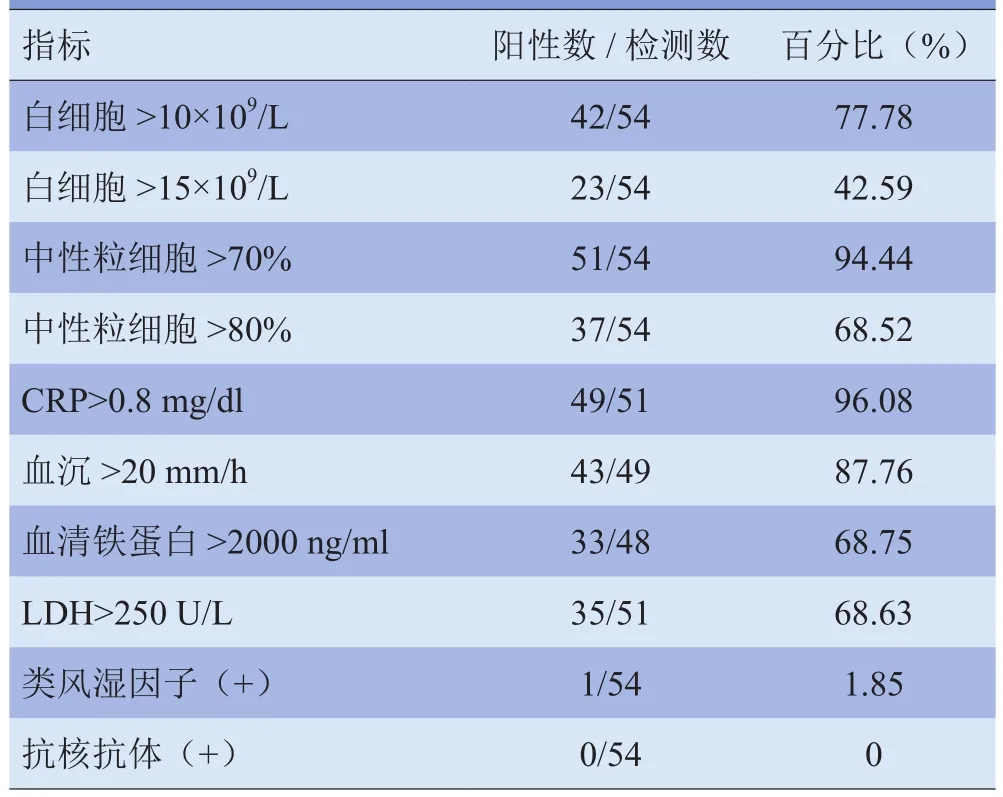
表1 AOSD患者实验室检查结果(n=54)
2 结果
2.1 受累器官的PET/CT表现 AOSD患者在PET/CT上主要表现为脾、骨髓及淋巴结的FDG摄取增高,见表2、图1。同机CT显示脾脏均有不同程度增大,最大达11个肋单元。42例淋巴结FDG摄取增高,高代谢淋巴结主要分布区域为颈部24例、锁骨27例、腋窝32例、肺门9例、纵隔17例、腹腔12例、腹膜后19例、盆腔24例、腹股沟26例。所有淋巴结均为椭圆形,未见融合或钙化。5例患者有关节部位FDG摄取增高,主要累及肩和髋关节,且临床均有关节痛。此外于胸膜、内乳淋巴结、食管、肌肉、肾下极、皮下结节处发现各有1例患者FDG摄取增高。
2.2 GC患者组间SUVmax的比较 不用GC组、用GC不发热组、用GC仍发热组间脾、骨髓、淋巴结SUVmax之间差异有统计学意义(P<0.05),见表3。两两比较显示,用GC仍发热组和用GC不发热组脾、骨髓、淋巴结SUVmax均显著低于不用GC组,差异有统计学意义(P<0.05),而用GC的两组间差异无统计学意义(P>0.05),见图2。

表2 AOSD患者FDG摄取增高部位的SUVmax
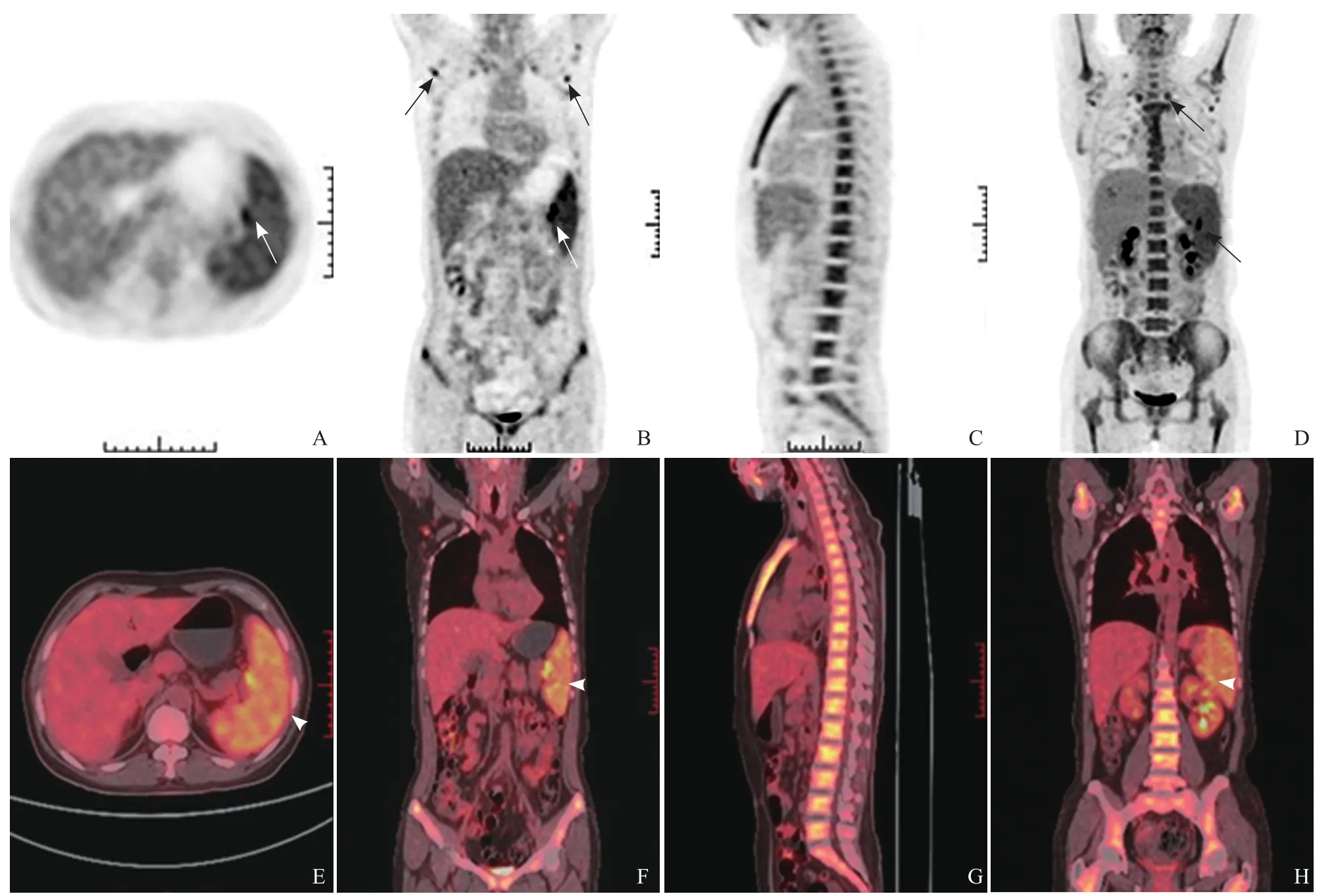
图1 女,43岁,AOSD。18F-FDG PET/CT示脾(箭头)、骨髓及多部位淋巴结(箭)18F-FDG摄取增高,SUVmax分别为3.5、4.3及4.9。A~D分别为轴位、冠状位、矢状位、冠状位的PET图像;E~H为轴位、冠状位、矢状位、冠状位的PET/CT融合图像
表3 是否使用GC各组肝、脾、骨髓的SUVmax比较(±s)
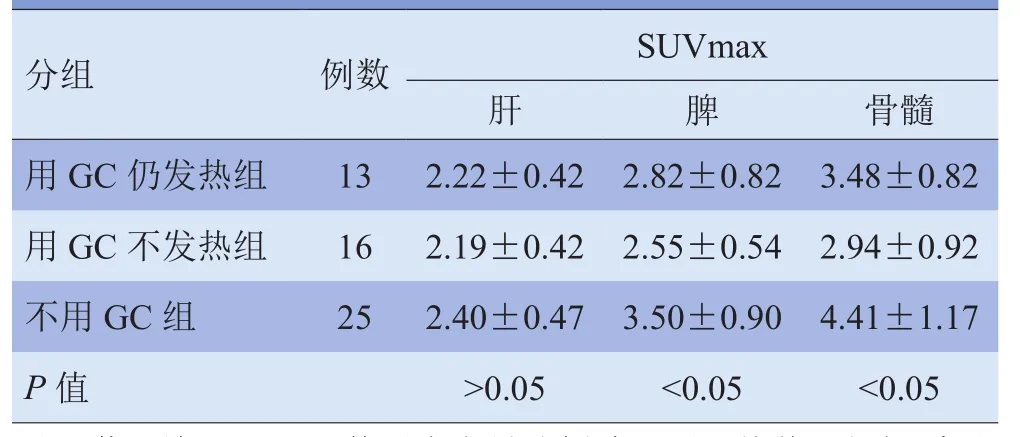
表3 是否使用GC各组肝、脾、骨髓的SUVmax比较(±s)
注:淋巴结SUVmax使用半定量分析法,无平均值,组间采用秩和检验比较
分组 例数 SUVmax肝脾骨髓用GC仍发热组 13 2.22±0.42 2.82±0.82 3.48±0.82用GC不发热组 16 2.19±0.42 2.55±0.54 2.94±0.92不用GC组 25 2.40±0.47 3.50±0.90 4.41±1.17 P值 >0.05 <0.05 <0.05
2.3 DMARDs两组间SUVmax比较 本研究中6例患者应用DMARDs及GC期间出现病情复发,在应用GC治疗的29例患者中,用DMARDs组肝、脾、骨髓及淋巴结的SUVmax均低于不用DMARDs组,但差异无统计学意义(P>0.05),见表4。
2.4 相关性分析 脾SUVmax与LDH、骨髓SUVmax与CRP呈正相关(r=0.33、0.30,P<0.05);其他部位SUVmax与实验室检查各指标(白细胞计数、中性粒细胞绝对值、血沉、血清铁蛋白)之间均无相关性(P>0.05),见表5。受累淋巴结的SUVmax与淋巴结大小之间存在相关性(r=0.41,P<0.05),见图3。

图2 用GC仍发热、不发热组与不用GC组两两比较骨髓(A)、脾(B)的SUVmax,*P<0.05
表4 用DMARDs与未用DMARDs患者肝、脾、骨髓的SUVmax比较(±s)
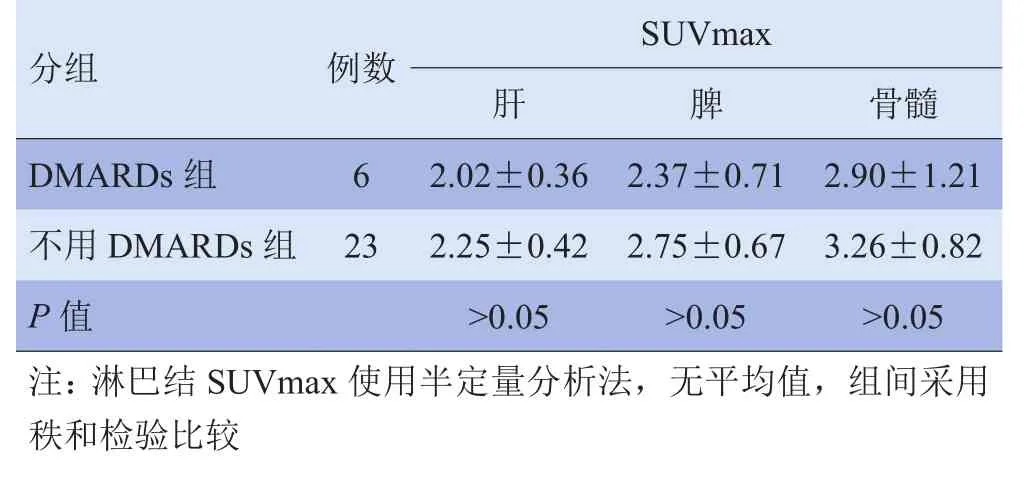
表4 用DMARDs与未用DMARDs患者肝、脾、骨髓的SUVmax比较(±s)
分组 例数 SUVmax肝脾 骨髓DMARDs组 6 2.02±0.36 2.37±0.71 2.90±1.21不用DMARDs组 23 2.25±0.42 2.75±0.67 3.26±0.82 P值 >0.05 >0.05 >0.05注:淋巴结SUVmax使用半定量分析法,无平均值,组间采用秩和检验比较

图3 淋巴结SUVmax和短轴直径的相关性
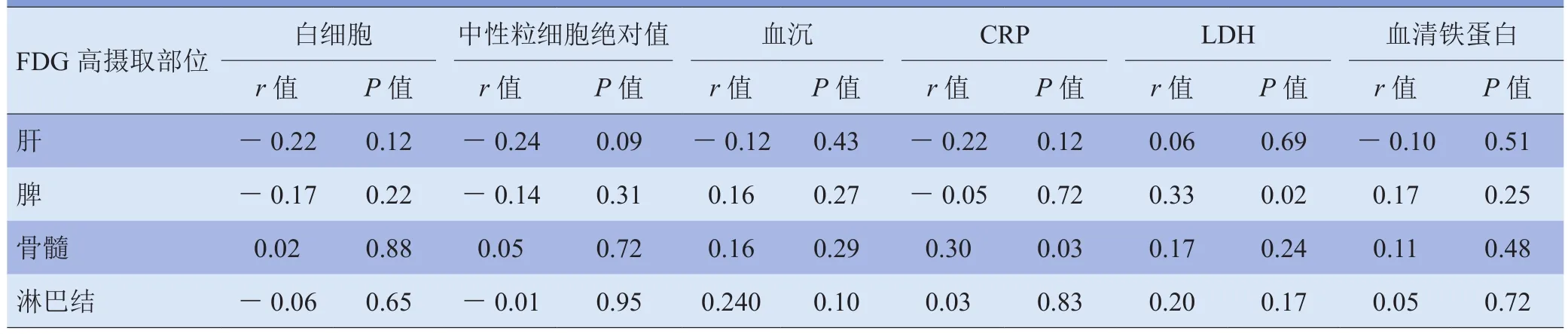
表5 各部位SUVmax与实验室检查指标的相关性分析
3 讨论
AOSD发病机制不明,可能与病毒感染、基因及免疫调节异常等因素相关[10]。巨噬细胞相关的细胞因子如白介素(interleukin,IL)-1、肿瘤坏死因子-α、IL-6、IL-18等在AOSD的发病机制中发挥重要作用,另外Th1和Th2细胞活化的失衡也与AOSD的发病相关。
18F-FDG是葡萄糖类似物,以糖为代谢底物的细胞均可摄取,故18F-FDG可反映不同细胞代谢率。除在肿瘤细胞中异常浓聚外,18F-FDG高摄取同样可见于其他代谢率较高的巨噬细胞、粒细胞、淋巴细胞等[11],反映机体炎症反应状态,因此,近年来18F-FDG PET/CT广泛应用于风湿领域。Dong等[6]和Yamashita等[7]均指出AOSD在PET/CT上表现为脾、骨髓及淋巴结的高摄取,2项研究中骨髓摄取增高比例均为100%,脾摄取增高比例分别为96.15%和90.9%,而本研究中骨髓摄取增高比例88.89%,脾79.63%,考虑GC的使用可能对骨髓及脾代谢产生影响,在未使用GC的25例患者中,骨髓及脾摄取增高比例均达到96%。2项研究中关节高摄取比例达61%~75%,而本研究中仅观察到5例有肩或髋关节摄取增高,除考虑GC的影响外,47例有关节痛/关节炎的患者中累及肩或髋关节者仅12例(25.5%),而本研究PET/CT扫查范围由颅顶至双股中部,未包括肘、腕、膝、踝、双手及双足,故本研究认为常规PET/CT并不能较好地反映全身关节受累情况。
Choe等[12]描述1例仅使用GC和非甾体抗炎药治疗的患者,15个月后复查PET/CT显示治疗前FDG高摄取的骨髓、脾及淋巴结经治疗后均无高摄取。Yamashita等[7]总结10例治疗前后AOSD患者的PET/CT资料,结果显示治疗后骨髓、脾、淋巴结SUVmax显著降低(P<0.05)。AOSD治疗相关的数据多来源于小样本的回顾性分析,缺乏前瞻性的随机双盲对照试验,因此目前仍是经验性治疗。临床中使用GC作为AOSD治疗的常用药,研究显示其单药治疗有效率达63%[13]。除GC外,现用于本病治疗的药物还包括DMARDs和生物制剂[14]。本研究中用GC组的骨髓、脾及淋巴结SUVmax均显著低于不用GC组,间接反映了GC对于AOSD治疗的效果。6例患者在PET/CT检查前使用DMARDs及GC治疗2个月以上,用DMARDs组的骨髓、脾、淋巴结的SUVmax均低于未使用DMARDs组,但差异无统计学意义(P>0.05)。由于本研究中大部分为初治患者,在PET/CT检查前应用DMARDs治疗者较少,有可能导致结果偏差,需继续扩大样本量深入研究。考虑到经济因素,本研究未将PET/CT作为病情缓解后的常规复查项目,54例患者复查中仅2例进行PET/CT检查,因此,本研究未能直接分析PET/CT对AOSD治疗反应的监测价值。
体温会影响机体的代谢率[15],故在行PET/CT检查时均要求所有患者体温<38.0℃,为排除GC对FDG摄取的影响,比较用GC仍发热与不发热两组脾、骨髓及淋巴结的摄取,其差异均无统计学意义(P>0.05),即PET/CT检查前1~3 d的高体温不会影响FDG摄取,体温升高不能解释AOSD患者FDG摄取的增高情况。GC可降低各器官SUVmax,而GC有抑制炎症反应的作用,故本研究认为AOSD患者FDG摄取升高为疾病本身炎症反应造成,而非单纯体温升高引起。PET/ CT检查时为使发热患者体温降至正常,不用GC组中6例临时使用地塞米松肌内注射,比较是否使用地塞米松患者间脾、骨髓、淋巴结的SUVmax,差异无统计学意义(P>0.05),提示在临床工作中分析SUVmax的高低,要考虑是否受到长期应用GC的影响,而临时使用地塞米松不会影响SUVmax。
各器官SUVmax与实验室检查的相关性分析中可观察到骨髓SUVmax与CRP呈正相关(r=0.30,P<0.05)。患者炎症越重,反映炎症最重要的急性期反应蛋白CRP就越高,骨髓SUVmax就越高[16]。另外观察到脾SUVmax与LDH呈正相关(r=0.33,P<0.05),该结果与Yamashita等[7]的研究相符,但在Dong等[6]的研究中并未发现此类相关性,且骨髓SUVmax与CRP、脾SUVmax与LDH之间相关性均较弱,后期研究可扩大样本量进一步验证此相关性。血沉作为反映急性期炎症水平的间接衡量指标,受到血液中多种因素的影响,并不能直接表现出与SUVmax的相关性。Murata等[17]发现骨髓FDG摄取与中性粒细胞计数相关,因为健康者骨髓中粒系比例最高(49%~65%),且寿命短(10 h)、更新快,而骨髓FDG摄取可反映骨髓代谢,但本研究却并未发现其相关性。进一步比较发现,2项研究入组患者不同,前者多为肿瘤性疾病,而本研究AOSD为自身炎症性疾病,白细胞计数多高于10×109/L,且白细胞及中性粒细胞在较短时间内变化较大,数据录入时选取距离PET/CT检查最近的1次化验结果,不能准确反映当时骨髓FDG摄取情况,所以并未发现两者之间的相关性。本研究发现淋巴结SUVmax与淋巴结大小相关(r=0.41,P<0.05),与Dong等[6]的报道一致,淋巴组织增生过程中可出现细胞代谢率增高,从而可观察两者的相关性。
随着PET/CT在风湿领域的应用,逐渐可了解不同风湿病的PET/CT表现,如皮肌炎表现为近端肢带肌群的FDG摄取增高[18];大动脉炎、巨细胞动脉炎主要表现为主动脉及其分支的FDG高摄取[19];IgG4相关疾病则在胰腺、唾液腺、淋巴结等受累器官出现FDG摄取增高[20]。不同于其他风湿疾病,AOSD的PET/CT图像主要表现为脾、骨髓、淋巴结的FDG高摄取。除易引起发热的其他风湿病,需与AOSD相鉴别的主要是淋巴瘤等恶性肿瘤。多项研究曾探讨SUVmax的截断值[21-23],良性组织为1.4~3.0,恶性组织5.4~7.1,炎性疾病2.7。本研究中23例患者行PET/CT检查排除恶性肿瘤后确诊为AOSD。另有31例根据SUVmax值PET/CT提示不除外恶性疾病,临床中需进一步对骨髓摄取增高者行骨髓活检,并对PET/CT显示SUVmax显著增高的淋巴结行穿刺活检。共24例患者行骨髓活检,其中23例提示反应性增生,1例为急性粒细胞缺乏,均未见异常细胞;11例患者行淋巴结穿刺活检,病理均提示淋巴组织增生,未见肿瘤细胞。AOSD缺乏特异性诊断方法,其确诊基于临床,在满足分类标准的情况下需排除感染、淋巴瘤等其他疾病即可诊断。对于临床支持AOSD诊断的患者行PET/ CT检查,表现为脾、骨髓及淋巴结FDG轻度摄取而无其他部位明显异常的FDG高摄取者可排除恶性肿瘤等,从而确诊AOSD;脾、骨髓或淋巴结SUVmax显著增高或处于良、恶性之间时,PET/CT可显示活检部位从而帮助诊断。
本研究为回顾性分析,部分数据缺失;仅纳入AOSD患者,未能直接比较AOSD与淋巴瘤等其他疾病间的差别;今后可以前瞻性纳入更多的AOSD、淋巴瘤及健康对照组进行更加全面、准确的分析。
总之,18F-FDG PET/CT在AOSD中主要表现为脾、骨髓及淋巴结的摄取增高,激素可降低各器官SUVmax。脾SUVmax与LDH、骨髓SUVmax与CRP呈正相关。PET/CT可作为排除其他疾病、帮助AOSD指导活检并协助诊断的有效检查。
[1] Efthimiou P, Paik PK, Bielory L. Diagnosis and management of adult onset Still's disease. Ann Rheum Dis, 2006, 65(5): 564-572.
[2] Sheng ZK, Ye J, Li JJ, et al. Utility of fluorodeoxyglucose positron emission tomography/computed tomography in patients with fever of unknown origin diagnosed as lymphoma. Med Princ Pract, 2014, 23(5): 437-442.
[3] Basu S, Ranade R. 18-Fluoro-deoxyglucose-PET/Computed tomography in infection and aseptic inflammatory disorders: value to patient management. PET Clin, 2015, 10(3): 431-439. [4] Yamashita H, Kubota K, Mimori A. Clinical value of wholebody PET/CT in patients with active rheumatic diseases. Arthritis Res Ther, 2014, 16(5): 423.
[5] 王冬艳, 杨彦松, 邵小南, 等.18F-FDG PET/CT在风湿性疾病的初步应用. 中国医学影像学杂志, 2015, 23(10): 759-763, 770.
[6] Dong MJ, Wang CQ, Zhao K, et al.18F-FDG PET/CT in patients with adult-onset Still's disease. Clin Rheumatol, 2015, 34(12): 2047-2056.
[7] Yamashita H, Kubota K, Takahashi Y, et al. Clinical value of18F-fluoro-dexoxyglucose positron emission tomography/ computed tomography in patients with adult-onset Still's disease: a seven-case series and review of the literature. Mod Rheumatol, 2014, 24(4): 645-650.
[8] Cush JJ, Medsger TA Jr, Christy WC, et al. Adult-onset Still's disease: clinical course and outcome. Arthritis Rheum, 1987, 30(2): 186-194.
[9] Yamaguchi M, Ohta A, Tsunematsu T, et al. Preliminary criteria for classification of adult Still's disease. J Rheumatol, 1992, 19(3): 424-430.
[10] Kadavath S, Efthimiou P. Adult-onset Still's disease-pathogenesis, clinical manifestations, and new treatment options. Ann Med, 2015, 47(1): 6-14.
[11] Meller J, Sahlmann CO, Scheel AK.18F-FDG PET and PET/ CT in fever of unknown origin. J Nucl Med, 2007, 48(1): 35-45.
[12] Choe JY, Chung DS, Park SH, et al. Clinical significance of18F-fluoro-dexoxyglucose positron emission tomography in patients with adult-onset Still's disease: report of two cases and review of literatures. Rheumatol Int, 2010, 30(12): 1673-1676.
[13] Franchini S, Dagna L, Salvo F, et al. Efficacy of traditional and biologic agents in different clinical phenotypes of adult-onset Still's disease. Arthritis Rheum, 2010, 62(8): 2530-2535.
[14] Jamilloux Y, Gerfaud-Valentin M, Henry T, et al. Treatment of adult-onset Still's disease: a review. Ther Clin Risk Manag, 2015, 11(4): 33-43.
[15] Meller J, Becker W. Nuclear medicine diagnosis of patients with fever of unknown origin (FUO). Nuklearmedizin, 2001, 40(3): 59-70.
[16] Nam HY, Kim SJ, Kim IJ, et al. The clinical implication and prediction of diffuse splenic FDG uptake during cancer surveillance. Clin Nucl Med, 2010, 35(10): 759-763.
[17] Murata Y, Kubota K, Yukihiro M, et al. Correlations between18F-FDG uptake by bone marrow and hematological parameters: measurements by PET/CT. Nucl Med Biol, 2006, 33(8): 999-1004.
[18] 裴蕾, 关志伟, 冀肖健, 等.18F脱氧葡萄糖-PET-CT在皮肌炎诊疗中的应用价值. 中华内科杂志, 2016, 55(7): 525-530.
[19] Besson FL, Parienti JJ, Bienvenu B, et al. Diagnostic performance of18F-fluorodeoxyglucose positron emission tomography in giant cell arteritis: a systematic review and meta-analysis. Eur J Nucl Med Mol Imaging, 2011, 38(9): 1764-1772.
[20] Zhao Z, Wang Y, Guan Z, et al. Utility of FDG-PET/CT in the diagnosis of IgG4-related diseases. Clin Exp Rheumatol, 2016, 34(1): 119-125.
[21] Hellwig D, Graeter TP, Ukena D, et al.18F-FDG PET for mediastinal staging of lung cancer: which SUV threshold makes sense? J Nucl Med, 2007, 48(11): 1761-1766.
[22] Komori T, Narabayashi I, Matsumura K, et al. 2-[Fluorine-18]-fluoro-2-deoxy-D-glucose positron emission tomography/ computed tomography versus whole-body diffusion-weighted MRI for detection of malignant lesions: initial experience. Ann Nucl Med, 2007, 21(4): 209-215.
[23] Chen YK, Su CT, Chi KH, et al. Utility of18F-FDG PET/CT uptake patterns in Waldeyer's ring for differentiating benign from malignant lesions in lateral pharyngeal recess of nasopharynx. J Nucl Med, 2007, 48(1): 8-14.
(本文编辑 周立波)
Imaging of18F-FDG PET/CT in Adult Onset Still's Disease
PurposeThe diagnosis of adult onset Still's disease (AOSD) is usually difficult due to the lack of specific clinical manifestation. This paper summarizes the manifestations of18F-FDG PET/CT in adult onset Still's disease and investigates the value of PET/CT in diagnosis and differential diagnosis of AOSD.Materials and MethodsFiftyfour patients who was diagnosed as AOSD were selected and underwent18F-fluorodeoxyglueosepositron emission tomography/computed tomography (18F-FDG PET/CT). The clinical features, laboratory examination and the maximum standard uptake value (SUVmax) of liver, spleen, bone marrow, lymph node were collected. Then the main PET/CT manifestations of patients with AOSD, the influence factor of SUVmax and correlation between SUVmax and laboratory indexes were analyzed.ResultsFDG accumulation occurred mainly in bone marrow (88.89%; SUVmax: 3.91±1.16), spleen (79.63%, SUVmax: 3.24±0.89) and lymph node (77.78%; SUVmax: 3.83±1.97). FDG accumulation can also occurred in joints, parotid gland, submandibular gland, pleural and other organs. Compared with the nonglucocorticoid group, SUVmax of the spleen, bone marrow and lymph node were significantly decreased in the glucocorticoid group with or without fever (P<0.05), whereas the SUVmax of liver, spleen, bone marrow and lymph node between the two glucocorticoid groups were not statistically different (P>0.05). The SUVmax of liver, spleen, bone marrow and lymph node between two groups with or without disease-modifying anti-rheumatic drugs were not statistically different (P>0.05). Correlation analysis showed that spleen SUVmax and lactate dehydrogenase, bone marrow SUVmax and C reactive protein were weakly correlated (r=0.33 and 0.30, P<0.05).ConclusionThe main manifestations of18F-FDG PET/CT of AOSD are FDG accumulation in spleen, bone marrow and lymph nodes. Glucocorticoid can reduce the SUVmax.18F-FDG PET/CT can help to rule out malignancy, guide biopsy and assist in definite diagnosis of AOSD.
Still's disease, adult-onset; Positron-emission tomography; Tomography, X-ray computed; Fluorodeoxyglucose F18
1.解放军总医院风湿科 北京 100853
2.解放军总医院核医学科 北京 100853
张江林
Department of Rheumatology, PLA General Hospital, Beijing 100853, China
Address Correspondence to: ZHANG Jianglin
E-mail: zhjl1966@vip.sina.com
R817.4;R593.9
2016-12-22
修回日期:2017-01-21
中国医学影像学杂志
2017年 第25卷 第3期:216-221
Chinese Journal of Medical Imaging
2017 Volume 25 (3): 216-221
10.3969/j.issn.1005-5185.2017.03.014
