基于体素内不相干运动成像定量评估CO中毒急性期脑损伤程度的初步研究
2017-06-05张艳利ZHANGYanli
张艳利 ZHANG Yanli
王天红 WANG Tianhong
田小雪 TIAN Xiaoxue
周超宁 ZHOU Chaoning
刘兆东 LIU Zhaodong
王少彧 WANG Shaoyu
雷军强 LEI Junqiang
基于体素内不相干运动成像定量评估CO中毒急性期脑损伤程度的初步研究
张艳利 ZHANG Yanli
王天红 WANG Tianhong
田小雪 TIAN Xiaoxue
周超宁 ZHOU Chaoning
刘兆东 LIU Zhaodong
王少彧 WANG Shaoyu
雷军强 LEI Junqiang
目的运用体素内不相干运动(IVIM)成像技术对CO中毒急性期脑损害程度进行定量评估。资料与方法收集2015年10月—2016年4月于兰州大学第一医院诊断为急性CO中毒患者26例(中毒组)及18例年龄、性别相匹配的健康体检者(对照组)。比较两组间不同脑区D值、D*值及f值的差异,并获得定量评估最佳临界值。分析组内意识状态与脑部易损区(苍白球)D值、f值间的相关性。结果与对照组相比,中毒组各感兴趣区D值、f值呈减低趋势。其中组间半卵圆中心、苍白球区及丘脑f值,半卵圆中心、侧脑室旁、胼胝体压部及苍白球区D值差异有统计学意义(P<0.05);其最佳临界值、敏感度、特异度依次为f半= 51%、77%、73%,f苍=61%、77%、83%,f丘=80%、85%、64%,D半=0.69×10-3mm2/s、85%、83%,D侧=0.65×10-3mm2/s、73%、89%,D胼=0.68×10-3mm2/s、62%、83%,D苍= 0.70×10-3mm2/s、81%、89%。组内意识障碍程度与苍白球区D值、f值下降呈正相关(rD=0.828、rf=0.745,P<0.05)。结论IVIM成像参数值D值、f值可定量评估CO中毒急性期脑损伤程度。
脑损伤;急性病;一氧化碳中毒;磁共振成像;体素内不相干运动
CO中毒主要引起组织缺氧。大脑由于吻合支少且代谢旺盛,故最易受到损害。中毒后急性期的主要病理改变为缺氧、脑血液循环障碍和脑组织水肿。如何使用无创手段监测到以上病理变化,从而为临床治疗方案的制订提供客观依据,对患者临床早期进行高压氧治疗以纠正缺氧、给予脱水治疗防治脑水肿意义重大。目前关于CO中毒的MRI研究集中于MRI平扫、扩散加权成像(DWI)和扩散张量成像(DTI)等序列,研究对象主要为亚急性期及慢性期患者,而急性期脑损伤的相关研究较少[1]。体素内不相干运动成像(incoherent motion intravoxel imaging,IVIM)作为扩散成像的衍生序列,除可获得扩散信息外,还可获得灌注信息,得到包括D、D*及f值在内的定量参数值[2]。同时该法无需造影剂,故具有重要的临床应用价值。本研究运用MRI新技术,即IVIM作为研究工具,研究对象设定为CO中毒急性期患者。通过对其不同感兴趣区(ROI)脑水肿、微循环灌注进行定量评估,以期为临床早期诊疗提供依据。
1 资料与方法
1.1 研究对象 收集2015年10月—2016年4月于兰州大学第一医院住院的急性CO中毒患者26例(中毒组),男15例,女11例;年龄24~78岁,平均(52.5±11.2)岁。同时,选取18例年龄、性别相匹配的健康体检者作为对照组。纳入标准:①按照国家诊断标准(GB87-88)诊断为急性CO中毒:患者具有较高浓度CO的接触史和急性发生的中枢神经损害的症状和体征,结合血中碳氧血红蛋白(carboxyhemoglobin,COHb)测定的结果,并排除其他病因后可诊断急性CO中毒[3];②中毒7 d以内。排除标准:①既往有脑炎、脑外伤、脑血管病、代谢性脑病、癫痫、精神疾病等病史;②发生迟发脑病;③非CO的其他气体中毒;④婴幼儿患者。
中毒原因:炭火取暖7例、煤炉燃烧19例。临床表现:轻者表现为不同程度头痛、头晕、恶心、呕吐、心悸和四肢无力,中重度患者主要表现为不同程度意识障碍和呼吸障碍。主要根据格拉斯哥昏迷量表(Glasgow outcome scale,GCS)[4]判断意识状态并获得GCS得分。中毒组中18例意识障碍(GCS得分为3~14分),其中轻度昏迷3例、中度昏迷9例、重度昏迷6例;8例意识清醒(GCS得分15分)。COHb定性测量,阳性9例、假阳性6例、阴性11例。所有患者均经入院常规检查、神经专科检查,获得知情同意后进行MR 平扫、DWI 及IVIM 检查。
1.2 仪器与方法 使用Siemens Skyra 3.0T MR扫描仪,对中毒组及对照组行头颅T1WI、T2WI、DWI、IVIM轴位扫描及T1WI矢状位扫描。其中T1WI扫描参数:TR 250 ms,TE 2 ms,层厚5 mm,层距6.5 mm;视野(FOV)255×255。T2WI扫描参数:TR 6000 ms,TE 99 ms,层厚 5 mm,层距 6.5 mm,FOV 240×240。DWI扫描参数:TR 5100 ms,TE 64 ms,层厚 5 mm,层距6.5 mm,FOV 160×160,b值取0和1000 s/mm2。IVIM扫描参数:TR 6400 ms,TE 98 ms,层厚 3 mm,层距3.9 mm,FOV 192×192,b值分别取0、50、100、150、200、300、400、600、800、1000 s/mm2。
1.3 图像分析 使用MITK Diffusion软件对IVIM图像进行后处理。由2名放射科主治医师参考T1、T2、tirm及DWI图在IVIM原始图像上共同商讨、手动勾勒ROI的范围。共选择6组15个ROI:①半卵圆中心;②侧脑室旁;③外周白质(ROI分别位于额叶、顶叶、颞叶、枕叶);④深部白质(胼胝体膝部、压部、干部);⑤深部灰质(苍白球、壳、丘脑);⑥幕下(小脑、中脑、脑干)。所有ROI区双侧对称放置(除胼胝体、中脑及脑干),测量3次求平均值。不同部位平均体素分别为:半卵圆中心约1090 mm3、侧脑室旁632 mm3、外周白质90 mm3、深部白质220 mm3、深部灰质152 mm3、小脑376 mm3、中脑80 mm3、脑桥280 mm3。
1.4 统计学方法 采用 SPSS 22.0软件。对数值变量行正态性检验。分类资料采用构成比的χ2检验或Fisher确切概率法。年龄、昏迷时间、GCS得分、MR检查结果以及中毒组与对照组间不同部位D值、f值及D*间的比较均采用独立样本t检验;意识状态与中毒易损区(苍白球)D值、f值的相关性采用Spearman等级相关分析。P<0.05表示差异有统计学意义。
2 结果
2.1 MRI检查结果 本研究所纳入的26例急性CO中毒患者中,MRI平扫及DWI图显示阳性患者17例,阴性患者9例。在MRI检查阳性组中,仅苍白球区出现病灶者14例,且病灶多呈对称性分布,表现为长T1长T2信号灶,DWI呈高信号,呈典型“熊猫眼”征(图1);2例病灶为单侧。仅在白质区出现病灶者2例,1例累及范围为半卵圆中心、侧脑室旁白质,1例为颞枕叶皮层区;苍白球、白质同时发现病灶者1例。
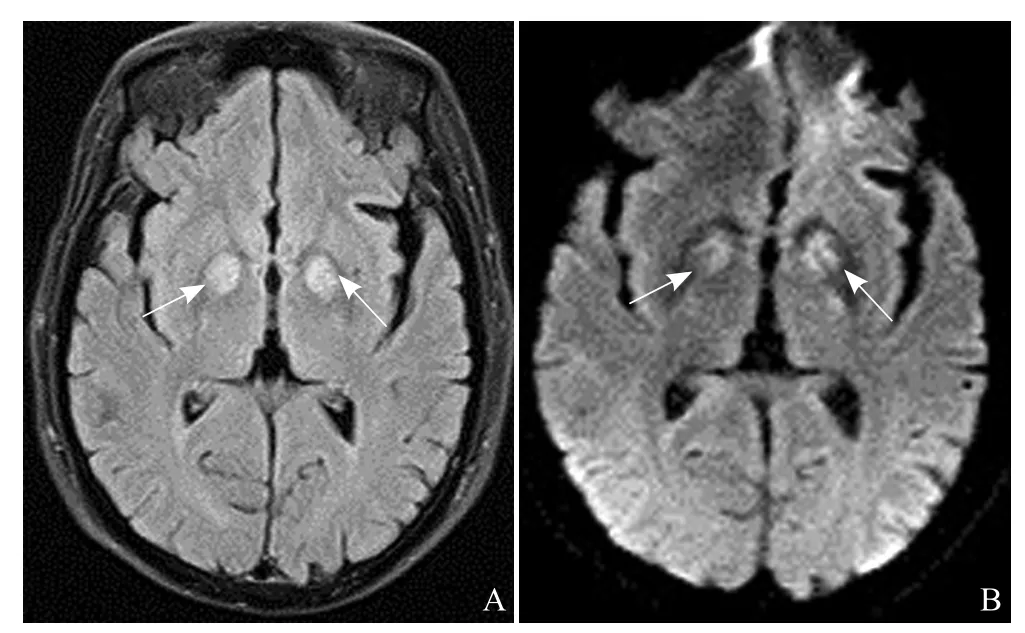
图1 男,51岁,煤烟中毒后8 h。tirm图(A)、DWI图(B)双侧苍白球区可见对称性高信号呈“熊猫眼征”(箭)
2.2 MRI临床影响因素 DWI阳性结果患者的昏迷时间较长、GCS得分较低(P<0.05),临床影响因素见表1。
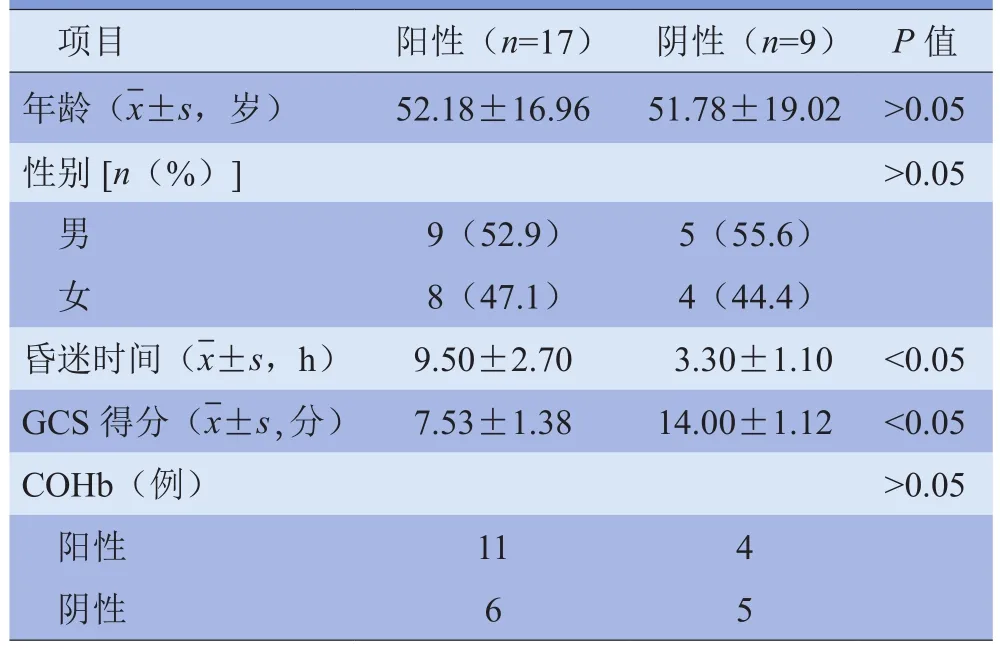
表1 DWI阳性结果的临床影响因素
2.3 两组不同部位D、D*、f值的比较 对同一ROI进行3次测量时,D*值的变化范围较大,可重复性差;D值、f值的可重复性较好。ROI划取及参数值显示见图2。与对照组比较,中毒组各部位D值、f值呈减低趋势。其中半卵圆中心、苍白球及丘脑f值,半卵圆中心、侧脑室旁、胼胝体压部、苍白球区D值差异均有统计学意义(P<0.05)。其最佳临界值、敏感度、特异度依次为:f半=51%、77%、73%,f苍=61%、77%、83%、f丘=80%、85%、64%,D半= 0.69×10-3mm2/s、85%、83%,D侧=0.65×10-3mm2/s、73%、89%,D胼= 0.68×10-3mm2/s、62%、83%,D苍= 0.70×10-3mm2/s、81%、89%。中毒组与对照组不同部位的D、D*及f值见表2。
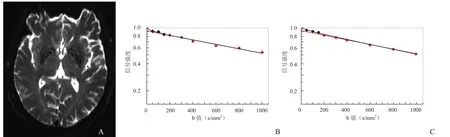
图2 女,36岁,煤烟中毒后13 h。IVIM原始图及感兴趣区的测量(A);左侧苍白球IVIM参数值图(B);右侧苍白球IVIM参数值图(C)。f左=7.16%,D左=0.57×10-3mm2/s,D*左=14.41×10-3mm2/s;f右=6.16%,D右=0.59×10-3mm2/s,D*右=6.96×10-3mm2/s
2.4 意识状态与苍白球区D值、f值的相关性 26例CO中毒患者中,18例出现意识障碍,主要表现为嗜睡、昏睡及浅昏迷,其中17例在MRI常规检查中呈阳性结果;8例意识清醒,在MRI常规检查中均呈阴性结果。意识状态与苍白球区D值、f值的下降呈正相关(rD= 0.828、rf=0.745,P<0.05),见图3。
3 讨论
CO中毒是常见的生活中毒和职业中毒,中毒后症状轻者仅表现为头晕、头痛;重者则出现视野缺损、不同程度意识障碍甚至死亡。以往研究将CO中毒分为4期:超期急性(<24 h)、急性期(24 h~7 d)、亚急性期(8~21 d)和慢性期(>22 d)[5];而在急性期,中毒主要造成脑组织广泛缺氧和缺血[6]。
对于CO中毒急性期患者脑部病变的检出,MR较CT具有更高的敏感性[7]。损伤部位主要为苍白球或白质,尤其是侧脑室旁白质,其次为丘脑、海马等部位[8-9]。本组病例中,苍白球区病灶出现率约为88.2%,原因可能为:一方面苍白球区供血动脉为终末小动脉,缺乏丰富的侧支血管,因此当组织缺氧缺血时,无法获得较好的血供代偿,易受缺血影响而造成损伤;另一方面,由于脑内苍白球区含铁最丰富,CO可直接与该处的血红素铁结合,造成苍白球缺氧损伤[10]。
然而,并非所有CO中毒患者急性期MRI均会出现阳性病灶。本研究中,9例患者在MRI平扫及DWI上表现为阴性。分析患者性别、年龄、中毒后意识不清持续时间、早期GCS得分、COHb结果与MRI阳性结果的关系,结果显示意识不清持续时间较长、早期GCS得分减低是MR检查阳性的影响因素。意识不清持续时间越长、早期GCS得分越低(P<0.05),表明患者脑缺氧、缺血程度越重。脑内ATP消耗越多,钠泵运转失常明显。另外,缺氧造成脑内酸性代谢产物蓄积越多,两者诱发脑细胞毒性水肿及脑组织间质水肿越显著,因而常规MRI及DWI越容易出现阳性结果。本研究结果显示,COHb含量并非MRI检查结果阳性的影响因素,这与以往研究报道动脉血COHb含量与CO中毒的严重程度不相关的结论一致[11-12],推测原因在于当患者撤离中毒环境或给予高压氧治疗后,血液中的COHb含量下降。另外,在Lu等[13]关于CO中毒的单光子发射计算机体层摄影研究结果也显示,COHb含量与CO中毒脑损伤无相关性。
表2 急性CO中毒患者与对照组不同部位D、D*及f值(±s)

表2 急性CO中毒患者与对照组不同部位D、D*及f值(±s)
注:与对照组比较,*P<0.05
部位 f值(%) D值(10-3mm2/s) D*值(10-3mm2/s)中毒组 对照组 中毒组 对照组 中毒组 对照组半卵圆中心 4.85±0.57* 6.34±0.59 0.62±0.07* 0.73±0.05 9.58±1.70 10.95±1.99侧脑室旁 5.22±0.42 5.57±0.46 0.62±0.05* 0.74±0.08 7.29±0.98 8.63±2.04外周白质额叶 5.78±1.02 6.48±0.68 0.71±0.06 0.74±0.06 9.57±1.01 10.44±1.29顶叶 5.64±1.47 6.89±1.37 0.77±0.03 0.80±0.03 7.94±2.19 9.96±2.79枕叶 5.30±0.32 5.32±0.39 0.79±0.07 0.80±0.04 7.32±2.37 8.21±3.32颞叶 5.25±0.84 5.72±0.36 0.71±0.13 0.81±0.05 7.13±1.25 8.12±0.67深部白质胼胝体膝 5.69±0.41 5.83±0.40 0.73±0.07 0.75±0.70 8.98±1.25 9.29±1.19胼胝体压 5.20±0.38 5.33±0.43 0.67±0.06* 0.73±0.05 8.58±1.58 9.36±0.80胼胝体干 5.36±1.16 5.21±1.62 0.69±0.05 0.76±0.05 8.69±1.13 9.64±1.62深部灰质苍白球 5.34±0.78* 8.89±0.55 0.63±0.09* 0.78±0.05 7.60±0.90 8.39±0.58壳核 7.18±1.18 7.56±0.61 0.69±0.04 0.71±0.03 8.34±3.04 9.20±3.62丘脑 6.02±2.21* 8.06±0.60 0.72±0.05 0.73±0.04 8.57±4.01 8.66±1.52幕下中脑 7.07±1.01 7.17±1.78 0.67±0.06 0.68±0.05 8.07±2.39 9.67±1.66脑桥 6.62±1.25 6.71±1.07 0.65±0.08 0.66±0.04 9.07±3.43 9.22±3.04小脑 5.85±1.38 6.19±1.62 0.59±0.12 0.62±0.08 6.81±1.23 8.17±1.70
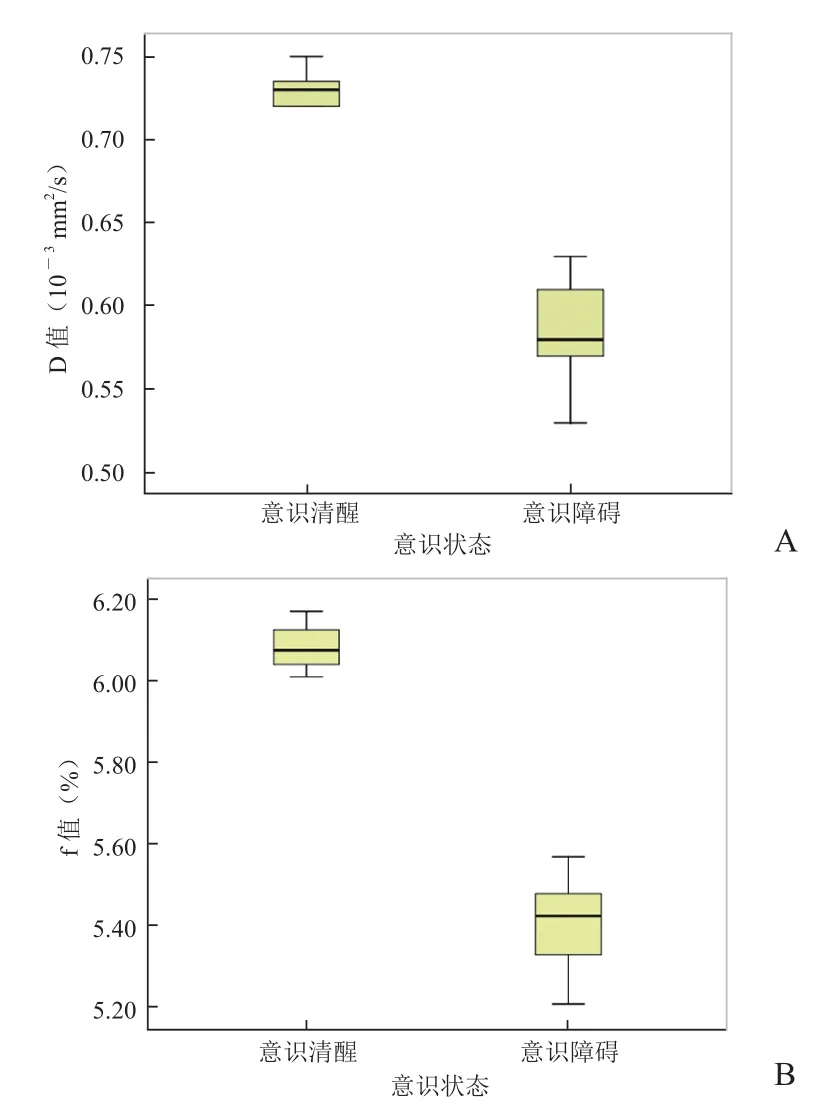
图3 意识状态和苍白球区D值、f值的Boxplots图。意识障碍组D值(A)、f值(B)中位数的位置明显低于意识清醒组,且变量值极差较大
IVIM是扩散成像的衍生序列,不同于经典的DWI单指数模型。IVIM成像基于双e指数模型原理,通常使用10个以上的b值,获得快扩散D*、慢扩散D、快扩散对应的比例系数f值共3个参数值。目前研究表明,IVIM在反映脑灌注改变中的应用具有可行性[14-15];而对于IVIM参数值D*、f与磁敏感动态增强所得灌注参数值的相关性尚有争论。Federau等[16]认为参数值D*、f与灌注参数值MTT-1、CBV呈正相关。Wu等[17]通过对IVIM、磁敏感动态增强及动脉自旋标记成像等模型间的比较,发现在不同信噪比条件下,f值与CBV相关性较好(r=0.29~0.48,P<0.05),D*值的可变性较大(灰质平均误差/变异率为100%/30%,白质平均误差/变异率为300%/60%)。本研究发现对同一ROI做3次测量时,D*值变化范围较大,即其测定的可重复性较差,而f值与D值的可重复性较好,这与Wu等[17]的研究结果一致。
本研究对象设定为CO中毒后1~7 d的患者。研究结果显示,脑实质各部位D值、f值均呈减低趋势,证实了在中毒急性期脑部存在细胞毒性水肿及灌注减低的病理变化。同时,本研究结果显示苍白球区D值评价CO中毒脑损伤的敏感度、特异度最高(81%、89%),推测其与苍白球是急性CO中毒易损区有关。Chen等[18]使用DWI检测CO中毒急性期患者与正常人脑部各部位ADC均数值的差异,同样发现急性期苍白球区ADC值差异有统计学意义;Lu等[13]通过对96例急性CO中毒患者行99Tcm-HMPAO SPECT检查发现,82.3%的患者存在灌注异常,主要部位为苍白球区(54.2%)、颞叶(50.0%)、顶叶(45.8 %)、额叶(31.2%)、枕叶(21.9%)及丘脑(8.3%),其中苍白球区、丘脑区存在灌注减低的结果与本研究相符。国内动物模型实验对14只家兔分别于中毒后1 h、3 d、5 d、7 d行MR灌注加权成像,并在海马层面选取ROI测量灌注参数值。结果显示14只家兔在中毒后1~7 d出现不同程度的血容量、血流量及平均通过时间减少[19]。同时,本研究显示幕上较幕下更易受到CO中毒损害,提示幕下对缺氧更具耐受力。以往报道也表明幕下出现病灶表明患者有严重的缺氧和低血压[20];而CO中毒幕下出现病灶者较少,仅有个案报道[21]。作为急性CO中毒的易损区,本研究讨论意识状态与苍白球区D 值、f值的相关性。结果显示,意识障碍的出现与苍白球区D值、f值减低呈明显正相关(rD=0.828、rf=0.745,P<0.05),表明与意识清醒组患者相比,意识障碍组患者细胞毒性水肿更明显,脑缺血更严重。此外,本研究结果显示深部灰质(苍白球、丘脑)f 值减低最明显,这是因为脑灰质较白质的耗氧量多5倍,对缺氧的耐受性更差。
总之,IVIM可作为一种无创手段用于评价CO中毒急性期患者脑部损害情况。半卵圆中心及苍白球区f值、D值,丘脑f值以及侧脑室旁、胼胝体压部D值的减低为CO中毒1~7 d患者脑细胞肿胀和微循环缺血等病理生理改变提供了一定的定量评估证据。同时,对于CO中毒急性期苍白球区f值<61%、D值<0.70×10-3mm2/s的患者已存在脑部损害,临床应引起足够重视,并给予积极治疗。最后,由于苍白球区f值、D值的减低程度与患者存在意识障碍呈正相关,证实患者早期意识障碍程度越重,其脑损害程度将越严重。由于本研究样本量较少,后续研究中将继续扩大样本量以提高研究结果的准确性;另外,系列研究还将结合患者预后做进一步探讨。
[1] Beppu T. The role of MR imaging in assessment of brain damage from carbon monoxide poisoning: a review of the literature. Am J Neuroradiol, 2014, 35(4): 625-631.
[2] Le Bihan D, Breton E, Lallemand D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging. Radiology, 1988, 168(2): 497-505.
[3] 陆再英, 钟南山. 内科学. 第7版. 北京: 人民卫生出版社, 2008: 936-937.
[4] McMillan T, Wilson L, Ponsford J, et al. The Glasgow outcome scale-40 years of application and refinement. Nat Rev Neurol, 2016, 12(8): 477-485.
[5] Hantson P, Duprez T. The value of morphological neuroimaging after acute exposure to toxic substances. Toxicol Rev, 2006, 25(2): 87-98.
[6] Kara H, Bayir A, Ak A, et al. Cerebrovascular ischaemia after carbon monoxide intoxication. Singapore Med J, 2015, 56(2): e26-e28.
[7] Stephen RA, Donal SW, Siobhain OB, et al. Carbon monoxide poisoning: Novel magnetic resonance imaging pattern in the acute setting. Int J Emerg Med, 2012, 5(1): 30.
[8] Parkinson RB, Hopkins RO, Cleavinger HB, et al. White matter hyperintensities and neuropsychological outcome following carbon monoxide poisoning. Neurology, 2002, 58(10): 1525-1532.
[9] Gale SD, Hopkins RO, Weaver LK, et al. MRI, quantitative MRI, SPECT, and neuropsychological findings following carbon monoxide poisoning. Brain Inj, 1999, 13(4): 229-243.
[10] Kinoshita T, Sugihara S, Matsusue E, et al. Pallidoreticular damage in acute carbon monoxide poisoning: diffusionweighted MR imaging findings. Am J Neuroradiol, 2005, 26(7): 1845-1848.
[11] Hampson NB, Piantadosi A, Thom SR, et al. Practice recommendations in the diagnosis, management, and prevention of carbon monoxide poisoning. Am J Respir Crit Care Med, 2012, 186(11): 1095-1101.
[12] Onodera M, Fujino Y, Kikuchi S, et al. Utility of the measurement of carboxyhemoglobin level at the site of acute carbon monoxide poisoning in rural areas. Scientifica (Cairo), 2016, 2016: 6192369.
[13] Lu YY, Tsai SC, Kao CH, et al. Regional cerebral blood flow in patients with carbon monoxide intoxication. Ann Nucl Med, 2012, 26(10): 771-776.
[14] Federau C, Maeder P, O'brien K, et al. Quantitative measurement of brain perfusion with intravoxel incoherent motion MR imaging. Radiology, 2012, 265(3): 874-881.
[15] Le Bihan D. Intravoxel incoherent motion perfusion MR imaging: a wake-up call. Radiology, 2008, 249(3): 748-752.
[16] Federau C, O'brien K, Meuli R, et al. Measuring brain perfusion with intravoxel incoherent motion (IVIM): initial clinical experience. J Magn Reson Imaging, 2014, 39(3): 624-632.
[17] Wu WC, Chen YF, Tseng HM, et al. Caveat of measuring perfusion indexes using intravoxel incoherent motion magnetic resonance imaging in the human brain. Eur Radiol, 2015, 25(8): 2485-2492.
[18] Chen NC, Huang CW, Lui CC, et al. Diffusion-weighted imaging improves prediction in cognitive outcome and clinical phases in patients with carbon monoxide intoxication. Neuroradiology, 2013, 55(1): 107-115.
[19] 黄冰. MR灌注加权成像在兔脑急性CO中毒中的应用研究.南昌: 南昌大学, 2006.
[20] O'Donnell P, Buxton PJ, Pitkin A, et al. The magnetic resonance imaging appearances of the brain in acute carbon monoxide poisoning. Clin Radiol, 2000, 55(4): 273-280.
[21] Hamcan S, Akgun V, Yilmaz O, et al. Isolated cerebellar damage caused by carbon monoxide intoxication. BMJ Case Rep, 2013, 2013.
(本文编辑 闻 浩)
Quantitative Assessment of Brain Damage in Acute Phase Carbon Monoxide Poisoning Using Intravoxel Incoherent Motion Imaging
PurposeTo quantitatively evaluate the severity of brain damage in the acute phase of CO poisoning using intravoxel incoherent motion imaging.Materials and MethodsMRI scans were performed in 26 patients with CO intoxication of acute stage and 18 healthy controls with matched age and gender. The difference of D value, D* value and f value in different ROIs between the poisoning and the control groups were compared, and the best cut-off values were determined. The correlation between the consciousness state and the D value as well as f value in the vulnerable area of the brain (globus pallidus) was analyzed.ResultsCompared with control group, the D and F value of the poisoning group were decreased in multiple ROIs, of which statistical significance was observed in the f values in the centrum semiovale, globus pallidus and thalamus, and the D values in the centrum semiovale, lateral ventricle, globus pallidus and corpus callosum splenium (P<0.05). The best cut-off value, sensitivity and specificity were as follows: fcs=51%, 77%, 73%; fga=61%, 77%, 83%; ft=80%, 85%, 64%; Dcs=0.69×10-3mm2/s, 85%, 83%; Dlv=0.65×10-3mm2/s, 73%, 89%; Dga=0.68×10-3mm2/s, 62%, 83%; Dccs=0.70×10-3mm2/s, 81%, 89%. The disturbance of consciousness was positively correlated with decrease of D value and f value (rD=0.828, rf=0.745, P<0.05).ConclusionThe D and f values of intravoxel incoherent motion imaging can quantitatively evaluate the brain damage severity in acute CO poisoning.
Brain injuries; Acute disease; Carbon monoxide poisoning; Magnetic resonance imaging; Intravoxel incoherent motion
兰州大学第一医院放射科 甘肃兰州730000
雷军强
Department of Radiology, the First Hospital of Lanzhou University, Lanzhou 730000, China
Address Correspondence to: LEI Junqiang
E-mail: leijq1990@163.com
R445.2;R595.1
2016-10-18
修回日期: 2016-12-21
中国医学影像学杂志
2017年 第25卷 第3期:185-189,195
Chinese Journal of Medical Imaging
2017 Volume 25 (3): 185-189, 195
10.3969/j.issn.1005-5185.2017.03.007
