TLR9激动剂对约氏疟原虫体液免疫记忆的影响
2017-06-01刘英杰
季 迁, 刘英杰
(1.沈阳医学院 附属卫生学校,辽宁 沈阳 110034;2.中国医科大学基础医学院 病原生物学教研室,辽宁 沈阳 110122)
TLR9激动剂对约氏疟原虫体液免疫记忆的影响
季 迁1, 刘英杰2*
(1.沈阳医学院 附属卫生学校,辽宁 沈阳 110034;2.中国医科大学基础医学院 病原生物学教研室,辽宁 沈阳 110122)
为探讨TLR9激动剂对疟疾体液免疫记忆的影响,用非致死型约氏疟原虫感染BALB/c小鼠,感染前2 d注射TLR9激动剂CpGl826,90 d后进行二次感染。薄血膜染色法观察红细胞感染率,流式细胞术检测脾细胞悬液中记忆性和活化性B细胞百分比,双夹心ELISA法检测特异性抗体水平。结果显示,二次感染前,TLR9激动剂处理鼠记忆性和活化性B细胞以及抗体水平略高于对照组;二次感染后,其再感染发生率和虫血症水平均略低于对照组;活化性B细胞和抗体以及记忆性B细胞也分别于二次感染后1 d和3 d出现了有意义的升高,且升高幅度均略高于对照组。表明TLR9激动剂对约氏疟原虫感染后体液免疫记忆的建立和维持有一定促进作用。
TLR9激动剂;约氏疟原虫;记忆性B细胞;体液免疫
疟原虫感染所致的疟疾流行于100多个国家和地区,是一种高发的寄生虫病,2015年全球新增病例200多万,有数10万人因罹患此病而死亡[1]。研发有效疫苗是防控疟疾最为有效的措施之一,而探明影响疟疾免疫记忆建立与维持的相关因素是研发有效疫苗的前提和基础。树突状细胞(Dendritic Cell, DC)是唯一能够活化初始 T 细胞的专职抗原递呈细胞,也是连接固有和适应性免疫应答的桥梁细胞。研究表明,Toll样受体 (Toll like receptor,TLR)是DC识别疟原虫抗原的主要模式识别受体,其表达水平直接介导DC对效应细胞活化状态的调控,进而影响免疫记忆的建立与维持[2-3]。然而有关TLR9激动剂是否能直接促进疟疾体液免疫记忆的建立与维持却少有报道。观察宿主抵御再感染的状况可直接判定其免疫记忆的时效性。间日疟原虫在我国流行最为广泛,其生物学特征与非致死型约氏疟原虫(Plasmodiumyoelii17XNL,P.y17XNL)具有一定相似性[4]。为此,本研究拟建立P.y17XNL 鼠疟模型,并给予外源性TLR9激动剂,通过再感染状况观察并分析其与记忆性B细胞及活化性B细胞数量变化的关系,进一步探讨TLR9激动剂在疟疾体液免疫记忆建立与维持过程中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物和疟原虫感染 雌性BALB/c小鼠,1.5~2月龄(中科院实验动物研究所),腹部感染P.y17XNL寄生的红细胞(1×106个);感染前2 d,小鼠经胫骨前肌肉分别注射CpGl826(Takara)和CpGl982(对照),50 μg/只。90 d后,用同数量疟原虫对小鼠进行第二次感染。
1.1.2 血清与脾细胞采集 正常对照鼠和二次感染前(0 d)小鼠以及二次感染后1、3、5 d小鼠经心脏采血1 mL左右,同时取出小鼠脾脏(5 d除外)。室温条件下,血液静置30 min后离心,收集血清,-80 ℃保存待抗体检测。脾脏在200目筛网上研磨后,用含5% FCS 的RPMI1640细胞培养液制成悬液,350 g离心10 min,红细胞裂解液去除红细胞,以含10% FCS 的RPMI1640悬浮细胞,调细胞密度为1×107/mL,待后续染色与检测。
1.2 方法
1.2.1 小鼠感染状态观察 感染不同时间点小鼠经尾尖取血,涂薄血膜,吉姆萨染色10 min,光镜下计数红细胞感染率。
1.2.2 血清特异性IgG抗体检测 用质量浓度为10 μg/mL的P.y17XNL抗原包被酶标板,4 ℃过夜,5%FCS封闭,洗涤后加入1∶100稀释的抗血清,37 ℃ 2 h。洗涤后加入1∶500稀释的HRP-羊抗鼠IgG,37 ℃ 1 h,加OPD-H2O2底物显色15 min,酶标仪检测490 nm处OD值。
1.2.3 记忆性和活化性B细胞数量检测 待测脾细胞悬液0.1 mL中加入PerCP-conjugated anti-mouse B220 mAb(BD Pharmingen),然后再加入FITC-conjugated anti-mouse IgG mAb(BD Pharmingen)用于检测记忆性B细胞;而加入PerCP-conjugated anti-mouse B220 mAb,然后再加入PE-conjugated anti-mouse CD69 mAb(BD Pharmingen)用于检测活化性B细胞。4 ℃避光染色30 min,以含1% FCS的PBS洗涤2次,用500 μL含2%多聚甲醛的PBS悬浮固定,流式细胞分析仪检测,利用FlowJo7.6.3软件进行数据分析。
1.2.4 数据统计与分析 数据经t试验,P<0.05为差异显著。
2 结果与分析
2.1 TLR9激动剂对虫血症水平的影响
初次感染后3 d可见疟原虫感染的红细胞出现于薄血膜上,随后感染率逐渐增加,于感染后13 d达到峰值,但TLR9激动剂处理组的感染率于感染15 d后下降较快,大部分小鼠于感染后19 d自愈(图1A);第二次感染后,TLR9激动剂处理组和对照组的10只鼠中分别有5只(50%)和7只(70%)出现疟原虫感染的红细胞,且前者的感染率水平也略低于后者(图1B)。这表明,TLR9激动剂对控制初次感染后期虫血症水平以及降低再感染发生率和红细胞感染率均具有一定作用。
2.2 TLR9激动剂对血清中特异性IgG水平的影响
抵御再感染的发生主要依赖特异性抗体。第二次感染前后不同时间点的特异性IgG水平见图2。与未感染的正常小鼠相比,TLR9激动剂处理组及对照组的血清中在二次感染前就存在一定水平的特异性IgG,但前者的水平略高于对照组;二次感染后1 d这些抗体均明显增加(P<0.01);二次感染后3 d,TLR9激动剂处理组的水平明显高于对照组(P<0.05)。由此提示,TLR9激动剂对于体液免疫记忆的维持以及再感染后体液免疫应答强度的提高均具有一定作用。
2.3 TLR9激动剂对活化性B细胞数量的影响
图3表明,二次感染前,TLR9激动剂处理组脾细胞中活化性B细胞百分比略高于对照组。感染后1 d,TLR9激动剂处理组的水平和对照组均出现了有意义的升高(P<0.05),但感染后3 d,前者比对照组升高更为显著(P<0.05)。由此进一步证明TLR9激动剂通过促进效应细胞数量增加而提高体液免疫应答强度,这与抗体的变化趋势也完全吻合。
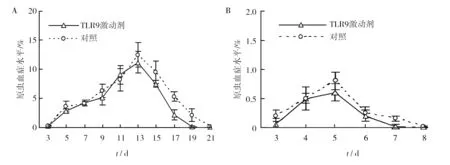
图1 初次感染红细胞感染率(A)和二次感染红细胞感染率(B)
2.4 TLR9激动剂对记忆性B细胞数量的影响
图4显示,二次感染前,TLR9激动剂处理组脾细胞中记忆性B细胞百分比略高于对照组,二次感染后3 d,两者均出现了有意义的升高(P<0.01),但在每一检测时点,TLR9激动剂处理组记忆性B细胞的水平均略高于对照组(尽管没有统计学意义),这表明TLR9激动剂对记忆性B细胞的形成和数量维持均具有一定促进作用。
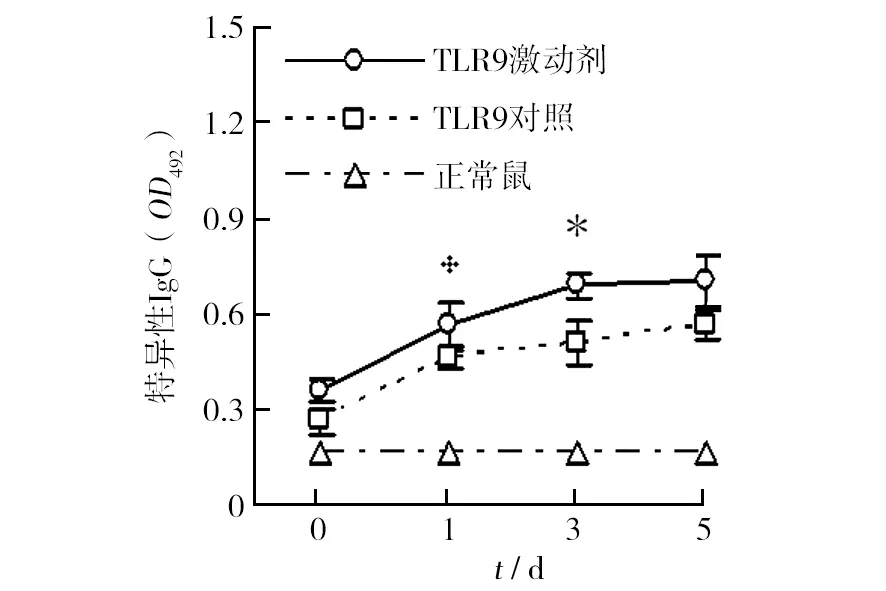
图2 P.y17XNL二次感染不同时间点特异性IgG水平Fig.2 The levels of specific IgG at different time points from mice after reinfection with P.y17XNL

图3 P.y17XNL二次感染0、1和3 d活化性B细胞百分比Fig.3 The percentage of actived B cells on day of 0, 1 and 3 after reinfection with P.y17XNL

图4 P.y17XNL二次感染0、1和3 d记忆性B细胞百分比Fig.4 The percentage of memory B cells on day of 0, 1 and 3 after reinfection with P.y17XNL
3 讨 论
疟疾反复感染在流行区极为常见,导致这一现象发生的根本原因之一是人体不能建立持久的免疫记忆。影响免疫记忆的主要因素可能在于疟原虫对宿主免疫系统产生的抑制效应,其中包括对DC成熟和功能的抑制[5]。TLR是DC识别疟原虫抗原的主要模式识别受体。作为多受体家族的一员,TLR9主要识别疟原虫的DNA和疟色素[6]。在TLR9介导下,DC完成对疟原虫抗原的内化,随之上调共刺激分子等多种表面分子表达,进而介导建立初始免疫应答。虽然有研究表明,特异性抗体在防止发生再感染的过程中发挥不可或缺作用,疟原虫感染可刺激宿主产生体液免疫应答,并维持部分记忆性B细胞的存在[7];TLR9激动剂可促进恶性疟感染者产生记忆性B细胞[3];但也有资料显示,约氏疟原虫感染可诱发记忆性B细胞的消除[8];伯氏疟原虫通过干扰生发中心微环境而影响B细胞的免疫记忆反应[9]。我们的研究结果显示,外源性TLR9激动剂对控制初次感染后期虫血症水平具有一定作用,同时可维持一定水平的特异性抗体及一定数量记忆性B细胞持续存在。二次感染后,活化性B细胞数量迅速升高并分泌高水平特异性IgG,进而降低了再次感染的发生率和虫血症水平。活化性B细胞短时间内明显增加除与一些初始B细胞开始活化有关外,更主要的原因可能与TLR9激动剂促进初始感染后形成的记忆性B细胞迅速活化有关。有文献报道,少许记忆性T细胞和记忆性B细胞的存在,虽然不能彻底防止再感染的发生,但也能显著降低再感染的发生率与红细胞感染率[10-11]。这与我们的研究结果完全契合。
有实验证实,恶性疟原虫对免疫记忆形成具有明显抑制效应[12],而痊愈后的间日疟原虫感染者其免疫记忆可持续存在一定时间[13]。提示,疟原虫毒力强弱或许是影响免疫记忆建立与维持的因素之一。本研究以毒力较弱的非致死型约氏疟原虫鼠疟模型明确了TLR9激动剂对体液免疫记忆的建立和维持有一定促进作用,但毒力较强的致死型约氏疟原虫模型是否能得出相同结论尚需进一步证实。
[1] WHO. World Malaria Report 2016[EB/OL]. http://www.who.int/malaria/publications/world-malaria-report-2016/report/en/, 2017-01-15.
[2] Loughland JR, Minigo G, Burel J, et al. Profoundly reduced CD1c+myeloid dendritic cell HLA-DR and CD86 expression and increased tumor necrosis factor production in experimental human blood-stage malaria infection[J].Infect Immun, 2016,84(5):1403-1412.
[3] Crompton PD, Mircetic M, Weiss G, et al. The TLR9 ligand CpG promotes the acquisition ofPlasmodiumfalciparumspecific memory B cells in malaria-naive individuals[J]. J Immunol, 2009, 182(5):3318-3326.
[4] Schaecher K, Kumar S, Yadava A, et al. Genome-wide expression profiling in malaria infection reveals transcriptional changes associated with lethal and nonlethal outcomes[J]. Infect Immun, 2005, 73(9):6091-6100.
[5] Wykes MN. Why haven’t we made an efficacious vaccine for malaria? [J]. EMBO Rep, 2013, 14(8):661.
[6] Kar A, Panigrahi S, Tripathy S, et al. Influence of common variants of TLR4 and TLR9 on clinical outcomes ofPlasmodiumfalciparummalaria in Odisha, India[J]. Infect Genet Evol, 2015,36:356-362.
[7] Krishnamurty AT, Thouvenel CD, Portugal S, et al. Somatically hypermutated plasmodium-specific IgM(+) memory B cells are rapid, plastic, early responders upon malaria rechallenge[J]. Immunity, 2016, 45(2):402-414.
[8] Wykes MN, Zhou YH, Liu XQ, et al.Plasmodiumyoeliican ablate vaccine induced long-term protection in mice[J]. J Immunol, 2005, 175:2510-2516.
[9] Carvalho LJ, Ferreira-da-Cruz MF, Daniel-Ribeiro CT, et al. Germinal center architecture disturbance duringPlasmodiumbergheiANKA infection in CBA mice[J]. Malar J, 2007, 6:59.
[10]Stephens R, Albano FR, Quin S, et al. Malaria-specific transgenic CD4(+) T cells protect immunodeficient mice from lethal infection and demonstrate requirement for a protective threshold of antibody production for parasite clearance[J]. Blood, 2005, 106(5):1676-1684.
[11]Wipasa J, Hemsokana P, Ruankham T, et al. Investigation of memory responses followingPlasmodiumchabaudiAS infection in mice distinct in susceptibility to clinical malaria[J]. Parasitol Res, 2009,106(1):283-287.
[12]Sullivan RT, Kim CC, Fontana MF, et al. FCRL5 delineates functionally impaired memory B cells associated withPlasmodiumfalciparumexposure[J]. PLoS Pathog, 2015,11(5):e1004894.
[13]Jangpatarapongsa K, Sirichaisinthop J, Sattabongkot J, et al. Memory T cells protect againstPlasmodiumvivaxinfection[J]. Microbes Infect, 2006, 8(3):680-686.
Effect of TLR9 Agonist on Humoral Immune Memory duringPlasmodiumyoeliiInfection
JI Qian1, LIU Ying-jie2
(1.TheAffil.HealthSchl.ofShenyangMed.Coll.,Shenyang110034; 2.Teach. &Res.Div.ofPatho.Biol.,Coll.ofBasicMed.Sci.,ChinaMed.Uni.,Shenyang110122)
The effect of TLR9 agonist on humoral immune memory during the infection withPlasmodiumspp. was investigated, BALB/c mice were infected with non-lethalP.yoelii, two days before the infection they were injected with LR9 agonist CpGl826, and after day 90 secondary infection was carried out. The parasitemia on thin blood membrane was observed by counting erythrocyte infection rate, and flow cytometry was used to analyze the percentage of memory and active B cells in spleen cell suspension, and the levels of specific antibody were also measured by double sandwich ELISA. It was found in the results that before the secondary infection, the memory and active B cell as well as the level of antibody of TLR9 treated mice were slightly higher than the control group; And after the secondary infection, the occurrence rate of re-infection and the parasitemia level was slightly lower than the control group, and active B cells and antibody as well as the memory B cells appeared significant rise on day 1 and day 3 d after secondary infection respectively, moreover, the rising scope were all slightly higher than the control group. These results suggested that TLR9 agonist had a certain enhancing effect on the establishment and the maintenance of humoral immune memory duringP.y17XNL infection.
TLR9 agonist;Plasmodiumyoelii; memory B cell; humoral immune
辽宁省自然科学基金项目(201202281)
季迁 女,副教授,硕士。主要从事生理与感染免疫研究。E-mail:1712441978@qq.com
* 通讯作者。男,教授,硕士生导师。主要从事疟疾感染与免疫研究。E-mail:lyjcmu@163.com
2017-01-25;
2017-03-09
Q939.91;R392
A
1005-7021(2017)02-0089-04
10.3969/j.issn.1005-7021.2017.02.015
