尿液血管紧张素原与IgA肾病肾脏组织病理损伤的研究
2017-05-27侯霜钟远龙郑爱萍熊祖应罗琼
侯霜 钟远龙 郑爱萍 熊祖应 罗琼
【摘要】 目的 探讨免疫球蛋白 A(IgA)肾病患者尿液血管紧张素原(AGT)活性与临床及肾脏组织损伤的关系。方法 55例肾穿刺活检确诊的IgA肾病患者, 分别测定其尿液AGT含量, 并与临床、病理指标相比较分析。结果 尿液AGT含量与24 h尿蛋白定量、肾小球、肾小管及肾间质积分呈正相关。随着病理评分的加重、尿蛋白定量的增加, 尿液AGT原逐渐升高(P<0.05)。结论 IgA肾病患者尿液AGT可以反映临床及肾脏组织损伤的程度, 可作为临床评估IgA肾病病情的无创指标之一。
【关键词】 免疫球蛋白 A肾病;血管紧张素原;尿蛋白定量;病理损伤
DOI:10.14163/j.cnki.11-5547/r.2016.31.002
【Abstract】 Objective To investigate relationship between urine angiotensinogen (AGT) activity and clinical and kidney tissue damage in immune globulin A (IgA) nephropathy patients. Methods Urine AGT contents were detected in 55 renal biopsy diagnosed IgA nephropathy patients to compare and analyze with clinical and pathological indexes. Results Urine AGT content was positively correlation with 24 h urine protein content, glomerulus, kidney tubules and renal interstitium score. Increasing pathological score and urine protein content led to gradually increased urine AGT (P<0.05). Conclusion Urine AGT reflects clinical and kidney tissue damage in IgA nephropathy patients, and it can be taken as one of noninvasive indexes in clinical evaluation of IgA nephropathy.
【Key words】 Immune globulin A nephropathy; Angiotensinogen; Urine protein quantitation; Pathological damage
IgA腎病(IgA nephropathy, IgAN)是我国最为常见的肾小球疾病之一, 约占我国原发性肾小球疾病的45%~50%[1]。它的病理组织特征以IgA为主, 伴或不伴有其他免疫球蛋白在肾小球系膜区沉积。其发病机制并不完全明确, 临床表现多样, 多数患者有慢性进展的趋势, 近20%患者在发病10年后可发展到终末期肾脏病(end-stage renal disease, ESRD)[1]。因此早期诊断, 正确评估病情对于改善IgA肾病的预后至关重要。本研究通过检测尿液血管紧张素原(angiotensinogen, AGT)这一无创性指标了解肾脏局部肾素-血管紧张素系统活性与IgA肾病临床及肾脏病理损伤的关系, 为IgA肾病的病情评估提供新的指标。
1 资料与方法
1. 1 一般资料 选取2015年3月~2016年4月在本院经肾穿刺活检确诊为IgA肾病不伴高血压患者55例。其中男32例, 女23例;年龄17~68岁, 平均年龄(36.08±11.23)岁。纳入标准:①肾脏组织病理学检查确诊IgA肾病;②未使用肾素-血管紧张素系统活性阻断剂[血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅰ转化酶抑制剂(ARB)];③既往无高血压病史, 住院2次检测血压正常;④签署知情同意书者。排除标准:①高血压、糖尿病、肾血管狭窄等疾病患者;②过敏性紫癜性肾炎、狼疮性肾炎、干燥综合征、乙肝或丙肝病毒感染、肝硬化等继发性IgA肾病患者;③近6个月内使用过细胞毒药物、激素等免疫抑制剂者;④依从性差, 不配合研究调查者。
1. 2 病理评分标准 根据肾活检标本病理切片中的肾小球总数、新月体总数、肾小球节段硬化数、肾小球硬化总数、系膜增生程度、肾小管间质病变(含肾小管萎缩、间质纤维化、间质炎细胞浸润)及小血管病变程度不同分别进行半定量积分。①肾小球积分:a.系膜增生的严重程度分为无增生(0分)、轻度增生(1分)、中度增生(2分)和重度增生(3分)[2];b.新月体、节段硬化、硬化小球以其数值与小球数的比值记分后加入肾小球积分;c. 内皮细胞无增生记为0分, 有增生记为1分。②肾小管及间质积分:按间质受累面积计分:无受累0分;<25%为1分;25%~50%记为2分;>50%记为3分[3]。③血管积分:观察小动脉内膜增厚程度, 无内膜增厚记为0分;部分小动脉内膜增厚记为1分;显著小动脉内膜增厚或玻璃样变、闭塞记为2分。由2位病理科医生分别独立阅片积分后取平均值。
1. 3 检测方法
1. 3. 1 所有受试者均行肾脏活组织检查, 当日清晨收集新鲜晨尿10 ml, 放冰水浴中冷却后, 1000 r/min 4℃离心5 min, 分离上清液, 分装后-20℃冰箱保存, 用于尿液AGT的测定。
采用日本JBL人总AGT酶联免疫吸附测定(ELISA)试剂盒(27412)进行测定。①尿液标本用ELISA稀释液1∶6稀释;②标准曲线孔内加100 μl不同浓度标准品, 空白孔内加100 μl
ELISA稀释液, 其余孔内加100 μl稀释后样品;③37℃孵育
60 min。④用洗涤缓冲液洗涤7次(每次每孔加入300 μl)后, 每孔加入100 μl 酶联抗体;⑤37℃孵育30 min;⑥用洗涤缓冲液洗涤9次(每次每孔加入300 μl)后, 每孔加入100 μl TMB显色剂;⑦避光室温孵育30 min后, 每孔加入100 μl终止液;⑧用酶标仪在450 nm波长处读取各孔的OD值, 根据不同浓度标准品的吸光值绘制浓度-OD值标准曲线, 然后根据标准曲线计算各孔样本的浓度。
1. 3. 2 所有肾活检标本均行常规病理检查, 观察肾小球、肾小管、肾间质、血管各种常见病理改变。包括:①光镜检查:肾活检组织均行石蜡包埋, 切片厚度为1.5~2.5 μm, 分别行苏木精-伊红染色法(HE)、Masson、六氨银染色法(PASM)、过碘酸雪夫染色法(PAS)染色;②免疫荧光检查:冰冻切片厚度4 μm, 直接免疫荧光法检测IgA、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、C1q、C3、Fib, 间接免疫荧光法检测乙肝表面抗原(HBsAg)及乙型肝炎核心抗原(HBcAg)。荧光显微镜下进行半定量统计:+~++++;③电镜检查:部分患者需电镜确诊或排除其他疾病。
1. 4 观察指标 尿液AGT及临床收缩压、舒张压、血肌酐、血尿酸、血白蛋白、24 h尿蛋白定量、血IgA、IgG、血C3。
1. 5 统计学方法 采用SPSS20.0统计学软件对数据进行统计分析。计量资料以均数± 标准差( x-±s)表示, 采用t检验;相关指标进行相关分析及多因素线性回归分析。P<0.05表示差异具有统计学意义。
2 结果
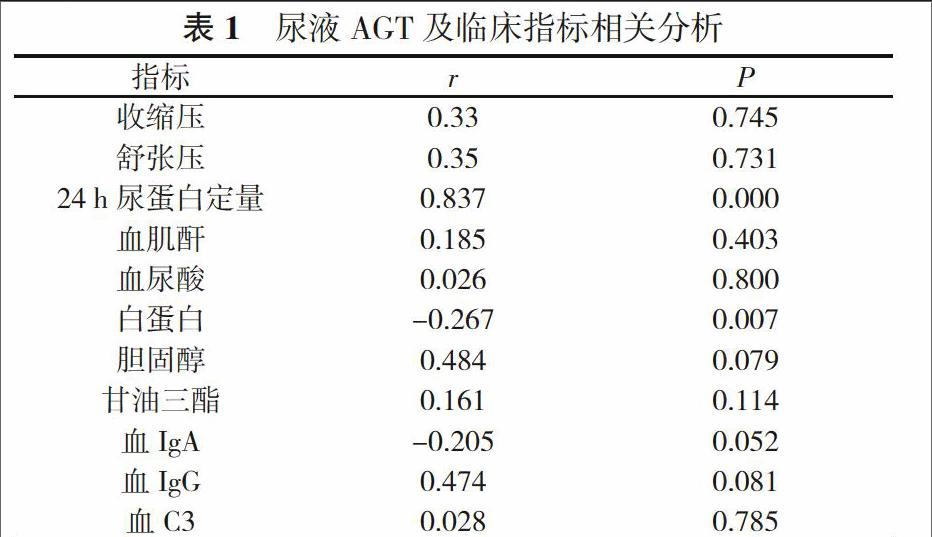
2. 1 尿液AGT与临床相关指标相关分析 尿液AGT与24 h尿蛋白定量呈正相关, 与血白蛋白呈负相关(P<0.05);与血肌酐、血尿酸、血脂(甘油三酯、胆固醇)、收缩压、舒张压、血IgA、血C3无显著相关性相关(P>0.05)。见表1。
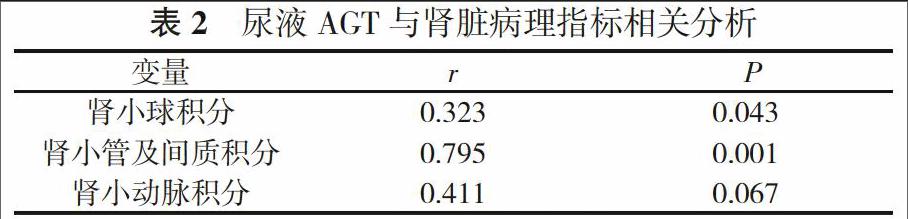
2. 2 尿液AGT与肾脏病理半定量积分指标相关分析 尿液AGT与肾小球积分、肾小管及间质积分正相关(P<0.05)。见表2。
2. 3 临床指标(尿蛋白定量、血白蛋白)、病理指标(肾小球积分、肾小管及间质积分)与尿液AGT进行多元线性回归分析 尿AGT与24 h尿蛋白定量、肾小球积分、肾小管间质积分正相关(P=0.000、0.012、0.002<0.05)。
3 讨论
近年来, 越来越多的研究证实:肾素-血管紧张素系统(RAS)的激活在慢性肾脏病的发生发展中起着重要的作用[4]。RAS活性的增强会导致肾小球出球小动脉阻力、肾小球毛细血管静水压的增加, 增加肾小球内压力, 降低肾小球灌注及滤过率。同时通过血管紧张素Ⅱ(AngⅡ)1型受体激活引起内皮细胞、系膜细胞等表型的改变, 促进细胞增殖, 影响多种生物活性物质(血管活性激素、生长因子、细胞外基质成分、细胞因子等)的基因表达, 激活多种细胞内信号传导途径(丝裂原激活蛋白激酶途径、酪氨酸激酶途径、各种转录因子等), 这些作用都参与了肾小球硬化的病理生理过程[5]。
除了传统意义上的RAS外, 局部組织如心脏、血管壁、肾脏、脑等组织均具有独立的RAS[6]。进一步研究表明:肾脏局部RAS的过度兴奋同样对慢性肾脏病的发生和发展起到关键作用。而AGT是RAS的主要作用底物, 作为一种大分子的糖基化球蛋白, 循环中的AGT并不能通过肾小球滤过屏障进入肾小管, 因此尿液中的AGT主要由肾脏分泌, 可以有效反映肾脏局部的RAS活性[7]。本文通过检测尿血管紧张素原评估IgA肾病患者肾脏局部RAS的活性 [8]。近期一项包括80例慢性肾脏病患者的研究发现, 尿液AGT的水平与表皮生长因子受体 (EGFR)呈负相关, 而与尿蛋白呈正相关。起始尿液AGT水平较高的患者出现进展性肾脏病的风险升高, 提示尿液AGT原可能是一种预测慢性肾脏病患者预后的标志物[9]。
本研究结果显示, 尿液AGT含量与24 h尿蛋白定量呈正相关, 随着蛋白尿的增多, 尿液AGT水平随之增高;同时它与肾小球积分、肾小管间及质积分呈正相关, 则提示病理组织损伤的加重, 病理积分增加, 尿液AGT含量也会增加, 从侧面证实了局部肾脏RAS活性的激活, 可伴随程度不同的肾脏组织病理损伤, 而尿蛋白及病理分级是影响IgA肾病预后的重要指标。随着蛋白尿的增加及病理组织损伤的加重, 提示IgA肾病患者病情加重, 预后不良[10]。因此临床可以通过尿液AGT的检测来定量评估IgA肾病的病情。而本研究中尿液AGT与血肌酐、尿酸、血脂、血压、血C3、IgA等无相关性, 则考虑与本组IgA肾病患者不伴高血压, 多以体检发现蛋白尿为就诊原因, 病情偏轻, 血肌酐、血尿酸、血脂水平均在正常范围居多有关。
综上所述, 尿液AGT含量随着肾脏病理损伤的程度加重而进行性增高, 可以通过它来间接评估肾脏组织病理损伤的程度, 同时其与尿蛋白定量呈正相关, 可以为早期IgA肾病患者提供更有效的监测和管理。
参考文献
[1] 张宏. KDIGO指南解读:IgA肾病治疗. 中国实用内科杂志, 2012(12):925-927.
[2] 邹万忠.肾活检病理学 .北京:北京大学医学出版社, 2006:255.
[3] Shi SF, Wang SX , Jiang L, et al. Pathologic predictors of renal outcome and therapeutic efficacy in IgA nephropathy: validation of the Oxford classification. Clinical Journal of the American Society of Nephrology, 2011, 6(9):2175-2184.
[4] Taskin E, Ozdogan K, Kunduz KE, et al. The restoration of kidney mitochondria function by inhibition of angiotensin-Ⅱ production in rats with acute adriamycin-induced nephrotoxicity//Intelligent man's guide to Indian philosophy / D.B. Taraporevala & Sons, 1935:606-612.
[5] Kim S, Iwao H. Molecular and cellular mechanisms of angiotensin II-mediated cardiovascular and renal diseases. Pharmacological Reviews, 2000, 52(1):11-34.
[6] Yiannikouris F, Karounos M, Charnigo R, et al. Adipocyte-specific deficiency of angiotensinogen decreases plasma angiotensinogen concentration and systolic blood pressure in mice. Ajp Regulatory Integrative & Comparative Physiology, 2012, 302(2):R244.
[7] Wu C, Lu H, Cassis LA, et al. Molecular and Pathophysiological Features of Angiotensinogen: A Mini Review. North American Journal of Medicine & Science, 2011, 4(4):183-190.
[8] Urushihara M, Kondo S, Kagami S, et al. Urinary Angiotensinogen Accurately Reflects Intrarenal Renin-Angiotensin System Activity. American Journal of Nephrology, 2010, 31(4):318-325.
[9] Yamamoto T, Nakagawa TH, Ohashi N, et al. Urinary angiotensinogen as a marker of intrarenal angiotensin Ⅱ activity associated with deterioration of renal function in patients with chronic kidney disease. Journal of the American Society of Nephrology Jasn, 2007, 18(5):1558-1565.
[10] Moriyama T, Tanaka K, Iwasaki C, et al. Prognosis in IgA Nephropathy: 30-Year Analysis of 1, 012 Patients at a Single Center in Japan. Plos One, 2014, 9(3):e91756.
[收稿日期:2016-11-11]
