甜叶菊毛状根绿原酸类化合物对α-淀粉酶的抑制作用
2017-05-12尹忠平彭大勇朱娟娟刘泽波
卢 桃,尹忠平,彭大勇,朱娟娟,邹 凯,刘泽波
(江西农业大学,江西省天然产物与功能食品重点实验室,食品科学与工程学院,江西南昌 330045)
甜叶菊毛状根绿原酸类化合物对α-淀粉酶的抑制作用
卢 桃,尹忠平*,彭大勇,朱娟娟,邹 凯,刘泽波
(江西农业大学,江西省天然产物与功能食品重点实验室,食品科学与工程学院,江西南昌 330045)
本文建立了微量α-淀粉酶抑制剂体外活性检测模型,并以此模型研究了甜叶菊毛状根绿原酸类化合物对α-淀粉酶的抑制作用效果及其动力学特征。优化后的α-淀粉酶抑制剂活性检测模型的主要参数如下:酶浓度为1.25 U/mL,底物浓度范围为0.05~6 mg/mL,反应时间为30 min。以此模型检测了由ACCC10060、R1601、A4三种发根农杆菌所诱导的甜叶菊毛状根总绿原酸提取物对α-淀粉酶的抑制效果,发现三者均对α-淀粉酶具有较强的抑制作用,其IC50分别为12.43、18.31和21.08 mg/mL。高效液相色谱检测结果表明,ACCC10060所诱导的甜叶菊毛状根的总绿原酸提物主要含绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸三种成分,含量分别为6.88、19.90和1.50 mg/g。酶抑制动力学检测结果显示,该三种绿原酸类化合物均对α-淀粉酶有较强抑制作用,以该三种绿原酸标品复配模拟毛状根总绿原酸提取物,发现其对α-淀粉酶的抑制作用与总绿原酸提取物无显著性差异。以上研究结果表明,甜叶菊毛状根绿原酸类化合物对α-淀粉酶有很好的抑制作用,其有效成分为绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸,可利用该毛状根生产以绿原酸类物质为主要活性成分的餐后血糖抑制剂。
甜叶菊,毛状根,绿原酸类化合物,α-淀粉酶抑制剂
糖尿病是一种常见内分泌代谢性疾病[1],已逐渐成为威胁人类健康的第三大疾病。世界卫生组织2011年的统计数据表明,全球糖尿病患者已达3.71亿人,而我国的糖尿病患者约1.14 亿人,占全球糖尿病患者的30.1%,其中绝大多数属Ⅱ型糖尿病[2]。糖尿病已对我国社会经济发展及人民健康产生了巨大的威胁。高血糖是糖尿病的重要特征,也是引起血管病变及多种糖尿病并发症的主要原因[3-5]。因此,控制血糖水平对预防和治疗糖尿病来说极其重要。
α-淀粉酶是一种影响饮食中淀粉等碳水化合物消化和吸收的关键酶之一,抑制其酶活性可以减缓人体对淀粉等物质的水解,从而抑制餐后血糖的升高。因此,α-淀粉酶抑制剂经常被用于治疗 II 型糖尿病,可降低餐后血糖水平和糖尿病并发症的发生[6]。目前市面上销售的餐后血糖控制剂有阿卡波糖、伏格列波糖、米格列醇等,这些化学合成药物有较好的效果,但是毒副作用也较大,并且有胀气、呕吐等副作用,所以从天然植物中寻找高效、副作用小的α-淀粉酶抑制剂引起了研究人员的广泛关注[7-20]。
研究表明,绿原酸类化合物具有抗氧化、抗炎、抗病毒、抗菌、降脂降糖、免疫调节等多种功效,在食品、保健、医疗和日用化工等领域有广泛的应用[9]。本文建立了α-淀粉酶体外消化模型,以此模型研究了ACCC10060、R1601、A4三种发根农杆菌所诱导的甜叶菊毛状根绿原酸提物对α-淀粉酶的抑制效果,并明确了其中的主要活性成分,以期为甜叶菊毛状根生产餐后血糖抑制剂提供参考和依据。
1 材料与方法
1.1 材料与仪器
甜叶菊毛状根ACCC10060、R1601、A4三种发根农杆菌所诱导的甜叶菊毛状根 均由江西省天然产物与功能食品重点实验室选育和培养;WPM培养基(生化试剂) 青岛高科园海博生物技术有限公司;可溶性淀粉(分析纯) 西陇化工股份有限公司;猪胰α-淀粉酶(13 U/mg) Sigma公司;绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸标准品(纯度>98%) 上海同田生物科技有限公司;甲醇(色谱纯) 美国Tieda试剂有限公司;1 mol/L pH6.8 Tris-HCl 缓冲液 北京索莱宝科技有限公司;3,5二硝基水杨酸(纯度>98%) 国药集团化学试剂有限公司;酒石酸钾钠、氢氧化钠、结晶酚、亚硫酸钠、氯化钠等化学药品 均为国产分析纯。
Aglient 126型高效液相色谱仪 美国Aglient科技有限公司;SpectraMax M2酶标仪 Molecular Devices。
1.2 实验方法
1.2.1 主要试剂的配制 1 mg/mL葡萄糖标准液:准确称取100 mg葡萄糖置于小烧杯中,加入少量去离子水溶解后,转移到100 mL容量瓶中,用去离子水定容至100 mL,混匀。置于4 ℃冰箱中保存备用。
显色剂(DNS)的配制:将6.3 g 3,5-二硝基水杨酸和262 mL NaOH溶液加到500 mL含有185 g 酒石酸钾钠的热水溶液中,再加入5 g结晶酚和5 g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000 mL,储存于棕色瓶中备用。
α-淀粉酶:将α-淀粉酶冻干粉溶于含1‰ Ca2+的8%的生理盐水中,配制成20 U/mL的酶溶液,分装,4 ℃储存备用。
淀粉溶液:称取适量可溶性淀粉,置于0.05 mol/L pH6.8 Tris-HCl 缓冲液中,混匀,然后置于沸水浴中加热15 min后冷却至室温,制得系列浓度的淀粉溶液。
1.2.2 材料预处理 甜叶菊毛状根的处理:在WPM无激素液体培养基中培养,20 d后收获,以蒸馏水冲洗干净,60 ℃烘干至恒重,磨成粉末,过60目筛,备用。
1.2.3 还原糖测定标准曲线的绘制 取不同体积的葡萄糖标准溶液(1 mg/mL)加入到2 mL离心管中(反应液中葡萄糖的终浓度分别为0、50、100、150、200、250、300 μg/mL),分别加入400 μL的DNS,再以蒸馏水补足至1000 μL,摇匀。在沸水浴中准确加热5 min,取出后迅速置于冰浴中冷却至室温。取100 μL反应液于96孔板,加入100 μL蒸馏水,混匀,在波长λ=540 nm下测定吸光度值。以葡萄糖的量(μg)为纵坐标,OD值A为横坐标,绘制还原糖测定标准曲线(以葡萄糖计)。
1.2.4α-淀粉酶体外消化模型 根据Udupa等[11]的方法并略作修改,总反应体系体积为1 mL,其中糊化好的可溶性淀粉溶液0.96 mL,α-淀粉酶溶液0.02 mL,0.05 mol/mL pH6.8 Tris-HCl缓冲液补足置于离心管中,混匀后立即置于37 ℃水浴中反应30 min,反应结束后迅速置于沸水中,灭酶20 min。取反应液300 μL,按1.2.3所述的方法测定其中的还原糖。
1.2.5α-淀粉酶体外反应模型主要参数的实验设计
1.2.5.1 底物浓度的确定 为了测量结果准确,误差小,本文进行了预实验,选择了浓度为0.05、0.25、0.5、0.75、1、1.25、1.75、2、2.5、3、3.5、4、5 U/mL的α-淀粉酶在一系列底物浓度为0、0.25、0.5、1、2、3、4、5、6、7、8 mg/mL条件下进行预实验。根据预实验结果,将模型中α-淀粉酶的浓度定为1.25 U/mL,以浓度分别为0.25、0.5、1、2、3、4、5、6、7、8 mg/mL糊化好的淀粉溶液为底物,按照1.2.4所述的方法进行体外消化反应,在波长λ=540 nm下测定吸光值。以吸光值(OD)对底物浓度(S)作图,以确定适合的底物浓度范围。
1.2.5.2 反应时间的确定 将模型中α-淀粉酶的浓度设为1.25 U/mL、底物浓度分别设为0.25、0.5、1、2、3、4、5、6 mg/mL,按照1.2.4所述的方法进行反应,每隔10 min测定一次吸光值(OD),连续测70 min。以吸光值(OD)对时间(T)作图,寻找模型恒速反应时间段,以确定最佳反应时间。
1.2.6 甜叶菊毛状根绿原酸类化合物的提取和测定
1.2.6.1 甜叶菊毛状根绿原酸类化合物的提取 分别称取200 mg由ACCC10060、R4、R1601三种发根农杆菌所诱导的甜叶菊毛状根粉末,以 50%(v/v)2 mL甲醇为提取溶剂,常温超声波辅助提取30 min,4000 r/min离心10 min,取上清液,定容,4 ℃储存备用[10]。
1.2.6.2 绿原酸类化合物标准品溶液的配制 分别准确称取绿原酸、3,5-二咖啡奎宁酸和4,5-二咖啡奎宁酸标准品各2 mg,以1 mL甲醇超声溶解,配制2 mg/mL的标准溶液,再吸取一定量的标准溶液进行稀释,配制成7个不同浓度的系列标准品溶液。
1.2.6.3 高效液相色谱测定方法 参考Fu等[10]的方法,具体检测条件如下 Waters Symmetry C18柱(4.6 mm×250 mm,5 μm);流动相:0.2%醋酸水(A)和甲醇(B);流速:1 mL/min;梯度洗脱程序:0~10 min:70% A;10~15 min:70%→45% A;15~25 min 45% A;25~26 min 45%→70% A;26~30 min:70% A;检测波长:327 nm;柱温:40 ℃;进样量:10 μL。
1.2.7 甜叶菊毛状根绿原酸类化合物对a-淀粉酶抑制活性的测定 按照1.2.4所述方法进行测定,以阿卡波糖为阳性对照物,主要操作步骤和参数如下:将浓度为1.25 U/mL的α-淀粉酶和待测抑制剂(绿原酸类化合物)按1∶1的体积比混匀,置于37 ℃ 水浴中孵育20 min,取0.04 mL上述混合液加到0.96 mL 1 mg/mL可溶性淀粉溶液中,混匀,37 ℃水浴反应30 min,立即置于沸水浴中灭酶20 min以终止反应,测量还原糖的生成量,计算反应速度。抑制活性以抑制百分率表示,计算公式如下:
I(%)=(V空白-V样品)/V样品×100
式中:I为抑制剂对淀粉酶的抑制活性(%),V空白为未添加抑制剂的空白实验组反应速度(μg/min);V样品为添加了待测抑制剂样品的反应速度(μg/min)。
1.2.8 酶抑制动力学分析方法 按1.2.6.2所述方法分别配制不同浓度的绿原酸(浓度为0、0.07、0.1 mg/mL)、3,5-二咖啡酰奎宁酸(浓度为0、0.04、0.05 mg/mL)和4,5-二咖啡酰奎宁酸(浓度为0、0.07、0.08 mg/mL)三种标品物质,用于测定对α-淀粉酶抑制作用,采用双倒数作图法进行抑制动力学分析:以1/V对1/S(底物浓度S为 0.25、0.5、1、2、3、4、5、6 mg/mL)作图,得到Lineweaver-Burk曲线,确定抑制类型,并计算Ki值。
1.2.9 标品复配模拟绿原酸类提取物及其对α-淀粉酶抑制活性的测定 从ACCC10060、R1601、A4三种发根农杆菌所诱导的甜叶菊毛状根中筛选出对α-淀粉酶抑制作用效果较好的一种,根据HPLC测定结果,以绿原酸、3,5-二咖啡奎宁酸和4,5-二咖啡奎宁酸三种标准品进行复配,模拟绿原酸类化合物提取物,并按1.2.7所述方法进行抑制活性测定,以验证抑制作用的主要活性成分。
2 结果与分析
2.1 还原糖测定标准曲线的绘制
为了准确测定α-淀粉酶-淀粉体外反应体系的反应速度,本文建立了还原糖测定标准曲线。实验测定数据经拟合所得的回归方程为Y=352.37X,式中:X为吸光度值,Y为还原糖的量(以葡萄糖计,μg),回归方程的R2达到了0.9992,表明所建立的标准曲线在检测范围内线性良好,可用于后续实验。
2.2α-淀粉酶体外抑制剂筛选模型的建立及主要参数的确定
为了使建立的模型能更好地适用于α-淀粉酶抑制剂的筛选及酶抑制动力学研究,本文对底物浓度和反应时间进行了确定。
2.2.1 底物浓度的确定 在α-淀粉酶浓度为1.25 U/mL的条件下,进行了底物浓度优化实验,结果如图1所示。由图1可知,随着底物浓度的增加,吸光度值(OD)先是快速上升,之后上升趋势逐步变缓,当浓度达到4 mg/mL以后,吸光度值(OD)基本保持不变,此时生成的还原糖的量(Y=352.37X)和单位时间内反应速度(V=Y/T)也是先增加后不变,说明反应体系中的酶已被底物饱和。在底物浓度为0.25~6 mg/mL范围内,反应速度曲线呈双曲线形,速度和底物浓度之间的相关关系基本符合米氏方程。因此,底物浓度范围确定为0.05~6 mg/mL。

图1 不同底物浓度下的吸光值的变化Fig.1 The changes in absorbance at different substrate concentrations
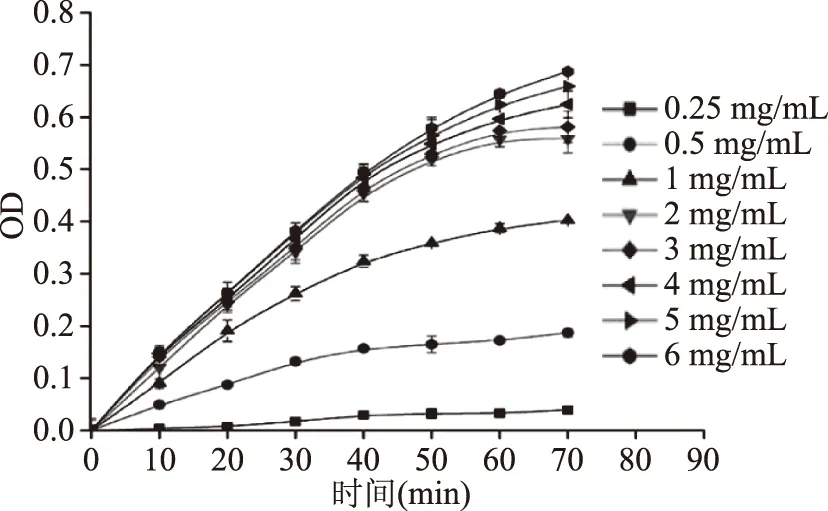
图2 不同底物浓度下70 min内的反应速度变化图Fig.2 The change profile of reaction velocity under different substrate concentrations within 70 min
2.2.2 反应时间的确定 研究表明,在酶促反应开始的一段时间内,反应速度基本保持不变,之后随着底物的消耗、产物的积累及部分酶分子失活,反应速度会逐步降低[12]。因此,酶促反应速度的测定应选在这个近似恒速反应阶段进行。在酶浓度1.25 U/mL的条件下,测定了0.25~6 mg/mL底物浓度下连续反应70 min的反应速度,结果如图2所示。由图2可知,反应40 min以后,低底物浓度体系的吸光值增加趋势变缓,即低底物浓度体系的反应速度开始显现降低的趋势,随着时间的推移,高底物浓度下的反应速度也相继出现了下降趋势。底物浓度越高,出现下降趋势的时间点越往后。据此可判定,在本模型所采用的条件下,前30 min反应基本处于恒速阶段。为了确保低底物浓度下的反应在测定反应速度时仍处于恒速阶段,本文将反应时间确定为30 min。

图4 三种甜叶菊毛状根绿原酸类化合物提取物HPLC测定色谱图Fig.4 HPLC chromatograms of authentic chlorogenic acid,3,5-dicaffeoylquinic acid, and 4,5-dicaffeoylquinic acid and three kinds of extracts from Stevia rebaudiana hairy roots注:1:绿原酸;2:3,5-二咖啡奎宁酸;3:4,5-二咖啡奎宁酸。
2.3 甜叶菊毛状根绿原类提取物对α-淀粉酶的抑制效果
由图3可知,在2.5~200 mg/mL毛状根生药浓度范围内,来源于ACCC10060、R1601、A4三种农杆菌诱导的甜叶菊毛状根的绿原酸类提取物对α-淀粉酶均具有一定的抑制作用。在2.5~50 mg/mL浓度范围内,抑制率随提取物物浓度的增加而增加,基本上呈线性正相关,但进一步提高提取物浓度时,抑制率不再升高。在本文所采用的模型条件下,三者的最大抑制率分别为81.23%,84.91%,83.32%,计算出来的IC50分别为12.43、18.31、21.08 mg/mL。由此可知,三种农杆菌所诱导的甜叶菊毛状根的绿原酸类提取物对α-淀粉酶均有较好的抑制作用。

图3 三种甜叶菊毛状根的提取物对α-淀粉酶的抑制效果Fig.3 Inhibitory effect on three kinds of Stevia rebaudiana hairy root extracts on α-amylase
2.4 HPLC定量检测与分析
2.4.1 绿原酸类化合物标准曲线的绘制 按照1.2.6.3色谱条件,建立了绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸三种化合物的测定标准曲线(如表1所示)。三种化合物测定回归方程在相应的检测范围内线性关系良好,可用于定量测定。
2.4.2 甜叶菊毛状根绿原酸类化合物的HPLC检测 按照1.2.6.3色谱方法,对来源于ACCC10060、R1601、A4三种农杆菌诱导的甜叶菊毛状根的绿原酸类化合物提取物进行了测定,结果如图4所示。检测结果表明,三种甜叶菊毛状根中都含有绿原酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸三种物质,但组成比例上有一定的区别。从三种物质的总含量表2来看,以ACCC10060毛状根最高,其次为A4毛状根。绿原酸含量以R1601毛状根最高,含量为9.84 mg/g,3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸都以ACCC10060毛状根为最高,含量分别为19.90,1.50 mg/g。

表1 绿原酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸高效液相测定标准曲线Table 1 The regression equation of chlorogenic acid,3,5 dicaffeylquinic acid and 4,5 dicaffeoylquinic acid determination by HPLC

表3 三种绿原酸类化合物对α-淀粉酶抑制作用的动力学参数Table 3 The calculated kinetics parameters of α-amylase under the inhibition of chlorogenic acids

图5 三种绿原酸类化合物对α-淀粉酶抑制作用的 Lineweaver-BurkFig.5 Lineweaver-Burk plot for inhibition of chlorogenic acids on α-amylase注:图a、b、c分别为绿原酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸对α-淀粉酶抑制作用的Lineweaver-Burk。
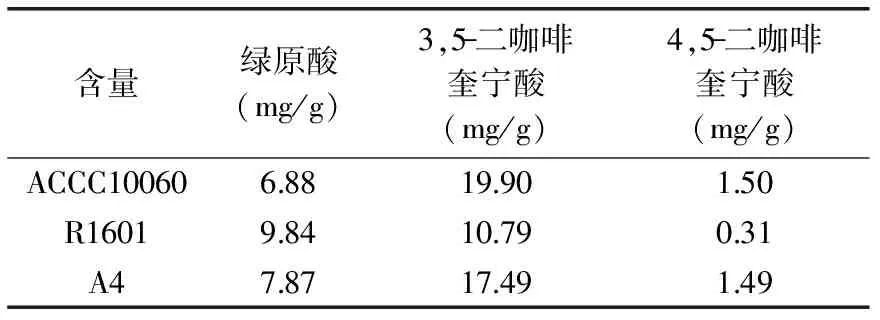
表2 三种毛状根中绿原酸类化合物的含量Table 2 The content of chlorogenic acid compounds in three hairy roots
2.4.3 三种绿原酸类化合物对α-淀粉酶的抑制动力学检测 为了明确甜叶菊毛状根绿原酸类提取物对α-淀粉酶起抑制作用的主要成分及其作用机制,本文测定了不同浓度的绿原酸(浓度为0、0.07、0.1 mg/mL)、3,5-二咖啡酰奎宁酸(浓度为0、0.04、0.05 mg/mL)和4,5-二咖啡酰奎宁酸(浓度为0、0.07、0.08 mg/mL)三种标品物质对α-淀粉酶抑制作用效果,并采用双倒数作图法进行了抑制动力学分析,结果如图5和表3所示。从双倒数作图的拟合效果来看,三种绿原酸类化合物作用下模型的1/V与1/S均呈现出了较好的线性关系,可用于抑制类型判断和抑制动力学参数测定。由图5a~图5c可知,绿原酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸作用下α-淀粉酶的表观Km值没有明显变化,但表观Vmax随着抑制剂浓度的升高而变小了,表明该三种物质没有改变酶对底物的亲和力,但降低了最大反应速度,表现出了非竞争型抑制剂的典型特征。从表3中的Ki来看。三种物质中以绿原酸对α-淀粉酶的抑制作用最好。
2.4.4 甜叶菊毛状根绿原酸类化合物对α-淀粉酶抑制作用的验证 从ACCC10060、R1601、A4三种发根农杆菌所诱导的甜叶菊毛状根绿原酸类化合物对α-淀粉酶的抑制作用效果来看,在2.5~37.5 mg/mL浓度范围内ACCC10060诱导的毛状根的提取物效果最好(如图3所示)。本文根据HPLC测定结果,以绿原酸、3,5-二咖啡奎宁酸和4,5-二咖啡奎宁酸三种标准品进行复配,模拟浓度为12.5 mg/mL的ACCC10060所诱导毛状根的绿原酸类化合物提取物,并进行抑制活性测定,以验证抑制作用的主要活性成分。结果表明,复配模拟物对α-淀粉酶的平均抑制率为39.81%,统计分析显示,提取物和复配物两者对α-淀粉酶的抑制作用无显著性差异。综上所述,甜叶菊毛状根绿原酸类化合物对α-淀粉酶有较好的抑制作用,其主要活性成分为绿原酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸三种物质。
3 结论
本文建立了微量α-淀粉酶抑制剂体外活性检测模型,并以此模型研究了甜叶菊毛状根绿原酸类化合物对α-淀粉酶的抑制作用效果及其动力学特征。优化后检测模型的主要参数如下:酶浓度为1.25 U/mL;底物浓度范围为0.05~6 mg/mL,反应时间为30 min。ACCC10060,R1601,A4三种发根农杆菌菌种诱导的甜叶菊毛状根的绿原酸类提取物对α-淀粉酶均有较好的抑制作用,其活性作用的主要成分为绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸。因此,可利用ACCC10060诱导的毛状根生产以绿原酸类物质为主要活性成分的餐后血糖抑制剂。
[1]Yamagishi S,Maeda S,Matsui T,et al. Role of advanced glycation end products(AGEs)and oxidative stress in vascular complications in diabetes[J]. Biochimica et Biophysica Acta(BBA)-General Subjects,2012,1820(5):663-671.
[2]Mahler R J,Adler M L. Type 2 diabetes mellitus:update on diagnosis,pathophysiology,and treatment[J]. The Journal of Clinical Endocrinology & Metabolism,1999,84(4):1165-1171.
[3]韦昭华. 糖尿病并发症的防治进展[J]实用心脑肺血管病杂志,2008,16(8):61-65.
[4]Anselmino M. Cardiovascular prevention in type 2 diabetes mellitus patients:the role of oral glucose-lowering agents[J]. Journal of Diabetes and its Complications,2009,23(6):427-433.
[5]Kim K Y,Nam K A,Kurihara H,et al. Potentα-glucosidase inhibitors purified from the red alga Grateloupia elliptica[J]. Phytochemistry,2008,69(16):2820-2825.
[6]Puls W,Keup U. Influence of anα-amylase inhibitor(BAY d 7791)on blood glucose,serum insulin and NEFA in starch loading tests in rats,dogs and man[J]. Diabetologia,1973,9(2):97-101.
[7]Tundis R,Loizzo M R,Menichini F. Natural products asα-amylase andα-glucosidase inhibitors and their hypoglycaemic potential in the treatment of diabetes:an update[J]. Mini Reviews in Medicinal Chemistry,2010,10(4):315-331.
[8]屠洁,李前龙.天然产物中α-葡萄糖苷酶抑制剂的筛选研究进展[J].食品研究与开发,2010,31(9):206-210.
[9]Watanabe T,Arai Y,Mitsui Y,et al. The blood pressure-lowering effect and safety of chlorogenic acid from green coffee bean extract in essential hypertension[J]. Clinical and Experimental Hypertension,2006,28(5):439-449.
[10]Fu X,Yin Z P,Chen J G,et al. Production of chlorogenic acid and its derivatives in hairy root cultures of Stevia rebaudiana[J]. Journal of Agricultural and Food Chemistry,2014,63(1):262-268.
[11]Udupa S L,Prabhakar A R,Tandon S.α-amylase inhibitors in foodstuffs[J]. Food Chemistry,1989,34(2):95-101.
[12]Copeland R A,Retey J. Enzymes:a practical introduction to structure,mechanism,and data analysis[M]. New York:VCH Publishers,1996.
[13]Yao X,Zhu L,Chen Y,et al.Invivoandinvitroantioxidant activity andα-glucosidase,α-amylase inhibitory effects of flavonoids fromCichoriumglandulosumseeds[J]. Food Chemistry,2013,139(1):59-66.
[14]De Silva S L,Perera H K I,Fernando W I T,et al. Partial Purification of(Alpha)-Amylase Inhibitor/s FromSyzygiumuminiLeaves[J]. Health and Hygiene,2014,18:153-153.
[15]Trinh B T D,Strk D,Jäger A K. Screening for potentialα-glucosidase andα-amylase inhibitory constituents from selected Vietnamese plants used to treat type 2 diabetes[J]. Journal of Ethnopharmacology,2016,186:189-195.
[16]Lordan S,Smyth T J,Soler-Vila A,et al. Theα-amylase andα-glucosidase inhibitory effects of Irish seaweed extracts[J]. Food Chemistry,2013,141(3):2170-2176.
[17]Hamid H A,Yusoff M M,Liu M,et al.α-Glucosidase andα-amylase inhibitory constituents of Tinospora crispa:Isolation and chemical profile confirmation by ultra-high performance liquid chromatography-quadrupole time-of-flight/mass spectrometry[J]. Journal of Functional Foods,2015,16:74-80.
[18]Thilagam E,Parimaladevi B,Kumarappan C,et al.α-Glucosidase andα-amylase inhibitory activity ofSennasurattensis[J]. Journal of Acupuncture and Meridian Studies,2013,6(1):24-30.
[19]Ngoh Y Y,Gan C Y. Enzyme-assisted extraction and identification of antioxidative andα-amylase inhibitory peptides from Pinto beans(Phaseolusvulgariscv. Pinto)[J]. Food Chemistry,2016,190:331-337.
[20]Hashim A,Khan M S,Khan M S,et al. Antioxidant andα-amylase inhibitory property ofPhyllanthusvirgatusL.:AnInvitroand molecular interaction study[J]. Bio Med Research International,2013,2013:729393-729393.
The inhibition onα-amylase of chlorogenic acids fromSteviarebaudianahairy coot cultures
LU Tao,YING Zhong-ping*,PENG Da-yong,ZHU Juan-juan,ZOU Kai,LIU Ze-bo
(Jiangxi Provincial Key Laboratory of Natural Products and Functional Food, Food Science and Engineering College,Jiangxi Agricultural University,Nanchang 330045,China)
This paper established a model of alpha amylase inhibitor screeninginvitro,and researched the inhibitory effects and the dynamic characteristics of chlorogenic acid compounds extracted fromSteviarebaudianahairy roots through this model. The optimized parameters of this model were as follows:the enzyme concentration,substrate concentration,reaction temperature,and reaction time were 1.25 U/mL,0.05~6 mg/mL,37 ℃,and 30 minutes respectively. The inhibitory effect ofSteviarebaudianahairy roots(ACCC10060,R1601,A4)extracts onα-amylase was studied by this modle,and it found that they all had strong inhibitory effect onα-amylase and the IC50were 12.43,18.310 and 21.084 mg/mL respectively. The results of HPLC showed that total chlorogenic acid extract of Stevia hairy roots ACCC10060 mainly contains chlorogenic acid,3,5-dicaffeylquinic acid and 4,5-dicaffeylquinic,whose content was 6.88,19.90 and 1.50 mg/g respectively. Enzyme inhibition kinetics test showed that all the three chlorogenic acid had strong inhibitory effects onα-amylase. The inhibitory effects onα-amylase between theSteviarebaudianahairy roots extracts and the mixture which contains three chlorogenic acid standard products according to the proportion of total chlorogenic acid extracts had no significant difference.The results above indicated that the chlorogenic acids of stevia hairy roots demonstrated the excellent inhibitory effect ofα-amylase,and the main active components were chlorogenic acid,3,5-dicaffeylquinic acid and 4,5-dicaffeoylquinic acid which were expected to developing into a natural,efficient postprandial blood glucose inhibitors.
Steviarebaudiana;hairy root;chlorogenic acids;alpha amylase inhibitor
2016-08-30
卢桃(1993-),女,硕士研究生,主要从事食品科学方面的研究,E-mail:18779883251@163.com。
*通讯作者:尹忠平(1971-),男,讲师,主要从事天然产物方面的研究,E-mail:yin_zhongping@163.com。
国家自然科学基金项目(31260368,31460436);江西省教育厅项目(GJJ14314)。
TS255.1
A
1002-0306(2017)08-0161-06
10.13386/j.issn1002-0306.2017.08.023
