6-苄氨基腺嘌呤和萘乙酸对三裂叶野葛毛状根生长和异黄酮含量的影响
2014-10-31何含杰施和平
何含杰,施和平
1 中南林业科技大学生命科学与技术学院 林业生物技术湖南省重点实验室/生物发育工程及新产品研发协同创新中心,湖南 长沙 410004
2 华南师范大学生命科学学院 广东省植物发育生物工程重点实验室,广东 广州 510631
三裂叶野葛Pueraria phaseoloides,系豆科多年生藤本植物,其根含有葛根素、大豆苷等异黄酮类化合物,具有改善心脑血循环、降低血脂与血糖、增强免疫力等功能及具有类似雌性激素的功效,广泛用于治疗高血压、冠心病、心绞痛等病症[1-2]。但由于其野生资源的匮乏以及人工栽培的时效性差而无法满足医药工业的巨大需求。为此,我们曾利用含野生型Ri质粒的发根农杆菌ATCC15834对三裂叶野葛叶片进行遗传转化,获得了能在无激素 MS培养基上自主快速生长及能产生较高含量葛根素的毛状根[3]。已有的研究结果表明,植物毛状根的生长和次生代谢物质的合成与积累易受到培养基类型、植物激素等诸多因素的影响[4-7]。细胞分裂素和生长素参与和调控了植物许多重要的生理过程,如器官的发育与衰老、药用植物的生长和次生代谢以及基因的表达调控等[8-11]。如在供试的培养基中添加不同的外源植物生长调节物质可以促进雪莲Saussurea involucrata毛状根和亚麻 Linum album毛状根的生长和次生代谢物的生物合成与积累[4,12]。但迄今为止未见有关生长素和细胞分裂素对三裂叶野葛毛状根生长和异黄酮含量影响的报道。本文报道细胞分裂素6-BA和生长素NAA对三裂叶野葛毛状根生长和异黄酮化合物含量的影响,旨在为运用植物激素来调节三裂叶野葛毛状根的生长和葛根素等异黄酮类物质的合成与积累奠定实验和技术基础。
1 材料与方法
1.1 材料
本文所采用的材料是由含野生农杆碱型 Ri质粒的发根农杆菌ATCC15834遗传转化三裂叶野葛叶片外植体所产生的毛状根,其诱导和继代培养方法见已发表方法[3]。
1.2 培养基及培养条件
采用的培养基为添加不同浓度 6-BA或6-BA+2.0 mg/L NAA组合的固体MS培养基,其中6-BA浓度分别为0、0.1、0.5、1.0、3.0和5.0 mg/L,每个150 mL锥形瓶中分装40 mL培养基。灭菌前pH值调至5.8−6.0,经121 ℃、20 min高温湿热灭菌后待用。接种后,毛状根置于培养架上,于 (25±2)℃暗培养。
1.3 三裂叶野葛毛状根培养及其生物量测定
选取生长旺盛的三裂叶野葛毛状根,用无菌水洗去培养基后,剪切成4−5 cm且具根尖的根段,按约0.5 g/瓶接入含植物激素的MS固体培养基中进行培养。在培养过程中,每隔5 d随机抽取毛状根培养物各 3瓶,用自来水洗去培养物上的培养基,并用吸水纸吸干水分后测定毛状根的鲜重和干重。一部分毛状根培养物于–80 ℃超低温冰箱中保存,供测定其可溶性蛋白含量和保护酶活性及提取植物基因组DNA;另一部分毛状根在恒温烘箱中60 ℃烘干后,供测定其异黄酮化合物含量。
1.4 三裂叶野葛毛状根培养物中异黄酮化合物含量的测定
三裂叶野葛毛状根中异黄酮化合物含量的测定,参照我们已发表的方法[3]。
1.5 毛状根培养物中可溶性蛋白含量、SOD和POD活性的测定
三裂叶野葛毛状根培养物中可溶性蛋白含量的测定参照 Bradford的方法。用考马斯亮蓝G-250对制备好的酶液进行染色,摇匀后于岛津UV-1206型紫外光/可见光分光光度仪上 (595 nm)测定其光吸收值 (OD),同时以制备提取液所用的磷酸缓冲液作为空白对照[13]。SOD活性的测定参照 Beauchamp和 Fridovich的方法进行操作,以抑制NBT光还原50%所需要的酶量为一个酶活性单位,酶活性以 U/mg蛋白表示[14]。POD活性的测定参照已发表的方法[15]。
1.6 毛状根基因组DNA的提取和琼脂糖凝胶电泳检测
三裂叶野葛毛状根基因组DNA的提取,参照文献[3]。琼脂糖凝胶电泳检测条件是:1%琼脂糖,1×50 TEB,50 V,1.5 h。
2 结果与分析
2.1 6-BA对三裂叶野葛毛状根生长的影响
无激素MS培养基 (对照)培养的三裂叶野葛毛状根生长最快,培养至25 d时其干重达到最大,约为1.47 g DW/瓶;随着培养时间的延长,毛状根逐渐褐化,其生物量也开始下降 (图1 A)。与对照相比,细胞分裂素6-BA明显抑制三裂叶野葛毛状根的生长,降低其生物量,且此抑制作用与6-BA浓度呈正相关;培养至30 d时,添加6-BA培养基培养的三裂叶野葛毛状根的干重虽达到最大值,但仅为同期对照生物量的26.3%−47.8% (图1 A);其中低浓度0.1 mg/L 6-BA可以抑制毛状根侧根的产生,促进老根的褐化与衰老;而5.0 mg/L 6-BA则完全抑制毛状根的生长,老根逐渐变成黑色或逐渐膨大且似愈伤化 (图1 B、C、D),表明6-BA可抑制三裂叶野葛毛状根的生长,降低毛状根的生物量。
2.2 6-BA对三裂叶野葛毛状根异黄酮化合物含量的影响
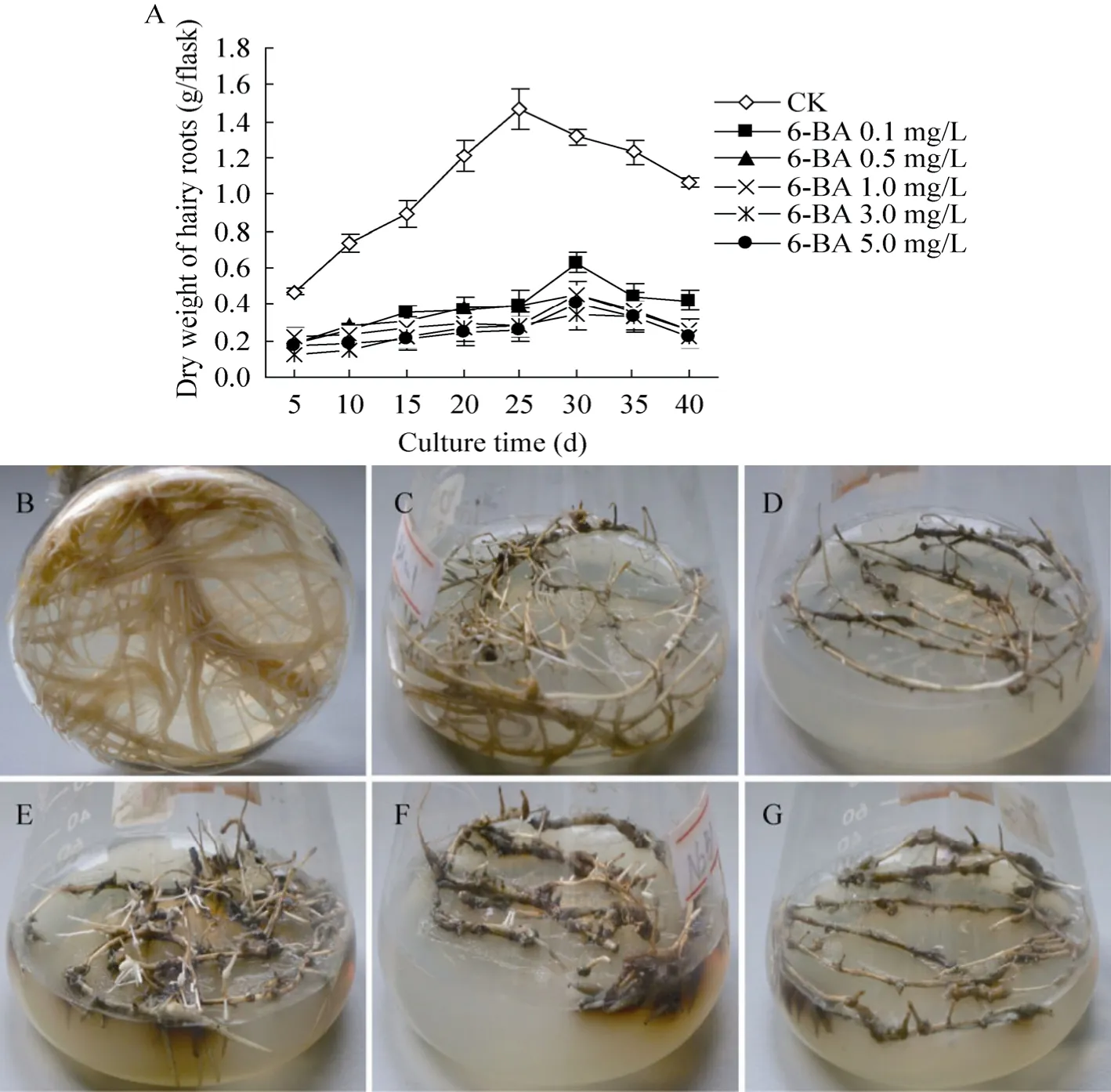
图1 6-BA或6-BA和NAA结合对三裂叶野葛毛状根生长的影响Fig. 1 Effects of 6-BA or in combination with NAA on the growth of P. phaseoloides hairy roots. (A)Effect of 6-BA on the biomass of P. phaseoloides hairy roots. (B), (C), (D)Treatment with 6-BA. (E), (F), (G)Treatment with 6-BA and NAA 2.0 mg/L combination, the 6-BA concentrations was 0 mg/L in (B), 0.1 mg/L in (C)and (E), 1.0 mg/L in (F), 5.0 mg/L in (D)and (G)(15 d).
图2为6-BA浓度对三裂叶野葛毛状根异黄酮化合物含量的影响。从图 2可见,对照毛状根培养物中异黄酮化合物呈先上升后下降的变化趋势,培养至10 d时,毛状根每克干物质中异黄酮化合物含量达到最高,约为32.22 mg/g DW(图2 A)。与对照相比,培养至25 d时,细胞分裂素6-BA 0.1 mg/L、0.5 mg/L、1.0 mg/L、3.0 mg/L和5.0 mg/L处理的毛状根每克干物质中异黄酮化合物含量分别是对照含量的1.2、1.7、1.8、1.7和1.7倍 (图2 A)。然而,细胞分裂素6-BA却降低每个培养瓶中毛状根的总异黄酮化合物的含量;培养至30 d时,培养瓶中总异黄酮化合物的含量是同期对照含量的47.8%−68.6% (图2 B)。这表明6-BA可降低每个培养瓶中毛状根的总异黄酮化合物含量。
2.3 6-BA和NAA结合对三裂叶野葛毛状根生长的影响
从图3可见,对照三裂叶野葛毛状根生长最快,培养至20 d时其干物质量达到最大值,约为1.0 g DW/瓶,是培养初期的10.1倍 (图3A)。而6-BA 0.1 mg/L、0.5 mg/L、1.0 mg/L、3.0 mg/L、5.0 mg/L和NAA 2.0 mg/L结合培养的毛状根则生长缓慢,培养至25 d时其干物质量达到最大值,其干重分别比起始培养时增加了6.1、5.6、5.3、4.8和 4.6倍,但仅为同期对照毛状根生物量的83.7%、78.0%、74.5%、68.4%和66.4% (图3)。培养5 d后,低浓度6-BA (0.1 mg/L和1.0 mg/L)和NAA 2.0 mg/L结合培养的三裂叶野葛毛状根的老根 (起始根端)上长出许多粗短的侧根,且随着培养时间的延长而逐渐增多;培养20 d后毛状根从白色变为黄色 (图1E、F)。相反,高浓度的6-BA 5.0 mg/L和NAA 2.0 mg/L结合则抑制毛状根的生长,其起始根段逐渐褐化和膨大(图 1G)。与对照相比,6-BA和 NAA 2.0 mg/L结合抑制三裂叶野葛毛状根的生长,且其抑制作用与6-BA的浓度成正比 (图3)。表明细胞分裂素6-BA和生长素NAA结合抑制三裂叶野葛毛状根的生长,且NAA具有协同作用。
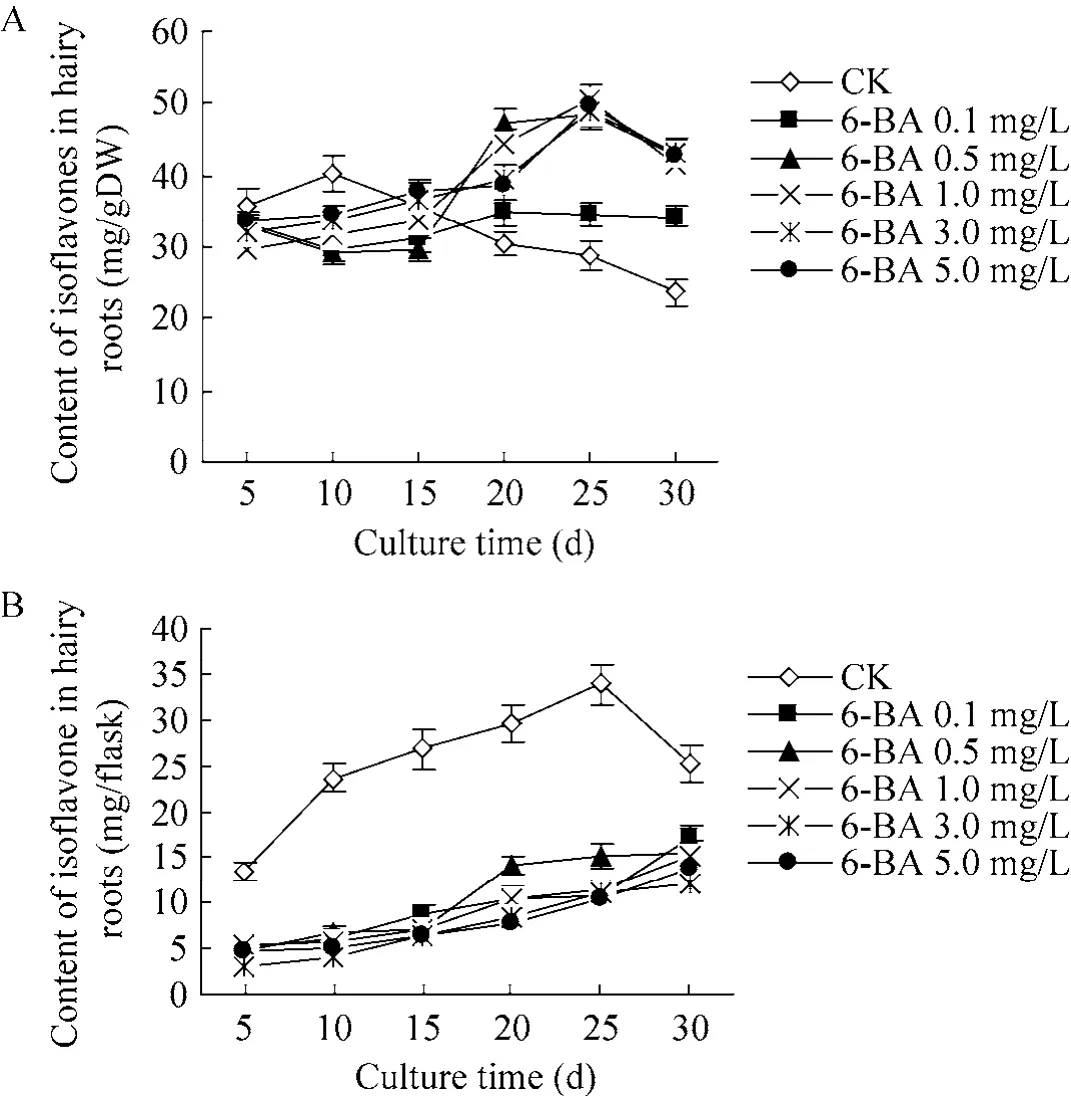
图2 6-BA对三裂叶野葛毛状根异黄酮含量的影响Fig. 2 Effects of 6-BA on the contents of isoflavones in P. phaseoloides hairy roots. (A)Isoflavones contents per gram in dry cultures of P. phaseoloides hairy roots. (B)Total isoflavones contents per flask in dry cultures of P. phaseoloides hairy roots.
2.4 6-BA和 NAA结合对毛状根中异黄酮化合物含量的影响

图3 6-BA和NAA对三裂叶野葛毛状根生长的影响Fig. 3 Effects of 6-BA and NAA on the growth of P. phaseoloides hairy roots.
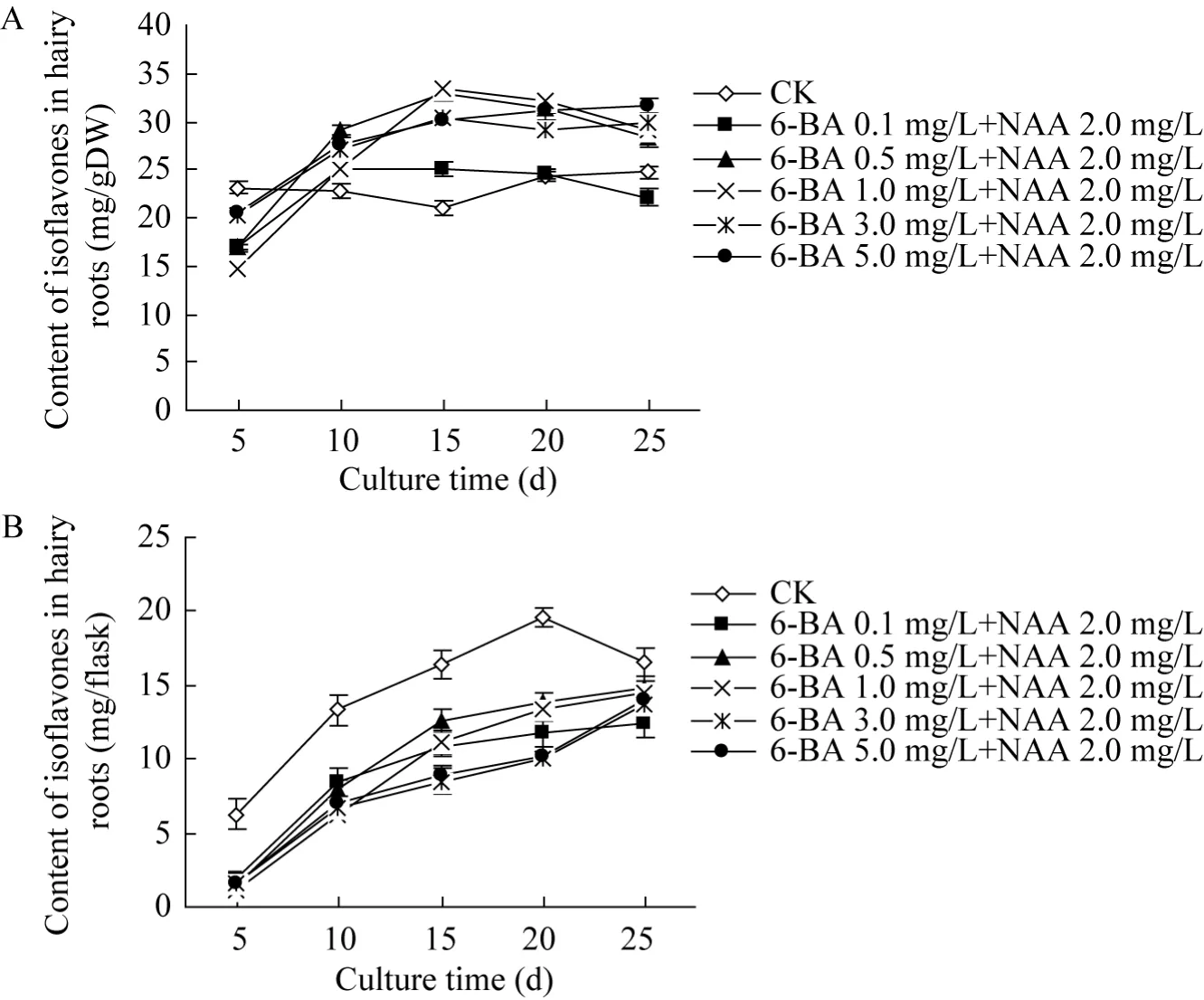
图4 6-BA和NAA对三裂叶野葛毛状根异黄酮化合物含量的影响Fig. 4 Effects of 6-BA and NAA on the contents of isoflavones in P. phaseoloides hairy roots. (A)Isoflavones contents per gram in dry cultures of P. phaseoloides hairy roots. (B)Total isoflavones contents per flask in dry cultures of P. phaseoloides hairy roots.
图4为6-BA和NAA结合对三裂叶野葛毛状根异黄酮化合物含量的影响。从图 4可见,培养至25 d时,对照毛状根培养物的异黄酮化合物含量达到最大值,约19.76 mg/g DW (图4 A)。与对照相比,不同浓度6-BA和NAA 2.0 mg/L结合则可促进毛状根每克干物质中异黄酮化合物的积累,且其促进作用随着 6-BA浓度的增加而愈加显著;培养至20 d时,6-BA和NAA组合处理的毛状根异黄酮化合物含量是同期对照含量的96.9%−131.7% (图4 A)。但若以每瓶异黄酮含量计,6-BA和NAA组合处理则降低每个培养瓶的毛状根总异黄酮化合物的含量,培养至25 d时,其总异黄酮化合物含量约为同期对照含量的 74.8%−89.6% (图 4 B)。这表明,6-BA和NAA组合不仅抑制三裂叶野葛毛状根的生长,而且降低每个培养瓶中毛状根的总异黄酮化合物含量。
2.5 6-BA和 NAA结合对三裂叶野葛毛状根的可溶性蛋白含量的影响
图5为6-BA和NAA结合对毛状根中可溶性蛋白含量的影响。从图 5可见,对照三裂叶野葛毛状根的可溶性蛋白含量随着培养时间的延长而逐渐下降,培养至25 d时其含量比起始水平下降约37.9%。与对照相比,6-BA 0.1、0.5、1.0、3.0或5.0 mg/L和NAA 2.0 mg/L组合处理的毛状根培养物的可溶性蛋白含量在培养至15 d时到达最大值,且分别比对照提高49.5%、47.5%、30.2%、52.6%和46.5%;随后其可溶性蛋白含量开始逐渐下降;培养至25 d时达到最低值,但其含量均比同期对照高 (图 5)。该结果表明,6-BA和NAA可以提高三裂叶野葛毛状根的可溶性蛋白的含量,推测其可能与毛状根的生长受到抑制有关。
2.6 6-BA和NAA对三裂叶野葛毛状根SOD活性的影响
图6为6-BA和NAA对三裂叶野葛毛状根SOD活性的影响。从图6可见,对照三裂叶野葛毛状根中SOD的活性随着培养时间的延长而逐渐升高,培养至25 d时达到最大值,是培养初期 SOD活性的 1.6倍。与对照相比,培养15 d时,6-BA和NAA结合处理的毛状根SOD活性达到最低值 (P<0.01),随后又开始逐渐升高;培养至 25 d时,不同浓度 6-BA和 NAA 2.0 mg/L结合处理的毛状根SOD活性分别是其培养初期的1.5、1.9、1.9、1.5和1.8倍,但仅是同期对照SOD活性的82.9%、89.5%、82.0%、69.0%和78.6% (图6)。可见在0−25 d培养期间,6-BA和NAA结合处理的毛状根SOD活性都低于同期对照,这表明,6-BA和NAA结合可以降低三裂叶野葛毛状根培养物的SOD活性。
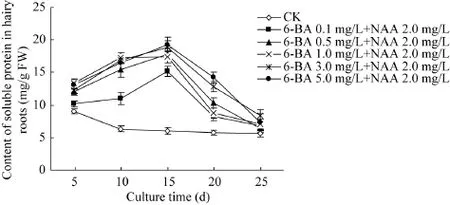
图5 6-BA和NAA对三裂叶野葛毛状根中可溶性蛋白含量的影响Fig. 5 Effects of 6-BA and NAA on the contents of soluble protein in P. phaseoloides hairy roots.
2.7 6-BA和NAA对三裂叶野葛毛状根POD活性的影响
图7为6-BA和NAA结合对三裂叶野葛毛状根POD活性的影响。从图7可见,不同浓度6-BA和NAA 2.0 mg/L结合培养的三裂叶野葛毛状根POD活性,随着培养时间的延长而逐渐升高,且均高于对照活性水平。培养至25 d时,其POD活性达到最大值,6-BA 0.1、0.5、1.0、3.0、5.0和NAA 2.0 mg/L组合培养的毛状根培养物POD活性比培养5 d时分别增加了2.8、4.6、3.0、4.5和3.2倍,分别是同期对照活性水平的1.3、1.9、1.6、1.7 和 1.3 倍 (P<0.05)(图 7)。这说明6-BA和NAA可以提高三裂叶野葛毛状根的POD活性,且其活性水平与毛状根生长受抑制程度和培养时间成正比。
2.8 6-BA和NAA对三裂叶野葛毛状根PCD的影响

图6 6-BA和NAA对三裂叶野葛毛状根中SOD活性的影响Fig. 6 Effects of 6-BA and NAA on the activities of SOD in P. phaseoloides hairy roots.

图7 6-BA和NAA对三裂叶野葛毛状根POD活性的影响Fig. 7 Effects of 6-BA and NAA on the activities of POD in P. phaseoloides hairy roots.

图8 6-BA和NAA处理后三裂叶野葛毛状根中DNA片段的电泳检测Fig. 8 Electrophoresis detection of DNA fragments in P. phaseoloides hairy roots under 6-BA and NAA treatment.(A)Detection of DNA fragments in P. phaseoloides hairy roots under 6-BA treatment alone. (B)Treatment with 6-BA and NAA 2.0 mg/L combination, the 6-BA concentrations was same in (A)and (B). M: marker; 1: 6-BA 0 mg/L; 2:6-BA 0.1 mg/L; 3: 6-BA 0.5 mg/L; 4: 6-BA 1.0 mg/L; 5: 6-BA 3.0 mg/L; 6: 6-BA 5.0 mg/L.
图8为6-BA或6-BA和NAA结合处理对三裂叶野葛毛状根PCD发生的影响。由图8可见,6-BA处理的三裂叶野葛毛状根培养至30 d时,通过琼脂糖凝胶电泳可以检测到140−200 bp大小的 DNA ladder,说明 6-BA可以诱导三裂叶野葛毛状根 PCD的发生 (图 8 A)。而 6-BA和 NAA结合处理的三裂叶野葛毛状根培养至20 d时,可以检测到DNA ladder,而培养至25 d时,其DNA ladder更加明显,这说明6-BA和NAA可以诱导三裂叶野葛毛状根PCD的发生,且NAA具有协同作用 (图8 B)。
3 讨论
已有的研究表明,毛状根的生长及其次生代谢物质的合成受到植物激素等因素的影响,但其影响程度因植物激素种类的不同而异[16]。NAA和IAA可显著地促进人参Panax ginseng毛状根的生长,而低浓度6-BA则可促进人参皂苷的合成和积累[17]。而NAA 1.0 mg/L和6-BA 1.0 mg/L结合则抑制酸浆果Physalis minima毛状根的生长,促进其毛状根培养物中澳洲茄胺的合成与积累,其含量约是对照含量的 3.6倍[18]。2,4-D可以强烈抑制何首乌Polygonum multiflorum毛状根的生长和蒽醌类化合物的合成,而适量浓度的NAA和6-BA结合则可促进毛状根的生长以及蒽醌类化合物的生物合成[8]。然而,在培养黄芩Scutellaria baicalensis毛状根时观察到,NAA可同时促进黄芩毛状根的生长和黄芩苷的合成;而6-BA则只抑制黄芩毛状根的生长,但有利于黄芩苷的合成和积累[19]。同时发现,NAA 0.5 mg/L则可以明显提高紫雪花 Plumbago indica毛状根培养物中矶松素的含量,但2,4-D则明显抑制紫雪花毛状根的生长和矶松素的合成与积累[20]。此外,KT 0.5 mg/L可以促进芜菁Brassica rapa毛状根中芥子油苷的积累,而对白芥Sinapis alba毛状根次生代谢物的含量无明显影响;但是,2,4-D (0.4 mg/L)不仅促进上述两种毛状根的生长,而且降低毛状根培养物中芥子油苷的含量[21]。这表明植物生长调节剂对毛状根的生长及其药用成分合成与积累的调控作用可因植物种类和植物激素种类的不同而有所差异。在本实验中,不同浓度的6-BA或6-BA和NAA结合均抑制三裂叶野葛毛状根的生长,此抑制作用与6-BA的浓度成正相关,且NAA具有协同作用 (图1、3)。虽然6-BA或6-BA和NAA结合可以促进三裂叶野葛毛状根每克干物质中异黄酮化合物的合成与积累,但是降低每个培养瓶中毛状根的总异黄酮化合物含量(10%−26%)(图2、4)。这表明6-BA或6-BA和NAA结合抑制三裂叶野葛毛状根的生长,降低其毛状根干物质量和总异黄酮化合物含量,这与Putalun等的实验结果基本一致[18]。
植物在受到伤害和逆境胁迫后,将开启自身的防御机制,如提高SOD、POD等保护酶的活性水平,同时将体内产生的大量活性氧(Reactive oxygen species, ROS)成分转化为H2O2和H2O,调整体内ROS含量至基准水平而发挥保护作用[22]。在培养黄瓜 Cucumis sativus毛状根时发现,6-BA可以延缓毛状根中可溶性蛋白含量的下降,降低毛状根SOD和POD活性水平,减少其内源性乙烯的释放量,从而调节毛状根的生长和衰老[23]。外施6-BA能有效阻止棉花 Gossypium spp.叶片内可溶性蛋白含量的迅速下降,提高叶片内SOD活性水平,并延缓棉花幼苗的衰老[24]。与对照相比,6-BA和NAA结合提高三裂叶野葛毛状根的可溶性蛋白的含量和POD活性水平,降低其体内的SOD活性水平,这与 Shi等的实验结果不一致 (图 5、6、7)[23]。我们推测,这种差异可能与植物种类及毛状根类型有关。
PCD是植物生长过程中一种重要的生理现象,并可受到许多因素的诱导和影响,如植物激素等[25-26]。高浓度激动素 KT (2.0 mg/L或4.0 mg/L KT)处理棉花悬浮细胞4 d后,不仅出现大量细胞死亡,而且可以检测到 140−180 bp及其倍增的DNA ladder[27]。外施6-BA可以促进烟草 Nicotiana tabacum和胡萝卜 Daucus carota细胞的衰老,诱导细胞PCD的发生,提高衰老相关基因 (Senescence-associated genes,SAG)SAG-12基因的表达水平,促进DNA ladder的形成[28]。实验结果显示,外源6-BA或6-BA和 NAA结合不仅抑制三裂叶野葛毛状根的生长,而且促进毛状根的衰老 (图1、3)。外源6-BA或 6-BA和 NAA结合处理三裂叶野葛毛状根20−30 d后,在毛状根基因组DNA中均可以检测到 140−200 bp或倍增的 DNA ladder,其中6-BA和NAA结合诱导的DNA ladder出现时间比6-BA单独诱导的出现时间提前约10 d (图8)。上述实验结果说明,6-BA或6-BA和NAA均可以促进三裂叶野葛毛状根 PCD的发生,而且NAA在6-BA诱导的PCD过程中具有协同作用。
细胞分裂素和生长素对植物生长发育过程的调控,最终是对靶基因和功能蛋白质表达水平的调控[29]。利用植物激素处理大豆 Glycine max细胞时发现,生长素或细胞分裂素均抑制饥饿相关基因 (Starvation-associated messages,SAMs)SAM22/26/46的表达,诱导S-腺苷高半胱氨酸水解酶基因的上调表达,但二者结合使用时则无诱导效果[30]。细胞分裂素可通过受体蛋白CRE1/AHK4感知和应答其信号,然后通过多级磷酸化作用向下游传递信号,并最终诱导拟南芥培养细胞PCD的发生[26,31]。而在烟草细胞培养过程中,外源生长素可诱导激素响应基因pLS216在转录水平的短暂积累,而细胞分裂素的诱导效果则较生长素迟缓,这与本实验结果不一致[32]。实验结果表明,6-BA或6-BA和NAA结合不仅诱导三裂叶野葛毛状根PCD的发生,而且NAA具有协同作用,但二者调控毛状根的生长、异黄酮化合物的代谢、PCD发生及相关基因表达的机制则尚不清楚,待今后进一步研究。
[1]Wu DL, Chen ZY, Huang XX. A study of Chinese Pueraria. J Trop Subtrop Bot, 1994, 2(3): 12–21(in Chinese).吴德邻, 陈忠毅, 黄向旭. 中国葛属的研究. 热带亚热带植物学报, 1994, 2(3): 12–21.
[2]Guo JP, Sun QR, Zhou Q. Advances of pharmacological research of gegen. Chin Tradit Herb Drugs, 1995, 26(3): 163–165 (in Chinese).郭建平, 孙其荣, 周全. 葛根药理作用研究进展.中草药, 1995, 26(3): 163–165.
[3]Shi HP, Quan H, Spiroskintzios. Induction of hairy roots Pueraria phaseoloides and its culture in liquid and solid medium. Chin J Biotech, 2003,19(3): 307–311 (in Chinese).施和平, 权宏, Spiroskintzios. 三裂叶野葛毛状根的诱导及其固体培养和液体培养. 生物工程学报, 2003, 19(3): 307–311.
[4]Qiao XL, Jiang SG, Lü XF, et al. Effects of phytohormones on plant regeneration and production of flavonoids in transgenic Saussurea involucrate hairy roots. Chin J Biotech, 2011,27(1): 69–75 (in Chinese).乔献丽, 蒋曙光, 吕晓芬, 等. 激素对转基因雪莲毛状根植株再生及类黄酮产生的影响. 生物工程学报, 2011, 27(1): 69–75.
[5]Yang R, Fu CX, Jin ZP, et al. Effects of physical and chemical factors on hairy root growth and flavonoids biosynthesis in the cultures of Saussurea medusa maxim hairy root. Chin J Biotech, 2005, 21(2): 233–238 (in Chinese).杨睿, 付春祥, 金治平, 等. 不同理化因子对雪莲毛状根生长和总黄酮生物合成的影响. 生物工程学报, 2005, 21(2): 233–238.
[6]He HJ, Liang P, Shi HP. Effects of sucrose and light on the growth and production of secondary metabolites in Pueraria phaseoloids hairy roots.Chin J Biotech, 2005, 21(6): 1003–1008 (in Chinese).何含杰, 梁朋, 施和平. 蔗糖和光对三裂叶野葛毛状根生长及次生物质产生的影响. 生物工程学报, 2005, 21(6): 1003–1008.
[7]Condori J, Sivakumar G, Hubstenberger J, et al.Induced biosynthesis of resveratrol and the prenylated stilbenoids arachidin-1 and arachidin-3 in hairy root cultures of peanut: effects of culture medium and growth stage. Plant Physiol Biochem,2010, 48(5): 310–318.
[8]Yu RM, Ma N, Yan CY, et al. Effects of exogenous phytohormones on hairy root growth and biosynthesis of Anthraquinones in the hairy root culture of Polygonum multiflorum. Chin J Biotech, 2006, 22(4): 619–623 (in Chinese).于荣敏, 马娜, 严春艳, 等. 外源激素对何首乌毛状根生长及蒽醌类成分生物合成的影响. 生物工程学报, 2006, 22(4): 619–623.
[9]Wu T, Zhang HT, Wang Y, et al. Induction of root Fe(Ⅲ)reductase activity and proton extrusion by iron deficiency is mediated by auxin-based systemic signaling in Malus xiaojinensis. J Exp Bot, 2012, 63(2): 859–870.
[10]Hentrich M, Bottcher C, Duchting P, et al. The jasmonic acid signaling pathway is linked to anxin homeostasis through the modulation of YUCCA8 and YUCCA9 gene expression. Plant J, 2013,74(4): 626–637.
[11]Xu F, Yang Z, Chen X, et al.6-Benzylaminopurine delays senescence and enhances health-promoting compounds of harvested roccoli. J Agric Food Chem, 2012,60(1): 234–240.
[12]Farkya S, Bisaria VS. Exogenous hormones affecting morphology and biosynthetic potential of hairy root line (LYR2i)of Linum album. J Biosci Bioeng, 2008, 105(2): 140–146.
[13]Bradfoud MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem, 1976, 72: 248–252.
[14]Beauchamp C, Fridovich I. Superoxide dismutase:improved assays and an assay applicable to acrylamide gels. Anal Biochem, 1979, 44(1):276–287.
[15]Shi HP, Eric PT, Wang YL, et al. Effect of cadmium, alone or in combination with CaCl2, on the growth, antioxidative enzyme activity and cadmium absorption of Solanum nigrum L. var pauciflorum hairy roots. Chin J Biotech, 2010,26(2): 147–158 (in Chinese).施和平, 曾宝强, 王云灵, 等. 镉及其与钙组合对褐脉少花龙葵毛状根生长、抗氧化酶活性和吸收镉的影响. 生物工程学报, 2010, 26(2):147–158.
[16]Fang CP, Wang WT, Wang ZF, et al. Effects of phytohormones on hairy root growth and tanshinone biosynthesis of Salvia miltiorrhiza. J Chin Med Mater, 2011, 34(5): 661–664 (in Chinese).房翠萍, 王维婷, 王志芬, 等. 植物激素对丹参毛状根生长和丹参酮生物合成的影响. 中药材,2011, 34(5): 661–664.
[17]Zhou QY, Ding JY, Liu J, et al. Effects of different phytohormones on the growth ad ginsenoside content of Panax ginseng hairy root. J Plant Resource Environ, 2003, 12(1): 26–28 (in Chinese).周倩耘, 丁家宜, 刘峻, 等. 植物激素对人参毛状根生长和皂甙含量的影响. 植物资源与环境学报, 2003, 12(1): 26–28.
[18]Putalun W, Prasamsiwamai P, Tanaka H, et al.Solasodine glycoside production by hairy root cultures of Physalis minima Linn. Biotechnol Lett,2004, 26(7): 545–548.
[19]Qi XJ, Guo LK. Effects of exogenous phytohormones on hairy root of Scutellaria baicalensis and biomass baicalin. J Shaanxi Univ Sci Technol, 2009, 27(2): 48–50 (in Chinese).齐香君, 郭乐康. 外源激素对黄芩毛状根生长及黄芩苷合成的影响. 陕西科技大学学报, 2009,27(2): 48–50.
[20]Gangopadhyay M, Dewanjee S, Bhattacharya S.Enhanced plumbagin production in elicited Plumbago indica hairy root cultures. J Biosci Bioeng, 2011, 111(6): 706–710.
[21]Kastell A, Smetanska I, Ulrichs C, et al. Effects of phytohormones and jasmonic acid on glucosinolate content in hairy root cultures of Sinapis alba and Brassica rapa. Appl Biochem Biotechnol, 2013, 169(2): 624–635.
[22]Mittler R, Vanderauwera S, Gollery M, et al.Reactive oxygen gene network of plants. Trends Plant Sci, 2004, 9(10): 490–498.
[23]Shi HP, Qi Y, Zhang Y, et al. Induction of cucumber hairy roots and effect of cytokinin 6-BA on its growth and morphology. Chin J Biotech,2006, 22(3): 514–520 (in Chinese).施和平, 齐莹, 张悦, 等. 黄瓜毛状根的诱导及细胞分裂素6-BA对其生长和形态的影响. 生物工程学报, 2006, 22(3): 514–520.
[24]Shen FF, Yu SX, Fan SL, et al. The relationship between hornone and membrance lipid peroxidation in cotton leaf during senescence. J Plant Physiol Mol Biol, 2003, 29(6): 589–592 (in Chinese).沈法富, 喻树迅, 范术丽, 等. 棉花叶片衰老过程中激素和膜脂过氧化的关系. 植物生理与分子生物学学报, 2003, 29(6): 589–592.
[25]Coll NS, Epple P, Dangl JL. Programmed cell death in the plant immune system. Cell Death Differ, 2011, 18(8): 1247–1256.
[26]Kunikowska A, Byczkowska A, Doniak M, et al.Cytokinins resume: their signaling and role in programmed cell death in plants. Plant Cell Rep,2013, 32(6): 771–780.
[27]Xia QZ, Zhang MJ, Zhang XL. High concentration of cytokinin induces programmed cell death of cotton suspension cultures.Southwest China J Agri Sci, 2005, 18(5): 579–583(in Chinese).夏启中, 张明菊, 张献龙. 高浓度细胞分裂素诱导棉花悬浮细胞程序性死亡的发生. 西南农业学报, 2005, 18(5): 579–583.
[28]Carmi F, Terzi M, Michele R, et al. High levels of the cytokinin BAP induce PCD by accelerating senescence. Plant Sci, 2004, 4(166): 963–969.
[29]Ye ZH, Varner JE. Expression of an auxin- and cytokinin-regulated gene in cambial region in Zinnia. Proc Natl Acad Sci USA, 1994, 91(14):6539–6543.
[30]Crowell DN, Amasino RM. Induction of specific mRNAs in cultured soybean cells during cytokinin or auxin starvation. Plant Physiol, 1991, 95(3):711–715.
[31]Vescovi M, Riefler M, Gessuti M, et al.Programmed cell death induced by high levels of cytokinin in Arabidopsis cultured cells is mediated by the cytokinin receptor CRE1/AHK4.J Exp Bot, 2012, 63(7): 2825–2832.
[32]Dominov JA, Stenzler L, Lee S, et al. Cytokinins and auxins control the expression of a gene in Nicotiana plumbaginifolia cells by feedback regulation. Plant Cell, 1992, 4(4): 451–461.
