外源钙对镉胁迫下南美蟛蜞菊毛状根生长、抗氧化酶活性和镉吸收的缓解效应
2012-02-10施和平王云灵曾宝强陈利华
施和平,王云灵,曾宝强,陈利华
1 华南师范大学生命科学学院 广东省植物发育生物工程重点实验室,广东 广州 510631
2 香港教育学院科学与环境学系,香港 新界
镉 (Cd) 虽不是植物生长必需的微量元素,但由于其移动性强、被植物吸收利用和累积后,不仅可影响植物的产量和品质,导致植物生长被抑制或产生毒害;而且也易通过食物链进入人和动物体内富集来危及人和动物健康,是目前土壤和水体环境中最受关注的、毒性最强的重金属元素之一,而且Cd污染问题已成为威胁土壤生态安全和制约农业可持续发展的一个重要因素[1]。因而,如何治理和控制重金属Cd污染,寻找降低Cd毒害或修复被Cd污染环境的有效方法,一直是国内外环境科学研究的热点与难点。根既是植物吸收矿质离子的最主要器官,也是镉最直接、最严重的受害器官之一。有研究表明,利用植物尤其是重金属蓄积植物的根系对土壤和水体中某种重金属污染元素具有特殊的吸收富集和转化能力,不失为治理重金属污染,实现生态修复的高效而廉价的有效方法之一[2]。与对照根(自然根) 相比,由发根农杆菌 Agrobacterium rhizogenes感染植物细胞遗传转化后产生的毛状根,由于具有产生分枝侧根能力很强、可快速自主生长,根系极发达及具有很大的吸收面积;近年相继有人利用可离体自主快速生长的毛状根来吸收重金属离子Ni和Cd[3],或根滤重金属铀以修复被放射性金属元素铀污染的环境[4],以及利用毛状根迅速吸收和转化废水中的2,4-D等污染物[5]。但到目前为止,国内外少见利用发根农杆菌遗传转化产生的毛状根或其再生植株来开展对重金属污染物修复的更多研究报道。南美蟛蜞菊Wedelia trilobata (L.) A.S.Hitche是华南地区常见的用作园林绿化的耐阴地被植物和护坡植物,并具有较强的对有害金属元素的吸附积累作用[6],但因其植物根系不发达,目前仍未见大量利用该植物进行环境修复的研究报道。我们曾用发根农杆菌获得了可自主生长的南美蟛蜞菊毛状根[7];而开展其毛状根对重金属镉的吸收和镉耐受能力的研究,是今后开发利用生长迅速,且根系发达的南美蟛蜞菊毛状根系及其再生植株进行重金属镉污染环境生物修复的前提。但至今为止,未见有关重金属 Cd对南美蟛蜞菊毛状根生长和毒害的影响及其对 Cd吸收的任何报道。
钙 (Ca) 是植物生长发育必需的大量元素。已有研究表明,Ca可以与Cd竞争植物根系上吸收位点,降低植物含Cd量[8];而外源Ca可以增强植物对许多非生物逆境的适应性,减轻逆境对植物所造成的伤害[9]。但到目前为止,少见有关Cd和Ca结合对毛状根生长或毒害影响的系统研究报道。
本研究以发根农杆菌遗传转化产生的可在无激素培养基上自主生长的南美蟛蜞菊毛状根为材料,来探讨重金属Cd及其与Ca结合对南美蟛蜞菊毛状根生长、抗氧化酶活性以及吸收 Cd影响的生理机理,旨在为今后开展利用生长迅速的具发达根系的南美蟛蜞菊毛状根及其再生植株来净化被重金属Cd污染的水体和土壤环境奠定实验技术基础和提供可能性。
1 材料与方法
1.1 植物材料
采用由含农杆碱型野生 Ri质粒的发根农杆菌ATCC15834遗传转化南美蟛蜞菊叶片外植体所产生的、能在MS培养基上自主快速生长并已继代培养的毛状根,其诱导和继代培养见欧少云等的方法[7]。
1.2 培养基及培养条件
在探讨培养基中Cd浓度对南美蟛蜞菊毛状根生长、抗氧化酶活性的影响时,采用添加不同浓度Cd (以CdCl2的形式加入) 的液体MS培养基,其中 Cd浓度分别为 0、10、50、100、300 µmol/L;而在探讨Cd与Ca组合对南美蟛蜞菊毛状根生长及酶活性的影响时,采用 200、300 µmol/L Cd和10、20、30 mmol/L Ca组合的MS培养基进行培养;在探讨培养基中Cd浓度及其与 Ca组合对南美蟛蜞菊毛状根吸收及吸附 Cd的影响时,分别采用 100 µmol/L或300 µmol/L Cd和10、20、30 mmol/L Ca组合的MS培养基进行培养。以上所有培养基在灭菌前pH值调至5.8~6.0,经121 ℃高温湿热灭菌后待用。每250 mL锥形瓶中盛50 mL液体培养基,定量接种南美蟛蜞菊毛状根后,将培养瓶置于摇床上,于 (25±2) ℃下振荡培养。
1.3 Cd对南美蟛蜞菊毛状根生长的影响
选取生长旺盛的南美蟛蜞菊毛状根,剪切成4~5 cm且具根尖的根段,按定量接种法接入含有不同浓度Cd或Cd-Ca组合的液体MS培养基中进行暗培养。每锥形瓶的接种量为0.2 g (FW)。在为期 25 d的培养过程中观察毛状根的生长变化并进行生物量的测定。每隔5 d随机抽取不同浓度处理的毛状根培养物各3瓶,用自来水冲洗去培养物上的残留液体培养基,然后再用蒸馏水冲洗并用吸水纸吸干水分后进行毛状根生物量(鲜重) 测量。将新鲜毛状根培养物保存于-80 ℃的超低温冰箱中,用于进行毛状根可溶性蛋白含量、POD、SOD活性和MDA含量的测定。
1.4 毛状根可溶性蛋白含量、POD、SOD活性及MDA含量的测定
为了探讨不同浓度Cd单独及其与Ca组合对毛状根过氧化物酶 (POD) 和超氧化物歧化酶(SOD) 及丙二醛 (MDA) 含量的影响,取毛状根定量接种到仅添加 10、50、100 µmol/L或300 µmol/L Cd及200 µmol/L或300 µmol/L Cd与10~30 mmol/L CaCl2组合的液体MS培养基中进行培养,并分别在培养后5、10、15、20、25 d取样进行测定。其中,毛状根培养物可溶性蛋白含量的测定参照Bradford的方法[10],用考马斯亮蓝G-250进行染色并用紫外分光光度法测定。培养过程中其 SOD活性变化的测定基本按照Beauchamp和 Fridovich的测定方法[11],以抑制NBT光还原50%所需要的酶量为1个酶活性单位;其POD活性的测定按照张志良等的愈创木酚法进行[12],以制备酶提取液所用的磷酸缓冲液作空白对照,用每分钟OD470变化值表示酶活性的大小,即以 OD470/(min·mg) 蛋白表示。MDA含量的测定按Heath和Packer的方法[13]。实验重复测定3次,取平均值。
1.5 南美蟛蜞菊毛状根Cd含量测定
南美蟛蜞菊毛状根在培养2~3 d后,分别移入含100、300 μmol/L Cd 和 (或) 10、20、30 mmol/L CaCl2组合的液体培养基中,分别培养2 d、4 d和6 d后,取出毛状根,用去离子水洗1遍后,再用约50 mL 20 mmol/L EDTA液洗2~3次,收集EDTA洗涤液,经浓缩、常规消化后供测定毛状根吸附的Cd含量用;残余的培养基经滤纸过滤后用去离子水定容至 50 mL ,经常规消化后供测定培养基残存的Cd含量用。毛状根样品置于60 ℃~70 ℃下烘干,精密称取粉碎过的毛状根样品于 100 mL锥形瓶中,加混酸(VHNO3∶VHClO4=4∶1) 15 mL消化,电炉上加热烘干后,1% HNO3定容,供测定毛状根吸收的Cd含量。各样品的Cd含量采用原子吸收分光光度计法测定。其测定条件为:波长228.8 nm,灯电流7 mA,狭缝宽度113 nm,干燥110 ℃,30 s,灰化500 ℃。实验重复测定3次,取平均值。
1.6 数据处理
数据处理采用SPSS13.0软件进行方差分析,采用LSD法进行处理间的差异性比较 (P<0.05),采用Excell 2003进行图表制作。
2 结果与分析
2.1 重金属Cd单独及其与Ca组合对南美蟛蜞菊毛状根生长的影响
南美蟛蜞菊毛状根接种至MS液体培养基中培养1~2 d后,可见从毛状根根段开始产生新的白色侧根,且根段不断伸长。与对照相比,培养至10 d时,无论是低浓度还是高浓度Cd培养的毛状根,其主、侧根都变粗,根段表面从浅红色变成紫红色。其中,10~50 µmol/L Cd培养的毛状根分支能力较强,根尖白色且健壮;而高浓度100~300 µmol/L Cd培养的南美蟛蜞菊毛状根的主根很少伸长,侧根数量少且短小,根尖开始发黄 (图1, A-E)。随着培养基中Cd浓度的升高和培养时间的延长,各浓度 Cd培养的南美蟛蜞菊毛状根在培养后期时根尖都逐渐变黄,起始根段开始变绿,并逐渐老化;而高浓度100~300 µmol/L Cd培养的毛状根根段开始发黑,呈现明显的重金属Cd毒害症状。
图2为Cd浓度对南美蟛蜞菊毛状根生长的影响。从图2可见,对照 (不添加Cd的MS培养基) 毛状根生物量 (鲜重) 在0~20 d的培养期内,随着培养时间的延长而逐渐增加,至培养20 d时达到最大,其生物量增值倍数达到12.475;随后毛状根逐渐老化,生长速率下降。与对照相比,不同浓度Cd培养的毛状根生物量在培养后5~10 d期间也逐渐增加,除高浓度300 μmol/L Cd外,≤100 μmol/L Cd培养的毛状根生物量增殖倍数都与对照相当或略高。但培养15 d后,除低浓度10 μmol/L Cd外,50~300 μmol/L Cd培养的毛状根生物量增殖倍数都随培养基Cd浓度的增加而逐渐下降,培养至 25 d时,高浓度300 μmol/L Cd培养的毛状根鲜重增值倍数仅为同期对照毛状根的40.69%。这表明高浓度Cd不仅抑制南美蟛蜞菊毛状根的生长,而且会使毛状根出现毒害症状。

图1 重金属镉单独及其与钙组合对南美蟛蜞菊毛状根生长形态的影响Fig. 1 Effect of Cd alone or in combination with calcium on the growth and morphology of hairy roots. (A-E) Hairy roots cultured for 10 days in medium with different concentration of Cd. (A) 0 μmol/L. (B) 10 μmol/L. (C) 50 μmol/L. (D) 100 μmol/L. (E) 300 μmol/L. (F-H) Hairy roots cultured for 20 days in medium with 200 μmol/L Cd and 10−30 mmol/L Ca. (F) 200 μmol/L Cd+10 mmol/L Ca. (G) 200 μmol/L Cd +20 mmol/L Ca. (H) 200 μmol/L Cd +30 mmol/L Ca.
图3为200 μmol/L Cd 与10~30 mmol/L Ca组合对南美蟛蜞菊毛状根生长的影响。与对照(仅添加200 μmol/L Cd培养的) 毛状根相比,200 μmol/L Cd与10~30 mmol/L Ca组合培养的毛状根鲜重增值倍数比对照显著提高,其中以200 μmol/L Cd 与20 mmol/L Ca组合培养促进毛状根生长的效果最好,不仅毛状根生长旺盛,而且分支侧根更多;在毛状根培养过程的各个时期,其鲜重增值倍数分别为对照的6.53倍、4.88倍、5.22倍、4.91倍和4.17倍;同时,与对照相比,培养5 d后,200 μmol/L Cd和10~30 mmol/L Ca组合培养的南美蟛蜞菊毛状根根表面也由浅红色变成紫红色,不仅根表面颜色比对照深;且其主、侧根变得更粗而弯曲 (图1,F,G,H)。而与对照 (仅添加300 μmol/L Cd培养的) 毛状根相比,300 μmol/L Cd与10~30 mmol/L Ca组合培养的毛状根根尖褐变程度和根生长受抑制程度明显比对照轻,不仅毛状根根系能产生较多的分枝侧根,根生长形态正常,根尖褐化变慢;而且300 μmol/L Cd 与10~30 mmol/L Ca组合培养的毛状根鲜重增殖倍数与 200 μmol/L Cd和10~30 mmol/L Ca组合培养的趋势相似,其根表面也呈现深紫红色、根体增粗且部分弯曲。这表明,低浓度Cd对毛状根生长的影响较小,甚至促进生长;但高浓度Cd则抑制其生长,且浓度愈高抑制程度愈强,甚至产生毒害;但外源添加10~30 mmol/L Ca可缓解高浓度Cd对毛状根生长的抑制和毒害。
2.2 Cd单独及其与Ca组合对南美蟛蜞菊毛状根可溶性蛋白含量的影响

图2 Cd浓度对南美蟛蜞菊毛状根生长的影响Fig. 2 Effect of Cd concentration in MS medium on the growth of W. trilobata hairy roots.
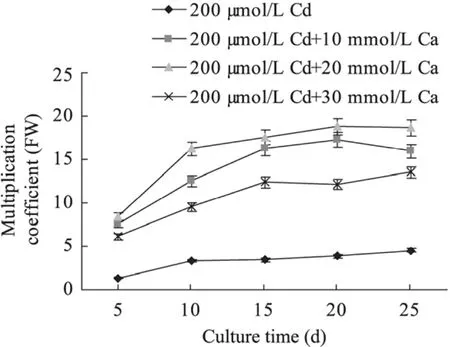
图3 200 μmol/L Cd与10~30 mmol/L Ca组合对南美蟛蜞菊毛状根生长的影响Fig. 3 Effect of 200 μmol/L Cd in combination with 10−30 mmol/L Ca on the growth of W. trilobata hairy roots.
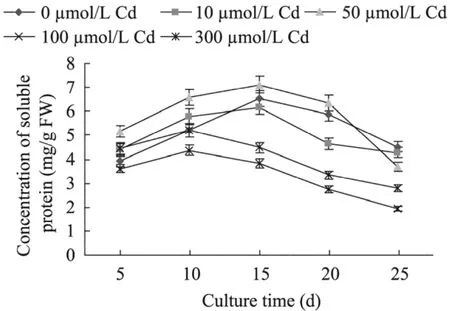
图4 Cd浓度对南美蟛蜞菊毛状根可溶性蛋白含量的影响Fig. 4 Effect of Cd concentration on the soluble protein content in hairy roots of W. trilobata.
图4为培养基Cd浓度对南美蟛蜞菊毛状根可溶性蛋白含量的影响。从图4可见,无论是对照还是不同浓度Cd培养的毛状根,其可溶性蛋白含量都随着培养时间的延长而呈先上升后逐渐下降的趋势。与对照相比,10 µmol/L Cd处理的毛状根可溶性蛋白含量仅在培养后5~10 d期间比同期对照提高;而后随着培养时间延长而逐渐下降。50 µmol/L Cd处理的毛状根可溶性蛋白含量几乎在整个培养期间都比对照提高,其中,以培养15 d的可溶性蛋白含量最高,达到7.12 mg/g FW;而100 µmol/L Cd培养的毛状根可溶性蛋白含量则比对照低;而当毛状根在300 µmol/L Cd中培养时,其可溶性蛋白含量仅在培养后5~10 d期间比同期对照提高,且随着培养时间延长而逐渐下降;但其可溶性蛋白含量在5~25 d的培养期间均比100 µmol/L Cd培养的毛状根高。这表明在培养过程中添加10~50 µmol/L Cd可在一定程度上促进毛状根可溶性蛋白的产生,但随着Cd胁迫时间的延长和Cd浓度的升高,毛状根的蛋白质合成受阻或合成能力逐渐下降。
而与对照 (仅添加 200 µmol/L Cd) 培养的毛状根相比,200 µmol/L Cd和10~20 mmol/L Ca组合培养的毛状根可溶性蛋白含量在培养后5~15 d间均比对照略高,而当毛状根在200 µmol/L Cd和30 mmol/L Ca组合的培养基中培养时,虽在培养5~15 d期间的可溶性蛋白含量比对照低,但在培养15~25 d期间,其可溶性蛋白含量随培养时间的延长而逐渐升高,且明显高于对照。与对照 (仅添加300 µmol/L Cd培养的毛状根) 相比,300 µmol/L Cd和10~30 mmol/L Ca组合培养的毛状根可溶性蛋白含量也随着培养时间的延长呈现先升高后逐渐下降的趋势,但其含量均比同期对照明显升高,尤其是当毛状根在300 µmol/L Cd和30 mmol/L Ca中培养时,其可溶性蛋白含量分别是同期对照的 2.39倍、1.80倍、1.62倍、3.11倍和 2.67倍。这表明,随着Cd胁迫处理时间的延长,Ca可能通过促进蛋白水解酶活性,加强了某些蛋白质的分解,通过提高南美蟛蜞菊毛状根的可溶性蛋白含量来影响重金属Cd对毛状根生长的抑制或毒害。
2.3 Cd单独及其与Ca组合对南美蟛蜞菊毛状根POD活性的影响
植物体内的超氧化物歧化酶 (SOD)、过氧化物酶 (POD) 是活性氧自由基清除系统中重要的保护酶,其活性的提高可以为细胞清除过多的自由基,是使细胞免受毒害的调节反应,但这种调节能力有一定限度。从图5可见,对照 (0 µmol/L Cd培养的毛状根) 的POD活性在培养过程中呈缓慢上升的趋势,与对照相比,不同浓度Cd培养的毛状根POD活性则呈先上升后下降的趋势;而无论是低浓度Cd (10 µmol/L和50 µmol/L) 还是高浓度Cd (100 µmol/L和300 µmol/L) 培养的毛状根POD活性在5~20 d内均比同期对照高。其中,100 µmol/L Cd培养的毛状根POD活性在培养至10 d达到最高,为同期对照的1.47倍,但培养10 d后其POD活性随着培养时间的延长而逐渐下降,至培养25 d时其POD活性甚至比对照及其他浓度 Cd培养的都低;而300 µmol/L Cd培养的毛状根POD活性则在培养的各个时期都比对照和其他镉浓度培养的毛状根高,其POD活性分别比同期对照增加25.6%、63.6%、77.6%、64.4%和44.4%,达到显著水平 (P<0.05)。这表明,在一定Cd浓度范围内南美蟛蜞菊毛状根可通过提高其POD活性来抵御Cd胁迫引起的毛状根生长的抑制或毒害。
图6为200 µmol/L与10~30 mmol/L Ca组合对南美蟛蜞菊毛状根POD活性影响的测定结果。从图6可见,200 µmol/L Cd和10~30 mmol/L Ca组合培养的毛状根 POD活性均比对照 (仅添加200 µmol/L Cd) 毛状根的POD活性明显降低,其毛状根POD活性在培养后5~20 d内均随时间的延长而逐渐升高;20 d后,除200 µmol/L Cd和30 mmol/L Ca组合培养的毛状根POD活性继续升高外,200 µmol/L Cd和 10 mmol/L及20 mmol/L Ca组合培养的毛状根POD活性迅速下降,培养到25 d时分别仅为对照的31.1%和38.0%。而300 µmol/L Cd和10~30 mmol/L Ca组合培养的毛状根POD活性与200 µmol/L Cd和10~30 mmol/L Ca组合培养的毛状根的POD活性变化趋势相似,其 POD活性也比仅添加300 µmol/L Cd培养的毛状根明显降低。这表明,外源Ca与Cd组合可以明显降低南美蟛蜞菊毛状根的POD活性,并可能通过对POD活性的调节来拮抗或减轻重金属Cd对南美蟛蜞菊毛状根生长的抑制或毒害。
2.4 Cd单独及其与Ca组合对南美蟛蜞菊毛状根SOD活性的影响

图5 Cd浓度对南美蟛蜞菊毛状根POD活性的影响Fig. 5 Effect of Cd concentrations on POD activities in hairy roots of W. trilobata.
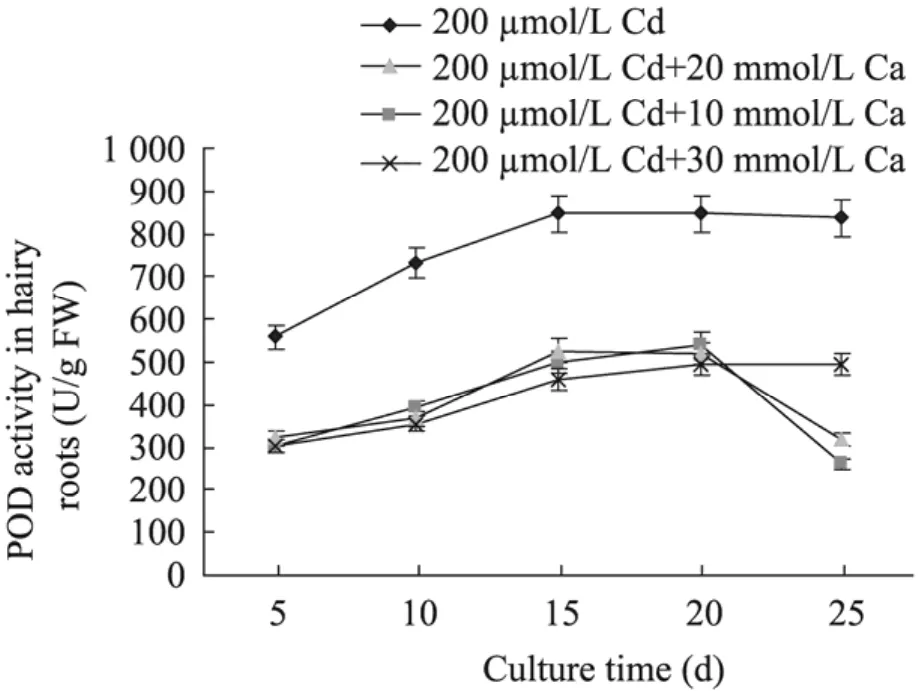
图6 200 μmol/L Cd与10~30 mmol/L Ca组合对南美蟛蜞菊毛状根POD活性的影响Fig. 6 Effect of 200 μmol/L Cd in combination with 10−30 mmol/L Ca on POD activities in hairy roots of W. trilobata.
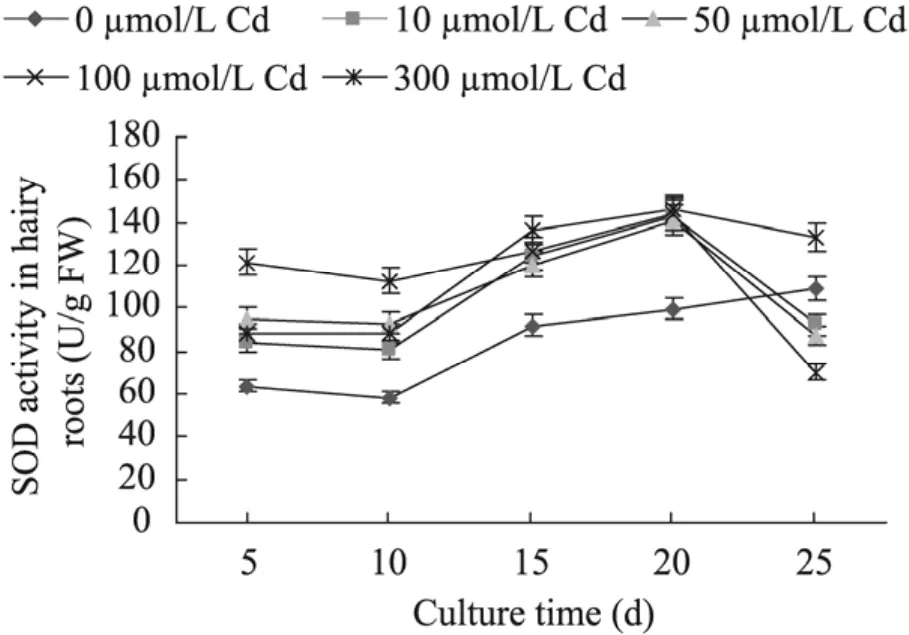
图7 Cd浓度对南美蟛蜞菊毛状根SOD活性的影响Fig. 7 Effect of Cd concentrations on SOD activities in hairy roots of W. trilobata.
图7为Cd浓度对南美蟛蜞菊毛状根SOD活性影响的测定结果。从图7可见,与对照相比,不同浓度Cd培养的南美蟛蜞菊毛状根SOD活性在培养后5~20 d间随培养时间的延长而逐渐升高,且其活性均比同期对照明显提高;而培养 20 d后,对照毛状根的SOD活性继续上升;而不同浓度Cd培养的毛状根SOD活性则逐渐下降,培养至25 d时,10、50、100 µmol/L Cd培养的毛状根 SOD活性甚至比同期对照还低;其中以100 µmol/L Cd培养的毛状根SOD活性最低,仅为同期对照SOD活性的64.06%。该结果表明,重金属Cd可明显提高毛状根的SOD活性,并可能通过对毛状根SOD活性的调节来影响Cd对毛状根生长的抑制或毒害。
而与对照相比,当南美蟛蜞菊毛状根在200 µmol/L Cd和10 mmol/L 或30 mmol/L Ca中培养5~20 d时,其SOD活性大都比同期仅添加200 µmol/L Cd培养的毛状根低,但培养至20~25 d时其SOD活性与对照相当或略升高;而200 µmol/L Cd和20 mmol/L Ca培养的毛状根SOD活性在培养后5~25 d期间则始终比对照降低,培养至 25 d时其 SOD活性为同期对照的46.76%。此外,当毛状根在300 µmol/L Cd和10、20和30 mmol/L Ca组合中培养时,在整个培养过程中其SOD活性呈先升后降的趋势,其SOD活性均较对应的仅添加300 µmol/L Cd培养的毛状根不同程度的降低。可见,与仅加高浓度 Cd培养的毛状根相比,外源加入10~30 mmol/L Ca可降低毛状根的SOD活性。而SOD作为一种重要的防御酶,其活性的维持和提高是植物耐受Cd胁迫的物质基础之一。该结果表明,南美蟛蜞菊毛状根对Cd胁迫具有一定的耐受能力;而外源添加一定浓度的 Ca可能通过降低毛状根的SOD活性,来减轻或缓解重金属Cd对南美蟛蜞菊毛状根生长的抑制或毒害。
2.5 Cd单独及其与Ca组合对南美蟛蜞菊毛状根MDA含量的影响
膜脂过氧化产物MDA含量的高低是细胞膜受损伤程度的重要指标之一。从图8可见,无论南美蟛蜞菊毛状根是在10 µmol/L或50 µmol/L低浓度 Cd,还是在高浓度 100 µmol/L Cd和300 µmol/L Cd中培养,其MDA含量均比同期对照升高,并且随着Cd浓度的增加而逐渐升高;其中,以300 µmol/L Cd培养的毛状根MDA含量最高,在整个培养过程中,其MDA含量分别为同期对照毛状根MDA含量的1.53、1.49、1.23、1.17和2.10倍。这可能表明,重金属Cd对南美蟛蜞菊毛状根生长的抑制或毒害可能与其对毛状根细胞膜脂过氧化的促进有关。

图8 Cd浓度对南美蟛蜞菊毛状根MDA含量的影响Fig. 8 Effect of Cd concentration on MDA content in hairy roots of W. trilobata.
而与对照 (仅添加 200 µmol/L Cd) 相比,200 µmol/L Cd和20~30 mmol/L Ca组合培养的南美蟛蜞菊毛状根 MDA含量比对照降低,而200 µmol/L Cd和10 mmol/L Ca组合培养的毛状根 MDA含量在 5~15 d培养期间比对照略高,而培养 15 d后也逐渐降低,至培养 25 d时其MDA含量比同期对照降低了33.72%。图9为300 µmol/L Cd与10~30 mmol/L Ca组合对南美蟛蜞菊毛状根 MDA含量的影响。从图 9可见,与对照 (仅添加300 µmol/L Cd) 相比,300 µmol/L Cd和10、20和30 mmol/L Ca组合培养的毛状根MDA含量在培养后5~20 d期间,其MDA含量都比对照明显降低;而培养至25 d时,300 µmol/L Cd和10~20 mmol/L Ca组合培养的毛状根的MDA含量略高于对照,但300 µmol/L Cd和30 mmol/L Ca培养毛状根的MDA含量则比对照低。可见,外源加入10~30 mmol/L Ca可降低毛状根的MDA含量。这可能表明,外源Ca可能通过降低毛状根细胞膜脂过氧化程度而对重金属镉对毛状根生长的抑制或毒害产生拮抗作用或缓解效应。
2.6 Cd2+及其与 Ca2+组合对南美蟛蜞菊毛状根吸收Cd2+的影响
图10为培养液Cd2+浓度对南美蟛蜞菊毛状根吸收重金属Cd2+的影响。从图10可见,当毛状根在含有100 µmol/L和300 µmol/L Cd2+的培养基中培养时,毛状根能从培养基中吸收重金属Cd2+,其中当培养基镉浓度100 µmol/L Cd2+时,毛状根对Cd2+的吸收量较高,且Cd2+吸收量随培养时间的延长而逐渐升高。然而,当毛状根在300 µmol/L Cd2+培养基中培养2 d、4 d和6 d后,其Cd2+吸收量则分别比100 µmol/L Cd2+培养的同期毛状根降低约40.23%、32.35%和42.53%。这表明,南美蟛蜞菊毛状根能吸收重金属Cd2+,但其对 Cd2+的吸收效率与 Cd2+的浓度和培养时间的长短等因素有关。

图9 300 μmol/LCd与10~30 mmol/L Ca组合对南美蟛蜞菊毛状根MDA含量的影响Fig. 9 Effect of 300 μmol/L Cd in combination with 10−30 mmol/L Ca on on MDA content in hairy roots of W. trilobata.
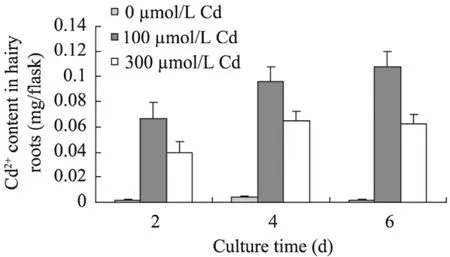
图10 Cd2+浓度对南美蟛蜞菊毛状根吸收 Cd2+的影响Fig. 10 Effect of Cd concentrations on absorption of Cd2+ in hairy roots of W. trilobata.
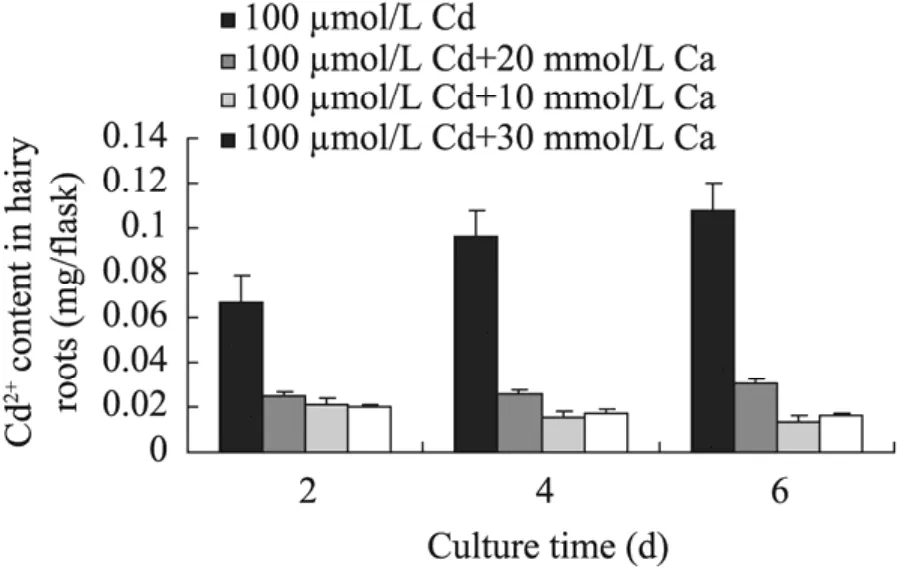
图11 100 μmol/L Cd2+与10~30 mmol/L Ca2+组合对南美蟛蜞菊毛状根吸收Cd2+的影响Fig. 11 Effect of 100 μmol/L Cd2+ in combination with 10−30 mmol/L Ca2+ on absorption of Cd2+ in hairy roots of W. trilobata.
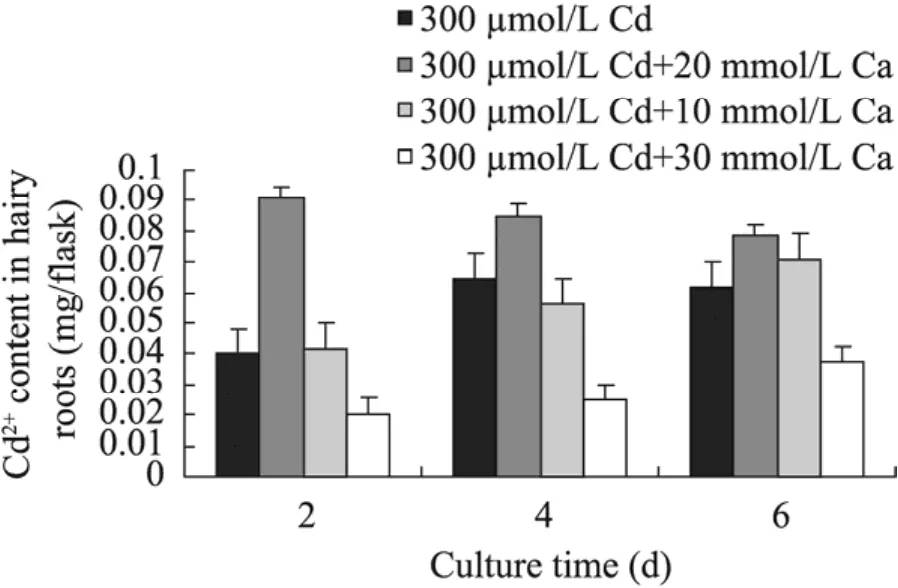
图12 300 μmol/L Cd2+与10~30 mmol/L Ca2+组合对南美蟛蜞菊毛状根吸收Cd2+的影响Fig. 12 Effect of 300 μmol/L Cd2+ in combination with 10−30 mmol/L Ca2+ on absorption of Cd2+ in hairy roots of W. trilobata.
图11和图 12分别为 100 µmol/L Cd2+和300 µmol/L Cd2+与10~30 mmol/L Ca2+组合培养对南美蟛蜞菊毛状根吸收Cd2+的测定结果。由图11可知,与对照 (仅添加100 µmol/L Cd2+培养的毛状根) 相比,外源添加10~30 mmol/L Ca2+可显著降低毛状根对Cd2+的吸收,其镉含量大都随培养基中Ca2+浓度的升高而逐渐下降。培养到第6天时,100 µmol/L Cd2+与10~30 mmol/L Ca2+组合培养的毛状根对 Cd2+的吸收量分别比同期对照降低了71.56%、87.49%和85.32%,达到显著水平 (P<0.05)。而从图 12可见,与对照 (仅添加300 µmol/L Cd2+培养的) 毛状根相比,外源加入10 mmol/L Ca2+时,毛状根对Cd2+的吸收量不但没有降低,反而比对照有明显提高,培养2 d、4 d和6 d时其毛状根Cd2+含量分别为同期对照毛状根Cd2+吸收量的2.26倍、1.31倍和1.26倍;但外源加入30 mmol/L Ca2+时毛状根对Cd2+的吸收才受到明显抑制,培养至6 d时,其毛状根吸收的Cd2+含量约比同期对照降低61.58%。可见,外源添加 Ca2+可以影响南美蟛蜞菊毛状根对重金属Cd2+的吸收能力,但当用高浓度Cd2+培养毛状根时,需添加较高浓度的外源Ca2+才能有效抑制毛状根对Cd2+的吸收。而这表明外源Ca2+可能通过降低或减少毛状根对Cd2+的吸收,从而拮抗或减弱高浓度Cd2+对毛状根生长的抑制或毒害。
2.7 Cd2+及其与 Ca2+组合对南美蟛蜞菊毛状根吸附Cd2+的影响
图13为Cd2+浓度对南美蟛蜞菊毛状根吸附Cd2+的影响。从图 13可见,当毛状根在含有100 µmol/L和300 µmol/L Cd2+的培养基中培养时,毛状根能吸附培养基中的Cd2+,并且其Cd2+吸附量随培养基 Cd2+浓度的增加及培养时间的延长而升高;其中300 µmol/L Cd2+培养的毛状根吸附的Cd2+含量较100 µmol/L Cd2+培养的高,培养2 d、4 d和6 d后,其Cd2+吸附量分别约为同期100 µmol/L Cd2+的0.82倍、3.74倍和5.26倍。这表明,南美蟛蜞菊毛状根具有较强的吸附重金属Cd2+的能力,且毛状根对镉的吸附作用与所用的Cd2+浓度及培养时间长短等有关。

图13 Cd2+浓度对EDTA洗脱的毛状根重金属Cd2+含量的影响Fig. 13 Effect of Cd2+ concentration on Cd2+ content diluted by EDTA solution from hairy roots of W. trilobata.
图14为100 µmol/L和10~30 mmol/L Ca2+组合对南美蟛蜞菊毛状根吸附Cd2+的测定结果。由图14可知,与对照 (仅100 µmol/L Cd2+培养的毛状根) 相比,外源加入 10~30 mmol/L Ca2+时毛状根对 Cd2+的吸附量随着 Ca2+浓度的升高增加而逐渐降低;其中以培养4 d时100 µmol/L Cd2+与 10~30 mmol/L Ca2+组合培养的毛状根对Cd2+的吸附量下降程度最明显,其Cd2+吸附量分别比同期对照下降约38.16%、62.26%和66.90%,达到显著水平 (P<0.05)。而与100 µmol/L Cd2+与10~30 mmol/L Ca2+组合相比,300 µmol/L Cd2+和 10~30 mmol/L Ca2+组合更可降低毛状根对Cd2+的吸附量;培养到6 d时,毛状根对Cd2+的吸附量分别比同期对照 (仅添加 300 µmol/L Cd2+培养的毛状根) 下降了 66.01%、71.13%和97.53%,差异达到显著水平 (P<0.05)。可见,外源加入10~30 mmol/L Ca2+能不同程度地降低毛状根对Cd2+的吸附量,并因而减少Cd2+对南美蟛蜞菊毛状根的抑制或毒害。

图14 100 μmol/L Cd2+与10~30 mmol/L Ca2+组合对EDTA洗脱的毛状根Cd2+含量的影响Fig. 14 Effect of 100 μmol/L Cd2+ in combination with 10−30 mmol/L Ca2+ on Cd2+ content diluted by EDTA solution from hairy roots of W. trilobata.
3 讨论
一些研究表明,Cd对植物生长、根的形态和侧根发生及其毒害的影响具有浓度剂量效应和因植物类型而异[14-15],如低浓度 (0.1 mg/L) Cd可促进小白菜Brassica chinensis L.侧根的发育,而≥5 mg/L Cd 则可使小白菜根变短变粗,根毛缺乏,侧根分枝减少[14];而受镉毒害的玉米幼苗根尖膨大变褐继而腐烂[15]。然而,所有这些有关Cd对植物生长和毒害的研究大都是通过水培、沙培或盆栽的方法来研究Cd对完整植株生长的影响,少见有关Cd对细胞培养物如愈伤组织或毛状根生长影响的系统研究报道,未见有关重金属Cd对南美蟛蜞菊W. trilobata毛状根生长影响及其Cd耐受能力研究的报道。Fornazier 等发现,低浓度 (0.01~0.1 mmol/L) CdCl2能明显促进甘蔗Saccharum officinarum L. 愈伤组织的生长,但高浓度 (0.5~1 mmol/L) CdCl2则强烈抑制其生长[16]。这与本实验的结果不完全一致。在本实验中,培养基中Cd≤50 μmol/L 时能促进南美蟛蜞菊毛状根生长,而高于100 μmol/L Cd 则抑制毛状根生长,使其侧根短小,根尖发褐或变黑,浓度越高抑制越重甚至产生毒害。所不同的是,在本实验中,无论是低浓度还是高浓度Cd培养南美蟛蜞菊毛状根,培养10 d后其主、侧根都变粗,分支较对照少;根体由浅红色变成紫红色;之后,随着培养时间的延长和培养基Cd浓度的加大,毛状根根尖逐渐变黄,直至发褐或变黑。然而,张艳等[17]液体培养黄瓜毛状根时发现,Cd≤10 mg/L能促进毛状根生长,并使根增粗,而Cd≥15 mg/L才抑制黄瓜毛状根生长,使根变得十分短而小,根尖膨大但不变褐,根表面变红。此外,Cd≤50 µmol/L几乎不影响褐脉少花龙葵毛状根的生长,甚至还能略促进生长;但≥100 µmol/L高浓度Cd则开始抑制生长,且浓度愈高抑制作用愈明显,使毛状根侧根根尖变褐变短,数目减少[18]。这与本实验的结果不完全一致。而这种差异表明重金属Cd对植物毛状根生长及毒害影响的程度不仅具有剂量效应,而且还可因植物或毛状根类型而异。
已有的研究表明,Cd对植物的毒害可能是通过损害生物体内的抗氧化保护酶POD和SOD的活性及蛋白质的合成等变化表现出毒性[19]。如低浓度Cd能促进植物蛋白质合成,但高浓度Cd则对蛋白质合成起破坏或抑制作用[15]。而张利红等在研究Cd污染对小麦生长和部分生理特性影响时发现,随着 Cd浓度的增加,小麦幼苗的SOD、POD活性随Cd浓度的增高而增加[20];而不同浓度Cd培养的黄瓜毛状根可溶性蛋白含量大都随着培养时间延长而逐渐下降,但其 SOD和 POD活性则逐渐升高[17]。然而在高浓度 Cd培养时,油菜Brassica napus L. cv Drakkar植株的抗氧化酶SOD和CAT活性均急剧下降;但高浓度Cd也可显著降低白菜Brassica campestris L. ssp. chinensis (L.) Makino叶片和芦苇Phragmite ausralis L.幼苗的SOD、CAT及POD 活性[21-22];然而也有报道表明,在超积累植物庭荠 Alyssum maritimum L.中,高浓度 Cd却可提高该植物的SOD活性[23];而受Cd胁迫时,印度芥菜Brassica juncea L.植株的抗氧化酶活性则保持恒定或几乎不变[24]。此外,随着镉浓度增加,土培的Cd超富集植物圆锥南芥 Arabis paniculata Franch的SOD活性呈下降趋势,但其POD和CAT等活性则呈先升高后降低的变化趋势[25]。而这些与本实验的结果不一致。在本实验中,各浓度Cd培养的南美蟛蜞菊毛状根的POD和SOD活性均随着Cd浓度提高而逐渐升高,其中尤以POD活性的表现最为明显,300 μmol/L Cd培养的毛状根POD活性明显高于其他浓度培养的毛状根。这些结论表明,Cd对植物抗氧化保护酶活性的影响程度可能与所使用的Cd浓度、植物类型以及毛状根的生长特性等有关。
丙二醛 (MDA) 是植物细胞膜脂过氧化作用的产物之一,其含量的高低在一定程度上能反映膜脂过氧化水平和膜结构的受害程度及植株的自我修复能力。有关Cd促进植物细胞膜脂质过氧化已有不少报道。如用10~50 μmol/L Cd培养印度芥菜和油菜时发现,Cd胁迫仅使油菜体内的脂质过氧化水平增加,而印度芥菜的 MDA含量则保持不变[24]。但扁桃Prunus dulcis L.幼苗在0~150 μmol/L Cd 水培时发现,无论是根还是叶中,高浓度Cd 可通过提高脂质过氧化水平而对植株产生氧化损伤[26]。而在本实验中,无论南美蟛蜞菊毛状根在低浓度≤50 μmol/L Cd,还是在高浓度 (>100 μmol/L Cd) 中培养,其MDA含量大都比同期对照 (不加 Cd处理) 升高,并且300 μmol/L Cd 处理的MDA含量在培养的各个时期几乎都是最高的。而施和平等[18]报道,不同浓度Cd培养的褐脉少花龙葵毛状根MDA含量均比同期对照显著提高,表明Cd可促进毛状根细胞膜脂质过氧化。然而,在Cd胁迫处理的胡萝卜Daucus carota L. 植株及其毛状根中并未出现明显的膜脂过氧化[27]。这显然与本实验的结果相反。而这种差异的产生表明Cd对植物细胞膜脂过氧化的促进也可能因所使用的Cd浓度、植物种类和毛状根类型等而异。
Ca是植物生长发育必需的大量元素。已有的研究表明,外源钙可能通过对有害矿质元素的拮抗作用[28]、维持较高的抗氧化保护酶系统活力[29]以及发挥钙信使系统的功能[30]等而发挥作用。如在镉胁迫下,玉米根部供钙可明显提高其SOD、POD和CAT 活性,降低其叶片丙二醛含量[15]。而在 Cd2+毒害下,用 5 mmol/L Ca2+和10 mmol/L Ca2+处理玉米种子后,其幼苗的SOD和CAT活性增加,而MDA含量逐渐下降,表明Ca能减少以至消除Cd2+对种子活力和幼苗生长的毒害作用[31]。然而,这些研究都是以完整植物为材料,少见有关Ca和Cd结合对毛状根生长影响的研究报道。在本实验中,南美蟛蜞菊毛状根不仅能从培养基中吸收和吸附Cd2+,而且,所吸收和吸附的 Cd2+含量随着培养基 Cd2+浓度的升高而增加;但外源加入 10~30 mmol/L Ca2+后,毛状根吸收和吸附的Cd2+含量则逐渐降低。此外还发现,与仅添加 Cd2+培养相比,外加10~30 mmol/L Ca2+不仅能通过离子拮抗而减少毛状根对Cd2+的吸收,降低其Cd2+含量,而且可降低毛状根可溶性蛋白含量和MDA含量,提高其抗氧化酶SOD活性,降低其膜脂过氧化水平,从而解除或减轻重金属Cd2+对其生长的毒害。贺迪等[22]发现,在营养液中 Cd2+浓度由 2 μmol/L增加到0.6 mmol/L时,芦苇幼苗的SOD、CAT和 POD等抗氧化酶活性显著降低,而加入10 mmol/L CaCl2则可抑制 MDA产生,并刺激Cd2+胁迫芦苇幼苗叶片SOD和CAT活性的增强,从而提高芦苇对Cd2+的抗性。而这与本实验的结果相似。这说明,外源 Ca2+可以缓解过量 Cd2+胁迫引起的膜脂过氧化和刺激植物细胞抗氧化酶活性的提高,从而对Cd2+导致的毛状根生长的抑制或毒害产生拮抗或缓解效果。
有研究表明,外源Ca2+在逆境胁迫中的作用可能与Ca2+-CaM的作用或与Ca2+在稳定细胞结构方面发挥的作用有关[30]。而在研究Cd2+对萝卜Raphanus sativus L. 种子萌发和幼苗生长时还发现,Ca2+可部分逆转Cd2+对种子生长和Cd2+吸收的抑制,而Cd2+不仅可与Ca2+竞争CaM的结合位点;还可抑制Ca2+-CaM依赖的磷酸二酯酶的活化,这表明Cd2+对种子萌发的毒害是通过Cd2+对Ca2+-CaM的影响而发挥作用[32]。而在我们的结果中,外源供给10~30 mmol/L Ca2+后,毛状根吸收和吸附的Cd2+含量虽比对照明显降低,或随着培养基中Ca2+浓度增加而降低,但含有相当高含量Cd2+的毛状根仍能较好地正常生长。这表明外源加入足够 Ca2+并不能完全抑制毛状根对Cd2+的吸收和吸附;而这是否表明在Cd-Ca拮抗过程中,外源Ca2+是否是通过Ca2+-CaM介导而发挥作用?或者说是否通过维持细胞内 Ca2+的低稳态水平而发挥其生理作用?重金属镉毒害是否与通过影响Ca2+-CaM的功能有关则待进一步研究。
本实验的结果表明,南美蟛蜞菊毛状根具有较强的重金属Cd耐受能力;而外源加入Ca可拮抗Cd对毛状根生长的抑制或毒害,减少毛状根对Cd的吸收和吸附。我们的结果为今后利用具发达根系的南美蟛蜞菊毛状根及其再生植株来对受重金属Cd污染的环境进行植物修复奠定了相关的前期工作基础并提供了可能性。
[1] Wagner GJ. Accumulation of cadmium in crop plants and its consequences to human health. Adv Agron, 1993, 51(5): 173−212.
[2] Salt DE, Blaylock M, Kumar NPBA, et al. Phytoremediation: a novel strategy for the removal of toxic metals from the environment using plants. Biotechnology, 1995, 13(5): 468−474.
[3] Boominathan R, Doran PM. Cadmium tolerance and antioxidative defenses in hairy roots of the cadmium hyperaccumulator, Thlaspi caerulescens. Biotechnol Bioeng, 2003, 83(2): 158−167.
[4] Eapen S, Suseelan KN, Tivarekar S, et al. Potential
for rhizofiltration of uranium using hairy root cultures of Brassica juncea and Chenopodium amaranticolor. Environ Res, 2003, 91(2): 127−133. [5] Angelinia VA, Orejasb J, Medinaa MI, et al. Scale up of 2,4-dichlorophenol removal from aqueous solutions using Brassica napus hairy roots. J Hazard Mater, 2011, 185(1): 269−274.
[6] Qian JH, Zayed A, Zhu YL, et al. Phytoaccumulation of trace elements by wetland plants: III. uptake and accumulation of ten trace elements by twelve plant species. J Environ Qual, 1999, 28(5): 1448−1455.
[7] Ou SY, Shi HP, Tsang PK Eric. Induction and in vitro culture of Wedelia trilobata hairy roots. Chin J Biotech, 2010, 26(3): 378−385.欧少云, 施和平, 曾宝强. 南美蟛蜞菊毛状根诱导及其离体培养. 生物工程学报, 2010, 26(3): 378−385.
[8] Andersson A, Nillsson KO. Influence of lime and soil pH on Cd availability to plants. Ambio, 1974, 3(5): 198−200.
[9] Jiang YB, Li JH, Fang LY, et al. Effect of calcium on drought resisting of alfalfa seedlings. Chin J Grassland, 2008, 30(1): 117−120.姜义宝, 李建华, 方丽云, 等. 钙处理对苜蓿幼苗抗旱性的影响. 中国草地学报, 2008, 30(1): 117−120.
[10] Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976, 72(1/2): 248−254.
[11] Beauchamp C, Fridovich I. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels. Anal Biochem, 1971, 44(1): 276−287.
[12] Zhang ZL, Zhai WJ. A Text-Manual for Plant Physiology. 3rd ed. Beijing: Higher Education Press, 2003: 123−124.张志良, 翟伟菁. 植物生理学实验指导. 3版. 北京: 高等教育出版社, 2003: 123−124.
[13] Heath RL, Packer L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation. Arch Biochem Biophys, 1968, 125(1): 189−198.
[14] Qin TC, Wu YS, Wang HX, et al. Effect of cadmium, lead and their interactions on the physiological and ecological characteristics of root system of Brassica chinensis. Acta Ecol Sin, 1998, 18(3): 320−325.秦天才, 吴玉树, 王焕校, 等. 镉、铅及其相互作用对小白菜根系生理生态效应的研究. 生态学报, 1998, 18(3): 320−325.
[15] Kong XS, Guo XP, Zhang MX. Effect of Cadmium stress on seed leng growth and physiologychemistry of maize. J Huazhong Agri Univ, 1999, 18(2): 111−113.孔祥生, 郭秀璞, 张妙霞. 镉胁迫对玉米幼苗生长及生理生化的影响. 华中农业大学学报, 1999, 18(2): 111−113.
[16] Fornazier RF, Ferreira RR, Pereira GJG, et al. Cadmium stress in sugar cane callus cultures: Effect on antioxidant enzymes. Plant Cell Tiss Org Cult, 2002, 71(2): 125−131.
[17] Zhang Y, Shi HP, Tsang PK Eric. Influences of heavy metal cadmium alone and in combination with zinc on the growth and activities of antioxidant enzymes of Cucumis sativus hairy roots. Chin J Biotech, 2009, 25(1): 60−68.张艳, 施和平, 曾宝强. 重金属镉及其与锌组合对黄瓜毛状根生长及其抗氧化酶活性的影响. 生物工程学报, 2009, 25(1): 60−68.
[18] Shi HP, Tsang PK Eric, Wang YL, et al. Effect of cadmium, alone or in combination with CaCl2, on the growth, antioxidative enzyme activity and cadmium absorption of Solanum nigrum L. var pauciflorum hairy roots. Chin J Biotech, 2010, 26(2): 147−158.施和平, 曾宝强, 王云灵, 等. 镉及其与钙组合对褐脉少花龙葵毛状根生长、抗氧化酶活性和吸收镉的影响. 生物工程学报, 2010, 26(2): 147−158.
[19] Chugh LK, Gupta VK, Sawhney SK. Effect of cadmium on enzymes of nitrogen metabolism in pea seedlings. Phytochemistry, 1992, 31(2): 395−400.
[20] Zhang LH, Li PJ, Li XM, et al. Effects of cadmium stress on the growth and physiological characteristics of wheat seedlings. Chin J Ecol, 2005, 24(4): 458−460.张利红, 李培军, 李雪梅, 等. 镉胁迫对小麦幼苗生长及生理特性的影响. 生态学杂志, 2005, 24(4): 458−460.
[21] Sun GW, Zhu ZJ, Fang XZ. Effects of different cadmium levels on the growth and antioxidant enzymes in Brassica campestris L. ssp. chinensis (L.) Makino. Acta Horticul Sin, 2004, 31(3): 378−380.孙光闻, 朱祝军, 方学智. 不同镉水平对白菜生长及抗氧化酶活性的影响. 园艺学报, 2004, 31(3): 378−380.
[22] He D, Liu YG, Huang YE, et al. Effects of calcium on chlorophyll and antioxidant enzymes in Phragmite ausralis under cadmium stress. J Agro-Environ Sci, 2007, 26(1): 197−201.贺迪, 刘云国, 黄玉娥, 等. 钙对不同浓度镉胁迫下芦苇幼苗叶绿素及抗氧化酶系统的影响. 农业环境科学学报, 2007, 26(1): 197−201.
[23] Schickler H, Capsi H. Response of antioxidative enzymes to nickel and cadmium stress in hyperaccumulator plants of the genus Alyssum. Physiol Plant, 1999, 105(1): 39−44.
[24] Nouairi I, Ben Ammar W, Ben Youssef N, et al. Antioxidant defense system in leaves of Indian mustard (Brassica juncea) and rape (Brassica napus) under cadmium stress. Acta Physiol Plant, 2009, 31(2): 237−247.
[25] Yu FM, Tang YT, Qiu RL, et al. Antioxidative responses to cadmium stress in the hyperaccumulator Arabis paniculata Franch. Acta Sci Circum, 2010, 30(2): 409−414.于方明, 汤叶涛, 仇荣亮, 等. Cd 胁迫下超富集植物圆锥南芥抗氧化机理. 环境科学学报, 2010, 30(2): 409−414.
[26] Nada E, Ferjani BA, Ali R, et al. Cadmium-induced growth inhibition and alteration of biochemical parameters in almond seedlings grown in solution culture. Acta Physiol Plant, 2007, 29(1): 57−62.
[27] Sanita di Toppi L, Lamberdi M, Pecchioni N, et al. Effects of cadmium stress on hairy root of Dacus carota. J Plant Physiol, 1999, 154: 385−391.
[28] Skórzyńska-Polit E, Tukendorf A, Selstam E, et al. Calcium modifies Cd effect on runner bean plants. Environ Exp Bot, 1998, 40(3): 275−286.
[29] Wang H, Zhou W, Lin B. Effects of Ca on growth and some physiological characteristics of maize under Cd stress. Plant Nutri Fert Sci, 2001, 7(1): 78−87.汪洪, 周卫, 林葆. 钙对镉胁迫下玉米生长及生理特性的影响. 植物营养与肥料学报, 2001, 7(1): 78−87.
[30] Wang LJ, Liu YL, Ma K. The role of calcium in promotion of proline accumulation induced by salt stress in Ficus carica L. cells. Acta Photophysiol Sin, 1999, 25(1): 38−42.汪良驹, 刘友良, 马凯. 钙在无花果细胞盐诱导脯氨酸积累中的作用. 植物生理学报, 1999, 25(1): 38−42.
[31] Song SQ, Jian WJ, Fu JR. Effect of Cd2+on seed vigor of Zea mays L. and antagonism of Ca2+to Cd2+. Chin J Appl Environ Biol, 1997, 2(1): 1−5.宋松泉, 简伟军, 傅家瑞. Cd2+对玉米种子活力的影响及 Ca2+的拮抗作用. 应用与环境生物学报, 1997, 2(1): 1−5.
[32] Rivetta A, Negrini N, Cocucci M. Involvement of Ca2+-calmodulin in Cd2+toxicity during the early phases of radish (Raphanus sativus L.) seed germination. Plant Cell Environ, 1997, 20(5): 600−608.