番茄皮渣蛋白质提取及其性质表征
2017-04-26华霄徐沙楠陈颖杨蕙杨瑞金
华霄,徐沙楠,陈颖,杨蕙,杨瑞金,2
1(江南大学 食品学院,江苏 无锡,214122) 2(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
番茄皮渣蛋白质提取及其性质表征
华霄1,2*,徐沙楠1,陈颖1,杨蕙1,杨瑞金1,2
1(江南大学 食品学院,江苏 无锡,214122) 2(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
从番茄皮渣中提取蛋白质并对蛋白质进行了分析和性质表征。以番茄酱加工所得的番茄皮渣为原料,脱脂后在常温(25 ℃)下用pH 9.0的NaOH溶液按料液比1∶20 (g∶mL) 的比例提取0.5 h,蛋白质提取率达到约70%。所得蛋白质碱提液经过1 000 Da超滤膜超滤至完全脱除盐分同时,脱除了74.3%的色素。凯氏定氮分析显示,所提取样品中蛋白质含量为46%,元素分析(C、H、N、S)结果表明,样品中除蛋白质外存在碳水化合物,红外光谱结果也显示糖类物质的存在的可能性,因此推测所得蛋白质为糖蛋白。相比大豆分离蛋白,番茄皮渣蛋白质具有更好的起泡性和相当的乳化性,但其泡沫稳定性和乳化稳定性稍弱于大豆分离蛋白。
番茄皮渣;蛋白质;提取;超滤;元素分析;起泡性;乳化性
番茄加工会产生大量皮渣,仅在番茄酱的精制阶段——从精制机内破碎的番茄浆汁中分离排出的皮籽产量就占到原料的3%左右[1]。据不完全统计,我国目前年加工番茄量约900万t,产生番茄皮渣约30万t[2]。番茄皮渣营养成分丰富,其中油脂含量占8%~10%、蛋白质含量占20%~30%、粗纤维含量占50%~60%,是一种优良的食品配料资源[3]。目前番茄皮渣的主要处理手段是直接风干后作为动物饲料,只能实现其基本价值[4],但随着食品加工技术的发展和农业资源开发利用程度提高,对番茄皮渣中油脂(包括番茄红素)、膳食纤维和蛋白质的开发利用已经逐渐引起业内广泛重视[5-6]。特别是番茄皮渣蛋白中不含有抗营养因子或有害物质,因此相比其他植物蛋白而言是一种更好的食品蛋白质[7],但目前为止。对番茄皮渣蛋白质的研究报道相对较少,尤其对其理化性质和加工特性表征不够深入。本文首先用稀碱溶液(pH 9.0)结合超滤从番茄皮渣中提取纯化蛋白质,然后对蛋白质进行了氨基酸组成分析、分子质量分布和元素分析表征,最后对蛋白质的起泡性和乳化性进行了研究。
1 材料与方法
1.1 材料与试剂
番茄皮渣,江苏省亚克西食品有限公司;大豆分离蛋白,山东谷神集团;食品级乙酸乙酯,广东省阳东县化工工业有限公司;三羟甲基胺基甲烷(Tris),十二烷基硫酸钠(SDS), 30%丙烯酰胺,甲叉双丙烯酰胺,考马斯亮蓝:分析纯,美国Sigma公司;标准分子量Marker,美国伯乐(Bio-Rad)公司;其他试剂均为分析纯(AR),上海国药集团。金龙鱼食用油,当地超市。
1.2 仪器与设备
A11型粉碎机,德国IKA公司;Pellicon超滤系统,美国Millipore公司;KDN-103F自动定氮仪,上海纤检仪器有限公司; UV1800紫外-可见分光光度计,日本Shimadazu公司;Vario Micro Cube元素分析仪,德国Elementar公司;iS5傅立叶红外光谱仪,美国Nicolet公司;Agilent1100高效液相色谱仪,美国Agilent公司;Powerpac Basic蛋白质电泳仪,美国Bio-Rad公司;T25高速分散器,德国IKA公司。
1.3 实验方法
1.3.1 番茄皮渣脱脂
番茄皮渣粉碎后过80目筛,按料液比1∶3(g∶mL)用食品级乙酸乙酯在常温(25℃)下提取30 min,真空抽滤固液分离。滤渣用乙酸乙酯充分洗涤3次,然后在通风橱中充分挥发直至无乙酸乙酯残留。
1.3.2 番茄皮渣蛋白质提取
将脱脂后的番茄皮渣粉末按一定的物料比与去离子水均匀搅拌混合,用5 mol/L NaOH溶液调节体系pH至特定值,在一定温度下搅拌反应一段时间,然后在5 000 r/min下离心20 min得到上清液即为蛋白质碱提液。渣相加入10倍体积水搅拌洗涤0.5 h,再次在5 000 r/min下离心20 min,所得上清液与蛋白质碱提液合并。蛋白质提取的单因素实验如下:
(1)提取时间确定:脱脂番茄皮渣粉末按照料液比1∶12.5(g∶mL)与去离子水均匀混合,用5 mol/L NaOH调节体系pH值为11.0,在T=50 ℃下分别搅拌提取0.5、1、2、3、4和5 h,每个实验重复3次。
(2)提取pH值确定:脱脂番茄皮渣粉末按照料液比1∶12.5(g∶mL)与去离子水均匀混合,用5 mol/L NaOH调节体系pH值分别为8.0,9.0,10.0和11.0,在T=50 ℃下分别搅拌提取0.5 h,每个实验重复3次。
(3)提取温度确定:脱脂番茄皮渣粉末按照料液比1∶12.5(g∶mL)与去离子水均匀混合,用5 mol/L NaOH调节体系pH值为11.0,分别在T=25、45、50、55和60 ℃下搅拌0.5 h,每个实验重复3次。
(4)提取物料比确定:脱脂番茄皮渣粉末分别按照料液比1∶10、1∶12.5、1∶15和1∶20 (g∶mL)均匀混合,用5 mol/L NaOH调节体系pH值为11.0,在T=50 ℃下分别搅拌提取0.5 h,每个实验重复3次。
所得蛋白质提取率根据式(1)计算:
(1)
式中:ρ为凯氏定氮法测得碱提液中蛋白质浓度,g/mL;V为碱提液体积,mL;m为凯氏定氮法测得原料番茄皮渣中蛋白质质量,g。
1.3.3 超滤纯化
选择截留分子质量为1 000 Da的超滤膜,采用恒体积渗滤模式脱除蛋白碱提液中的色素和盐分。当透过液体积为原料液体积的2倍时,转为浓缩渗滤直至原料液体积减少为原体积的50%。超滤过程中每当透过液体积增加100 mL,测定截留液和透过液的pH和电导率。超滤结束后,用波长420 nm处的吸光值(OD420)计算色素的脱除率式(2),并测定透过液、截留液中的蛋白质浓度。所得截留液经冷冻干燥得到蛋白质样品。

(2)
式中:A0和A1分别代表超滤前后的OD420值。
1.4 分析检测方法
1.4.1 番茄皮渣原料成分测定
用凯氏定氮法(GB5009.5—2010)测定蛋白质含量;用索氏提取法(GB/T 5009.6—2003)测定脂质含量;用直接干燥法(GB 5009.3—2010)测定水分含量;根据GB/T 5009.10—2003测定粗纤维含量。
1.4.2 氨基酸组成分析
准确称取200.0 mg番茄皮渣蛋白质于水解管内,加入8 mL 6 mol/L HCl,充氮封管,在120 ℃下水解22 h,然后水解液全部转移至25 mL容量瓶中,用5 mol/L NaOH中和后定容,2层滤纸过滤至10 mL小烧杯,离心并移取400 μL上清液,在Agilent 1 100高效液相色谱仪上测定氨基酸含量。色谱条件:色谱柱Agilent Hypersil ODS (5 μm, 4.0 mm× 250 mm);流动相A(pH 7.2)∶27.6 mmol/L 醋酸钠-三乙胺-四氢呋喃(体积比500∶0.11∶2.5),流动相B(pH 7.2)∶80.9 mmol/L 醋酸钠-甲醇-乙腈(体积比1∶2∶2);梯度洗脱程序:0 min 8%B;17 min 50%B;20.1 min 100%B;24.0 min, 0%B;流速1.0 mL/min,柱温40 ℃,紫外检测器波长338 nm,脯氨酸262 nm。
氨基酸评分(AAS)采用WHO/FAO氨基酸模式进行计算,公式如下:
(3)
式中:[AA]1和[AA]0分别为样品和WHO/FA氨基酸模式中的氨基酸含量,mg/g。
1.4.3 SDS-PAGE
通过十二烷基硫酸钠——聚丙烯酰胺凝胶垂直平板电泳(SDS-PAGE)表征蛋白质分子质量分布,分离胶浓度12%(pH 8.8),浓缩胶浓度5%(pH 6.8)。取100 μL蛋白质溶液和25 μL 5倍上样缓冲液于沸水浴中加热3 min,然后上样。
1.4.4 元素分析
氦气和氧气压力分别为 0.12 MPa、0.20 MPa,氦气流量为 200 mL/min;氧气流量:10 mL /min;燃烧炉温度:1 150 ℃。还原炉温度:850 ℃;第一次加氧时间:80 s,第二次加氧时间:100 s。准确称取5 mg样品,用锡纸包裹。另测5个空白样(2个加氧空白和3个无氧空白)、2个活化标准物质(磺胺)和3个校正因子标准样品(磺胺)。
1.4.5 FTIR
取1.5 mg番茄皮渣蛋白质样品和90 mg KBr于玛瑙研钵中充分研磨混合,压片后进行红外光谱(FTIR)扫描,扫描范围500~4 000 cm-1,光谱分辨率4.0 cm-1,扫描16次,以KBr空白片作为背景。
1.4.6 起泡性测定
取0.5 g番茄皮渣蛋白质样品,溶解于50 mL去离子水,配成浓度为10 g/L的番茄皮渣蛋白质溶液,在100 mL量筒中用高速分散器在15 000 r/min下分散40 s,重复3次,然后静置记录气泡体积变化直至气泡体积不变。用相同方法测定大豆分离蛋白的起泡性。
1.4.7 乳化性测定
1.4.7.1 乳化能力测定
取0.5 g番茄皮渣蛋白质样品,溶解于50 mL去离子水中,室温下15 000 r/min高速分散6 min,然后加入0.5 mL食用油,继续15 000 r/min分散2 min,静置2 min后用光学显微镜观察是否存在游离油。重复添加食用油及分散操作,直至观察到游离油。
1.4.7.2 乳化稳定性测定
将0.5 g番茄皮渣蛋白质,溶解于50 mL去离子水,按照V(水相)∶V(油相)=20∶3比例混合,15 000 r/min分散2 min后立即吸取200 μL乳状液于10 mL比色管中,用1 g/L SDS稀释到10 mL,500 nm下测定吸光值。间隔一定时间取样按相同方法测定吸光值,并按式4计算乳化稳定性(ES)。用相同方法测定大豆分离蛋白的乳化稳定性。
(4)
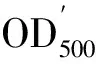
1.5 数据处理
采用SPSS 16.0对数据进行ANOVA单因素方差分析及Ducan′s多重检验,设定显著差异水平P<0.05,数值以(平均值±标准偏差)的形式表示。
2 结果与分析
2.1 原料组分分析及脂质提取结果
番茄皮渣中粗脂肪含量为(8.66±0.81)%,蛋白质含量为(24.74±0.70)%,粗纤维含量(56.15±1.86)%,水分含量(8.83±0.41)%,该结果与文献报道值相似[8-9]。用乙酸乙酯可以提取75%的脂质,考虑到皮渣中粗脂肪含量较低且不溶于水,因此残余脂质并不影响碱提蛋白质的纯度。粗纤维中约95%为水不溶性的纤维素和半纤维素[10],在碱提蛋白质过程中不会溶出。
2.2 碱提蛋白质的单因素实验
2.2.1 pH值的影响
碱提蛋白质是利用OH-离子中和蛋白质表面的正电荷,从而增加蛋白质之间的静电斥力,提高蛋白质的水溶性。直接以去离子水提取蛋白质提取率仅为23%左右(图1),此时体系pH值为4.6,H+离子可能来源于番茄皮渣中的游离酸,此时蛋白质表面负电荷被中和,静电斥力消失,分子间疏水相互作用较强,因此溶解度较小。当调节体系pH值到8.0以上,蛋白质提取率提高到70%左右。但在pH 9.0~11.0范围内蛋白质提取率没有显著变化(P>0.05),说明pH 9.0已经满足提取需要。
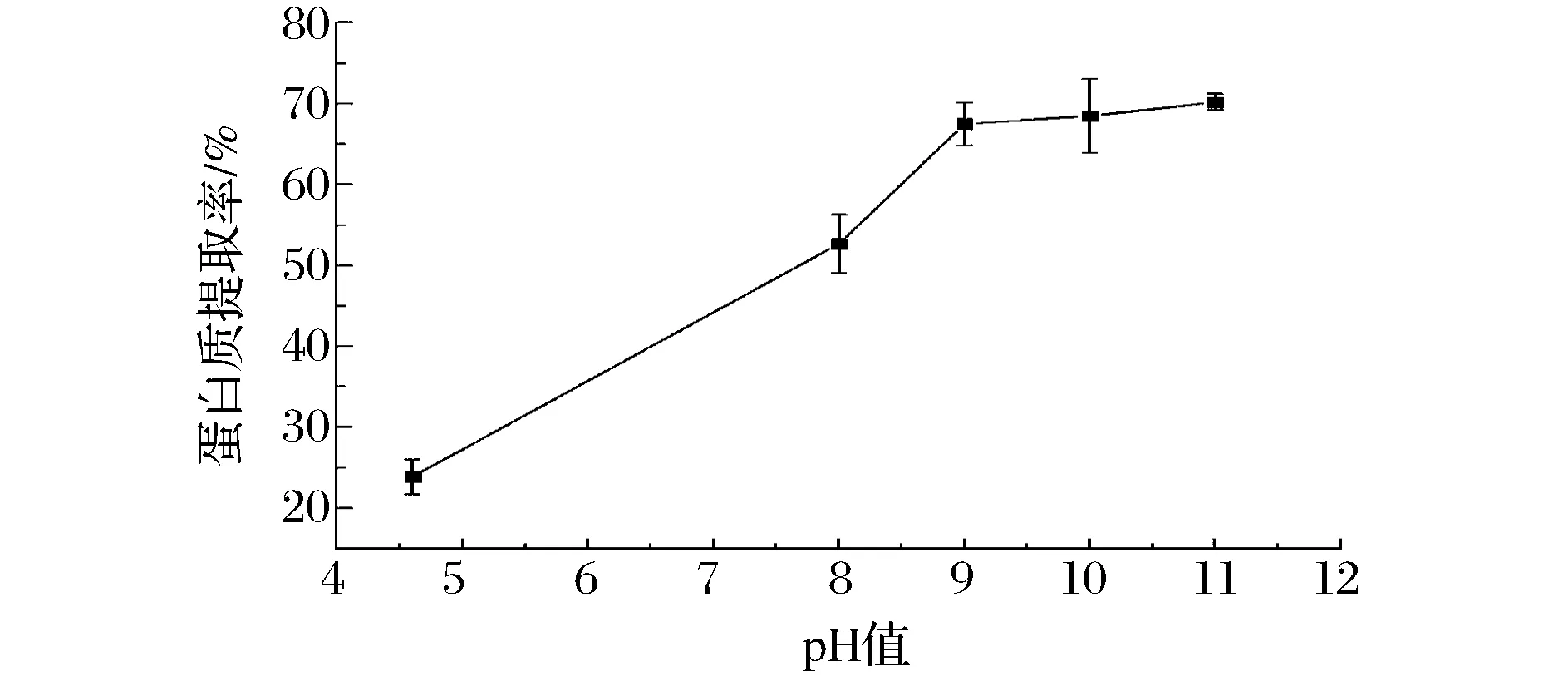
图1 pH对番茄皮渣蛋白质提取率的影响(料液比=1∶12.5(g∶mL),T=50℃,t=0.5 h)Fig.1 Effect of extraction pH on the yield of tomato peel protein
2.2.2 温度的影响
通常升高提取温度可以加速蛋白质分子向水相的迁移速度,但过高的温度会引起蛋白质变性,因此考察了25~65 ℃内温度对蛋白质提取率的影响。如图2所示,在25 ℃下蛋白质提取率可达到约70%,而在40~65 ℃内提取率没有显著提高(P>0.05)。
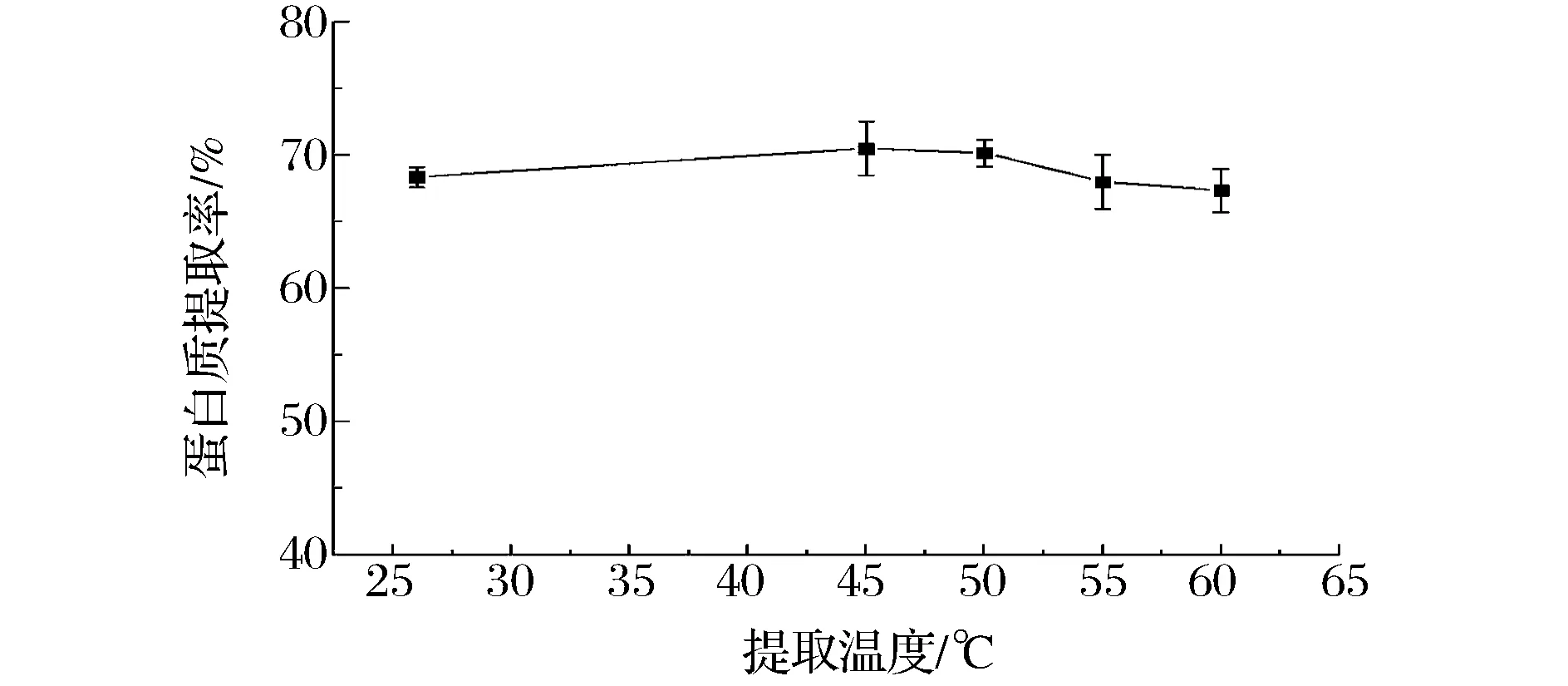
图2 提取温度对番茄皮渣蛋白质提取率的影响(料液比=1∶12.5(g∶mL),pH=11,t=0.5 h)Fig.2 Effect of extraction temperature on the yield of tomato peel protein
在植物细胞中蛋白质与油脂(包括番茄红素)一般形成有色体[11],由于在脱脂过程中大部分油脂(包括番茄红素)已经被乙酸乙酯提取,因此蛋白质处于游离态,很容易溶解在碱溶液中。
2.2.3 提取时间的影响
适当延长提取时间有利于蛋白质充分溶出,提取时间过长则提高生产成本。图3为提取时间对蛋白质提取率的影响,从图3中看出在0.5~5 h内,蛋白质提取率没有显著变化(P>0.05),仍然为70%左右。该结果与图2的结果相符,说明番茄皮渣中的蛋白质处于游离态,易溶于水,在短时间内就能溶于碱溶液。
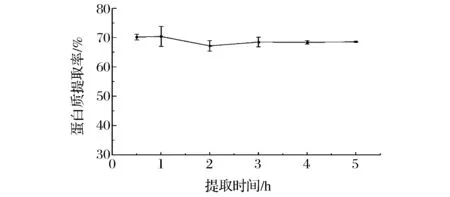
图3 提取时间对番茄皮渣蛋白质提取率的影响(料液比=1∶12.5(g∶mL),pH=11,T=50 ℃)Fig.3 Effect of extraction time on the yield of tomato peel protein
2.2.4 料液比的影响
料液比对蛋白质提取率的影响如图4所示。

图4 物料比对番茄皮渣蛋白质提取率的影响(pH=9,T=50 ℃,t=1 h)Fig.4 Effect of solid-to-liquid ratio on the yield of tomato peel protein
当料液比为1∶10(g∶mL)时蛋白质提取率就能达到64%,逐渐提高料液比至1∶15时蛋白质提取率并无显著提高(P>0.05),但在1∶20时提取率可提高至70%(P<0.05)。这可能是由于料液比小于1∶15时体系黏度较高,固液分离较为困难,部分蛋白质也不能完全溶出。
综上所述,从脱脂后的番茄皮渣中提取蛋白质,在常温下用pH 9.0的稀NaOH溶液按料液比1∶20提取0.5 h,提取率即可达到约70%。相比文献报道提取番茄籽蛋白所用条件(料液比1∶10,pH 8.0,50 ℃,1 mol/L NaCl)[12],本文的提取条件更温和一些。另据文献报道,番茄皮渣中的蛋白质主要存在于番茄籽中[13],而番茄籽蛋白包括清蛋白、球蛋白、醇蛋白和麦谷蛋白等,其中球蛋白含量达到70%[14],因此用pH 9.0 稀碱溶液能提取出几乎全部清蛋白和球蛋白,而难溶的醇蛋白和麦谷蛋白则残留在渣相。
2.3 番茄皮渣蛋白质碱提液的超滤纯化
2.3.1 pH值、电导率及色素变化情况
蛋白质碱提液中的杂质主要为NaOH、无机盐和水溶性色素,因此使用截断分子质量1 000 Da的超滤膜进行纯化。体系初始pH值为8.2,在超滤过程中盐分逐渐被脱除,至终点时pH值降低至7.4,相应地体系电导率从3 000 μs/cm降低至900 μs/cm,说明NaOH和其他无机盐几乎已被完全除去。由于蛋白质为两性分子,因此蛋白质溶液也具有一定的电导率。超滤前后蛋白质碱提液的OD450分别为1.252和0.322,根据式(2)计算得到色素脱除率为74.3%。
2.3.2 蛋白质浓度变化情况
表1为超滤过程中蛋白质溶液浓度的变化。从表1可知,在恒体积渗滤过程中约有30%的N损失,这部分应该是氨基酸和小肽(聚合度<10)。在浓缩过程中有也有少量蛋白质损失,这是由于浓缩过程中超滤膜两侧浓差极化效应加强,跨膜压差增大,部分蛋白质被截留在膜孔中。超滤过后,在100 g番茄皮渣原料中提取得到11.23 g固体样品,但用凯氏定氮法测得蛋白质质量仅为6.43 g,其原因在后文讨论。

表1 超滤过程中蛋白质溶液的浓度变化
2.4 番茄皮渣蛋白质理化性质分析
2.4.1 分子质量分布
文献报道番茄籽蛋白中主要有5个组成部分,分子质量分别为48、33、20、19和10 kDa[12],另有文献报道称番茄籽中水溶性蛋白主要有3个,分子质量分别为39.2、30.1和15.8 kDa[15]。本研究所提取的蛋白质的SDS-PAGE照片如图5所示,样品主要包含了5个蛋白质组分,分子质量分别为41.4、31.3、 22.2、17.2和15.6 kDa。另外,样品中还包括较多分子量<15 kDa的肽链(聚合度<140)。蛋白质在常温中性pH水溶液中相当稳定,本文确定的提取条件为用pH 9.0的弱碱性水溶液常温短时间提取,因此提取过程并不会对所提取蛋白质造成明显降解,而膜分离过程为常温下的物理过程,也不会引起蛋白质肽链降解。另外,在已有的文献报道中[16],也观察到分子质量在17~10 kDa内有明显的蛋白分布。由于SDS-PAGE为还原态电泳,蛋白质之间的非共价键作用被充分破坏,因此SDS-PAGE结果仅说明所提取蛋白质中含有<15 kDa的肽链,但不能反应各肽链之间的相互作用。
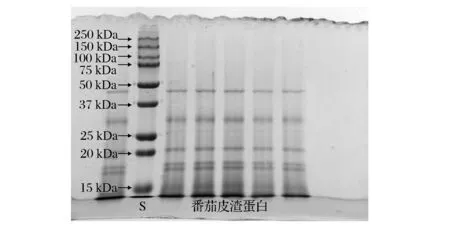
图5 标准蛋白和番茄皮渣蛋白的SDS-PAGE电泳图Fig.5 SDS-PAGE of the standard protein and tomato peel protein
2.4.2 氨基酸组成
据文献报道,番茄皮渣蛋白中富含谷氨酸和天冬氨酸[17],以及相比其他植物蛋白更高的赖氨酸含量[18]。本研究提取的番茄皮渣蛋白质氨基酸组成结果如表2所示,共有17种氨基酸,主要含有谷氨酸、天冬氨酸、亮氨酸和精氨酸等,与上述文献报道结果相符。表2也列出了样品中含有7种人体必需氨基酸和2种条件必需氨基酸(半胱氨酸和酪氨酸)。特别需要说明的是,由于采用酸水解预处理,在此过程中色氨酸被破坏而无法检出。对比WHO/FAO氨基酸模式,计算得到各种必需氨基酸的AAS值。若不计色氨酸,则蛋氨酸为第一限制性氨基酸。
2.4.3 元素分析
根据凯氏定氮法测定的蛋白质含量,在冻干后得到的样品中仅占46%。为进一步表征其他成分存在的可能性,对样品进行了元素分析,结果如表3所示。样品中N元素含量约为7.5%,与凯氏定氮法结果相近;S元素含量约为0.45%,来自半胱氨酸和蛋氨酸,根据其对应的摩尔含量(0.01 mol/100 g)计算含硫氨基酸(蛋氨酸和半胱氨酸)的含量(11 mg/100 g)与氨基酸组成分析结果(9.1 mg/100 g)能很好地符合;由于元素分析采用氧气气氛,因此O元素通过减量计算,约为46.5%。从元素分析结果推测,样品中还存在由C,H和O构成的物质,排除油脂和有机物小分子的可能性之后,可初步认为是糖类物质。由于在超滤过程中单糖、寡糖均能被渗滤脱除,而纤维类大分子多糖不溶于水,果胶质由于和纤维素、半纤维素交织共存,在常温弱碱性条件水溶性很低[19],因此推测所得蛋白质是糖蛋白,其中糖占比(质量百分比)约54%。
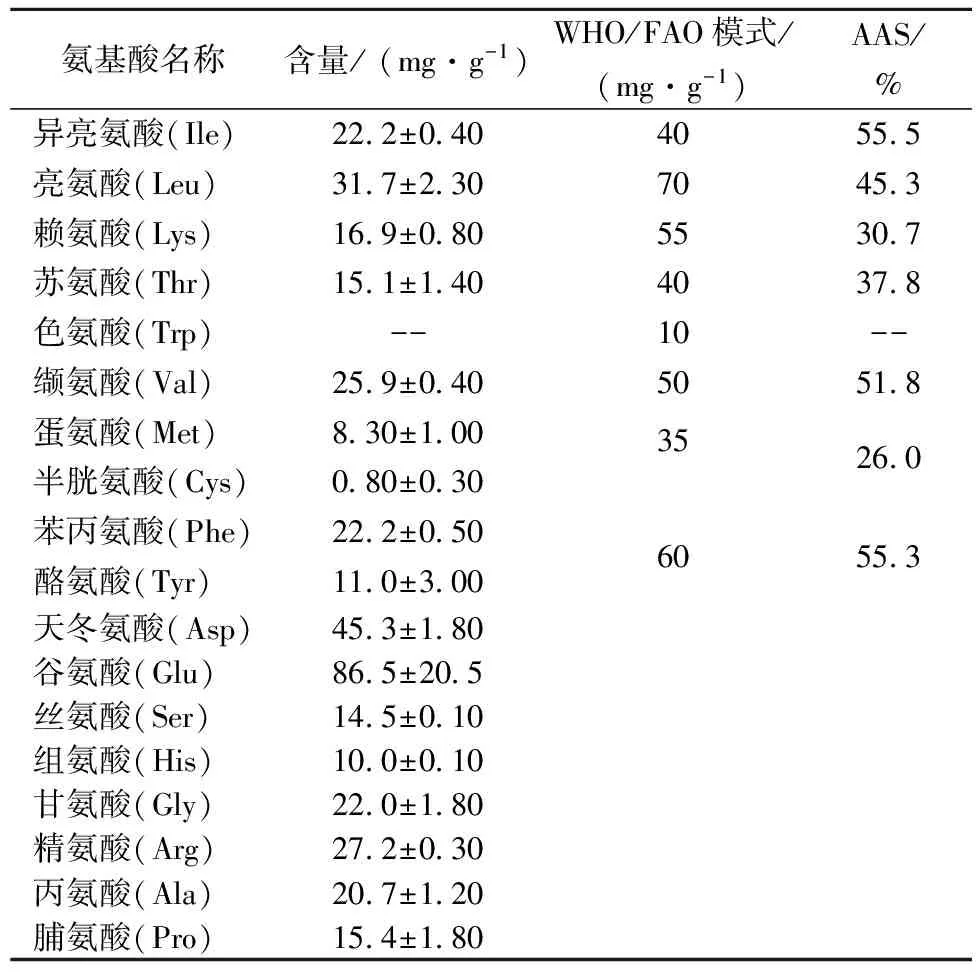
表2 番茄皮渣蛋白质的氨基酸组成及含量
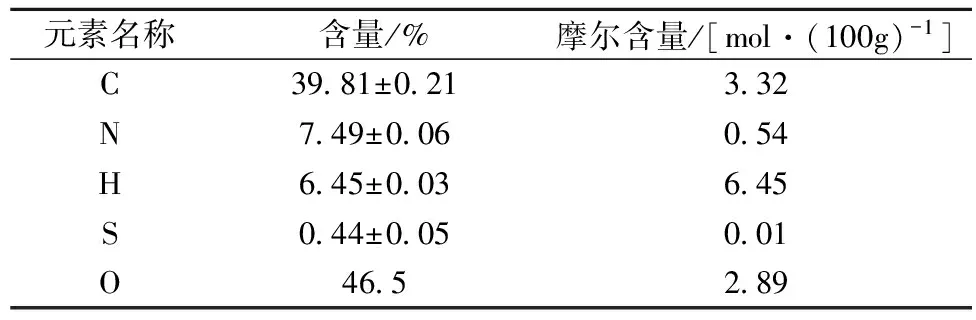
表3 番茄皮渣蛋白元素分析结果
2.4.4 FTIR
为进一步确定蛋白质样品中糖类物质的存在,对样品进行了红外光谱分析(图6)。1 630~1 690 cm-1处为蛋白质肽链的酰胺键伸缩振动峰。3 000~3 500 cm-1为羟基或羧酸上的O—H伸缩振动,但是羟基O—H伸缩振动峰尖锐而羧酸O—H伸缩振动宽泛,且在1 400 cm-1和900 cm-1附近没有羧酸O—H的强而宽泛的弯曲振动吸收峰,相反在1 000 cm-1处的强而尖锐的吸收峰可归为糖类物质中C—O单键的伸缩振动特征吸收。另外,在2 800~2 900 cm-1范围内的吸收峰包含了氨基酸和糖单元上亚甲基(—CH2—)的C—H伸缩振动信号。
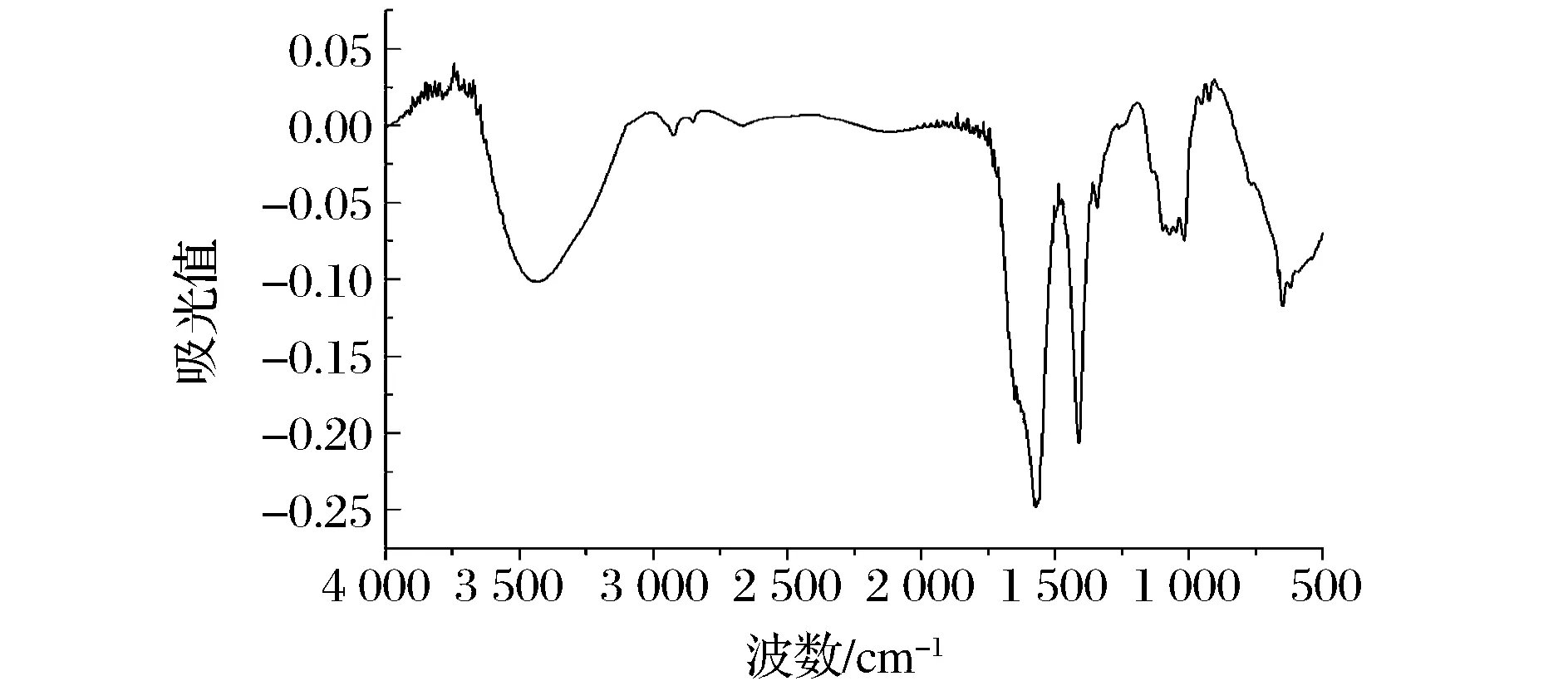
图6 番茄皮渣蛋白的红外光谱图Fig.6 FT-IR of tomato peel protein
2.4.5 起泡性
图7显示所制备的番茄皮渣蛋白的起泡性。
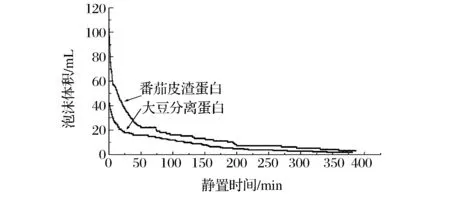
图7 番茄皮渣蛋白与大豆分离蛋白的起泡性Fig.7 Foaming ability of tomato peel protein and soybean protein isolate
在分散后0 min时刻10 g/L番茄皮渣蛋白溶液的起泡能力达到100 mL,是同等浓度下大豆分离蛋白的2.5倍(40 mL),从SDS-PAGE结果来看,番茄皮渣蛋白分子量小于50 kDa,明显小于大豆分离蛋白的分子质量(一般为数十万),因此番茄皮渣蛋白能更快地到达水-空气界面,在相同时间内形成更多泡沫体积。另一方面,番茄皮渣蛋白所结合的糖分子高度亲水,提高了蛋白质与水相的相容性同时降低了表面张力。2种蛋白质的泡沫体积减少50%所需的时间均为13 min左右,期间主要是大体积泡沫不断破裂。50 min以后泡沫体系逐渐稳定,体积缓慢减少,2种蛋白质气泡体积减少曲线变化情况非常相似,但是番茄皮渣蛋白的气泡体积始终大于大豆分离蛋白。
2.4.6 乳化性
2.4.7.1 乳化能力
乳化能力是指每克蛋白质所形成乳液能包埋的油相体积(mL)。图8显示了随所添加油相体积逐渐增加,番茄皮渣蛋白质所形成的乳液的光学显微镜照片。

(a) 1∶4;(b) 1∶8;(c) 1∶12;(d) 1∶14;(e) 1∶16;(f) 1∶20;(g) 1∶40;(h) 1∶50图8 不同蛋白质∶油相(g∶mL)比例的乳液光学显微镜照片(×100)Fig.8 Optical observation (×100) of emulsions with various protein-to-oil ratio
当包埋量为4 mL/g得到细小乳液(图8-(a)),当包埋量逐渐提高到16 mL/g时(图8(b)~(c)),观察到乳液液滴数量明显增多且液滴直径变大。如前所述所提取番茄皮渣蛋白是一种糖蛋白,糖分子的存在显著提高了蛋白质的亲水性,降低了蛋白膜形成乳液时的表面张力。同时若有糖分子连接不同的蛋白质则会进一步提高蛋白膜的稳定性,因此当乳液半径增加,包埋量增多时液滴不至于破裂。当包埋量提高到20 mL/g时,仍然没有观察到有游离油(图8-(f)),但是在包埋量逐步提高到50 mL/g(图8(g)~(h))过程中,可以发现很多大乳液滴中含有多个小乳液滴,这种现象说明乳化体系逐渐由O/W的亮相体系转变为O/W/O的三相体系。为了和大豆分离蛋白进行对比,本研究中取接近相转变零界点的15 mL/g包埋量测试乳化稳定性。
2.4.7.2 乳化稳定性
乳化稳定性与时间、乳化粒径2个因素相关,粒径越小则乳化液稳定性越好[16],因此番茄皮渣蛋白所形成的较大O/W乳液在一定程度上不利于稳定,更倾向于溶合聚集。随着静置时间的延长,小颗粒逐渐聚集在一起变成较大颗粒,相同情况下吸光度增大,表明乳化稳定性随之降低。从图9看出,充分分散后番茄皮渣蛋白和大豆分离蛋白的初始乳化性均能达到95%左右,之后缓慢下降,两者下降趋势类似,但大豆分离蛋白的乳化稳定性要高于番茄皮渣乳液,这可能是因为大豆分离蛋白的分子量更大,一旦形成蛋白膜以后其稳定会更高。静置5 h后,大豆分离蛋白乳液稳定性下降30%左右,而番茄皮渣蛋白乳液稳定性下降了42%左右。
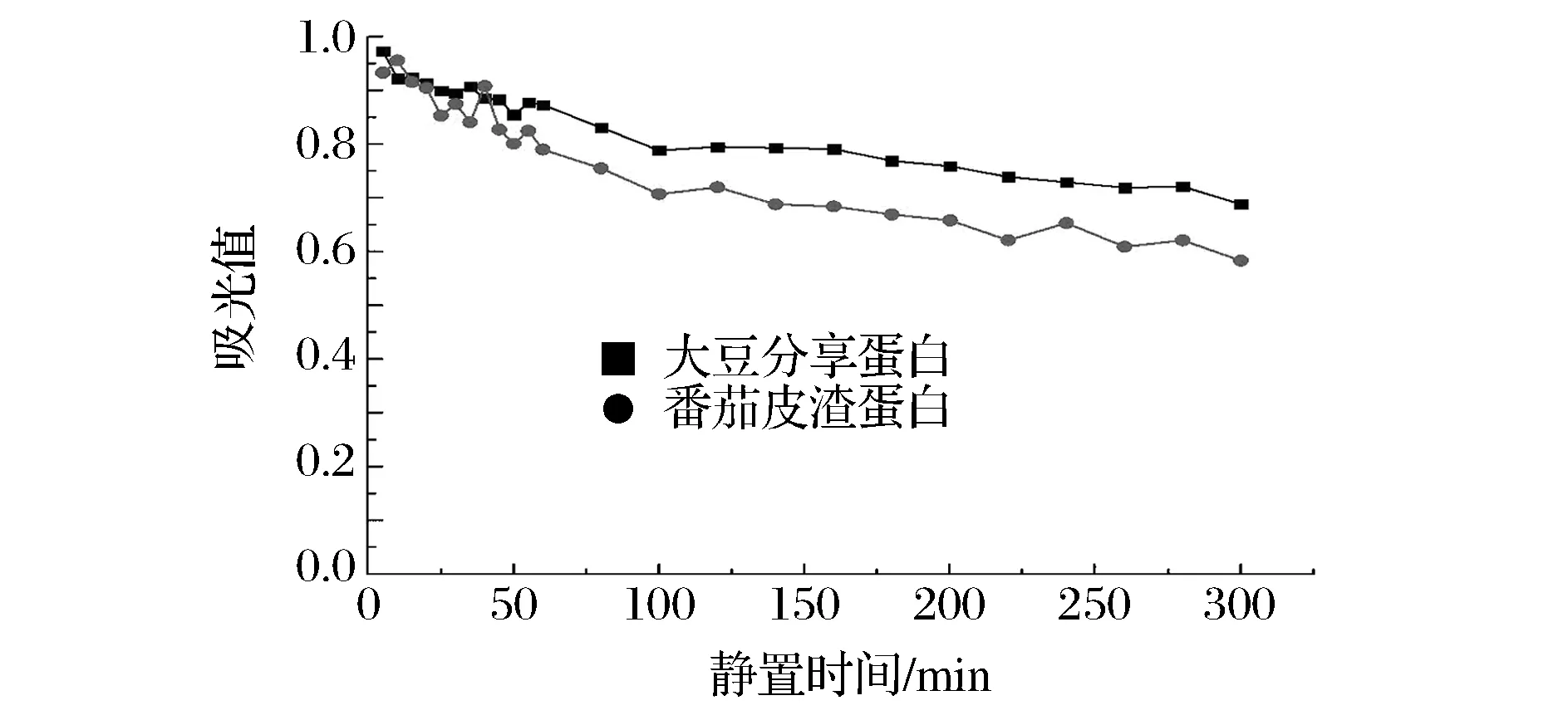
图9 番茄皮渣蛋白与大豆分离蛋白的乳化性Fig.9 Emulsion stability of tomato peel protein and soybean protein isolate
3 结论
本文首先从番茄皮渣中提取得到了蛋白质。由于脱脂过程将脂质与蛋白质分离,因此使用稀碱(pH 9.0)溶液在常温下短时间内就能提取蛋白质,提取率达到70%。表征分析结果显示,所得蛋白质可能为糖蛋白,相比大豆分离蛋白,番茄皮渣蛋白质具有更好的起泡性和相当的乳化性,但其泡沫稳定性和乳化稳定性稍弱。由于番茄皮渣资源丰富,因此番茄皮渣蛋白有望成为一种性质优良的食品加工配料。
[1] ROSSINI G, TOSCANO G, DUCA D, et al. Analysis of the characteristics of the tomato manufacturing residues finalized to the energy recovery[J]. Biomass Bioenergy, 2013, 51:177-182.
[2] 关文超, 杨裕,卜鸿静. 值得开发利用的好饲料--番茄渣及番茄红素[J]. 山西饲料, 2014, 35(6): 31-34.
[4] CELMA A R, Cuadros F, LPEZ-RODRGUEZ F. Characterization of pellets from industrial tomato residues [J]. Food and Bioproducts Processing, 2012, 90: 700-706.
[5] TOSCANO G, PIZZI A, PEDRETTI E F, et al. Torrefaction of tomato industry residues [J]. Fuel, 2015, 143 (1):89-97.

[7] SOGI D S, BHATIA R, GARG, S K, et al. Biological evaluation of tomato waste seed meals and protein concentrate [J]. Food Chemistry, 2005, 89(1): 53-56.
[8] BHARGAVA B, TALAPATRA S K. Studies on fruit and vegetable factory wastes. The chemical composition of fruit and vegetable factory waste products [J]. Indian Veterinary Journal, 1968, 45(10): 948-952.
[9] Del VALLE M. Utilidad del subproducto obtenido en la elaboración de derivados de tomate [D].Madrid:Unlversided Complutens de Madrid, 2004.
[10] ALFARO F A, CEBRIN M, HERRERA V J, et al. Molecular variability of Spanish and Hungarian isolates of Tomato torrado virus [J]. Plant Pathology, 2010, 59(4): 785-793.
[11] BARTLEY G E, SCOLNIK P.A. Plant carotenoids-Pigments for photoprotection, visual attraction, and human health [J]. Plant Cell, 1995, 7 (7):1 027-1 038.
[12] SARKAR A, KAMARUDDIN H, BENTLEY A, et al. Emulsion stabilization by tomato seed protein isolate: Influence of pH, ionic strength and thermal treatment [J]. Food Hydrocolloids, 2016, 57:160-168.
[13] 黄志莲. 番茄皮渣的保存[J]. 新疆畜牧业, 2013, 46(12): 40-41.
[14] ALA’A H, AL-HARAHSHEH M, HARARAH M, et al. Drying characteristics and quality change of unutilized-protein rich-tomato pomace with and without osmotic pre-treatment [J]. Industrial Crops and Products, 2010, 31(1): 171-177.
[15] 沈心妤, 许时婴, 王璋. 番茄籽蛋白的功能和结构[J]. 食品科学, 2005, 26(11): 42-46.
[16] 白雪.番茄籽蛋白改性研究[D]. 南昌: 南昌大学, 2015.
[17] PERSIA M, PARSONS C, SCHANG M, et al. Nutritional evaluation of dried tomato seeds [J]. Poultry Science, 82(1):141-146.
[18] SARKAR A, KAUL P. Evaluation of tomato processing by-products: a comparative study in a pilot scale setup [J]. Journal of Food Process Engineering, 2014, 37(3): 299-307.
[19] MOHNEN D. Pectin structure and biosynthesis [J]. Current Opinion in Plant Biology, 2008, 11: 266-277.
Extraction and characterization of protein from tomato peel waste
HUA Xiao1,2*, XU Sha-nan1, CHEN Ying1, YANG Hui1, YANG Rui-jin1,2
1 (School of Food Science and Technology, Jiangnan University, Wuxi 214122,China) 2 (State Key Lab of Food Science and Technology, Jiangnan University, Wuxi 214122,China)
Tomato pulp protein was extracted and characterized. Tomato pulp is the waste of tomato source processing after defatting, and was extracted by pH 9.0 NaOH at 25℃; the solid-to-liquid ratio was 1∶20 (g∶mL), and yield was around 70%. Protein extract was then ultra-filtrated by a 1 000 Da membrane to remove salts, and meanwhile 74.3% of the pigments were permeated. The protein content determined by Kjeldahl method was about 46%. Elemental analysis (C, H, N, S) indicated the possibility of carbohydrates and it was further confirmed by FTIR (Fourier Transform infrared spectroscopy). Therefore, the protein could be a glycoprotein. In comparison to soybean protein isolate, the tomato pulp protein showed better foaming ability and equivalent emulsion ability, but its foam stability and emulsion stability was weaker.
tomato pulp waste; protein; extraction; ultrafiltration; elemental analysis; foaming ability; emulsion ability
10.13995/j.cnki.11-1802/ts.201703045
博士,副教授(本文通讯作者,E-mail:huaxiao@jiangnan.edu.cn)。
十二五国家科技支撑计划课题(2014BAD04B01);江苏省农业支撑项目(BN2015162);中央高校基本科研基金(JUSRP51501)
2016-06-24,改回日期:2016-08-14
