响应面法优化猕猴桃皮渣酶解取汁工艺
2014-12-16沈丽雯刘春燕陈安均刘兴艳
刘 娟,沈丽雯,蒲 彪,* ,刘春燕,陈安均,刘兴艳
(1.四川农业大学食品学院,四川雅安625014;2.开县农业委员会,重庆开县405499)
猕猴桃(Actinidia chinensis)又名羊(阳)桃、猕猴梨、奇异果等,隶属于猕猴桃科(Acyinidiaceae)猕猴属(Actinidia Lindl),为浆果落叶木质藤本植物,从北纬50°到赤道附近均有分布,原产于我国长江流域[1]。近代研究表明,猕猴桃不仅具有很高的营养价值,而且还有一定的抗氧化、抗肿瘤、降低脂质过氧化水平、降血压、治疗烧伤等作用[2-5]。
中国作为猕猴桃的起源国,猕猴桃属植物资源丰富,分布范围广,产量居世界前列。我国猕猴桃除了鲜食外,还有各种加工产品主要是猕猴桃果干、果汁、果酱等,随着猕猴桃果业的不断发展,其加工副产物也不断增加。其中就有20%~30%的物质以皮渣的形式被废弃,不仅降低了猕猴桃加工的附加值,而且形成了新的环境污染源[6]。猕猴桃皮渣中含有大量的膳食纤维、果胶、黄酮类化合物等功能性物质,可广泛应用于制药、化妆品、食品工业等,具有很好的利用价值和经济效益。猕猴桃皮渣用途广泛,除了从其中提取果胶、可溶性膳食纤维、蛋白质等功效成分以及与整果一起发酵果酒外,目前已开发出多种加工产品,如猕猴桃皮渣饲料、皮渣果醋等[7-9]。
猕猴桃皮渣中果胶物质含量很高,由于其粘性过大因此在压榨过程中不易直接出汁,因此需要用酶处理或者其它方法提高猕猴桃的出汁率,最常用的方法是使用果胶酶处理从而提高出汁率[10-14]。本研究以猕猴桃皮渣为原料,采用果胶酶酶解方法,通过响应面分析优化皮渣酶解工艺,以期提高猕猴桃皮渣的出汁提高率、减少猕猴桃加工过程中果渣的排放,从而提高猕猴桃的综合利用率和解决食品加工中环境污染等问题。
1 材料与方法
1.1 材料与仪器
猕猴桃 充分成熟,由四川省天全农兴源农业发展有限责任公司提供,品种为海沃德[Actinidia deliciosa(A.Chev)C.F.Liang et A.R.Ferguson cv.‘Hayward’];本实验以经螺旋压榨取汁后的皮渣为原料;纤维素酶(30u/g) 上海楷洋生物技术有限公司;果胶酶(5000u/g) 上海蓝季科技发展有限公司;氢氧化钠、酒石酸钾钠、硫酸铜、盐酸、乙醇、次甲基亚蓝和酚酞等 成都科龙化工试剂厂。
LZ-1.5螺旋榨汁机 张家港白熊韩东机械有限公司;LT 1001型电子天平 常熟市天量仪器有限责任公司;JD 200-3型电子天平 北京赛多利斯仪器系统有限公司;SHB-Ⅲ循环水多用真空泵 菏泽市鑫源仪器有限公司;HH-S6数显恒温水浴锅 江苏金坛市国胜实验仪器厂水浴锅;DHG-9245A电热恒温鼓风干燥箱 上海一恒科学仪器公司;722S型分光光度计 上海尤尼柯仪器有限公司。
1.2 实验方法
1.2.1 原料品质分析与预处理 选用新鲜、充分成熟、未变质的猕猴桃为原料,祛病除杂,整果打浆取汁得到皮渣,并且测定包括出汁率和总糖在内的基本品质指标。再将皮渣与水1∶1混合打浆[15],得到皮渣浆。
1.2.2 酶选择实验
1.2.2.1 果胶酶实验 均匀称取猕猴桃皮渣浆6份,每份100g,分别装入6个250mL烧杯中,用柠檬酸调节pH至3.5,分成2组,一组为实验组,一组为对照组。参照他人对果胶酶酶解皮渣的研究结果,向实验组加入0.18mg/g果胶酶,对照组不加。置于水浴锅中,50℃保温3h后,抽滤,测定皮渣出汁提高率以及汁液的澄清度[16-17]。
1.2.2.2 纤维素酶添加量确定实验 处理条件为pH4.0,温度为 55℃,加酶量为 0.08~0.40mg/g,以0.08mg/g为间距,设置不同酶量梯度。
1.2.2.3 混合酶实验 同果胶酶实验设置,处理条件为pH4.0、温度为55℃以及加入0.18mg/g混合酶,果胶酶和纤维素酶的比例分别是 2∶1,1∶1,1∶2。
1.2.3 皮渣酶解单因素实验
1.2.3.1 酶解温度的确定 称取猕猴桃皮渣浆,每份100g,分别放入250mL烧杯中。用柠檬酸调节pH至3.5,加入0.18mg/g在1.2.2中所选取的最佳作用酶,下文中所添加的酶也均为此酶。置于水浴锅中,分别于30、40、50、60 和 70℃ 中保温 3h 后,抽滤,测定各组皮渣出汁提高率。
1.2.3.2 酶解pH的确定 酶添加量0.18mg/g、温度50℃、保温时间3h。用柠檬酸和碳酸钠分别调节pH至2.5、3.5、4.5、5.5和6.5,测定各组皮渣出汁提高率。
1.2.3.3 酶用量的确定 温度50℃,保温时间3h,pH3.5,分别按 0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20和0.22mg/g加入酶,测定各组皮渣出汁提高率。
1.2.3.4 酶解时间的确定 温度50℃、pH3.5、酶用量0.18mg/g,分别保温 1、2、3、4 和 5h,测定各组皮渣出汁提高率[18-19]。
1.2.4 皮渣酶解工艺优化 依据Box-Behnken设计原理和单因素实验结果,以单因素实验中对响应值影响显著的因素为自变量(A:温度;B:pH;C:时间;D:加酶量),以出汁提高率为响应值,对皮渣酶解工艺进行响应面分析。响应面实验因素与水平设计见表1。

表1 响应面实验因素与水平设计表Table 1 Coded values and corresponding actual values of the optimization parameters used in response surface analysis
1.2.5 指标测定方法 pH:酸度计测定;可溶性固形物(TSS,%):手持式糖量计测定法;GB/T 5009.7-2006直接滴定法;总糖:处理参照 GB/T 15038-2006[20],测定按照 GB/T 5009.7-2006[21]直接滴定法;总酸:GB/T 15038-2006指示剂法。
澄清度:取少量酶解后的澄清汁装入1cm的比色杯中,650nm下用分光光度计测定其透光率[16]。
皮渣出汁提高率(%)=(实验组猕猴桃皮渣汁质量-对照组猕猴桃皮渣汁质量)/猕猴桃皮渣质量× 100[17]。
1.2.6 数据分析方法 每次实验平行测定三次,利用Design Expert8.05b和Origin8.1对所得数据进行处理分析。
2 结果与分析
2.1 皮渣品质分析
皮渣品质分析如表2所示。
2.2 酶选择实验
2.2.1 纤维素酶用量对皮渣出汁提高率的影响 由图1可知:随着纤维素酶添加量的增加,皮渣出汁提高虽增长明显,但增长的值不大,加酶量高达为0.40mg/g时,出汁提高率仅为(13.2±0.6)%。此外,纤维素酶的价格也高于果胶酶,从经济的角度考虑,也不宜单独采用纤维素对皮渣进行酶解。
2.2.2 果胶酶和混合酶对猕猴桃皮渣出汁提高率的影响 从表3可知,在果胶酶添加量为0.18mg/g,pH3.5,50℃水浴3h条件下,皮渣出汁提高率为(32.0±1.2)%,优于其它几组;汁液澄清度方面,在这几组实验条件下,没有显著性差异(p>0.05)。因此,采用果胶酶对猕猴桃皮渣进行酶解工艺优化。

表2 猕猴桃皮渣品质分析Table 2 The quality analysis of Chinese gooseberry pomace

表3 果胶酶和混合酶对猕猴桃皮渣出汁提高率的影响Table 3 Effects of pectinase and combined cellulasen and pectinase on the increased ratio of juice yield from Chinese gooseberry pomace
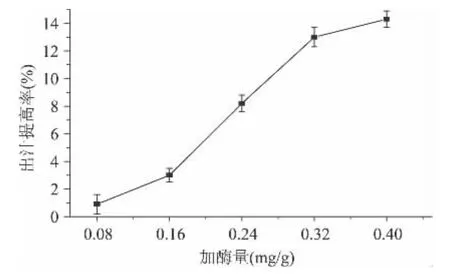
图1 纤维素酶对皮渣出汁提高率的影响Fig.1 Effects of pectinase on the increased ratio of juice yield from Chinese gooseberry pomace
2.3 皮渣酶解单因素实验
2.3.1 温度对皮渣出汁提高率的影响 从图2可知,当温度低于50℃时,皮渣的出汁提高率随着温度的逐渐升高而不断增大,在50℃左右达到出汁提高率的最大值。当温度超过50℃之后,皮渣的出汁提高率随着温度的升高而不断减小,这是由于温度太高会降低果胶酶的活性,因此,其酶解的温度以50℃左右为宜。
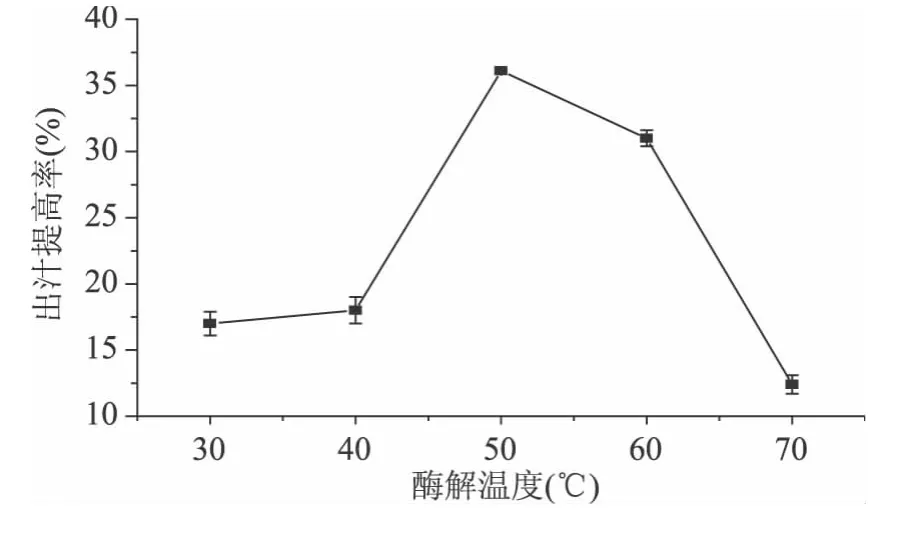
图2 温度对皮渣出汁提高率的影响Fig.2 Effects of temperature on the increased ratio of juice yield from Chinese gooseberry pomace
2.3.2 pH对皮渣出汁提高率的影响 由图3可得,当pH在2.5~3.5之间时,皮渣的出汁提高率随pH的增大而增加;在pH为3.5左右时达到最大,之后随着pH的逐渐增大,皮渣的出汁提高率缓慢减小;当pH到达4.5之后,出汁提高率快速减小,甚至出现负值,出现这种现象的原因是过高的pH不仅抑制了外源加入果胶酶的活性,而且还影响了皮渣自身含有的果胶酶的活性[19],由上可得,酶解的pH控制在3.5左右为宜。
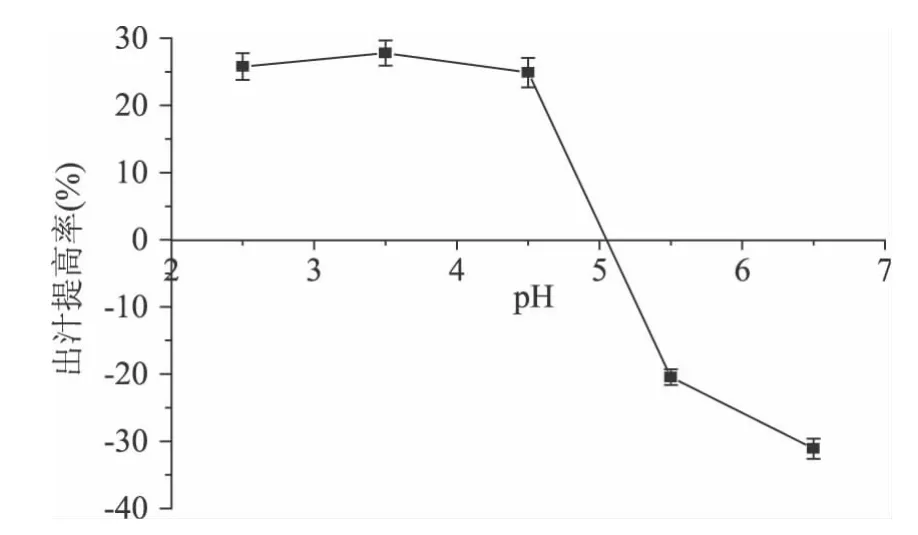
图3 pH对皮渣出汁提高率的影响Fig.3 Effects of pH on the increased ratio of juice yield from Chinese gooseberry pomace
2.3.3 酶用量对皮渣出汁提高率的影响 由图4可知,加酶量在0.18mg/g以下时,皮渣的出汁提高率随加酶量的增加而迅速增加,高于0.18mg/g后,皮渣的出汁提高率增加幅度较小,加酶量为0.18mg/g与0.40mg/g下的皮渣出汁提高率差异性不显著(p>0.05)。因此,酶添加量在0.18mg/g左右为宜。
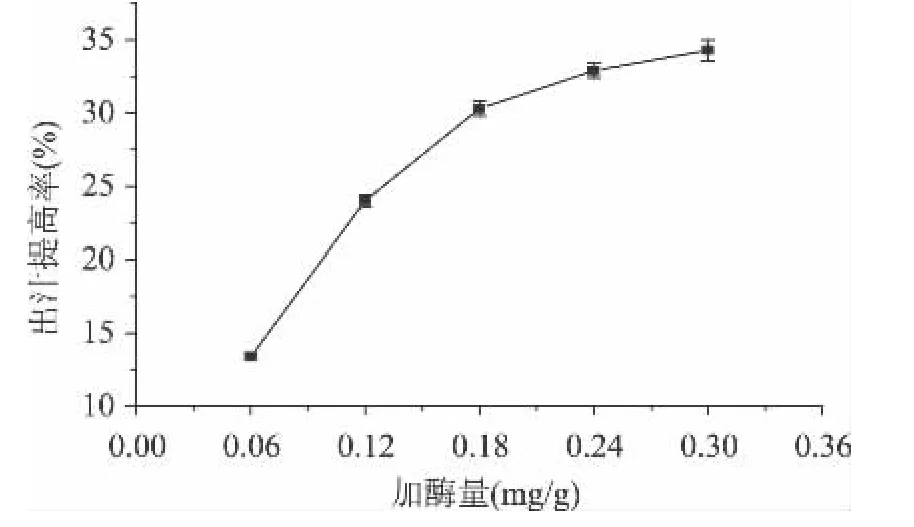
图4 酶用量对皮渣出汁提高率的影响Fig.4 Effects of total enzyme on the increased ratio of juice yield from Chinese gooseberry pomace
2.3.4 酶解时间对皮渣出汁提高率的影响 从图5可得,随着酶解时间的延长,皮渣出汁提高率不断增加,但在3h后增长缓慢,皮渣酶解3h与5h的出汁提高率没有显著性差异(p>0.05),而且随着时间的延长,能耗也因此加大。所以,从经济有效的角度考虑,酶解时间应不超过4h。
2.4 响应面优化皮渣的酶解工艺
2.4.1 响应面实验设计与结果 猕猴桃皮渣酶解响应面实验结果见表4。
2.4.2 响应面实验数据回归分析 采用Design Expert 8.06 b软件,对响应面实验数据进行多元回归拟合。以出汁提高率为响应值(I),温度(A)、pH(B)、时间(C)、加酶量(D)为自变量,建立回归方程如下:

图5 酶解时间对皮渣出汁提高率的影响Fig.5 Effects of hydrolysis time on the increased ratio of juice yield from Chinese gooseberry pomace
I=44.10-0.21A-0.27B+2.63C+2.89D+0.20AB-3.43AC-0.55AD-1.35BC-0.20BD+2.43CD-11.95A2-6.89B2-4.17C2-3.30D2
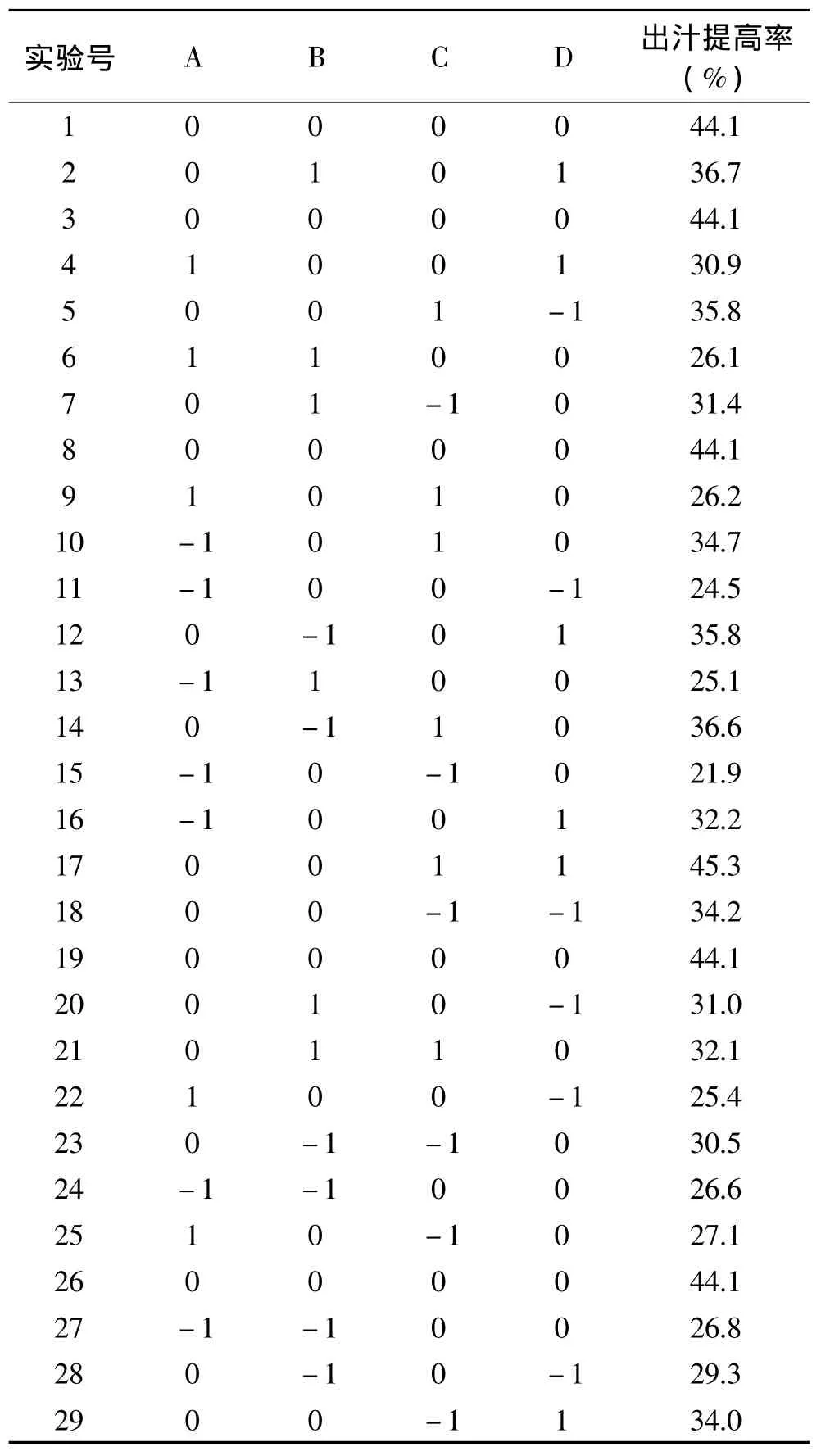
表4 响应面实验设计及结果Table 4 Test’s data from the response surface design
对二次回归方程进行方差分析,结果见表5。
从表5可看出,根据p值判断,p值<0.0001,说明该模型具有很高的显著性。方程的失拟项(p>0.05)不显著,因此可用该回归方程代替实验真实点对实验结果进行分析。结果表明,C,D,AC,CD,A2,B2,C2,D2对皮渣出汁提高率影响极显著,其他项为不显著。说明酶解时间和加酶量对猕猴桃皮渣出汁提高率的影响较强,酶解温度和酶解pH影响不显著,其中酶解时间和加酶量对猕猴桃皮渣出汁提高率的影响极其显著(p<0.01),且各因素对猕猴桃皮渣出汁提高率的影响不是简单的线性关系。对猕猴桃皮渣出汁提高率大小的影响条件依次是酶解时间、加酶量、pH以及温度。在各因素的交互作用中,酶解温度与酶解时间以及酶解时间与加酶量的交互作用影响较显著。
通过响应面的数字最优组合分析得到最佳工艺条件为:酶解温度48.98℃、pH3.42、酶解时间3.32h、果胶酶用量0.26mg/g,在此条件下,皮渣的预测出汁提高率为45.73%。回归模型的R2Adj=0.9636,说明有96.36%的猕猴桃皮渣出汁提高率变化可以用模型来解释,因此拟合度良好,实验误差较小,该模型可以用来对猕猴桃皮渣出汁提高率进行分析和预测。
2.4.3 响应面分析 因素之间的交互作用见图6、图7。

图6 酶解温度和酶解时间对皮渣出汁提高率影响的交互作用响应面图Fig.6 Response surface diagram for temperature and time on the increased ratio of juice yield from Chinese gooseberry pomace
图6为酶解温度与酶解时间之间的交互作用,酶解pH为3.5,加酶量为0.20mg/g,当酶解时间较短时,随着酶解温度的升高,猕猴桃皮渣出汁提高率迅速上升后又下降,升高幅度明显,当酶解时间较短长时,随着温度的增加,猕猴桃皮渣出汁提高率上升后又下降,升高幅度较小,猕猴桃皮渣出汁提高率一直处于较高水平;当酶解温度处于较低水平时,随着酶解时间的增加,猕猴桃皮渣出汁提高率下降后趋于平稳,当酶解温度处于较高水平,随着酶解时间的增加,猕猴桃皮渣出汁提高率升高后降低。酶解解温度与酶解时间之间的交互作用极显著。
图7为酶解时间与加酶量之间的交互作用,酶解温度为50℃,酶解pH3.5,当酶解时间较短时,随着加酶量的增加猕猴桃皮渣出汁提高率下降后趋于平稳,之后再上升,升高幅度较小。当酶解时间较长时,猴桃皮渣出汁提高率随着加酶量的增加而不断升高,升高幅度较大。当加酶量处于低水平时,当酶解温度处于较低水平时,随着酶解时间的增加,猕猴桃皮渣出汁提高率一直处于上升状态,当加酶量处于较高水平,随着酶解时间的增加,猕猴桃皮渣出汁提高率下降后上升。水解度酶解时间与加酶量之间的交互作用较显著。
2.4.4 验证实验 经回归方程计算得到皮渣酶解的最佳工艺参数:酶解温度48.98℃、pH3.42、酶解时间3.32h、果胶酶用量0.26mg/g,在此条件下皮渣出汁提高率的预测值为45.73%。考虑到实际操作的便利,将酶解工艺条件修正为酶解温度49℃、pH3.5、酶解时间3.3h、果胶酶用量0.26mg/g,在该条件下,进行验证实验,得到皮渣的出汁提高率实验值为(44.21±1.22)%,与理论值的相对误差为2.46%。
3 结论与讨论
本文以猕猴桃皮渣为原料,研究了果胶酶、纤维素酶以及果胶酶和纤维素酶的混合酶对果渣出汁提高率的影响。结果表明:在同等条件设置下,果胶酶对猕猴桃皮渣出汁的效果明显优于纤维素酶以及果胶酶和纤维素酶的混合酶,因此,本实验采用果胶酶对猕猴桃皮渣进行酶解工艺优化。这与刘新等[17]人对柑橘皮渣酶解工艺的研究结果——果胶酶和纤维素酶的混合酶其酶解效果优于单独使用果胶酶和纤维素酶,有所不同,可能是因为柑橘皮渣中纤维素含量高于猕猴桃皮渣,因此,纤维素酶对其酶解出汁的作用更显著。
确定了实验所用酶之后,运用响应面分析方法,对猕猴桃皮渣的酶解取汁工艺进行优化。首先在单因素分析的基础上,采用Box-Behnken中心组合实验,建立二次回归方程模型,模型相关系数R2=0.9636,对模型进行方差分析,确定了猕猴桃皮渣的最佳酶解工艺参数:酶解温度48.98℃、pH3.42、酶解时间3.32h、果胶酶用量0.26mg/g。这与其他研究者的研究结果在温度、pH基本相同,但酶解时间和酶用量上有所不同[17-18],可能是研究的原料和果胶酶种类不同所致。
考虑到实际操作的便利,将酶解工艺条件修正为酶解温度49℃、pH3.5、酶解时间3.3h、果胶酶用量0.26mg/g,在该条件下,进行验证实验,得到皮渣的出汁提高率实验值为(44.21±1.22)%,与理论值的相对误差为2.46%。回归分析与验证实验均表明:运用响应面分析方法对猕猴桃皮渣酶解工艺进行优化所获得的工艺参数科学、可靠。
[1]左长青.中华猕猴桃栽培与加工技术[M].北京:中国农业出版社,1996:1-2.
[2]Halliwell B,Gutteridge JMC.The definition and measurement of antioxidants in biological sys-temes[J].Free Rddic Biol Med,1995,18:125-126.
[3]Bursal,Ilhamol,Gulcin Polyphenol.The contents and in vitro antioxidant activities pf-lyophilized aqueous extract of kiwifruit(Actinidia deliciosa)[J].Food Research Intermational,2011,44:1482-1489.
[4]楼丽君,吕定量,胡增仁,等.猕猴桃根抗肝癌的实验研究[J].中华中医药学刊,2009,27(7):1509-1511.
[5] Hafezil,Hamind,ElmiRad,etal.Actindiadelicicosa(Kiwifruit),a new drug for enzymatic debridement of acute burn wounds[J].Meat Science,2009,82:324-330.
[6]赵莎莎,姚晓丽,金邦荃,等.酶法提取猕猴桃皮和渣中果胶的工艺研究[J].安徽农业科技,2012,39(12):7097-7100.
[7]杨远通,钟海雁,潘曼,等.超微粉碎对猕猴桃皮渣膳食纤维功能性质的影响[J].食品与机械,2011,27(1):11-18.
[8]李加兴,孙金玉,陈双平,等.猕猴桃果醋发酵工艺优化及质量分析[J].食品科学,2011,32(24):306-310.
[9]张超,徐洲,吴登,等.野生猕猴桃果酒带皮渣发酵的研究[J].食品研究与开发,2012,33(8):23-27.
[10]A Figoli,A agarelli,B Cavaliere,et al.Evaluation of pervapoeation process of kiwifruit juice by SPMW-DV/Ion TRAP Mass Spectrometry[J].Desalination,2010,250:1113-1117.
[11]A Igoli,A Figoli,A Tagarelli,et al.Integrated membrance process for the production of highly nutritional kiwifruit juice[J].Desalination,2006,189:21-30.
[12]G I Figoli,P.Katapodis,P S Taoukis.Modelin the effect of temperature and high hydrostatic pressure on the proteolytic activity of kiwi fruit juice[J].Journal of Food Engineering,2009,94:40-45.
[13]A Cassano,L Donato,C Conidi,et al.Recovery of bioactive compounds in kiwifruit juice by ultrfiltration[J].Innovative Food Sinence and Emerging Technologies,2008,9:556-562.
[14]Shela Gorinstein,Ratiporn Haruenkit,Sumitra Poovarodom,et al.The comparative characteristics of snake and kiwifuits[J].Food and Chemical Toxicology,2009,5:34-35.
[15]何伟,张富县,艾乃吐拉,等.杏皮渣白兰地酒精发酵最佳工艺条件的研究[J].酿酒科技,2011(11):21-25.
[16]李加兴,刘飞,范芳利,等.响应面法优化猕猴桃皮渣可溶性膳食纤维提取工艺[J].食品科学,2009,30(14):143-148.
[17]刘新,李新生,吴三桥,等.响应面法优化柑橘果渣酶解工艺[J].食品科学,2012,33(4):86-90.
[18]汪志君,韩永斌,顾振新,等.响应面法优化猕猴桃果浆酶解工艺参数研究[J].食品科学,2006,27(10):326-330.
[19]刘东红,曾超,王衍彬,等.果胶酶ROHAPECT D5S对猕猴桃取汁率、澄清的影响[J].食品科学,2001,22(3):44-46.
[20]中华人民共和国卫生部.GB/T 5009.7-2006食品中还原糖的测定[S].北京:中国标准出版社,2008.
[21]全国食品工业标准技术委员会酿酒分技术委员会.GB/T 15038-2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2008.
