高效液相色谱法测定四角蛤蜊、菲律宾蛤仔中呈味核苷酸
2017-04-26张倩刘睿王欣之程建明张文英杜俊潮吴皓
张倩,刘睿,3,王欣之,3,程建明,3,张文英,杜俊潮,吴皓,3*
1(南京中医药大学 药学院,江苏 南京,210023) 2(江苏省海洋药用生物资源研究与开发重点实验室,江苏 南京,210023) 3(江苏省中药资源产业化过程协同创新中心,江苏 南京,210023)
高效液相色谱法测定四角蛤蜊、菲律宾蛤仔中呈味核苷酸
张倩1,2,刘睿1,2,3,王欣之1,2,3,程建明1,2,3,张文英1,2,杜俊潮1,2,吴皓1,2,3*
1(南京中医药大学 药学院,江苏 南京,210023) 2(江苏省海洋药用生物资源研究与开发重点实验室,江苏 南京,210023) 3(江苏省中药资源产业化过程协同创新中心,江苏 南京,210023)
建立高效液相色谱法(high performance liquid chromatography,HPLC)同时测定四角蛤蜊、菲律宾蛤仔中呈味核苷酸5’-尿苷酸(5’-UMP)、5’-鸟苷酸(5’-GMP)、5’-肌苷酸(5’-IMP)和5’-腺苷酸(5’-AMP)含量。采用Waters Atlantis T3(4.6 mm×250 mm,3 μm)色谱柱,以0.01 mol/L KH2PO4溶液-甲醇为流动相梯度洗脱,紫外检测器在260 nm处进行检测,外标法进行定量。结果表明:各呈味核苷酸线性关系良好,相关系数R2均为0.999 9,回收率在96.19%~103.25%内,相对标准偏差在1.08%~1.28%内。四角蛤蜊与菲律宾蛤仔中均含有4种呈味核苷酸,其中5’-AMP含量最多,其次是5’-IMP和5’-UMP,而5’-GMP含量最低。该方法简单,重现性好、灵敏度和准确度高,适用于四角蛤蜊、菲律宾蛤仔中呈味核苷酸含量测定,为研究贝类风味及贝类食品的开发提供一定的依据。
高效液相色谱法(high performance liquid chromatography,HPLC);四角蛤蜊;菲律宾蛤仔;呈味核苷酸
四角蛤蜊(MactraveneriformisReeve)、菲律宾蛤仔(Ruditapesphilippinarum)是江苏沿海地区重要的经济贝类[1],营养丰富,肉质鲜美。核苷酸是机体体内重要的极性小分子化合物,其中5’-UMP,5’-GMP,5’-IMP,5’-AMP等核苷酸成分具有明显的呈鲜特点[2],极大程度上影响着贝类的口感及鲜度。
目前,呈味核苷酸的含量测定方法有分光光度法[3]、高效液相色谱法[4-6]、高效毛细管电泳法[7]及离子交换色谱法[8]等。国内外对肉类、水产品等食用产品中核苷酸进行了大量的研究[9-10],而对江苏沿海低值贝类中呈味核苷酸的研究相对较少,本实验采用高效液相色谱法对江苏沿海低值贝类四角蛤蜊、菲律宾蛤仔中4种呈味核苷酸进行分析测定,为食用贝类的风味研究及贝类食品的开发提供依据。
1 材料与方法
1.1 材料与试剂
四角蛤蜊、菲律宾蛤仔(江苏省海洋水产研究所,批号为20150714、20150920,经江苏省海洋水产研究所万夕和研究员鉴定为蛤蜊科动物四角蛤蜊MactraveneriformisReeve,帘蛤科动物菲律宾蛤仔Ruditapesphilippinarum);5’-尿苷酸(5’-UMP)、5’-鸟苷酸(5’-GMP)、5’-肌苷酸(5’-IMP)’5’-腺苷酸(5’-AMP)(纯度≥99%,美国Sigma-Aldrich公司);甲醇(色谱纯),德国默克公司;KH2PO4(分析纯),国药集团化学试剂公司;水为超纯水。
1.2 仪器与设备
Waters 2695高效液相色谱仪,Waters 2489 UV检测器(美国Waters公司);3-16pk高速离心机(美国Sigma-Aldrich公司);UNIQUE-s15超纯水机(美国Millipore公司);BT-125D型电子分析天平(德国Sartorius公司)
1.3 实验方法
1.3.1 混合对照品溶液的制备
分别称取5’-UMP,5’-GMP,5’-IMP,5’-AMP,精密称定,加水制成质量浓度为1.0 mg/mL对照品储备液。将5’-UMP,5’-GMP,5’-IMP配制成质量浓度为0.2、1.0、5.0、10.0、20.0、40.0 μg/mL的系列标准溶液;5’-AMP配制成2.5、5.0、10.0、20.0、40.0、80.0 μg/mL的系列标准溶液。
1.3.2 供试品溶液的制备
取四角蛤蜊、菲律宾蛤仔新鲜软体适量,称量,加入3倍质量水煎煮,每次45 min,煎煮2次,将滤液浓缩至软体质量的1/3,100 00 r/min离心10 min,去沉淀,得上清液,加乙醇调节体积分数至80%,静置12 h,抽滤,滤液减压回收乙醇至无醇味,得水提醇沉上清液,超纯水定容,过0.45 μm滤膜过滤,高效液相色谱仪进行测定。
1.3.3 HPLC分析条件
色谱柱:Waters T3色谱柱(4.6 mm×150 mm, 3 μm);流动相A相为甲醇,B相为0.01 mol/L KH2PO4,梯度洗脱(0~10 min,1%~3% A;10~20 min,3%~20% A;20~25 min,20%~25% A;)流速为0.4 mL/min,检测波长:260 nm,进样体积:10 μL。
1.4 数据处理
将核苷酸混合标准品溶液和样品溶液注入高效液相色谱仪中,以每个标准品的保留时间定性,以外标法定量。
2 结果与分析
2.1 HPLC条件的考察
2.1.1 色谱柱的考察
呈味核苷酸是极性大的小分子化合物,在一般的C18色谱柱上不易保留,分别考察了Waters XBridgeTMHILIC色谱柱、Phenomenex Luna C18(2) 色谱柱、Waters Atlantis T3色谱柱对4种呈味核苷酸的分离效果,结果见图1。
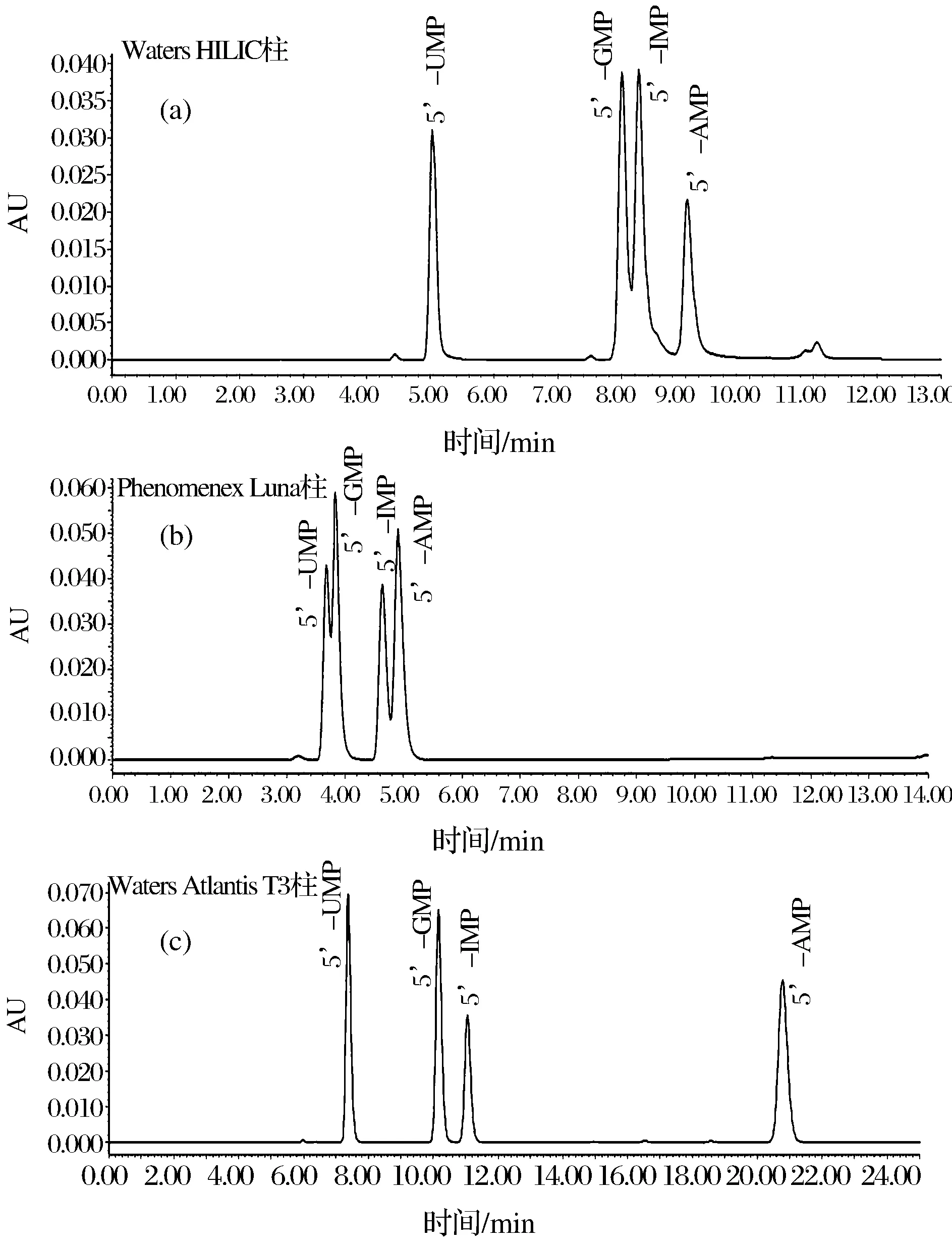
图1 Waters HILIC(a)、Phenomenex Luna C18(b)、Waters Atlantis T3色谱柱(c)对呈味核苷酸的分离效果图Fig.1 Separation schematic diagram of flavor nucleotides on Waters HILIC, Phenomenex Luna C18, Waters Atlantis T3
结果显示T3色谱柱对核苷酸的保留能力明显强于HILIC色谱柱与Phenomenex Luna C18(2) 色谱柱,且5’-GMP与5’-IMP达到分离度要求,故选择Waters Atlantis T3色谱柱作为分离呈味核苷酸的色谱柱。
2.1.2 流动相种类的考察
核苷酸类成分在色谱柱的分离中易发生拖尾现象,原因是色谱柱上固定相与核苷酸之间产生氢键作用,产生拖尾现象[11]。分别选用了磷酸、乙酸及磷酸缓冲盐进行实验(见图2),发现在乙酸条件下,5’-GMP与5’-IMP部分重叠且每个峰有拖尾现象。在磷酸条件下,拖尾现象有所改善但5’-GMP与5’-IMP仍没达到分离要求。而使用KH2PO4磷酸二氢钾作为流动相,能将4种呈味核苷酸达到基线分离的效果,且能抑制拖尾现象,故选择磷酸二氢钾作为流动相。

图2 不同流动相条件下呈味核苷酸的分离效果图Fig.2 Separation schematic diagram of flavor nucleotides in different mobile phase conditions
2.1.3 缓冲盐浓度的考察
针对缓冲KH2PO4的浓度进一步考察,分别选用0.01、0.02、0.05 mol/L进行实验(见图3),结果表明随着缓冲盐浓度的上升,每个物质的保留时间逐渐减小,而对分离效果的影响不大。高浓度的缓冲盐溶液对色谱柱及色谱仪有一定的危害,故在达到核苷酸分离效果的前提下,选择低浓度0.01 mol/L的KH2PO4。
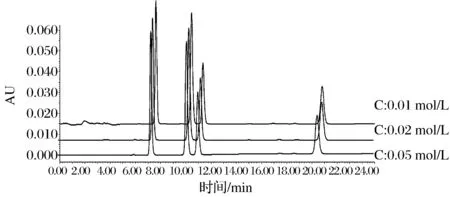
图3 缓冲盐浓度对呈味核苷酸分离的影响Fig.3 Chromatogram of effect of buffer concentration on the separation of flavor nucleotides
2.2 方法学考察
2.2.1 专属性考察
在色谱条件下,混合对照品溶液与四角蛤蜊、菲律宾蛤仔供试品溶液的色谱图见图4,样品中4种呈味核苷酸均达到基线分离。
2.2.2 线性关系考察
分别将质量浓度为0.2、1.0、5.0、10.0、20.0、40.0 μg/mL的5’-UMP,5’-GMP,5’-IMP系列标准溶液;2.5、5.0、10.0、20.0、40.0、80.0 μg/mL的5’-AMP系列标准溶液,按照上述色谱条件取10 μL注入高效液相色谱仪,以峰面积Y对核苷酸浓度X进行回归计算,绘制标准曲线,回归方程见表1。
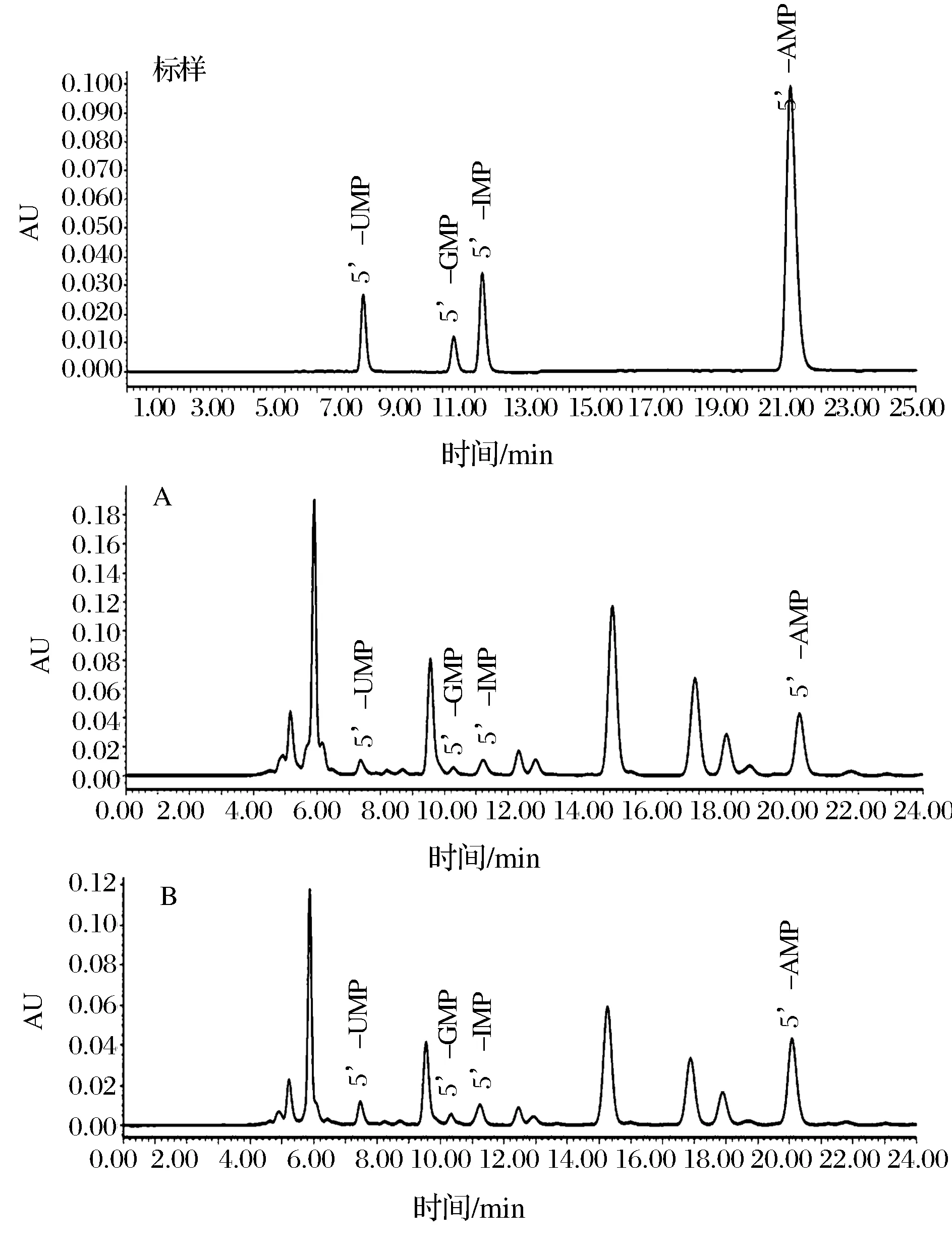
图4 呈味核苷酸对照品(标样)及样品(A四角蛤蜊、B菲律宾蛤仔)色谱图Fig. 4 HPLC chromatogram of flavor nucleotides(Std) and samples(A,B)

表1 4种呈味核苷酸的线性关系和线性范围
2.2.3 精密度考察
取“1.3.2”项下的供试品溶液,将同一份样品在色谱条件下平行测定6次,样品中5’-UMP,5’-GMP,5’-IMP,5’-AMP经过测定后,相对的标准偏差分别是0.31%、0.37%、0.39%、0.42%,符合精密度要求。
2.2.4 重复性与稳定性考察
取四角蛤蜊(批号20150714)、菲律宾蛤仔(批号20150920) 100g,按供试品溶液制备方法平行制备6份,按1.2.3色谱条件下进样分析,测定相应峰面积,计算RSD。结果表明5’-UMP,5’-GMP,5’-IMP,5’-AMP的RSD为2.30%、2.22%、1.98%、1.92%,表明该方法的重复性良好。
对样品中核苷酸的稳定性进行考察,分别考察0、2、4、8、12、24 h的峰面积,结果表明5’-UMP,5’-GMP,5’-IMP,5’-AMP的RSD为1.72%、2.25%、1.89%、1.51%,表明四角蛤蜊、菲律宾蛤仔中4种核苷酸在24 h内稳定。
2.2.5 加样回收率考察
取2.2.4中的四角蛤蜊(批号20150714)共6份,根据标准曲线得到各核苷酸含量,分别加入等量的混合对照品,密塞,摇匀,按照1.3.2供试品溶液制备方法进行处理,在1.3.3色谱条件进样,平行3次,结果见表2。结果显示,5’-UMP,5’-GMP,5’-IMP,5’-AMP的平均加样回收率在96.19%~103.25%,相对标准偏差在1.08%~1.28%之间,表明该测定方法的准确度符合要求,研究方法可靠。
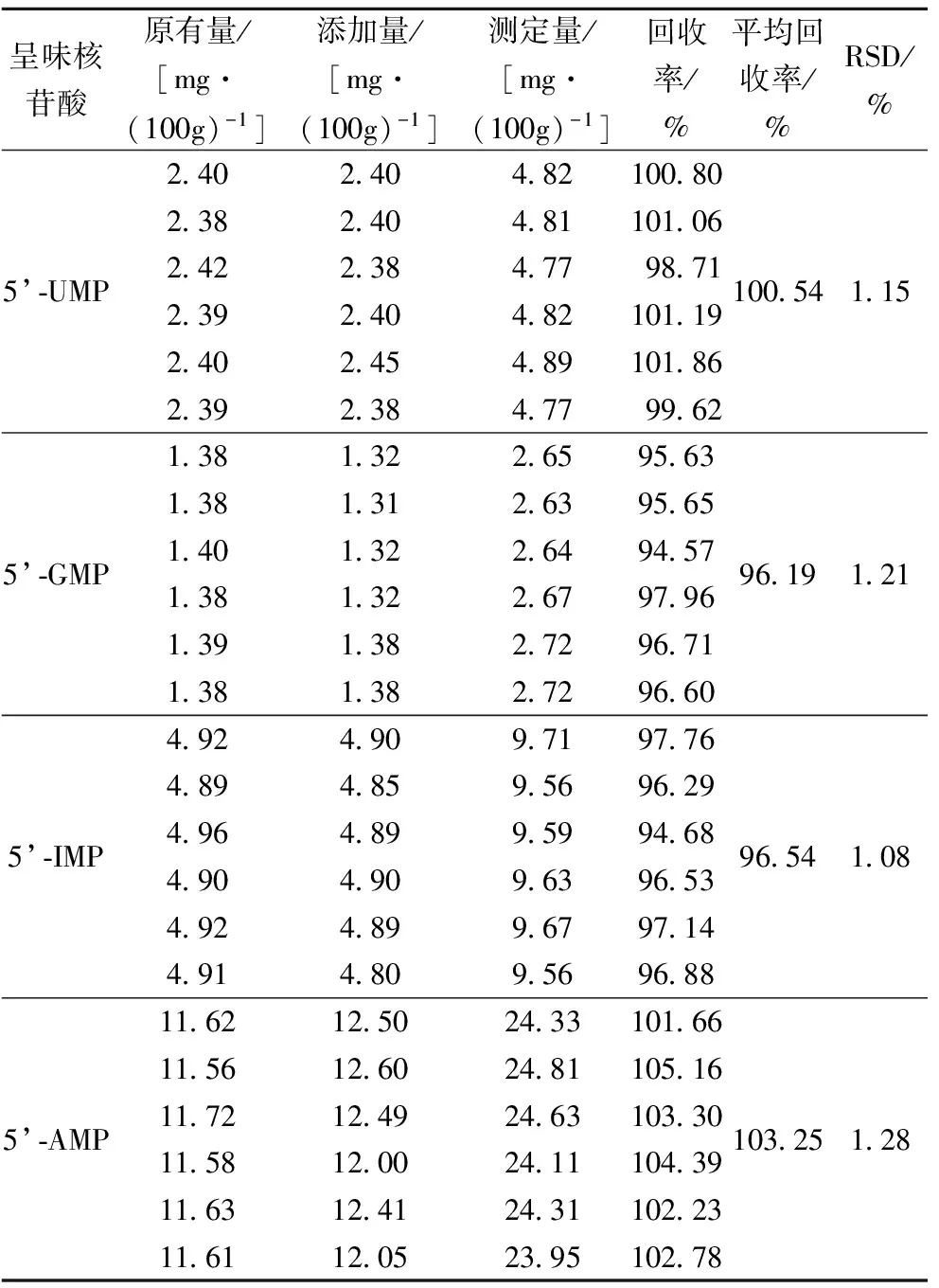
表2 样品中呈味核苷酸的回收率(n=6)
2.3 样品中呈味核苷酸的测定
取四角蛤蜊与菲律宾蛤仔适量,按照1.3.2供试品溶液制备方法进行处理,在1.3.3色谱条件进样,平行3次,结果见表3。由表3可知,四角蛤蜊与菲律宾蛤仔中均含有4种呈味核苷酸,且5’-UMP,5’-IMP及5’-AMP均含量相似,而5’-GMP在这两种贝类中含量差异明显(P<0.05)。在四角蛤蜊与菲律宾蛤仔中,5’-AMP的含量明显高于其他呈味核苷酸,而5’-GMP的含量最低。
味道强度值(taste activity value, TAV)=滋味物质的含量/该滋味物质的阈值。当呈味物质的TAV值大于1时,说明该呈味物质对滋味有贡献,其值越大表明贡献越大,反之则对味道贡献不大[12]。结果表明四角蛤蜊与菲律宾蛤仔中鲜味的来源主要是5’-AMP,其次是5’-IMP和5’-GMP。
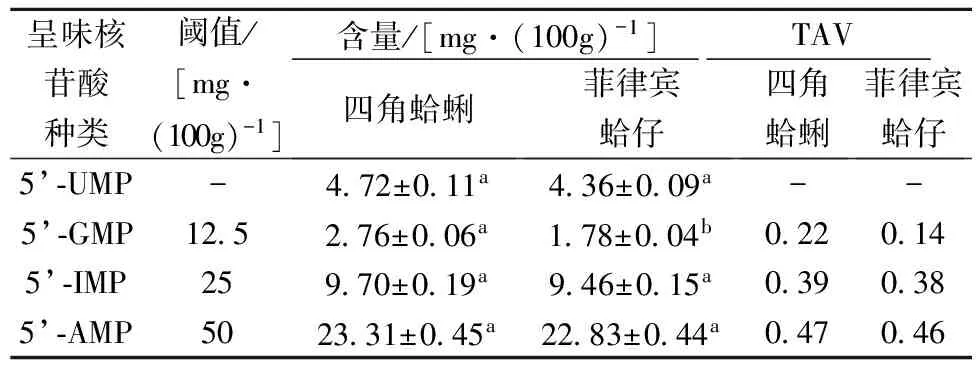
表3 四角蛤蜊、菲律宾蛤仔中4种呈味核苷酸的含量及呈味强度值
注:同一行中字母相同表示均值间差异不显著(P>0.05),字母不同则表示差异显著(P<0.05)。
3 讨论
本文建立了高效液相色谱法同时测定四角蛤蜊、菲律宾蛤仔中呈味核苷酸含量的方法,该方法快速简便,重现性、准确性良好,可应用于江苏低值贝类四角蛤蜊、菲律宾蛤仔中核苷酸的含量测定。测定结果表明四角蛤蜊、菲律宾蛤仔中均含有4种呈味核苷酸 (见表3),其中5’-AMP含量最多,其次是5’-IMP和5’-UMP,5’-GMP含量相对较低。
在呈味强度上,5’-AMP是提供四角蛤蜊与菲律宾蛤仔鲜味的主要来源,其次是5’-IMP和 5’-GMP,这与四角蛤蜊、菲律宾蛤仔作为鲜食贝类密切相关。造成不同呈味核苷酸含量和鲜味的差异可能与贝类摄食的藻类,海洋的环境及采收期等有关,后续将开展不同产地及采收期的贝类中核苷酸动态变化规律研究,为贝类食品或保健品开发提供依据。
[1] 刘睿,吴皓,程建明,等.江苏沿海低值贝类资源综合利用现状与展望[J].南京中医药大学学报,2015,31(1):93-96.
[2] 陈正行,狄济乐.食品添加剂新产品与新技术[M].南通:江苏科学技术出版社,2002.
[3] 黄亚光,黄永嫦,王焕章,等.双波长分光光度法测定呈味核苷酸二钠混合物含量[J].食品与发酵工业,2004,30(7):108-111.
[4] 赵艳,汪宏吉,张凤枰,等.反相离子对高效液相色谱法测定猪肉中呈味核苷酸[J].食品工业科技,2016,37(2):64-67.
[5] REN Yi-ping, ZHANG Jing-shun,SONG Xiao-dan,et al. Simultaneous determination of 5'-monophosphate nucleotides in infant formulas by HPLC-MS[J]. Journal of Chromatographic Science,2011,49:332-337.
[6] 陈丽花,张健,陈培琼,等.反相高效液相色谱法测定中国对虾中呈味核苷酸[J].食品科学,2009,30(10):215-218.
[7] 李佳,李芸,宋宝花,等.高效毛细管电泳法测定酱油中5′-单磷酸核苷酸[J].食品科学,2011,23(22):264-267.
[8] STUDZINSKA S,ROLA R,BUSZEWSKI B.Determination of nucleotides in infant milk formulas using novel dendrimer ion-exchangers[J].Journal of Chromatography B,2014,949-950:97-93.
[9] 陈德慰,苏键,刘小玲,等.广西北部湾3种贝类中主要呈味物质的测定及呈味作用评价[J].食品科学,2012,33 (10):165-168.
[10] 温泉,吴轶.采用高效液相色谱法测定猪肉中的呈味核苷酸[J].现代食品科技,2010,26(1):117-119.
[11] BEILKE M C,BERESM J,OLESKS V.Gradient enhanced-fluidity liquid hydrophilic interaction chromatography of ribonucleic acid nucleosides and nucleotides: A “green” technique[J].Journal of Chromatography A,2016,1436:84-90.
[12] CHEN De-wei, ZHANG Min.Non-volatile taste active compounds in the meat of Chinese mitten carb(Eriochersinensis)[J].Food Chemistry,2007,104(3):1 200-1 201.
Determination of flavor nucleotides inMactraveneriformisandRuditapesphilippinarumby high performance liquid chromatography
ZHANG Qian1,2,LIU Rui1,2,3,WANG Xin-zhi1,2,3,CHENG Jian-ming1,2,3, ZHANG Wen-ying1,2,DU Jun-chao1,2,WU Hao1,2,3*
1(College of Pharmacology, Nanjing University of Chinese Medicine, Nanjing 210023, China) 2(Jiangsu Key Laboratory of Research and Development in Marine Bio-resource Pharmaceutics, Nanjing 210023, China) 3(Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing 210023, China)
A method was established for determination of flavor nucleotides inMactraveneriformisandRuditapesphilippinarumby high performance liquid chromatography. Methods: Separation and quantization were perfored by using a Waters Atlantis T3 column, with 0.01 mol/L KH2PO4- methanol as the mobile phase in gradient elution. The detection wavelength was 260 nm. Results: The external standard calibration curves were used for quantization. A good linear correlations for flavor nucleotide was shown withR2>0.999 9. The average spike recovery of flavor nucleotides was 96.19%-103.25%, with relative standard deviations of 96.19%-103.25%. Conclusion: The method is simple, with good reproducibility, sensitivity and high accuracy. It is suitable for determining flavor nucleotides inMactraveneriformisandRuditapesphilippinarum. The method provideds a basis for the research of shellfish flavor and the development of shellfish food.
high performance liquid chromatography(HPLC);Mactraveneriformis;Ruditapesphilippinarum; flavor nucleotides
10.13995/j.cnki.11-1802/ts.201703039
硕士研究生(吴皓教授为通讯作者,E-mail:whao5795@vip.sina.com)。
国家公益性海洋行业专项基金(201305007,201405017);国家高技术研究发展计划(863计划,2013AA093003);江苏省高校优势学科建设工程项目(PAPD);江苏省青蓝工程;江苏省“333”工程
2016-05-27,改回日期:2016-08-15
