桑葚果酒专用酵母的分离、筛选及鉴定
2017-04-26曹倩雯郑飞云赵佳迪张明芳李佳泰王金晶李崎
曹倩雯,郑飞云,赵佳迪,张明芳,李佳泰,王金晶*,李崎
1(江南大学, 工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
桑葚果酒专用酵母的分离、筛选及鉴定
曹倩雯1,2,郑飞云1,2,赵佳迪1,2,张明芳1,2,李佳泰1,2,王金晶1,2*,李崎1,2
1(江南大学, 工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
以市售桑葚为分离源,从其自然发酵醪液中分离得到42株酵母,通过杜氏小管发酵法初筛,产酒精能力复筛,耐SO2能力及香气活力值(odor activity value,OAV)三级筛选,最终得到最优菌株JNB-14。采用18S rDNA 序列鉴定,确定其与1株酿酒酵母Saccharomycescerevisiae(序列ID: AFD50639.1)有最高匹配度,为100%。
桑葚果酒;酵母;筛选;鉴定
桑葚又名桑果,是桑科落叶灌木或小乔木的果实。据医药史书记载,桑葚味甘性寒,归心、肝、肾经, 具有滋阴补血、生津止渴、补肝益肾等功效[1]。桑葚果肉多汁,色泽艳丽并且富含多种生物活性物质如维生素、胡萝卜素、黄酮醇、花青素、酚酸等酚类化合物[2],是酿酒的极佳原料。
目前桑葚酒在市场上并不多见,一般都由一些小企业、小作坊采用葡萄酒通用酵母酿造而成。工业上尚无酿造桑葚酒的专用酵母,而在果酒酿造的过程中,酵母起着非常重要的作用,直接影响到所酿果酒的口感、风味以及理化性质,决定了果酒品质的优劣[3],因此筛选适于桑葚酒发酵的酵母菌株非常重要。本实验从市售桑葚果发酵液中分离筛选适合酿造桑葚酒的优良酵母,得到了1株发酵性能优良、香气馥郁、风味优良酵母菌并对其进行了菌株鉴定。
1 材料与方法
1.1 实验材料与试剂
桑葚果、白砂糖,市售;酵母基因组DNA提取试剂盒,天根生化科技(北京)有限公司;蛋白胨、琼脂粉、酵母粉,Thermo Fisher Oxoid;偏重亚硫酸钾(K2S2O5),国药集团化学试剂有限公司。
富集培养基(含抗菌素的YPD液体培养基):葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,青霉素1 g/L[4]。
YPD培养基平板:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,琼脂粉20 g/L。
斜面保藏培养基(YPD固体培养基):葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,琼脂粉20 g/L。
1.2 仪器与设备
生化培养箱BSP-250、低温水浴槽,上海博迅公司;阿贝折光仪,泰光有限公司;PL2002电子天平、AL204分析天平,梅特勒-托利多仪器有限公司;气相色谱串联质谱联用仪,美国瓦里安(Varian)公司。
1.3 实验方法
1.3.1 菌种分离
将新鲜成熟的桑葚果榨汁,放入灭完菌的三角瓶中于28 ℃自然发酵,待三角瓶中有大量气泡产生时,取10 mL发酵醪液接入富集培养基,28 ℃恒温培养2~3 d,将富集好的菌悬液稀释5个梯度,采用YPD培养基平板涂布分离,每个梯度3个平行,28 ℃倒置培养2 d。典型的酵母菌菌落表面光滑、湿润、黏稠,质地柔软,易挑起,多为乳白或奶油色,有酒香味[5]。据此特征从培养好的平板上选取有典型酵母形态的菌落,分别在YPD培养基平板上划线分离,直到出现单菌落,将所得单菌落转接到YPD斜面于4 ℃保存并进行编号命名。
1.3.2 酵母的初筛
将活化好的酵母以5%的接种量接入无菌的桑葚汁中,采用杜氏管发酵法[6]观察各菌株的产气速度和产气量。根据实验结果初步筛选出发酵能力强、发酵香气宜人的菌株。
1.3.3 酵母的复筛
将初筛所得发酵力强且发酵气味较好的菌株活化后按5%的接种量接入含糖22°Bx的桑葚汁中,24 ℃发酵7 d。采用蒸馏法测定每瓶发酵液的酒精度[7],并对其进行感官品评。
1.3.4 酵母的三级筛选
1.3.4.1 酵母SO2耐受力实验
采用杜氏管发酵法,调整桑葚汁SO2浓度为40、80、120、160 mg/L,24 ℃下发酵2 d,观察杜氏管中起泡情况。
1.3.4.2 香气活力值(OAV)分析风味筛菌
将复筛所得产酒精能力强且感官品评良好的菌株活化后按5%的接种量接入含糖22 °Bx的桑葚汁中,24 ℃发酵7 d。采用气相色谱-质谱(GC-MS)分析桑葚酒的香气成分,并对其进行感官品评。
样品前处理萃取条件:20 mL顶空瓶中,加入8 mL桑葚酒样品,3.0 g NaCl,在45 ℃预热5 min,萃取60 min。萃取完成后,将萃取头插入进样口,解吸附5 min,进行GC-MS分析[8]。实验以2-辛醇为内标作半定量分析。
分析条件为:GC条件:PEG-20M弹性石英毛细管柱,30 m×0.25 m×0.25 μm;载气为高纯氦气,恒定流量为0.8 mL/min;升温程序:从180 ℃开始,保持2 min,以3 ℃/min升温到230 ℃,保持10 min;进样口温度250 ℃,出样口温度200 ℃;检测电压350 V。MS条件:EI离子源,发射电流200 μA,电子能量70 eV,扫描范围20~550 u。
1.3.5 菌株鉴定
以2%接种量取-80 ℃甘油贮存液接种于YEPD培养基中,28 ℃、150 r/min培养24 h。取适量培养液离心1 min(12 000 r/min,4 ℃),弃尽上清液,得到适量菌体,用酵母基因组DNA提取试剂盒提取基因组DNA。用酵母ITS通用引物对正向引物ITS1、反向引物ITS4扩增基因组DNA,反应条件为:94 ℃预变性5 min后进入以下循环:94 ℃变性45 s,55 ℃退火40 s,72 ℃延伸60 s,35个循环;72 ℃延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳检测。产物送往生工生物工程(上海)股份有限公司测序。
1.3.6 感官品评[9]
组织经过感觉品评培训的老师及学生对每批桑葚酒进行感官品评,结果取平均值。
2 结果与分析
2.1 菌种分离
从市售桑葚果自然发酵液中共分离出42株酵母菌,可以看出桑葚汁自然发酵过程中可以富集其生长环境中的酵母菌,且种类较多。
2.2 菌种初筛
对分离出的酵母菌进行杜氏小管发酵,发酵温度为24 ℃。恒温静置发酵48 h后,有33株酵母的杜氏小管内都充满了气泡,并能闻到淡淡的酒香,说明这些菌株发酵能力旺盛;有31株酵母发酵气味优良,具备桑葚酒发酵的典型香气。其中,发酵能力强且发酵气味愉悦的共有30株。初筛结果如表1。
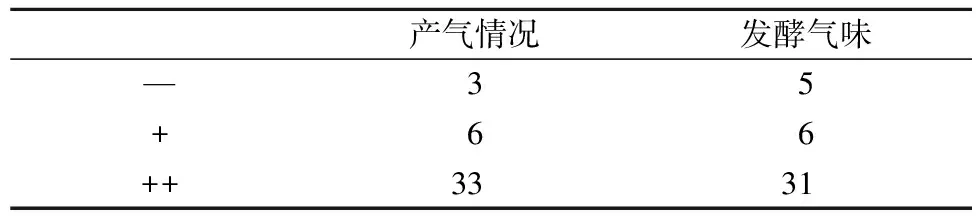
表1 酵母初筛结果
注:“—”表示产气很少不足 1/2 试管或者发酵气味很差有酸败味;“+”表示产气较好,达到甚至超过 1/2 试管或者发酵无异味但香气较淡;“++”表示产气量充足超过2/3甚至充满试管或者发酵气味好、有酒香。
2.3 菌种复筛
对初筛所得的30株酵母进行三角瓶发酵,调整桑葚汁糖度为22°Bx,24 ℃发酵7 d后测定酒精度情况如表2。其中,酒精度最高的桑葚酒为11.3%,酒精度最低的桑葚酒为7.0%。感官品评结果显示得分较高的菌株共有15株,综合产酒精情况,最终保留12株品评结果良好且产酒精能力强的酵母。
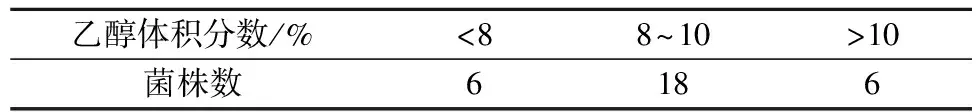
表2 酵母产酒精能力筛选
2.4 酵母的三级筛选
2.4.1 菌株耐SO2能力筛选
果酒发酵一般会添加SO2,它可以抑制各种微生物的活动(繁殖和发酵)。各种微生物对SO2的敏感性不同,细菌最为敏感,其次是尖端酵母,而酿酒酵母耐SO2的能力较强。通常在发酵前加入适量的SO2,可减少其他微生物对酿酒酵母的影响,确保发酵顺利完成。在果酒贮藏过程中,适量SO2可以抑制所有微生物的影响(包括酵母、乳酸菌和醋酸菌),防止果酒的二次发酵和果酒的腐败[10]。但是SO2添加太多会影响酵母的活性,使其发酵迟缓,酒体变苦,GB 2760—2014规定了SO2添加剂最大使用量(以SO2残留量计)为0.25 g/L[11]。本实验通过添加偏重亚硫酸钾来调节桑葚汁中SO2的浓度,用杜氏小管发酵法进行酵母的SO2耐受性实验。实验结果显示复筛所得的酵母菌表现出与葡萄酒酿酒酵母D254相当的耐SO2能力,在最大实验添加量下都生长较旺盛,并且考虑到实际发酵时SO2浓度一般为40~80 mg/L,此轮筛选保留所有菌株。

表3 酵母对SO2耐受性筛选
注:“+++”表示产气量充满杜氏管;“++”表示产气量达到甚至超过2/3杜氏管;“+”表示产气量达到甚至超过1/2杜氏管。
2.4.2 GC-MS风味分析筛菌
某种香气物质的绝对含量并不能反映它对酒体整体香气的贡献,还需要结合它在酒中的阈值来分析[12]。OAV值是一种表征挥发化合物对酒体的整体风味贡献大小的参数。OAV值是指挥发性化合物的浓度与其阈值的比值,理论上,只有OAV值大于1的挥发性化合物才对酒体的整体风味有贡献,并且OAV值越大其香气贡献越大[13]。正如FERREIRA指出,酒的特征香气成分,其含量往往都在阈值以上(OAV>1),并且去掉这些香气成分之后,酒原先所具有的典型香气也会消失[14]。因此,OAV值对确定桑葚酒中的特征香气和重要香气成分非常有帮助。
在桑葚酒中共检测出近50种香气成分,综合OAV值分析可知,桑葚酒中的重要香气物质(OAV>1)有:辛酸乙酯、β-大马酮、正庚醇、异戊酸乙酯、乙酸异戊酯、己酸乙酯、芳樟醇、乙酸苯乙酯、乙醛二乙缩醛、里哪醇、辛酸和癸酸乙酯,主要呈现水果香和花香,赋予酒体怡人的香气,对桑葚酒体有很大贡献。酯类大部分来源于发酵过程中醇和酸的酯化反应,蒸馏过程也有部分酯的产生;贮存过程既有酯化反应,也有水解反应,主要是支链酯的酯化反应和高浓度的直链酯类的水解反应[15]。由OAV总值分析可知,相比于葡萄酒酿酒酵母D254和其他筛选所得菌株,9号菌的总OAV值最高,且其感官品评结果也最好,其他常规指标检测均正常。综合考虑,9号菌更适合桑葚酒的酿造,得到的酒体颜色饱满透亮,果香馥郁,口味纯正,酒体丰满,故将其命名为JNB-14并申请专利1篇。
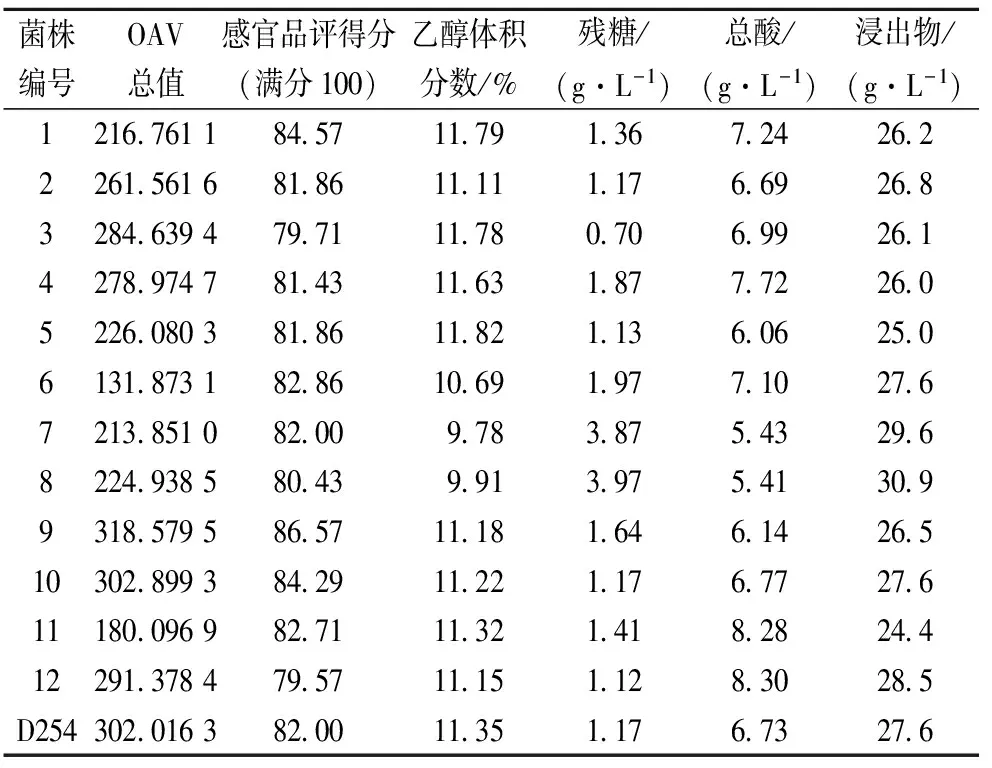
表4 十二种桑葚酒的各指标分析结果
2.5 菌种鉴定
2.5.1 菌种鉴定
如图1所示,PCR产物经1%琼脂糖凝胶电泳鉴定结果良好。将扩增产物寄送生工基因测序,在NCBI网站上进行BLAST序列比对,发现JNB-14与1株酿酒酵母Saccharomycescerevisiae(序列ID:AFD50639.1)具有最高的18S rDNA 基因序列相似性( 100%) ,故将其鉴定为酿酒酵母。
2.5.2 生长曲线测定
测定酿酒酵母生长曲线所使用的培养基为YEPD培养基,115 ℃灭菌15 min。以1%接种量取-80 ℃甘油贮存液接种于YEPD培养基中,28 ℃培养测生长曲线,生长期每2 h取样,稳定期每4 h取样,紫外分光光度计测2株酵母培养液在600 nm下的吸光值,共培养72 h。
由图2可以看出,酵母JBN-14在培养第4 h就进入了对数生长期,第16 h进入平稳期且稳定时间长。这说明该酵母的发酵能力较强。

表5 桑葚酒中挥发性成分的阈值和OAV值(仅列出OAV>1的香气成分)

M-10kb ladder;1-样品图1 酵母PCR产物琼脂糖电泳图Fig.1 PCR products by agarose electrophoresis of yeast
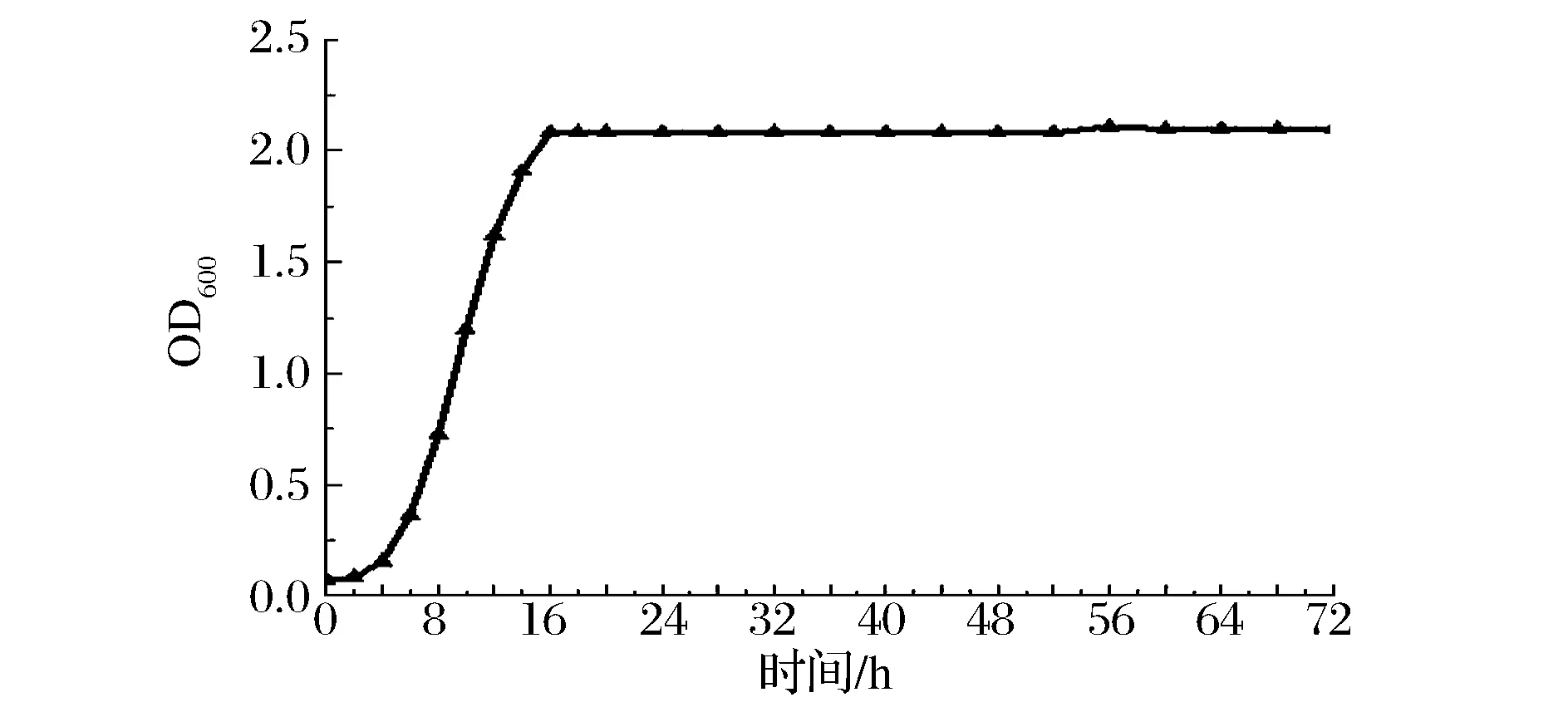
图2 酵母JNB-14生长曲线图Fig.2 Growth curve of yeast JNB-14
3 讨论
果酒加工行业面临的一个较大的问题就是缺少专用水果品种和专用果酒酿造酵母。对于酿造产业而言,菌种是企业的命脉,选用葡萄酒酿酒酵母或者直接将野生型酵母菌投入生产会导致成品酒的质量和产量均存在一定的不足。本实验主要目的是筛选出能在满足桑葚酒酿造的基本要求的基础上拥有较强发酵产香性能的酵母。一级筛选淘汰了发酵能力弱或发酵气味不愉悦的酵母,二级筛选淘汰了产酒精能力弱的酵母,三级筛选的出发菌株均能满足桑葚酒酿造基本要求,这就要求在筛选时通过对感官品评和发酵风味综合评估的方法淘汰那些风味平淡、没有典型性的酵母菌株,而选择香气浓郁、典型性好的菌株。果酒的关键香气化合物是构成酒体香气感官轮廓的主要因素,但由于呈香物质间存在增效作用、协同作用、抑制作用等,使得多种物质并非都能呈现各自的香气。要确定所有挥发性成分中哪些化合物加强了桑葚酒的整体香气,哪些掩蔽了桑葚酒的整体香气,仪器分析仍难以做到;而大量研究结果证实,经过一定培训且有果酒基本知识的人员组成的品评小组具有良好的稳定性,且组内成员对同一酒样的评价具有良好的一致性。感官分析与仪器分析各自存在优势和一定的局限性,可将二者结合,相互弥补。本实验中OAV值可以反映酒体中各香气成分含量及其对酒体的贡献,通过比较OAV总值,可以很直观地分析出酵母的产香能力;而感官品评结果可以直接反映酒体的风味协调性。结合两者结果分析,本实验成功从桑葚表皮分离筛选出1株发酵性能良好、发酵香气馥郁、风味优良、OAV值高的酿酒酵母JNB-14。利用这株酵母酿造的桑葚酒香气优雅且典型性明显,具有较强的工业应用前景。
[1] LIU Xue-ming,XIAO Geng-sheng,CHEN Wei-dong.Advances in research and development of mulberry[J].Chinese Traditional & Herbal Drugs,2001,32(6):569-571.
[2] LIANG Ling-hong,WU Xiang-yang,ZHAO Ting,et al.Invitro,bioaccessibility and antioxidant activity of anthocyanins from mulberry(Morus atropurpurea, Roxb.) following simulated gastro-intestinal digestion[J].Food Research International,2012,46(1):76-82.
[3] 罗佳丽,王雪莹,王孝荣,等.甜橙果酒酵母筛选及发酵性能[J].食品科学,2013,34(11):222-227.
[4] 王雪莹.优质甜橙果酒酵母分离、筛选及发酵特性研究[D].重庆:西南大学,2013.
[5] 刘慧.现代食品微生物学[M].北京:中国轻工业出版社,2011:12-14.
[6] 刘贞,刘小翠,赵思明,等.发酵米浆中高发酵性能酵母菌和乳酸菌的筛选和鉴定[J].食品科学,2010,31(7):232-235.
[7] 全国食品工业标准化技术委员会酿酒分技术委员会.GB/T 15038-2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[8] 沈海月,范文来,徐岩,等.应用顶空固相微萃取分析四种红葡萄酒挥发性成分[J].酿酒,2008,35(2):71-74.
[9] 李宏,刘锐萍,张克义.葡萄酒感官品评技术要求及品评方法研究[J].酿酒科技,2013(5):122-127.
[10] 方强,籍保平,乔勇进,等.果酒中二氧化硫及其控制技术的研究进展[J].农业工程技术·农产品加工,2008(2):12-17.
[11] 中华人民共和国国家卫生和计划生育委员会.GB 2760-2014食品添加剂使用标准[S].北京:中国标准出版社,2014.
[12] 李佳.昌黎原产地域赤霞珠葡萄酒香气成分研究[D].杨凌:西北农林科技大学,2007.
[13] 尹建邦.烟台产区蛇龙珠葡萄酒中挥发性香气成分的研究[D].无锡:江南大学,2009.
[14] MORENO-ARRIBAS V,POLO C.Wine Chemistry and Biochemistry[M].10th ed.New York:Springer New York,2009:55-71.
[15] 范文来,徐岩.酒类风味化学[M].北京:中国轻工业出版社,2014:220-235.
The isolation , screening and identification of yeasts for mulberry wine
CAO Qian-wen1,2, ZHENG Fei-yun1,2, ZHAO Jia-di1,2, ZHANG Ming-fang1,2, LI Jia-tai1,2, WANG Jin-jing1,2*, LI Qi1,2
1(The Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China) 2(School of Biotechnology, Jiangnan University, Wuxi 214122, China)
A total of 42 yeast strains were isolated from natural fermented mash of commercially available mulberries. Through duchenne tubular screening, alcohol yield ability test, SO2resistance ability test and odor activity value (odor activity value,OAV) screening, the optimal strain JNB-14 was obtained finally. The 18S rDNA sequence amplification was conducted for molecular biology identification of JNB-14 and it turned out to have the highest degree of match (100%) withSaccharomycescerevisiae(sequence ID: AFD50639.1).
mulberry wine; yeast; screening; identification
10.13995/j.cnki.11-1802/ts.201703017
硕士研究生(王金晶副教授为通讯作者,E-mail:jjwang@jiangnan.edu.cn)。
江苏高校优势学科建设工程资助项目(PAPD);国家高新技术研究发展计划(863计划,No.2013AA102106-03);国家自然科学基金(No.31271919,No. 31571942,No.31301539,No.31601558,& No.31601445);江苏省自然科学基金(BK20150159);江苏基础研究资助项目(JUSRP51306A, JUSRP51402A & JUDCF13008)
2016-09-06,改回日期:2016-11-07
