乳酸菌代谢保护剂中糖产酸对冷冻保护的影响
2017-04-26崔树茂赵建新陈卫张灏
崔树茂,赵建新,陈卫,张灏
(江南大学 食品学院,江苏 无锡,214122)
乳酸菌代谢保护剂中糖产酸对冷冻保护的影响
崔树茂,赵建新,陈卫,张灏*
(江南大学 食品学院,江苏 无锡,214122)
真空冷冻干燥是乳酸菌菌粉制备的关键技术手段,在冻干前须将菌泥与保护剂混匀并进行预冻。文中系统研究了菌泥与保护剂混匀过程中的代谢产酸情况,及产酸引起的pH值降低对预冻的影响。测定了不同菌泥添加保护剂后在室温和冷藏温度下的产酸速率,以及不同pH值下冷冻后菌株的存活率,分析了不同pH值条件下冷冻对菌株ATP酶、β-半乳糖苷酶、乳酸脱氢酶及细胞膜完整性和流动性的影响。结果表明,菌泥与保护剂混合后,室温环境下的产酸速率很快,可在短时间内将菌悬液的pH值降至4.0。而pH值降低确实会对冷冻菌株的存活产生影响,pH值在降至4.0时,菌株冷冻存活率显著降低。低pH值条件下的冷冻,会损伤ATP酶、β-半乳糖苷酶及降低细胞膜的流动性,是导致冷冻存活率降低的原因。因此,为提高真空冷冻干燥的菌株存活率,首先须控制菌泥与保护剂混合时的温度和时间,确保预冻阶段乳酸菌无损失。
乳酸菌;产酸速率;存活率;酶
乳酸菌能够发酵糖类产酸,具有优良的发酵性能,赋予发酵食品特有的风味和品质,被广泛地应用到发酵乳制品[1],发酵果蔬[2],发酵香肠[3]等。同时乳酸菌也是一种益生菌,具有改善肠胃,治疗便秘,拮抗肠炎,提高免疫等功能性[4-6]。发酵食品的乳酸菌发酵剂、益生菌片剂、动物饲料乳酸菌添加剂、乳酸菌活性饮料等乳酸菌制品深受广大消费者的喜爱。
为了便于运输和保藏,以及后期产品的加工利用,乳酸菌的生产通常以菌粉的形式呈现。而目前最有效地获得乳酸菌菌粉的技术是真空冷冻干燥,将菌体预冻成固体,水分在低温和低分压条件下挥发。但是,直接冻干乳酸菌会对菌体造成严重的机械损伤,并对细胞膜、酶等造成破坏,杀死细胞[7]。因此,冻干保护剂的使用是提高乳酸菌冻干存活率的主要手段。蛋白质和糖类是主要的保护剂,因其能够在冷冻过程形成无定形结构,减少细胞损伤,是提高冻干存活率的先决条件;且糖类能够通过氢键替代稳定脂质膜和蛋白[8]。脱脂乳、海藻糖、蔗糖是应用最广泛的冻干保护剂。
但是,脱脂乳中的乳糖、海藻糖和蔗糖均能被乳酸菌利用产生有机酸。酸能够以未解离的分子形式与细胞膜的磷脂高度互溶,从而通过被动扩散进入细胞内部[9-11],造成膜电位的耗散,细胞质酸化及细胞内酸根离子积累,对胞内关键酶和细胞膜造成损伤,从而对菌体产生毒害作用[12]。因此在冻干前,保护剂中的糖有可能被乳酸菌代谢产酸,引起菌悬液pH值的降低,从而造成菌体在预冻时即产生损伤。
本研究的目的是探讨冻干前不同乳酸菌在含糖类保护剂中的产酸规律,探讨酸对菌株冷冻存活的影响,为提高乳酸菌的冻干存活率,以及冻干前的准备工作时提出指导方案。
1 材料和方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌(Lactobacillusplantarum)CCFM 8661,干酪乳杆菌(Lactobacilluscasei)CCFM 30,鼠李糖乳杆菌(Lactobacillusrhamnosus)CCFM1107,江南大学食品生物技术中心保藏。
1.1.2 试剂
脱脂乳,上海光明乳业股份有限公司;海藻糖(纯度≥98%),日本林原;蔗糖,上海国药集团;MRS培养基,青岛海博生物技术有限公司。
1.2 仪器与设备
GRP-9160型隔水式恒温培养箱,上海森信实验仪器有限公司;RCBIOS10型冷冻离心机,赛默飞世尔科技公司;FE-20型pH计,梅特勒-托利多集团;SCIENTZ-48型高通量均质机,浙江宁波新芝科技有限公司;F-7000型荧光分光光度计,日本日立公司。
1.3 实验方法
1.3.1 乳酸菌的活化与培养
从甘油保菌管内吸取 200μL乳酸菌菌液,接种到5mLMRS液体培养基中,在各自的最适温度(植物乳杆菌和鼠李糖乳杆菌的最适温度是37 ℃,干酪乳杆菌的最适温度是42 ℃)条件下活化培养18~24h,重复上述操作1次得到活化菌液。然后以体积分数5%接种到MRS液体培养基中,置于最适温度培养。
1.3.2 乳酸菌菌泥的收集
乳酸菌生长至稳定期后,在4℃条件下以6 000~8 000g的离心力离心10min。弃上清液,菌泥分别用10g/L的无菌蛋白胨水溶液(pH7.0),9g/L的无菌生理盐水(pH7.0)和0.01mol/L的无菌磷酸盐缓冲液(phosphatebuffersaline,PBS,pH7.0)洗涤2次。不同溶液洗涤得到菌泥添加与菌泥等质量的无菌生理盐水,振荡,充分混匀菌体,形成的菌悬液用于后续实验,以未洗涤的菌泥作为对照。
1.3.3 保护剂的配制
称取一定质量的脱脂乳,完全溶解于纯化水中,配制一定浓度的脱脂乳溶液,105 ℃灭菌10min;然后称取一定质量的蔗糖和海藻糖,分别配制成适宜浓度的蔗糖和海藻糖溶液,115 ℃高温灭菌20min。灭菌后将脱脂乳溶液和糖溶液按一定比例混合,使其与菌泥混合后,各保护剂成分满足以下浓度:脱脂乳 120g/L,海藻糖 20g/L,蔗糖 20g/L。所有保护剂溶液均在无菌环境下调整pH值至pH7.0。
1.3.4 保护剂溶液中pH值与含酸量的对应曲线
取10mL上述已配制好的保护剂溶液添加不同量的乳酸,测定其pH值,以乳酸浓度为横坐标,pH值为纵坐标,绘制曲线。
1.3.5 乳酸菌在不同温度下的产酸速率
不同保护剂溶液中分别添加不同量的菌泥,除了满足上述各保护剂成分的浓度,使植物乳杆菌、干酪乳杆菌和鼠李糖乳杆菌的菌泥终浓度分别为1、2、4g/10mL。将菌悬液立即放入冰水(0℃)和室温[(23±2)℃]环境下,每10min取样,测定菌悬液的pH值和总酸浓度。以时间为横坐标,不同质量菌泥在不同时间的产酸量为纵坐标,线性拟合得斜率为不同质量菌泥单位时间的产酸量;再以菌泥质量为横坐标,不同质量菌泥单位时间的产酸量为纵坐标,线性拟合得斜率为乳酸菌单位质量单位时间的产酸量,即为单位质量的产酸速率。
pH值的测定:FE-20型型酸度计直接测定。
可滴定总酸度(乳酸):直接酸碱滴定法,以乳酸计。
1.3.6 乳酸菌在不同pH值的冷冻存活
按1.3.5的菌泥终浓度将乳酸菌菌泥与保护剂溶液混匀后,调节pH值为pH7.0,然后在室温环境下静置,在pH值分别降至pH7.0、6.0、5.0、4.0时取样测定菌株的存活率,其余样品立即放入液氮中冷冻。冷冻4h后解冻,测定不同pH条件下冷冻后菌悬液的活菌浓度。计数采用平板菌落计数法。

式中:NA,不同pH值条件下冷冻前后的活菌浓度,CFU/mL;NB,冷冻前pH值为7.0时的活菌浓度,CFU/mL。
1.3.7 无细胞提取物的制备
冷冻后的样品在室温条件下解冻后离心,上清液用于胞外β-半乳糖苷酶和乳酸脱氢酶的测定。菌泥用无菌蒸馏水洗涤2次,然后用无菌蒸馏水重悬至冷冻前体积。以体积比1∶1.5添加玻璃珠(直径0.1 mm),在高通量均质机中研磨1 min,冰浴5 min,循环10次后离心,上清液用于测定总蛋白(蛋白测定采用上海碧云天P0011型BCA试剂盒测定)、ATP酶、胞内β-半乳糖苷酶和乳酸脱氢酶。
1.3.8 ATP酶的测定
ATP酶采用南京建成的A016-1型的ATP酶试剂盒按照说明书测定。酶活定义:每分钟每克蛋白质分解ATP产生1 μmol无机磷的量为1个ATP酶活力单位。即1 U= 1μmolPi/(g·min)。
1.3.9 β-半乳糖苷酶的测定
β-半乳糖苷酶能够催化分解邻硝基苯-β-D-半乳糖苷(o-nitrophenyl-β-d-galactoside,oNPG)生成邻硝基苯(o-nitrophenyl,oNP)和半乳糖,该酶的测定采用BHOWMIK描述的方法[13]。酶活定义:每分钟每克蛋白质分解oNPG生成1 μmoloNP的量为1个β-半乳糖苷酶活力单位。即1 U= 1μmoloNP/(g·min)。
1.3.10 乳酸脱氢酶的测定
乳酸脱氢酶能够将丙酮酸还原成乳酸,在此过程中降低还原型辅酶(reduced form of nicotinamide-adenine dinucleotid,NADH)在340 nm处的吸收。该酶的测定按照BERGMEYER和BERNT在1974年提出的经典方法进行[14]。酶活定义:每分钟每克蛋白质降低1个吸收值,为1个乳酸脱氢酶活力单位。即1 U= 1 μE/(g·min)。
1.3.11 细胞膜流动性的测定
荧光各异性被用来描述细胞膜的流动性,其测定按照LOUESDON描述的方法进行[15]。荧光偏振(P)、各向异性(r)和微黏度(η)用来评价膜流动性的高低,他们根据LI的方法进行估算[16]。P,r,η越高表示膜的流动性越低。
1.3.12 数据统计与分析
实验中不同组(>3)之间的显著性差异通过SPSS 16.0软件进行ANOVA判断(Tukey’s检验),P<0.05则认为差异显著。
2 结果与分析
2.1 不同溶液洗涤对产酸速率的影响
乳酸菌在培养至稳定期时,胞内会积累大量的有机酸,如果不洗涤菌泥,添加保护剂后菌泥中的酸会使菌悬液的pH值降低。经测定,植物乳杆菌CCFM8610、干酪乳杆菌CCFM30及鼠李糖乳杆菌CCFM1107的湿菌泥含酸量分别为:0.217 mmol/g,0.159 mmol/g和0.152 mmol/g。图1显示,10 mL保护剂溶液中添加2 g以上的湿菌泥即会使菌悬液的pH值降至pH 5.5以下。因此,离心收集后的湿菌泥需要中性溶液进行洗涤,去除胞内残留的乳酸。

图1 保护剂溶液中pH值与乳酸含量的对应曲线Fig.1 The corresponding curves of pH and lactic acid content in the solution of protective agent
中性的生理盐水、PBS(pH 7.0,0.01 mol/L)水及10 g/L的蛋白胨水溶液被广泛地用于菌泥的洗涤,均能达到去除菌泥中酸残留的效果。表1展示了不同溶液洗涤后菌泥的产酸速率,以未洗涤的菌泥为对照。结果表明,不同溶液洗涤的菌泥产酸速率与未洗涤的菌泥产酸速率无显著差异,洗涤以及洗涤溶液并不会对菌泥产酸速率产生影响。生理盐水成本低,配制简单,因此后续试验均采用中性的生理盐水作为菌泥的洗涤剂。

表1 菌泥经不同溶液洗涤后在不同温度下的产酸速率 单位:mmol/(g·min)
2.2 不同温度对产酸速率的影响
乳酸菌代谢保护剂中糖产酸是一系列的酶促反应过程,酶的作用受到温度的影响。从表1可以看出,在室温环境下乳酸菌的产酸速率明显高于冷藏温度。且在室温环境时,不同的乳酸菌产酸速率不同,植物乳杆菌产酸最快,其次是干酪乳杆菌,鼠李糖乳杆菌产酸速率低于其他2株菌。在冷藏温度时,酶系反应基本被抑制,3株乳酸菌的产酸速率均很低,且无明显差异。
在乳酸菌的冻干菌粉生产过程中,菌泥洗涤后通常在室温环境下添加保护剂,振荡或搅拌混匀后,将菌体与保护剂充分混匀后移至冻干机进行预冻。从添加保护剂至温度降至样品冻结,这一过程通常需要1~2 h,甚至更长。结合表1和图1可知,10 mL保护剂溶液中添加2 g湿菌泥,30 min即可将菌悬液的pH值降至pH 4.0左右。
2.3 产酸引起的pH值降低对冷冻存活率的影响
室温条件下,菌泥会快速代谢保护剂中的糖类产酸,使菌悬液的pH值降低。虽然菌悬液中菌的存活率并没有伴随着pH值的降低而降低(数据未列出),但是pH值的降低却对冷冻后的存活率产生影响。图2显示,3株乳酸菌在pH值降到pH4.0时,冷冻后的存活率显著地降低。pH值高于pH5.0时,冷冻后的存活率没有显著变化。因此,为了确保后续冻干的存活率,菌泥与保护剂混合过程中,要避免pH值的过度降低。控制菌泥与保护剂的混合温度是必要的,使其尽可能地保持低温,且混匀时间尽可能短,确保菌株不因产酸而在预冻过程中即产生损伤。
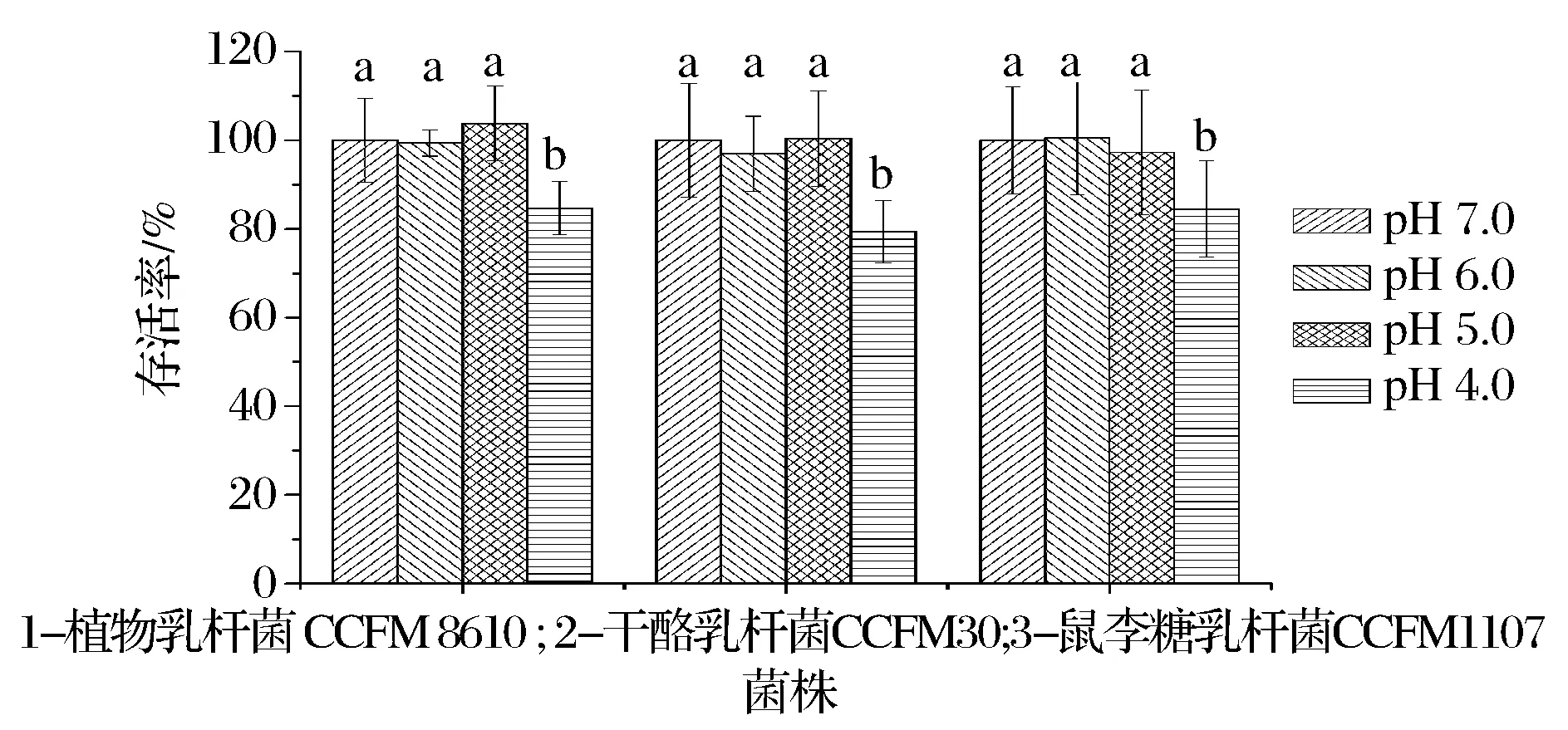
图2 pH值对冷冻存活率的影响Fig.2 Effect of pH on survival rate of Lactobacillus during freezing注:标有不同字母表示酶活在不同pH具有显著性差异,P<0.05
2.4 产酸引起的pH值降低对冷冻细胞ATP酶的影响
ATP酶是乳酸菌细胞膜上维持细胞正常生理功能的重要酶系。Na+K+-ATP酶镶嵌在细胞膜脂质双分子层中,能够催化ATP水解供能,驱动Na+和 K+于细胞膜两侧的对向运输,维持着细胞膜两侧的膜电位、调节细胞渗透压,为营养物质的吸收提供动力等方面起着重要作用[17]。Ca2+Mg2+-ATP酶是乳酸菌调节细胞Ca2+和Mg2+的浓度的另一种重要的膜酶。从图3和图4可以看出,pH值对冷冻后ATP酶活的影响与存活率一致,在pH值降至5.0以后,Na+K+-ATP酶和Ca2+Mg2+-ATP酶均出现显著的降低。说明pH值的降低,加重冷冻对乳酸菌ATP酶的损伤,ATP酶的破坏是导致存活率降低的原因之一。
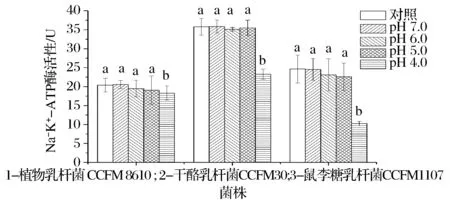
图3 冷冻过程中pH值对乳酸菌Na+K+-ATP酶的影响Fig.3 Effect of pH on Na+K+-ATP of Lactobacillus during freezing注:标有不同字母表示酶活在不同pH具有显著性差异,P<0.05。
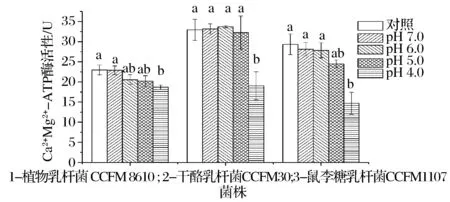
图4 冷冻过程中pH值对乳酸菌Ca2+Mg2+-ATP酶的影响Fig.4 Effect of pH on Ca2+Mg2+-ATP of Lactobacillus during freezing注:标有不同字母表示酶活在不同pH具有显著性差异,P<0.05
2.5 产酸引起的pH值降低对冷冻细胞β-半乳糖苷酶的影响
β-半乳糖苷酶是乳酸菌分解乳糖的重要酶,该酶的活性直接影响乳酸菌的代谢能力。图5显示,干酪乳杆菌CCFM 30和鼠李糖乳杆菌CCFM 1107在pH值降至pH4.0时,冷冻后β-半乳糖苷酶的活性显著降低。而植物乳杆菌CCFM 8610在pH值降至pH6.0时,冷冻后β-半乳糖苷酶的活性即显著降低,但此时存活率并未受影响;在pH值降至pH4.0时,β-半乳糖苷酶的活性出现更显著的降低。说明pH值的降低,会加重冷冻对乳酸菌β-半乳糖苷酶的损伤,该酶活性降低至一定程度后,会影响菌株的存活。

图5 冷冻过程中pH值对乳酸菌β-半乳糖苷酶的影响Fig.5 Effect of pH on β-galactosidase of Lactobacillus during freezing注:标有不同字母表示酶活在不同pH具有显著性差异,P<0.05
2.6 产酸引起的pH值降低对冷冻细胞乳酸脱氢酶的影响
乳酸脱氢酶是糖酵解途径的关键酶,在该途径的最后一步将丙酮酸还原成乳酸,该酶活力大小直接影响菌株的代谢能力,更会影响菌株的存活。图6显示,伴随着pH值的降低,乳酸脱氢酶在冷冻后酶活升高,且在pH值降至pH 5.0以下时,乳酸脱氢酶酶活显著上升。此现象归因于乳酸菌遇到酸胁迫时的自我保护机制[18-19]。此结果表明pH值的降低不会导致冷冻对乳酸菌乳酸脱氢酶的破坏,在低pH值时冷冻存活率的降低与乳酸脱氢酶没有关系。

图6 冷冻过程中pH值对乳酸菌乳酸脱氢酶的影响Fig.6 Effect of pH on LDH of Lactobacillus during freezing(注:标有不同字母表示酶活在不同pH具有显著性差异,P<0.05)
2.7 产酸引起的pH值降低对冷冻细胞膜完整性和流动性的影响
β-半乳糖苷酶和乳酸脱氢酶均是胞内酶,只有膜的完整性遭到破坏时两种酶才会泄漏到胞外。在该实验中,任何条件下的胞外液体均未检测到两种酶的存在。说明膜的完整性良好,即使pH值降低,冷冻亦未对乳酸菌的细胞膜产生破坏。
但是膜的流动性却因pH值的降低而产生影响,表2中可以看出,3株乳酸菌在pH值降至pH 4.0时,冷冻后细胞膜的荧光偏振(P)、各向异性(r)和微黏度(η)均显著升高,表明膜的流动性降低。细胞膜流动性的降低是乳酸菌在冻干过程存活率降低的主要因素之一[16]。结果表明,pH值的降低导致冷冻对细胞膜的流动性产生破坏,从而影响了菌株的冷冻存活率。

表2 pH值对细胞膜荧光偏振、各向异性及微黏度的影响
注:a,b表示数值间具有显著性差异,p<0.05。
3 结论
(1)乳酸菌添加冻干保护剂后,室温环境下可代谢保护剂中糖类产酸,2 g/10 mL的菌泥浓度,可使菌悬液的pH值在30 min内降至pH 4.0左右。
(2)中性的生理盐水、PBS(pH 7.0,0.01mol/L)水及10 g/L的蛋白胨水溶液洗涤菌泥后,菌的产酸速率没有区别。
(3)pH值降至pH 4.0时,冷冻后乳酸菌的存活率显著降低。
(4)低pH值条件下乳酸菌冷冻存活率的降低归因于Na+K+-ATP酶,Ca2+Mg2+-ATP酶,β-半乳糖苷酶的损伤以及细胞膜流动性的降低,与乳酸脱氢酶和细胞膜的完整性无关。
(5)为了提高乳酸菌的冻干存活率,须确保预冻阶段菌的存活,因此须控制菌泥与保护剂混合时的温度及时间,避免乳酸菌代谢保护剂中糖大量产酸。
[1] STILES M E, HOLZAPFE W H. Lactic acid bacteria of foods and their current taxonomy[J]. International Journal of Food Microbiology, 1997,36(1):1-29.
[2] DI CAGNO R, CODA R, DE ANGELIS M, et al. Exploitation of vegetables and fruits through lactic acid fermentation[J].Food Microbiology, 2013, 33(1):1-10.
[3] AMMOR M S, MAYO B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production: An update[J]. Meat Sci, 2007, 76(1):138-146.
[4] CHO I, BLASER M J. The human microbiome: at the interface of health and disease[J]. Nat Rev Genet, 2012, 13(4):260-270.
[5] GAREAU M G, SHERMAN P M, WALKER W A. Probiotics and the gut microbiota in intestinal health and disease[J]. Nat Rev Gastroenterol Hepatol, 2010, 7(9):503-514.
[6] WELLS J M, MERCENIER A. Mucosal delivery of therapeutic and prophylactic molecules using lactic acid bacteria[J]. Nat Rev Microbiol, 2008, 6(5):349-362.
[7] SUN Xiao-qi, GAO Li-li, WANG Song, et al. Use of beta-galactosidase liposome model as a novel method to screen freeze-drying cryoprotectants[J]. World J Microbiol Biotechnol, 2013, 29(10):1 907-1 912.
[8] ONNEBY K, PIZZUL L, BJERKETORP J, et al. Effects of di-and polysaccharide formulations and storage conditions on survival of freeze-driedSphingobiumsp.[J]. World J Microbiol Biotechnol, 2013, 29(8):1 399-1 408.
[9] AXE D D,BAILEY J E. Transport of lactate and acetate through the energized cytoplasmic membrane ofEscherichiacoli[J]. Biotechnology and Bioengineering, 1995, 47(1):8-19.
[10] NARENDRANATH N, THOMAS K, INGLEDEW W. Effects of acetic acid and lactic acid on the growth ofSaccharomycescerevisiaein a minimal medium[J]. Journal of Industrial Microbiology and Biotechnology, 2001, 26(3):171-177.
[11] CARPENTER C E, BROADBENT J R. External concentration of organic acid anions and pH: key independent variables for studying how organic acids inhibit growth of bacteria in mildly acidic foods[J]. J Food Sci, 2009, 74(1):12-15.
[12] PIETERSE B, LEER R J, SCHUREN F H, et al. Unravelling the multiple effects of lactic acid stress onLactobacillusplantarumby transcription profiling[J]. Microbiology, 2005, 151(12):3 881-3 894.
[13] BHOWMIK T, JOHNSON M C, RAY B. Factors influencing synthesis and activity of β-galactosidase inLactobacillusacidophilus[J]. Journal of Industrial Microbiology, 1987, 2(1):1-7.
[14] BERGMEYER H U, BERNT E.Methods of enzymatic analysis[M]. 2th ed. New York:Academic Press, 1974.
[15] LOUESDON S, CHARLOT-ROUGE S, JUILLARD V, et al. Osmotic stress affects the stability of freeze-driedLactobacillusbuchneriR1102 as a result of intracellular betaine accumulation and membrane characteristics[J]. Journal of Applied Microbiology, 2014, 117(1):196-207.
[16] LI Bao-kun, TIAN Feng-wei, LIU Xiao-ming, et al. Effects of cryoprotectants on viability ofLactobacillusreuteriCICC6226[J]. Appl Microbiol Biotechnol, 2011, 92(3):609-616.
[17] 李保坤. 乳酸杆菌冷冻干燥生理损伤机制及保护策略研究[D].无锡:江南大学, 2011.
[19] YE Li-dan, ZHAO Hua, LI Zhi, et al. Improved acid tolerance ofLactobacilluspentosusby error-prone whole genome amplification[J]. Bioresource Technology, 2013,135:459-463.
Effect of acids produced by metabolizing carbohydrate of protectants on viability ofLactobacillusduring freezing
CUI Shu-mao, ZHAO Jian-xin, CHEN Wei, ZHANG Hao*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Vacuum freeze-drying is the key technology for preparingLactobacilluspowder. It is significant for cell pastes to be mixed with protectants before freeze drying. In this paper, the acid production rate in the mixing processing of cell pastes and protectants, and the effect of pH decrease caused by acid production on viability ofLactobacillusduring freezing, were studied. The rate of acid production at room temperature and cold storage temperature, as well as the survival rate ofLactobacillusat different pH value after freezing, were determined. In addition, ATPase, β-galactosidase, lactate dehydrogenase (LDH), and cell membrane integrity and fluidity ofLactobacillusafter freezing at different pH were measured. The results showed that the rate of acid production at room temperature was very fast, which could reduce the pH of the bacterial suspension to 4.0 in a short time after mixed with protectants. The low pH indeed decreased the survival rate of frozen strains, which was significantly reduced at pH 4.0. The damage of ATP enzyme and β-galactosidase, and the reduction of the fluidity of cell membrane caused by freezing under low pH could result in the low survival rate. Therefore, the temperature and time for mixing cell pastes with protectants must be controlled to avoid loss of lactic acid bacteria in pre-freezing stage in order to improve the survival rate during vacuum freeze drying.
Lactobacillus; acid production rate; survival rate; enzyme
博士研究生(张灏教授为通讯作者,E-mail:zhanghao@jiangnan.edu.cn)。
十二五国家科技支撑项目:发酵乳制品乳酸菌菌种与发酵剂的研究与开发
2016-06-08,改回日期:2016-08-04
10.13995/j.cnki.11-1802/ts.201703004
