微波辅助提取沙田柚囊衣中柚皮苷及其对抗氧化性的影响
2017-04-26李楠楠马亚琴李申张震
李楠楠,马亚琴,李申,张震
(西南大学 柑桔研究所,重庆,400712)
微波辅助提取沙田柚囊衣中柚皮苷及其对抗氧化性的影响
李楠楠,马亚琴*,李申,张震
(西南大学 柑桔研究所,重庆,400712)
采用微波提取技术对沙田柚囊衣中柚皮苷的提取工艺进行优化,并对提取液的抗氧化活性进行分析。以单因素试验为基础,选取溶剂体积分数、微波功率和料液比3个因素,根据Box-Behnken Design中心组合设计原理进行响应面分析,建立柚皮苷得率的二次多项数学模型。得到提取柚皮苷的最佳工艺条件:提取溶剂为体积分数52%乙醇,微波功率587 W,料液比1∶20 (g∶mL),柚皮苷的提取量为15.581 0 mg/g。此外,根据DPPH法、FRAP法及ABTS法3种方法测定的提取液的抗氧化性表明,有效的微波处理能显著影响提取物的抗氧化性。
沙田柚囊衣;柚皮苷;微波提取;抗氧化性
柚子是芸香科植物柚的成熟果实,常见的有沙田柚、葡萄柚、蜜柚等多个品种[1]。目前,柚皮除少量加工成蜜饯类产品及药用外,绝大多数没有得到合理利用,一般直接作为垃圾处理,这不仅造成资源的浪费,还造成严重的环境污染[2]。国内外研究表明,柚皮中不仅含有丰富的营养成分如氨基酸、抗坏血酸、β-胡萝卜素等[3-4],还含有多种生物活性成分,其中黄酮类、类柠檬苦素等含量甚至高于果实中的含量,因此具有极高的开发价值[5]。
研究显示,柚皮中的主要活性成分为黄酮类物质[6],如柚皮苷、新橙皮素等,其中柚皮苷含量最高[7-8]。柚皮苷具有抗菌[9]、抗肿瘤[10-11]、改善局部微循环和营养供给等功效,还可用于防治心脑血管疾病[12-13]。但由于柚皮苷在人体内不能合成,因此天然柚皮苷的研究与开发受到研究人员的高度关注[14-15]。
目前,天然活性物质的高效绿色提取已成为提取技术的研究热点和发展趋势,最大限度地降低提取时间和节约能耗的同时,还应有效提高提取率。文献资料显示,柚皮苷的主要提取方法包括:溶剂提取法[15-17]、热水提取法、碱提酸沉法[18]、微波辅助提取法[19]、超声波辅助提取法[20]、超滤法等。微波提取技术具有快速、高效、绿色的工艺条件等优势[21-22],已被广泛应用于提取各种生物活性物质[23-26]。微波高效提取活性物质的机理在于微波能对植物组织细胞产生生物效应,其高能量使细胞内温度升高,根据摩尔方程,温度升高,细胞内压力增大,当压力大于细胞膜的承受力时,细胞立即破裂,释放出内含物[27]。因此,加快了细胞内含物流出,大大降低提取时间,增强活性物质的抗氧化能力[28-29]。
因此,本文以重庆地区广泛种植的成熟沙田柚(Shatian pomelo)为原料,微波辅助提取柚皮囊衣中的柚皮苷,并采用响应面设计优化柚皮囊衣中油皮苷的工艺条件,通过分析柚皮苷提取液抗氧化性的变化,综合得到油皮苷的最佳提取工艺条件,以期为柚类副产物综合利用的开发寻找有效途径。
1 材料与方法
1.1 材料与试剂
沙田柚,采摘于西南大学柑桔研究所资源室;甲醇,乙醇,冰乙酸,均为分析纯,均购于成都市科龙化工试剂厂;柚皮苷标准品,纯度均为≥95.5%,购于Sigma公司。
1.2 试验仪器与设备
HWC-3LA型微波提取设备,天水华圆制药设备科技有限责任公司;高效液相色谱仪 Ultimate3000,戴安中国有限公司;电子分析天平FAZ004B,上海精密仪器有限公司;氮吹仪TTL-DCI,北京同泰联科技发展有限公司;TU-1901 紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 样品制备
新鲜沙田柚去除柚子果皮表面的油胞层,取白囊衣,切成1 cm2大小的碎片,60 ℃恒温箱烘干,粉碎机制得粉末(粒径60目)备用。
1.3.2 柚皮苷含量的测定
采用高效液相色谱测定柚皮苷的含量。检测条件[30]:Thermo Fisher色谱柱(5 μm,100 A,4.6 mm×250 mm),柱温30 ℃,V(1%冰乙酸)∶V(甲醇)=68∶32,流速1.0 mL/min,进样量20.0 μL,紫外检测线283 nm下测定柚皮苷的峰面积,外标法定量测定。
标准曲线的绘制:标品用纯甲醇定容进样,将以上母液分别稀释成不同的浓度,绘制标准曲线。标准曲线方程为:y=23.73x+9.017 2(式中y为柚皮苷标品的峰面积,x为柚皮苷标品的含量,R2=0.997 7)。
1.3.3 总酚含量的测定
以没食子酸(GA)为对照品,参考HE等[31]采用的Folin-酚法对总酚含量进行测定,以GA当量表示样品的总酚含量。GA标准曲线:y=0.103 9x+0.002 9(式中y为波长760 nm 处的吸光度,x为每克干样所含微克当量没食子酸,R2=0.999 5)。
1.3.4 不同微波参数对柚皮苷及总酚提取量的影响
1.3.4.1 单因素试验
称取1g囊衣粉末作为样品,分别研究乙醇体积分数(0、20%、40%、60%、80、100%)、微波功率(200、300、400、500、600、700 W)、微波时间(1、2、4、6、8 min)和料液比(1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL),确定各因素的最佳条件。每组对照处理,将1 g样品浸泡在蒸馏水中30 min,料液比为1∶30(g∶mL)。
1.3.4.2 响应面试验
基于单因素试验结果,选择乙醇体积分数、微波功率、料液比为影响因素,并以A、B、C分别表示3个因素,以-1、0、1分别表示各因素的3个水平。采用Design Expert3因素3水平的Box-Behnken Design(BBD)试验设计原理,研究响应值以及最佳变量的优化组合。试验因素水平见表1。

表1 微波辅助提取沙田柚囊衣中柚皮苷的工艺优化响应面分析因素水平表
1.3.5 不同微波参数对提取液抗氧化性的影响
1.3.5.1 FRAP法[32]
标准曲线:准确称取0.05 g Trolox,用甲醇容易定容于25 mL的容量瓶。稀释标准品浓度至0.1 mg/mL,用移液枪分别准确移取0、50、80、100、150、200 μL Trolox标准溶液于试管中,并加入4.9 mL FRAP试剂在暗室反应10 min,在593 nm处测定其最大吸收光值。
标准曲线方程为:y=0.023 5x+0.004(式中y为波长 593 nm 处的吸光度,x为每克干样所含毫克当量Trolox,R2=0.998 6)。
样品测定:0.1 mL的提取液与4.9 mL的FRAP工作液在暗室中充分反应10 min后,采用紫外分光光度计在593 nm处测定其最大吸收值,结果以每克干样所含毫克当量Trolox来表示。
1.3.5.2 DPPH法[33]
标准曲线:配制不同浓度的Trolox溶液,加4 mL DPPH溶液,于517 nm下测吸光值,以吸光值的减少值与Trolox含量作标准曲线。标准曲线方程为:y=2.934x-0.367(式中y为DPPH自由基清除率,x为每克干样所含微克当量Trolox,R2= 0.999 1)。
样品测定:100 μL的提取液加入4 mL DPPH溶液,在暗室中静置10 min,接着在517 nm测定其吸收值,结果以每克干样所含毫克当量Trolox来表示。
1.3.5.3 ABTS法[34]
标准曲线:先配制140 mmol/L过硫酸钾储备液和7 mmol/L的ABTS储备液,然后取过硫酸钾溶液440 μL与ABTS溶液25 mL混合避光反应12~16 h,然后用乙醇稀释ABTS溶液至吸光值为(0.7±0.002),准确称取0.05 g Trolox,用甲醇容易定容于25mL的容量瓶。配制不同浓度梯度的Trolox溶液于试管中,加3.9 mL ABTS+溶液,于734 nm下测吸光值。标准曲线方程为:y=0.038 5x+0.002 3(式中y为ABTS+·清除率,x为每克干样所含毫克当量Trolox,R2=0.999 1)。
样品测定:取3.95 mL ABTS+溶液与50 μL提取液,混合均匀后反应10 min,于734 nm下测吸光值,结果以每克干样所含毫克当量Trolox来表示。
1.4 统计分析
所有测得的实验数据都以3个重复的“平均值±标准差”表示。数据处理采用Design-Expert 8.0,方差分析(ANOVA)通过SPSS 20.0.0完成,采用Duncan多元回归方法分析了在0.05的水平上均值的显著性差。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇体积分数对提取液中柚皮苷及总酚的影响
由图1可知,在微波功率600 W、微波时间6 min,料液比1∶30(g∶mL)条件下,随乙醇体积分数的增大,柚皮苷提取量增加,随后增幅变缓,当乙醇体积分数为60%时,柚皮苷提取量达到14.28 mg/g,之后随着乙醇体积分数的增大,柚皮苷提取量反而降低。提取液中总酚的提取量与柚皮苷提取量具有相同的趋势,随着乙醇体积分数的上升而增大,总酚溶解越彻底,当乙醇体积分数为60%时,总酚提取量达到392 μg/g,当乙醇体积分数大于80%时,总酚提取量呈显著下降趋势。与本实验研究结果一样,蒋志国等[35]在利用超声-微波协同提取菠萝蜜果皮中多酚类物质,乙醇体积分数对其得率的影响同样呈先增大后减小的趋势;XIAO等[36]利用微波辅助提取黄芪中黄酮,研究表明黄酮得率随着乙醇体积分数显著增加,当乙醇体积分数超过90%时迅速下降。柚皮苷溶于乙醇,乙醇体积分数越大,溶解越彻底,当乙醇体积分数达到80%,不再增加柚皮苷溶解度,乙醇体积分数增大则产生较大的渗透压,影响柚皮苷的提取速度,同时高浓度的乙醇与液相中的柚皮苷发生反应,影响柚皮苷提取量,不利于柚皮苷的提取[36-38]。综合分析选取提取溶剂为体积分数60%的乙醇。
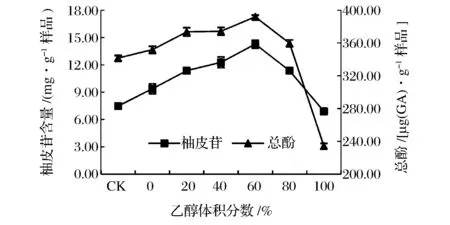
图1 乙醇体积分数对沙田柚囊衣中柚皮苷及总酚提取量的影响Fig.1 Effect of ethanol concentration on the yield of naringin and total phenolics from Shatian pomelo white white layer.
2.1.2 微波功率对提取液中柚皮苷及总酚的影响
由图2可知,因微波的破壁效应和热效应,当微波功率增大时,柚皮苷提取量显著增加(P<0.05)。在乙醇体积分数60%、微波时间6 min,料液比1∶30 (g∶mL)条件下,当微波功率达到600 W时,柚皮苷提取量达到17.79 mg/g,当微波功率的增大到700 W时,柚皮苷提取量迅速降低。提取液中总酚提取量随着微波功率增大而增加,在超过600 W之后,微波功率过大造成内部温度过高,导致酚类物质分解,总酚提取量下降。与CK相比较,在微波功率为600 W时的总酚提取量增加了14.73%。项昭保等[39]分别利用超声波、微波在提取橄榄多酚的研究中,其功率的影响与本结果相似。由于微波功率的增加,物料吸收微波能导致内部升温加剧,提取溶剂温度升高引发内部压力增大而导致细胞快速破裂[40],同时,微波所产生的电磁场加快了被提取组分由物料内部趋向提取溶剂界面的扩散速度,增强了柚皮苷溶解到提取溶剂的速率。随微波功率的继续增加,或会导致柚皮苷的分解。因此,在本研究中,选择提取柚皮苷的最佳微波功率为600 W。
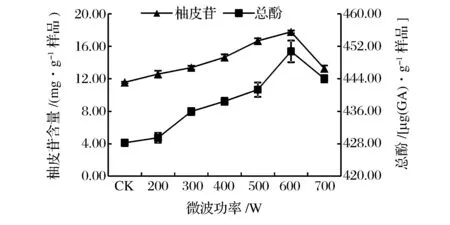
图2 微波功率对沙田柚囊衣中柚皮苷及总酚提取量的影响Fig.2 Effect of microvave power on the yield of naringin and total phenolics from Shatian pomelo white white layer.
2.1.3 微波时间对提取液中柚皮苷及总酚的影响
由图3可知,在乙醇体积分数60%,微波功率600 W,料液比1∶30(g∶mL)条件下,柚皮苷提取量随着微波时间的延长而增加,当处理时间2 min时,柚皮苷提取量达到13.03 mg/g,继续延长时间柚皮苷提取量反而下降。在微波电磁场,物质吸收微波能,细胞内部温度迅速上升,高温使其内部压力超出细胞空间膨胀力,导致细胞破裂,细胞内有效成分快速溶解到介质中,从而提高了提取量。当提取量达到最大值之后,随微波处理时间的延长,热能急剧增加,高温导致柚皮苷分子降解,最终造成柚皮苷含量下降[41]。综合经济效益和柚皮苷产量等因素,微波时间为2 min对柚皮苷的提取效果最好。

图3 微波时间对沙田柚囊衣中柚皮苷及总酚提取量的影响Fig.3 Effect of microvave treatment time on the yield of naringin and total phenolics from Shatian pomelo white layer.
由图3可知,随着微波时间的延长,总酚提取量增加,在微波时间延长到4 min时,与CK相比较总酚含量增加了22%,总酚提取量达到420 μg/g,当微波时间超过6 min,总酚含量反而有所下降,可能是处理时间过长,温度上升过高,对总酚成分有所破坏。
2.1.4 料液比对提取液中柚皮苷及总酚的影响
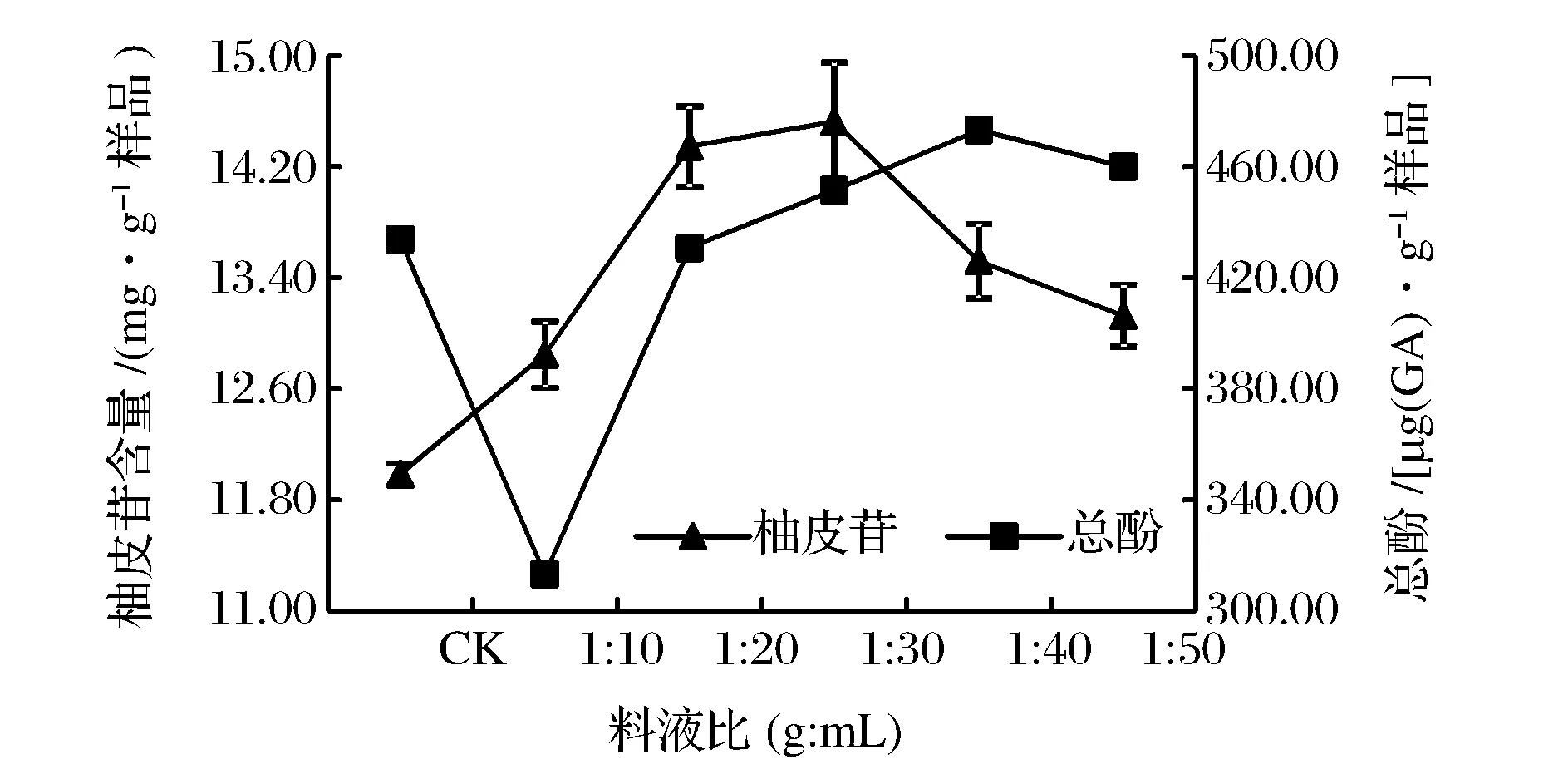
图4 料液比对沙田柚囊衣中柚皮苷及总酚提取量的影响Fig.4 Effect of solid-to-solvent ratio on the yield of naringin and total phenolics from Shatian pomelo white layer.
由图4可知,在乙醇体积分数60%,微波功率600 W,微波时间2 min条件下,随着溶剂量的增加,样品与溶剂接触面增大,溶剂中溶质的浓度差和溶剂能够溶解的物质的量不断增大,使得柚皮苷提取量逐渐增大[42],当料液比超过1∶40(g∶mL)时,柚皮苷提取量呈下降趋势。总酚物质在低料液比中因没有全部溶解到提取溶剂中,造成提取溶剂中总酚提取量较低,之后随着料液比增大,酚类物质溶于乙醇中直到饱和,乙醇过量造成酚类物质的浓度被稀释,总酚提取量降低。焦士蓉等[43]利用微波提取柚皮黄酮类物质的研究与本实验的结果相似;XIAO等[36]提取黄酮类化合物研究料液比对提取量的影响得出最佳料液比也是1∶30(g∶mL)。物料比较小不利于提取物的溶出,表现为低提取量;而物料比过大相对稀释了提取物的浓度,提取量呈现下降趋势。此外,料液比的增加同样会加速物料中的其他成分溶解,进而影响柚皮苷的提取量[44]。因此,本研究选择提取果胶的最佳料液比为1∶30(g∶mL)。
2.2 响应面试验
综合以上单因素试验结果,选择乙醇体积分数(A)、微波功率(B)、料液比(C)3个较优水平。以2分钟为微波时间,确定3因素3水平的响应面分析法,柚皮苷提取量的提取结果见表2。表2所得的试验数据进行二次回归分析,得到以柚皮苷提取量为目标函数的二次回归方程:
Y=15.19-0.59A-0.44B-0.59C+0.31AB-0.21AC-0.3BC-0.29A2-1.52B2-0.22C2
对该模型进行回归方差分析,结果见表3。P<0.01,表明响应回归模型达到极显著水平。此外,R2=0.928 1,表明响应值柚皮苷提取量实际值与预测值之间具有较好的拟合度,该实验方案是可行的。该模型的失拟项P>0.05,表明该模型合理。
表4表明回归系数显著性检验结果,该模型中的A、C均达到极显著水平,B达到显著水平;交互项均不显著,二次项B2表现为极显著。表明各因素对柚皮苷含量的影响不是简单的线性关系。从各个因素的显著性水平差异可知,对提取液中柚皮苷含量的影响次序为:乙醇体积分数=料液比>微波功率。
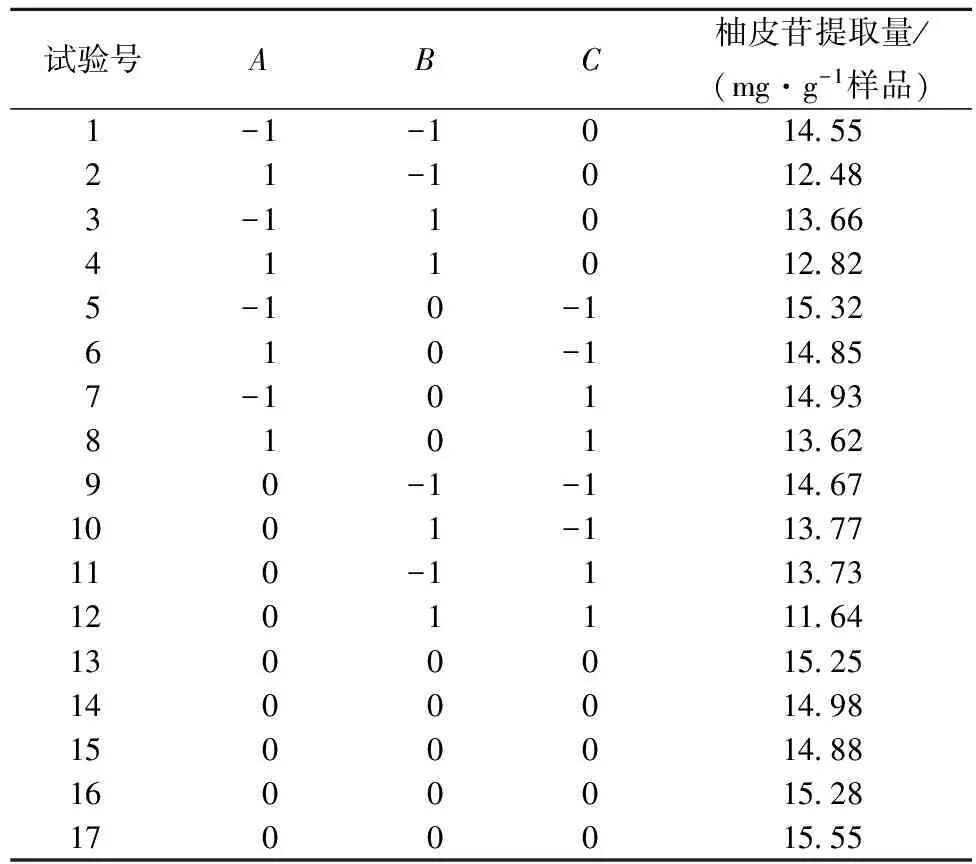
表2 微波辅助提取沙田柚囊衣中柚皮苷的工艺优化响应面试验设计及结果
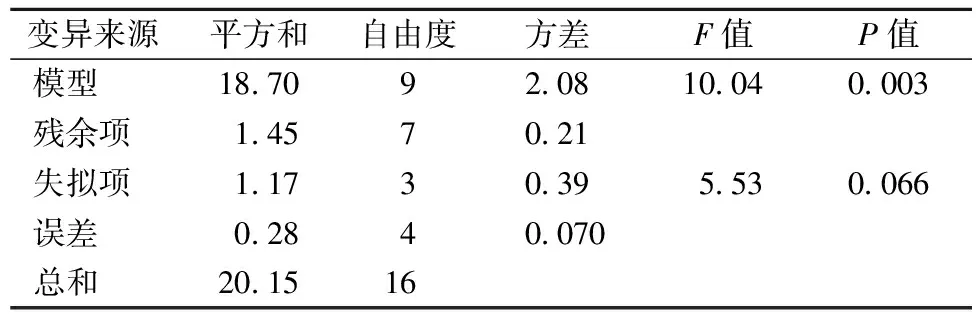
表3 回归模型方差分析

表4 回归系数及显著性检验
注: *.显著(P<0.05); **.极显著(P<0.01)。
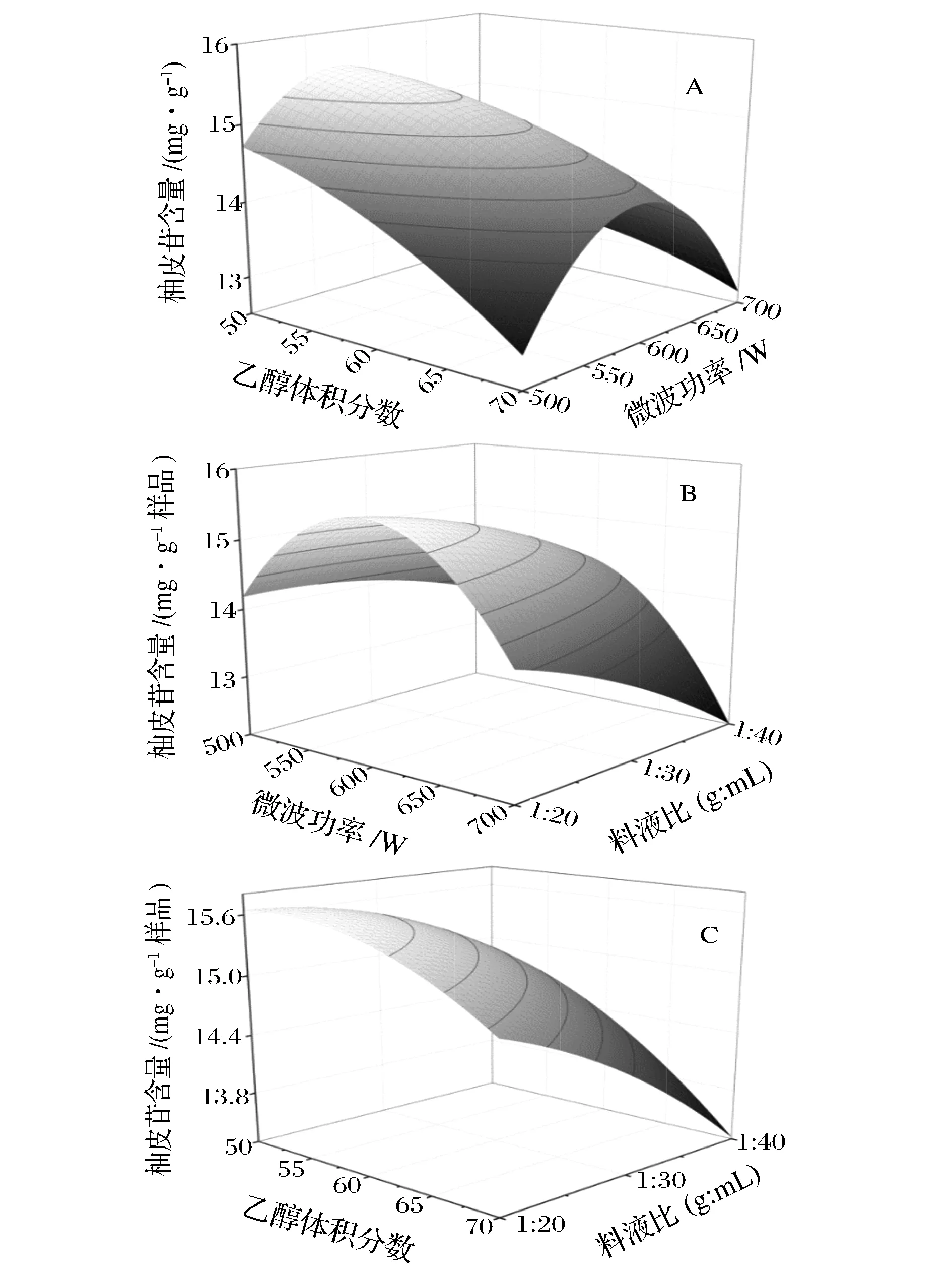
图5 乙醇体积分数、微波功率和料液比对沙田柚囊衣中柚皮苷提取量影响的响应面图Fig.5 Effect of response surface on: (A) microwave power level and ethanol concentration; (B) microwave power level and solid-to-solvent ratio; (C) ethanol concentration and solid-to-solvent ratioon naringin yield from Shatian pomelo white layer(注:固定水平:料液比1∶30(g∶mL);乙醇体积分数60%;微波功率600 W)
当响应曲面坡度比较平滑,说明响应值受各个变量变化的影响较小;相反,当响应曲面坡度较陡峭,则说明响应值受变量交互作用较为明显。由图5A可知,乙醇体积分数和微波功率对提取液中柚皮苷提取量均有显著影响(P<0.05),随着乙醇体积分数的变化,响应面曲面比较陡峭,但微波功率的变化引起响应面曲面的变化比较平坦。两者的交互作用没有达到显著水平;由图5B可知,微波功率的增大可能导致柚皮苷分子结构的破坏,使得提取液中柚皮苷提取量下降,从响应面曲线图来看,料液比对柚皮苷提取量的影响较微波功率的影响显著;由图5C可知,乙醇体积分数对柚皮苷提取量的影响相对较弱,表现为曲线较为平滑,随着料液比的变化,响应面曲线急剧陡峭,说明料液比对提取液中柚皮苷提取量的影响是显著的。利用Design-Expert 8.0软件分析,得出最佳微波提取柚皮苷的工艺条件为乙醇体积分数51.91%、微波功率586.75 W、料液比1∶20(g∶mL),提取3次,模型预测柚皮苷提取量15.685 7 mg/g。采用优化条件进行验证实验,为了便于在实验中实际操作,将实验条件修改为乙醇体积分数52% e、微波功率587 W、料液比1∶20(g∶mL),在最佳微波条件下进行3次重复实验,柚皮苷提取量为15.581 6 mg/g。柚皮苷含量回归模型的预测值和实验所得到的实际值基本一致,说明本实验采用响应面法对柚皮囊衣中柚皮苷的提取条件优化合理可行。
2.3 提取液抗氧化性分析
2.3.1 乙醇体积分数对提取液抗氧化性的影响
由图6可知,随着乙醇体积分数的增加,提取液的抗氧化能力增强,在乙醇体积分数为40%与60%之间时,提取液的抗氧化能力达到最强,之后随着乙醇体积分数的增加抗氧化性减弱。

图6 乙醇体积分数对提取液抗氧化性的影响Fig.6 Effect of ethanol concentration on antioxidant activities of extracts.(注:FRAP法和ABTS法在主坐标轴,DPPH法在次坐标轴)
2.3.2 微波功率对提取液抗氧化性的影响
由图7可知,微波功率对提取液的抗氧化性的影响随微波功率的增大,抗氧化性能逐渐增强,微波功率超过600 W时,抗氧化性能力呈现下降趋势。
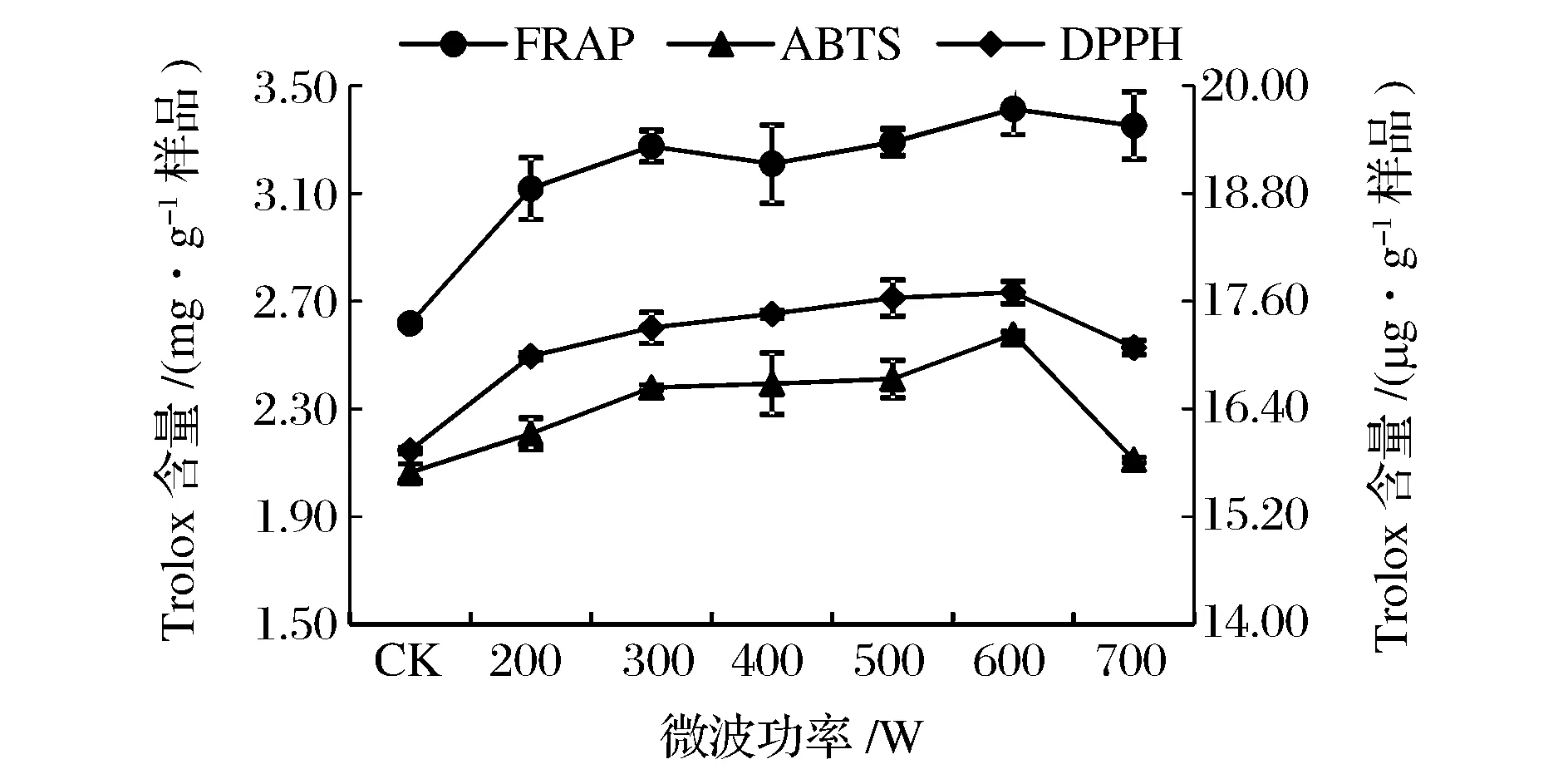
图7 微波功率对提取液抗氧化性的影响Fig.7 Effect of microwave power on antioxidant activities of extracts.(注:FRAP法和ABTS法在主坐标轴,DPPH法在次坐标轴)
2.3.3 微波时间对提取液抗氧化性的影响
由图8可知,微波处理组与对照组在抗氧化性上具有显著性差异,但是不同时间的微波处理之间没有显著性差异,微波处理6 min后,FRAP法、DPPH法和ABTS法测定的抗氧化能力均有所下降。

图8 微波时间对提取液抗氧化性的影响Fig.8 Effect of microwave treatment time on antioxidant activities of extracts.(注:FRAP法和ABTS法在主坐标轴,DPPH法在次坐标轴)
2.3.4 料液比对提取液抗氧化性的影响
由图9可得,因其测量抗氧化性的机理不同,导致在FRAP法、ABTS法、DPPH法的最大值在不同料液比上,并且FRAP法和ABTS法测出的Trolox提取量明显高于DPPH法的。
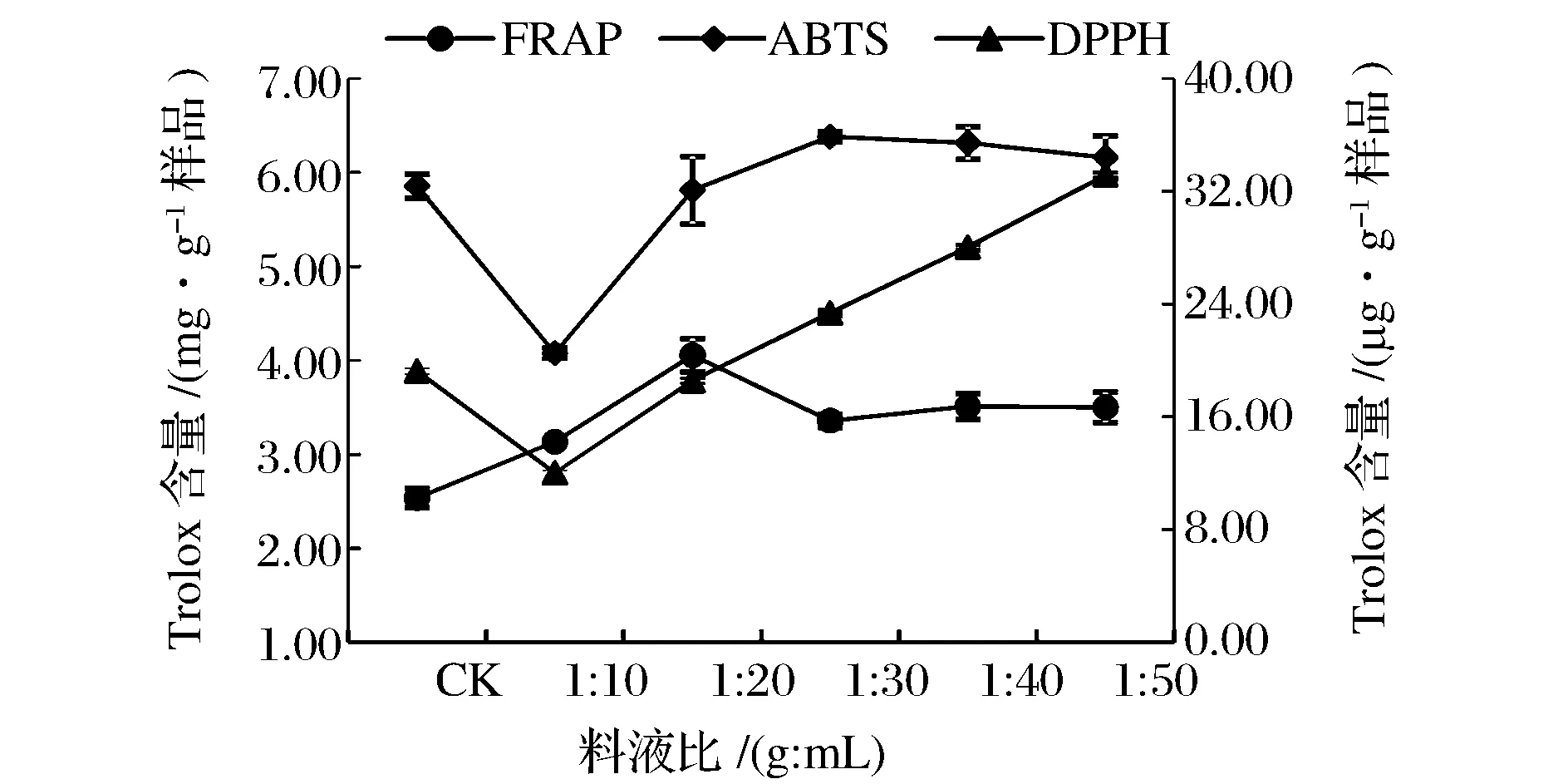
图9 料液比对提取液抗氧化性的影响Fig.9 Effect of solid-to-solvent ratio on antioxidant activities of extracts.(注:FRAP法和ABTS法在主坐标轴,DPPH法在次坐标轴)
2.4 相关性分析
2.4.1 总酚提取量与抗氧化能力之间的相关性

A:铁离子还原力;B:DPPH自由基消除能力;C:ABTS自由基消除能力图10 抗氧化活性与其总酚提取量的相关性Fig.10 Correlation between the antioxidant activities and phenolic content
从图10可知,总酚提取量与Fe3+还原能力(R2=0.541 9,P<0.01)、DPPH·清除能力(R2=0.823 9,P<0.01)、ABTS+·清除能力(R2=0.664 4,P<0.01)存在着一定的线性关系,与总酚的相关性强弱分别是:DPPH法>ABTS法>FRAP法,这与以往的研究结论是一致的[45-46]。但是,孙丹[47]等研究苦荞中总酚与DPPH·的清除能力、ABTS+·清除能力和铁离子还原能力之间具有较强的相关性(r>0.95,P<0.01)。原料以及处理条件的不同,从而影响总酚的提取效果或是抗氧化能力结果,导致相关性的差异[48]。
2.4.2 各方法测定抗氧化能力之间的相关性
从图11可知,各种方法测得的抗氧化活性之间存在着较强的线性关系,其中ABTS法与DPPH法之间存在着很强的线性相关关系,显示酚类有较强的ABTS+·清除能力和Fe3+还原能力,这与以往的研究是一致的[49]。FRAP法与ABTS法之间也存在着较强的线性关系,但FRAP法与DPPH法之间的相关性较弱,其原因值得进一步研究,这与陈冠林等[50]的研究相一致。
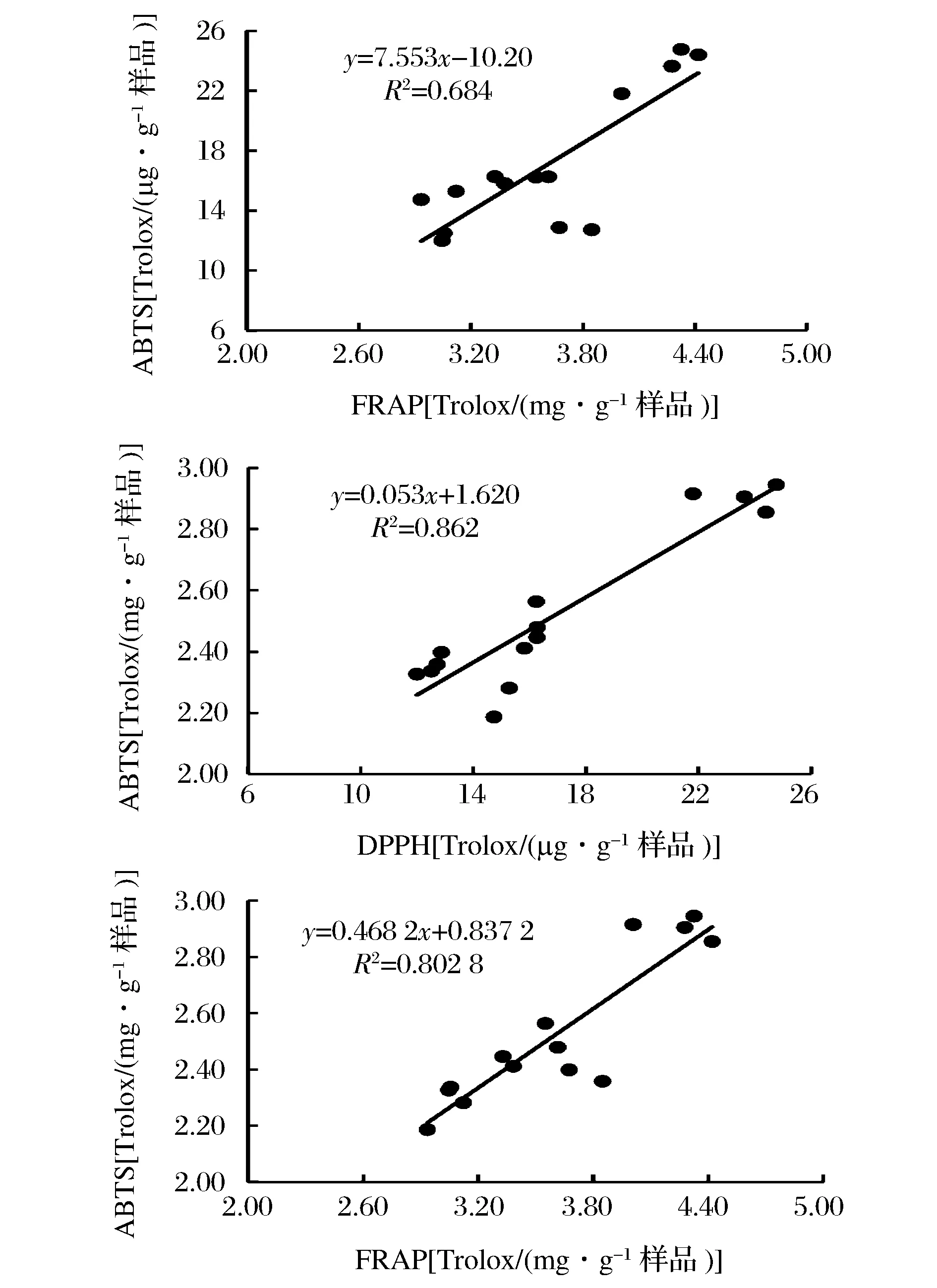
图11 FRAP、DPPH以及ABTS法测定的抗氧化能力之间的相关性Fig.11 Correlation between the antioxidant activities of FRAP, DPPH and ABTS assay
3 结论
本研究利用微波辅助提取沙田柚白囊衣中的柚皮苷,并对提取液的抗氧化性进行分析。在单因素的基础之上,应用响应面法优化了白囊衣中柚皮苷提取的工艺参数,考虑到实验的可行性以及效益等综合因素,确定最佳工艺条件为乙醇体积分数52%、微波功率587 W、料液比1∶20(g∶mL),柚皮苷提取量为15.581 6 mg/g,在此微波条件下进行3次重复实验,柚皮苷平均提取量为15.581 0 mg/g,与预测值基本吻合。各因素对响应值结果影响的主次关系依次为:乙醇体积分数=料液比>微波功率,且3因素对柚皮苷提取量的影响均到达显著水平。应用微波辅助技术能有效地缩短提取时间、提高提取率。与此同时,将单因素方法得到的粗提取液进行抗氧化研究,结果表明,微波醇提取液总酚含量显著增加,且抗氧化能力增强。说明采用微波技术提取天然产物,有利于提高天然产物的活性功能,为沙田柚及其柚类黄酮类物质的进一步开发利用提供了基础参数。
[1] 邓桂兰, 魏强华, 刘冬梅. 柚子皮的综合利用研究[J]. 食品工业, 2013,34(9):180-184.
[2] 周晖, 韩香云. 柚子皮吸附废水中重金属的研究[J]. 污染防治技术, 2013,26(2):11-15.
[3] 许鹭.柚皮中柚皮苷的提取、分离纯化及其固体分散体与卵磷脂复合物的制备及表征[D]. 广州:华南理工大学, 2015.
[4] LARSEN A K R, MOLLER M T N, Blankson H, et al. Naringin-sensitive phosphorylation of plectin, a cytoskeletal cross-linking protein, in isolated rat hepatocytes[J]. Journal of Biological Chemistry, 2002,277(38):34 826-34 835.
[5] 蔡文, 谭兴和, 张喻, 等. 超声波辅助提取柚子皮果胶的工艺优化[J]. 农产品加工(学刊), 2013,314(4):17-21.
[6] WANG Y, CHUANG Y, HSU H. The flavonoid, carotenoid and pectin content in peels of citrus cultivated in Taiwan[J]. Food Chemistry, 2008,106(1):277-284.
[7] 阳梅芳.柚子黄酮类物质提取、分离及生物特性研究[D]. 广州:华南理工大学, 2013.
[8] WU T, GUAN Y, YE J. Determination of flavonoids and ascorbic acid in grapefruit peel and juice by capillary electrophoresis with electrochemical detection[J]. Food Chemistry, 2007,100(4):1 573-1 579.
[10] KANNO S, SHOUJI A, HIRATA R, et al. Effects of naringin on cytosine arabinoside (Ara-C)-induced cytotoxicity and apoptosis in P388 cells[J]. Life Sciences, 2004,75(3):353-365.
[11] DING X.Extracts of pomelo peels prevent high-fat diet-induced metabolic disorders in c57b1/6 mice through activating the PPARα and GLUT4pathway[BE/OL].[2013-11-16].http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0077915.
[12] HONG H J,JIN J Y,YANG H,et al. Dangyuja (Citrus grandis Osbeck) peel improves lipid profiles and alleviates hypertension in rats fed a high-fat diet[J]. Laboratory Animal Research,2010,26(4):361-367.
[13] TANG D M, ZHU C F, ZHONG S A, et al. Extraction of naringin from pomelo peels as dihydrochalcone's precursor[J]. Journal of Separation Science, 2011,34(1):113-117.
[14] 吴琼英, 贾俊强. 柚皮黄酮的超声辅助提取及其抗氧化性研究[J]. 食品科学, 2009,30(2):29-33.
[15] 周石磊, 王鸿飞, 杜洁雄. 柚皮中柚皮苷乙醇提取工艺研究[J]. 农业工程学报, 2006,22(7):184-187.
[16] 贾冬英, 姚开, 谭敏, 等. 柚皮中柚皮苷的乙醇提取工艺研究[J]. 中草药, 2002,33(9):36-37.
[17] 许方驰, 潘思轶. 响应面分析琯溪蜜柚果皮中柚皮苷的醇提取工艺[J]. 食品工业科技, 2016,37(11):238-248.
[18] 游见明, 兰江涛. 柑橘类柚皮苷提取工艺研究[J]. 现代食品科技, 2006,22(2):160-161.
[19] 苏东林.柑桔皮中黄酮类物质的提取、分离及纯化研究[D]. 长沙:湖南农业大学, 2007.
[20] 刘英, 但俊峰, 吴丹, 等. 柚皮中柚皮苷的超声波辅助提取条件研究[J]. 西北农林科技大学学报(自然科学版), 2008(4):218-222.
[21] LI Y, SKOUROUMOUNIS G K, ELSEY G M, et al. Microwave-assistance provides very rapid and efficient extraction of grape seed polyphenols[J]. Food Chemistry, 2011,129(2):570-576.
[22] ZIGONEANU I G, WILLIAMS L, XU Z, et al. Determination of antioxidant components in rice bran oil extracted by microwave-assisted method[J]. Bioresource Technology, 2008,99(11):4 910-4 918.
[23] LI Y, SKOUROUMOUNIS G K, ELSEY G M, et al. Microwave-assistance provides very rapid and efficient extraction of grape seed polyphenols[J]. Food Chemistry, 2011,129(2):570-576.
[24] ZHANG H, ZHANG X, YANG X, et al. Microwave assisted extraction of flavonoids from cultivated Epimedium sagittatum: Extraction yield and mechanism, antioxidant activity and chemical composition[J]. Industrial Crops and Products, 2013,50(10):857-865.
[25] 刘学仁, 蔡品品, 姜涛, 等. 微波辅助提取枳壳中柚皮苷、新橙皮苷的工艺研究[J]. 中成药, 2013(2):420-423.
[26] 王桂花, 周峰, 赵常青, 等. 微波辅助萃取枳壳中有效成分柚皮苷的研究[J]. 时珍国医国药, 2009(11):2 712-2 713.
[27] AHMAD J, LANGRISH T A G. Optimisation of total phenolic acids extraction from mandarin peels using microwave energy: The importance of the Maillard reaction[J]. Journal of Food Engineering, 2012,109(1):162-174.
[28] LIAZID A, SCHWARZ M, VARELA R M, et al. Evaluation of various extraction techniques for obtaining bioactive extracts from pine seeds[J]. Food and Bioproducts Processing, 2010,88(2):247-252.
[29] HAYAT K, HUSSAIN S, ABBAS S, et al. Optimized microwave-assisted extraction of phenolic acids from citrus mandarin peels and evaluation of antioxidant activity in vitro[J]. Separation And Purification Technology, 2009,70(1):63-70.
[30] 白小鸣, 曾小峰, 王华, 等. 响应面法优化超声波辅助提取梁平柚果皮中柚皮苷工艺研究[J]. 西南师范大学学报(自然科学版), 2016,41(2):58-65.
[31] HE B, ZHANG L, YUE X, et al. Optimization of ultrasound-assisted extraction of phenolic compounds and anthocyanins from blueberry (Vacciniumashei) wine pomace[J]. Food Chemistry, 2016,204:70-76.
[32] 张文娟.柑橘幼果功能成分提取分析及抗氧化活性研究[D]. 杭州:浙江大学, 2015.
[33] SONG F, GAN R, ZHANG Y, et al. Total Phenolic Contents and Antioxidant Capacities of Selected Chinese Medicinal Plants[J]. International Journal of Molecular Sciences, 2010,11(6):2 362-2 372.
[34] ALMEIDA M M B, DE SOUSA P H M, ARRIAGAM C, et al. Bioactive compounds and antioxidant activity of fresh exotic fruits from northeastern Brazil[J]. Food Research International, 2011,44(7):2 155-2 159.
[35] 蒋志国, 李斌, 王燕华, 等. 菠萝蜜果皮多酚超声微波协同提取工艺优化及抗氧化活性研究[J]. 食品工业科技, 2016,37(2):270-275.
[36] XIAO W, HAN L, SHI B. Microwave-assisted extraction of flavonoids from Radix Astragali[J]. Separation & Purification Technology, 2008,62(3):614-618.
[37] HEMWIMON S, PAVASANT P, SHOTIPRUK A. Microwave-assisted extraction of antioxidative anthraquinones from roots of Morinda citrifolia[J]. Separation and Purification Technology, 2007,54(1):44-50.
[38] 杨秋明,李靖雅,肖安风,等.柚皮中柚皮苷和类柠檬苦素的提取及分离纯化[J]. 集美大学学报(自然版),2015,20(6):414-420.
[39] 项昭保, 刘星宇. 响应面法优化超声-微波协同辅助提取橄榄多酚工艺研究[J]. 食品工业科技, 2016,37(1):195-200.
[40] 马亚琴, 吴厚玖, 周志钦, 等. 微波辅助提取柑橘鲜皮渣中果胶的工艺优化[J]. 食品科学, 2012,33(24):31-35.
[41] FRANCO-VEGA A, RAMREZ-CORONA N, PALOU E, et al. Estimation of mass transfer coefficients of the extraction process of essential oil from orange peel using microwave assisted extraction[J]. Journal of Food Engineering, 2016,170:136-143.
[42] 郑玲利, 李燕, 黄玲, 等. 枸杞多糖的微波提取及抗氧化性分析[J]. 解放军药学学报, 2016,32(1):1-4.
[43] 焦士蓉, 郑贵菊. 柚皮黄酮类物质的微波辅助提取及其抗氧化活性研究[J]. 食品与机械, 2007,23(1):73-75.
[44] 朱攀攀, 马亚琴, 窦华亭, 等. 超声处理条件对血橙皮渣中黄酮类物质的影响[J]. 食品与发酵工业, 2015,42(1):126-130.
[45] WAONG C, LI H, CHENG K, et al. A systematic survey of antioxidant activity of 30 Chinese medicinal plants using the ferric reducing antioxidant power assay[J]. Food Chemistry, 2006,97(4):705-711.
[46] ERSUS S, CAM M. Determination of organic acids, total phenolic content, and antioxidant capacity of sour Citrus aurantium fruits[J]. Chemistry of Natural Compounds, 2007,43(5):607-609.
[47] 孙丹, 黄士淇, 蔡圣宝. 不同加工方式对苦荞中总酚、总黄酮及抗氧化性的影响[J]. 食品与发酵工业, 2016,42(1):141-147.
[48] 徐颖, 樊明涛, 冉军舰, 等. 不同品种苹果籽总酚含量与抗氧化相关性研究[J]. 食品科学, 2015,36(1):79-83.
[49] SONG F, GAN R, ZHANG Y, et al. Total phenolic contents and antioxidant capacities of selected chinese medicinal plants[J]. International Journal of Molecular Sciences, 2010,11(6):2 362-2 372.
[50] 陈冠林, 陈松根, 赵颖莹, 等. 33种水果的总酚含量及其抗氧化能力研究[J]. 食品工业, 2014,35(9):264-268.
Effect of microwave-assisted extraction on the yield of naringin and antioxidant activities of extracts from Shatian pomelo white layer
LI Nan-nan, MA Ya-qin*, LI Shen, ZHANG Zhen
(Citrus Research Institute,Southwest University,Chongqing 400712,China)
Microwave-assisted extraction of naringin from Shatian pomelo white layer using was optimized by response surface methodology(RSM. The antioxidant activity of extracts were analyzed in vitro. On the basis of the single-factor experiment results, use extracting volume ratio, microwave power and solid-to-solvent ratio as the indexes, based on central composite experimental design of the Box-Behnken, a second order quadratic equation for extraction of naringin was established. The optimal extraction conditions for naringiin from Shatian pomelo white layer were: extraction solvent 52% aqueous ethanol; microwave power 587 W; solid-liquid ratio 1∶20 (g∶mL). Furthermore, the result indicated that appropriate microwave treatment can significantly influence antioxidant activities of extracts according to the results from DPPH, FRAP and ABTS.
Shatian pomelo white layer; naringin; microwave extraction; antioxidant activities
10.13995/j.cnki.11-1802/ts.201703046
硕士研究生(马亚琴副研究员为通讯作者,E-mail:myaya211@163.com)。
国家现代农业柑橘产业技术体系(CARS-27-05B);中央高校基本科研业务费专项(XDJK2015B004)
2016-07-22,改回日期:2016-09-07
