香菇生物碱类物质的毛细管电泳指纹图谱
2017-04-26何晋浙毛燚杰冯婷婷孙培龙
何晋浙,毛燚杰,冯婷婷,孙培龙
(浙江工业大学 海洋学院,浙江 杭州,310014)
香菇生物碱类物质的毛细管电泳指纹图谱
何晋浙,毛燚杰,冯婷婷,孙培龙*
(浙江工业大学 海洋学院,浙江 杭州,310014)
采用快速溶剂法醇提香菇中生物碱类物质,进行毛细管电泳色谱分析。毛细管电泳优化条件:背景电解质溶液:25 mmol/L硼砂-10 mmol/L β-环糊精,pH:9.5,运行电压:20 kV,进样条件:20 psi,5 s,温度:25 ℃,检测波长:214 nm。毛细管电泳色谱方法学考察,其精密度、稳定性和重复性均符合指纹图谱要求,分别建立了福建、湖北、吉林、云南等地的香菇生物碱类成分的毛细管电泳指纹图谱,确定14个共有峰,通过相似度评价系统对10批香菇进行评价,多数香菇样品的相似度在0.8以上,可用于香菇的质量控制。
香菇;生物碱类物质;毛细管电泳;指纹图谱
香菇具有抗病毒、抗肿瘤、增强免疫力、降血脂、抗血栓、保肝等功效[1-3]。其中,生物碱类物质是香菇中重要的药效成分。生物碱结构复杂、种类繁多,而指纹图谱具有整体性特点,能有效鉴别中药、食品的类别、真假和产地,并对不同产地、时期的药材质量稳定性和均一性做出准确评价。高效毛细管电泳因其低消耗、无污染、柱效高、样品处理简单而日益受到重视[4]。本研究运用高效毛细管电泳法对食用菌进行指纹图谱的研究,并运用国家药典委推荐的《中药色谱指纹图谱相似度评价(2004A)》软件,对香菇中的生物碱类物质进行了指纹图谱测定和相似度计算。
1 材料与方法
1.1 材料与设备
1.1.1 仪器与设备
DJ-04型中药粉碎机,上海淀久仪器公司;APLE-3000加速溶剂萃取仪,北京吉天仪器有限公司;AL-104电子天平,METTLER TOLEDO有限公司;SHB-Ⅲ-A 型循环水真空泵,杭州大卫科教仪器公司;RE-2000A旋转蒸发仪,上海亚荣生化仪器厂;Milli Q超纯水系统,美国密理博公司;未涂层石英毛细管柱(55 cm × 50 μm(i.d.)),河北永年光纤厂;QT-2旋涡振荡混合器,上海琪特仪器公司;K3200LH超声波清洗器,上海科导超声仪器公司;CR21G Ⅱ型高速冷冻离心机,日本日立仪器公司;PHS-3C型数显酸度计,杭州科晓化工仪器设备有限公司;UV-7504紫外可见分光光度计,上海欣茂仪器有限公司;P/ACETMMDQ型高效毛细管电泳仪,美国Beckman公司。
1.1.2 样品与试剂
S1为益生菌发酵生料栽培香菇,批号为241#,由浙江省庆元县食用菌研究所提供,其他9批香菇购自各产地,分别产于福建古田大花菇(S2)、福建古田香菇(S3)、福建古田小花菇(S4)、湖北花菇(S5)、湖北金钱菇(S6)、湖北香菇(S7)、吉林大花菇(S8)、吉林香菇(S9)、云南丽江野生香菇(S10)。
体积分数为95%酒精,食品级;无水乙醇、甲醇、NaH2PO4、Na2HPO4、氨基丁三醇、柠檬酸、H3BO3、硼砂、β-环糊精均为分析纯,实验用水均为超纯水。
1.2 实验方法
1.2.1 电泳条件
运行缓冲液:25 mmol/L硼砂-10 mmol/L β-环糊精(pH 9.50);检测波长:214 nm;分离电压:20 kV;进样条件:20 psi,5 s;毛细管温度:25 ℃[5]。毛细管使用前依次用0.1 mol/L氢氧化钠溶液、超纯水和运行缓冲液分别冲洗3、7、8 min,上述试剂使用前均经0.45 μm滤膜过滤,并超声脱气。每日实验结束后依次用0.1 mol/L氢氧化钠溶液、超纯水冲洗毛细管各10 min[6]。
1.2.2 供试样品制备
香菇样品经烘干、粉碎、过筛后,采用快速溶剂萃取法制备供试样品[7]。准确称取4 g香菇粉末,置于萃取池中,萃取池底部提前加入过滤膜,样品与硅藻土粉末混合均匀,填满萃取池,将萃取池放在萃取池固定装置上。以体积分数为80%的乙醇为提取溶剂,设定提取参数:静态萃取时间15 min、提取温度140 ℃、循环2次、吹洗体积80%,启动加速溶剂萃取仪,提取完成后自动停止,将提取液离心过滤,定容,用0.45 μm滤膜过滤,得供试品溶液。
2 结果与分析
2.1 电泳条件优化
2.1.1 背景电解质的选择
分别试验了50 mmol/L NaH2PO4、25 mmol/L Tris-cit、25 mmol/L Tris-10 mmol/L H3BO3、30 mmol/L硼砂、25 mmol/L PBS、25 mmol/L BBS、50 mmol/L NaH2PO4-25 mmol/L硼砂、25 mmol/L硼砂-10 mmol/L β-环糊精等多种缓冲溶液体系。将指纹图谱积分信号导入“中药色谱指纹图谱超信息特征数字化评价系统”软件[8],计算在各背景电解质条件下的分离结果,用分离量指数(RF)表示,如表1所示。RF反映了指纹信号强度、峰间等距性、分布均化性和分离效率等指标,RF值越大分离效果越好[9]。结合相应的指纹图谱,可知前7种缓冲溶液体系基线漂移较大,离子强度大,电导高,基电压较高,噪声较大,而最后一种即硼砂-β-环糊精缓冲液离子强度小、背景电导低、分析灵敏度高、分离效果最好、电泳电流小,因此选择了此缓冲液。缓冲液用量过大会产生焦耳热,导致峰形变差,配制的25 mmol/L硼砂-10 mmol/L β-环糊精缓冲液效果较其他浓度的好[10]。

表1 不同背景电解质下的毛细管电泳指纹图谱分离量指数
2.1.2 缓冲溶液pH 的选择
缓冲液的pH影响毛细管表面的电势,从而影响电渗流的方向和速度[5]。考察缓冲液的pH为7.5、8.0、8.5、9.0、9.5、10.0和10.5时对电泳分离效果的影响,结果如表2所示,发现pH过低,峰的分离度不高,但随着pH的增大,各组分的分离度增加,迁移时间延长。综合分离效率考虑,确定缓冲液pH为9.5。
2.1.3 运行电压的选择
运行电压主要影响毛细管电泳的分离效率和分离度,升高电压虽然能够缩短整个分析时间,但超过某一特定程度时,缓冲溶液的焦耳热难以散发,导致其黏度有所降低,增加了迁移率,从而分离度下降[5]。实验结果如表2所示,结合毛细管电泳指纹图谱可知,低电压时分离度增大且基线稳定,但用时过长;而当电压增加后,分析时间有一定的缩短,但是其分离效果十分不理想且基线漂移严重。本文将分离电压进行梯度调试(12、15、18、20、22、25、30 kV),最终确定其运行电压为20 kV。
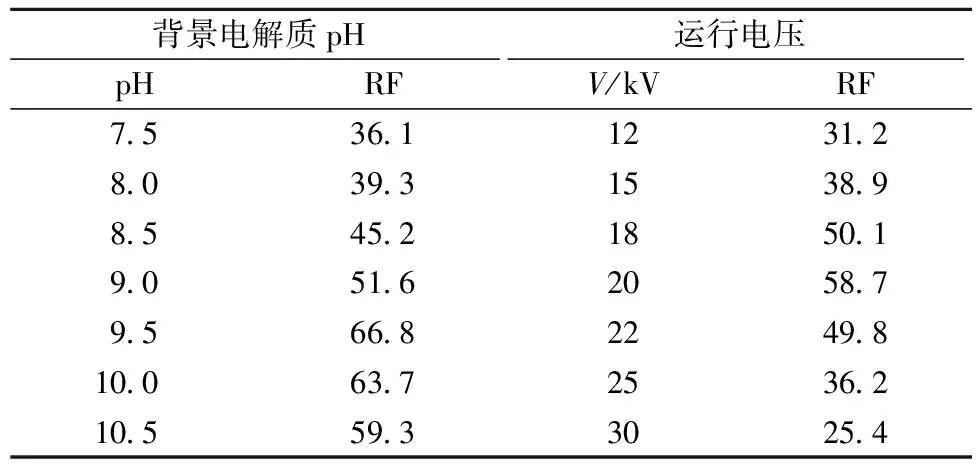
表2 缓冲溶液的不同pH、不同运行电压下的毛细管电泳指纹图谱分离量指数
2.1.4 检测波长的选择
在190~400 nm波长范围内对供试样品溶液进行紫外扫描,扫描结果在214、230、270 nm处有出峰,比较这3个波长下的出峰情况,如表3所示,结果发现在214 nm下峰的分离效果最好,当检测波长大于214 nm时,出峰变少且峰形变钝,故选择214 nm为检测波长。
2.1.5 进样条件的选择
随着样品进样量的增加,仪器浓度响应值也会相应提高,但是过大的进样量,超过了毛细管的负荷,出现了峰展宽和分离度降低等现象[11]。本文以压力20 psi进样,以进样持续时间(5、10、15、20 s)考察进样量对分离效果的影响,结果如表3所示,最终确定进样时间为5 s。

表3 不同检测波长、进样时间下香菇生物碱类成分的的RF值
2.2 高效毛细管电泳的方法学考察
2.2.1 稳定性试验
取S1的供试品溶液,按“1.2.1”电泳条件,样品在室温下分别放置0、1、2、4、6 h后进行测定并记录所有电泳图,如图1所示。以8号峰的峰面积和迁移时间为参照,计算出共有峰的相对迁移时间的RSD<1.5%,相对峰面积的RSD<2.8%,表明供试品溶液在6 h内基本稳定。

图1 稳定性试验Fig.1 Stability tests
2.2.2 精密度试验
取S10的供试品溶液,按“1.2.1”电泳条件,重复进样5次,记录电泳图,如图2所示。以8号峰的峰面积和迁移时间作为参照,计算得到共有峰相对迁移时间的RSD<3.7%,相对峰面积的RSD<4.7%,表明检测系统的进样精密度合格。

图2 精密度试验Fig.2 Precision tests
2.2.3 重复性试验
取S10号供试品溶液,按“1.2.1”电泳条件,制备5份供试品溶液作为平行,进样检测,记录电泳图,如图3所示。以8号峰的峰面积和迁移时间作为参照,计算得出共有峰相对迁移时间的RSD<3.3%,相对峰面积的RSD<4.6%,表明方法重复性良好。
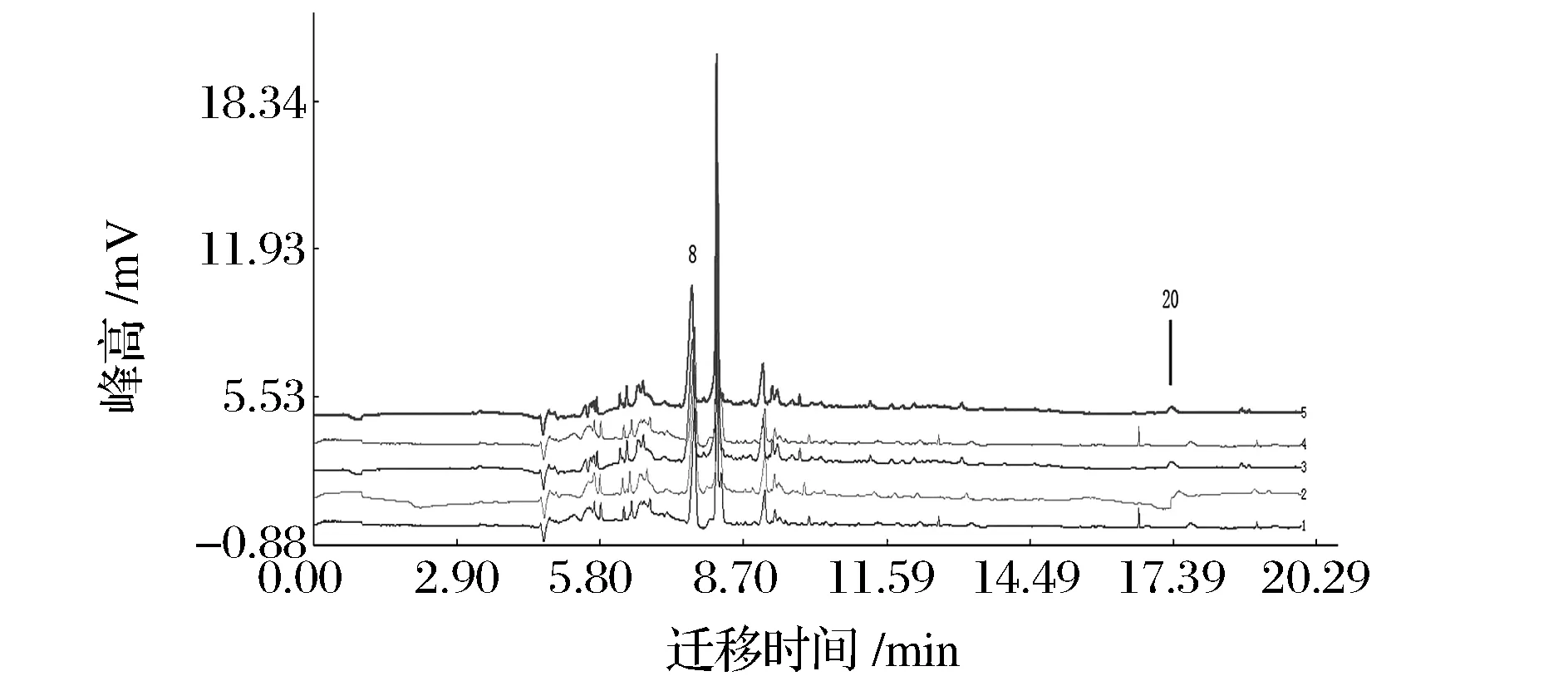
图3 重复性试验Fig.3 Repeatability tests
2.3 样品测定及毛细管电泳指纹图谱建立
取10批香菇供试品,按“1.2.1”电泳条件进行测定,记录色谱图,通过《中药色谱指纹图谱相似度评价系统软件(2004A版)》软件分析,得到香菇指纹图谱中14个色谱峰为共有峰,香菇指纹图谱共有模式及10批香菇的毛细管电泳指纹图谱,如图4、图5所示。

图4 香菇生物碱类成分的毛细管电泳图谱Fig.4 Fingerprint of the alkaloids from lentinus edodes

图5 10批香菇的毛细管电泳指纹图谱Fig.5 Fingerprint of 10 batches of lentinus edodes
2.4 共有指纹峰的相对保留时间及相对峰面积
在供试品色谱中,以8号峰为参照峰,将其他特征峰的保留时间及峰面积与之相比,得到各峰的相对保留时间和相对峰面积,结果如表4、表5所示。比较各个样品共有指纹峰的相对保留时间和相对峰面积,结果表明共有指纹峰的相对保留时间和相对峰面积比值变化范围不大,稳定性强,可作为其指纹信息特征[12]。

表4 十批香菇总生物碱指纹图谱的相对保留时间

表5 十批香菇总生物碱指纹图谱的相对峰面积
2.5 相似度评价
采用《中药色谱指纹图谱相似度评价系统软件(2004A版)》对10批香菇进行相似度评价,以香菇241#作为对照图谱,计算各色谱图的整体相似度,结果如表6所示。10批香菇中有8批香菇毛细管电泳指纹图谱的相似度大于0.8,相似度较高,但由于香菇成分含量及其比例的变化受种植环境、种植时间等诸多因素的影响,各香菇品种间存在差异,如S4的相似度只有0.702,S9的相似度只有0.720。每个不同品种和产地的香菇除了14个共有峰之外还具有自己的特征峰,如图2和图3中云南野生香菇S10毛细管电泳图谱上的20号峰。由共有特征峰来看,可以判断食用菌香菇类质量是稳定的,具有良好的相似度,可以建立香菇指纹图谱,对香菇的质量控制具有指导意义,通过指纹图谱的数据库建立可对不同产地的香菇品种、来源进行质控评价,为香菇的开发利用提供了技术支撑,并以此作为食用菌指纹特征峰的获取方法,为下一步的中药谱效学的研究提供食用菌量化的指纹特征数据[13]。
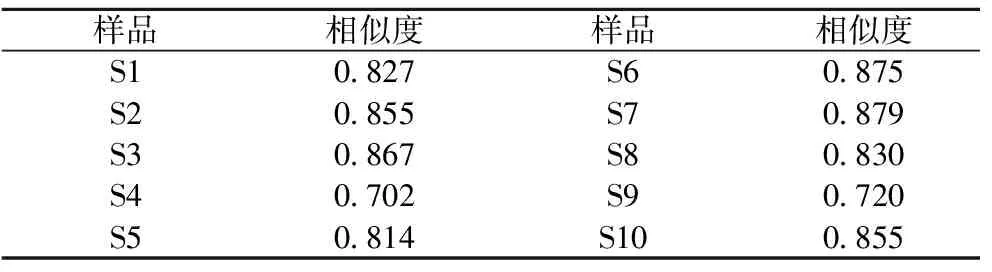
表6 十批香菇生物碱类成分相似度计算结果
3 结论
采用快速溶剂法醇提香菇中生物碱类物质,进行毛细管电泳色谱分析。毛细管电泳优化条件:背景电解质溶液:25 mmol/L硼砂-10 mmol/L β-环糊精,pH:9.5,运行电压:20 kV,进样条件:20 psi,5 s,温度:25 ℃,检测波长:214 nm。毛细管电泳色谱方法学考察,其精密度、稳定性和重复性均符合指纹图谱要求,分别建立了福建、湖北、吉林、云南等地的香菇生物碱类成分的毛细管电泳指纹图谱,确定14个共有峰,通过《中药色谱指纹图谱相似度评价系统软件(2004A版)》对10批香菇进行评价,多数香菇样品的相似度在0.8以上,表明各产地和品种之间具有较好的相关性。但同时存在差异,如14个共有峰的高低、大小都有所不同,也就是生物碱含量有差别,除共有峰之外,不同产地的香菇还具有各自的特征峰或杂峰。因为相似度差异越大,其成分差别越大,所以指纹图谱就为香菇生物碱的质量控制提供了研究依据。
[1] 梁巧玲.香菇食用与药用价值[J].保鲜与加工, 2006, 6(5):47.
[2] 薛艳蓉,梁茂文,王呈,等.香菇的价值及系列食品的生产工艺[J].甘肃农业科技,2011(10):19.
[3] 戴尔珣,汪步海,戴金梁,等.香菇多糖诱导CIK细胞对肺癌A549细胞杀伤作用的研究[J].江苏中医药,2016,48(6):71-74.
[4] 许靖,王成芳,杜树山,等.金钱白花蛇商品药材的高效毛细管电泳指纹图谱研究[J].中成药,2014,36(3):563-566.
[5] 谷巍,巢建国,刘训红,等.安徽道地药材牡丹皮高效毛细管电泳指纹图谱研究[J].中国实验方剂学杂志,2011,17(17):58-61.
[6] 车磊,孙国群,李闫飞.桂附地黄丸的毛细管电泳指纹图谱研究[J].中南药学,2011,9(6):460-463.
[7] RICHTER B E,JONES B A,EZZELL J L,et al.Accelerated solvent extraction: a technique for sample preparation[J].Analytical Chemistry,ACS Publications,1996,68(6):1 033-1 039.
[8] 孙国祥,刘晓玲,邓湘昱,等.色谱指纹图谱指数F和相对指数Fr的研究[J].药学学报,2004,39(11):921-924.
[9] 孙国祥,殷瑞娟.柏子养心丸的毛细管电泳指纹图谱[J].色谱,2012,30(5):495-500.
[10] 姜新刚,孟作环,贾继明.广西菲牛蛭药材的高效毛细管电泳指纹图谱研究[J].中国中药杂志,2012,37(4):495-499.
[11] 翁蓓,陶遵威.毛细管电泳技术在中药方面的研究进展[J].天津药学,2015,27(1):61-63.
[12] SHEN D,WU Q,SCIARAPPA W J,et al.Chromatographic fingerprints and quantitative analysis of isoflavones in Tofu-type soybeans[J].Food Chemistry,Elsevier,2012,130(4):1 003-1 009.
[13] BERTRAND B,BOULANGER R,DUSSERT S,et al.Climatic factors directly impact the volatile organic compound fingerprint in green Arabica coffee bean as well as coffee beverage quality[J].Food Chemistry,Elsevier,2012,135(4):2 575-2 583.
Study on capillary electrophoresis fingerprints of alkaloids from lentinus edodes
HE Jin-zhe,MAO Yi-jie,FENG Ting-ting,SUN Pei-long*
(College of Ocean, Zhejiang University of Technology, Hangzhou 310014, China)
Accelerated solvent extraction was used in extracting alkaloids from lentinus edodes and its analysis was performed by capillary electrophoresis. The optimized conditions of capillary electrophoresis were: background electrolyte 25 mmol/L borax-10 mmol/L β-cyclodextrin; pH 9.5; the running voltage 20 kV; the sample size 20 psi×5 s; the column temperature 25 ℃ and the detection wavelength 214 nm. Capillary electrophoresis methodology analysis showed that the method is precision, stable and reproductive. They were meet with the requirements of fingerprints. The capillary electrophoresis fingerprints of the alkaloids of letinous edodes in different regions were established. We found out 14 common peaks from the fingerprints, and evaluated the similarity of 10 batches of lentinus edodes through professional similarity evaluation system. The results showed that similarity of majority of those lentinus edodes were above 0.8 which indicate that the method can be served as a novel reference to identify and control the quality of lentinus edodes.
lentinus edodes; alkaloids; capillary electrophoresis; fingerprint
10.13995/j.cnki.11-1802/ts.201703037
学士,副教授(孙培龙教授为通讯作者,E-mail:sun_pl@zjut.edu.cn)。
浙江省科技创新团队建设项目(2009R50029)
2016-07-11,改回日期:2016-08-25
