细胞色素P450蛋白在不对称环丙烷化反应中的研究进展
2017-04-25魏尔曼马宏敏瞿旭东邓子新
魏尔曼,马宏敏,瞿旭东,邓子新
(武汉大学药学院,湖北武汉430071)
细胞色素P450蛋白在不对称环丙烷化反应中的研究进展
魏尔曼,马宏敏,瞿旭东,邓子新
(武汉大学药学院,湖北武汉430071)
在过去几十年间,运用手性金属催化剂进行不对称环丙烷化反应,一直是有机化学领域的研究热点,并且取得了令人瞩目的成就。合成生物学方法因其具有环境可持续性以及良好的能量效率等优点,逐渐成为一种新的研究趋势。为了弥补天然酶催化的局限性,将生物体内部的酶反应与工业界的合成反应之间形成无缝对接是当务之急。与传统化学手段相比,利用细胞色素P450催化合成不对称环丙烷具有显著的优势。本文中,笔者综述了近年来细胞色素P450在不对称环丙烷反应的研究状况。
细胞色素P450;不对称环丙烷;生物催化;生物制造
近年来,运用微生物工程来生产生物燃料以及化学品的报道越来越多,甚至使得人们认为将来可以通过微生物工程菌株来生产几乎所有的有机化合物[1]。由于具有环境可持续性以及良好的能量效率,合成生物学方法的研究逐渐受到重视。但是很不幸,很多目标产物并不能通过已知酶所能催化反应的有限组合得到。由于代谢工程成功与否主要取决于将酶合适地装配进生物合成途径中,而天然酶只能催化仅仅一部分在工业上所用到的化学反应,使得上述目标的实现受到限制。因此,有必要将生命体内部的酶反应与工业界的合成反应做一个无缝对接。例如,最近报道了能催化C—H键活化的铑配位的酶[2]以及计算机辅助设计的能催化Kemp消除[3]和Diels-Alder反应的酶[4]。因此,生物制造过程最终取决于人们能否创造性地设计出有效催化已知或新型化学反应的新催化剂。
细胞色素P450单加氧酶是一种能与CO结合的蛋白,广泛分布于各种动物、植物、真菌和细菌中。作为一种末端加氧酶,细胞色素P450参与了生物体内的甾醇类激素合成以及包括药物、环境化合物在内的外源性物质的代谢等过程。许多天然产物的生物合成途径涉及P450介导的氧化,从而对疏水骨架进行官能团化,例如萜烯、生物碱和聚酮的生物合成。除了上述反应,天然或改造的P450被开发后被用于催化出更多的反应类型。由此,细胞色素P450酶已成为能催化最多反应类型的生物催化剂,例如:芳基、芳基偶联反应、开环反应、缩环反应、醚和硫醚以及胺的脱烷基化反应、脱羧反应、氧化环化反应,醛醇氧化反应、去饱和化反应、硫醚氧化反应、氮氧化反应、环氧化反应、C—C键断裂反应和硝基化反应等[5-6]。
手性环丙烷结构作为特殊的刚性结构,存在于萜类、信息素和非天然氨基酸等生理化合物以及西司他汀、除虫菊酯等药物中,发挥着杀虫、除草、抗真菌、抗细菌、抗病毒和抗肿瘤等重要生理活性[7]。在过去几十年间,运用手性金属催化剂进行不对称环丙烷化反应,一直是有机化学领域的研究热点问题,取得了令人瞩目的成就[8]。该反应实现卡宾中间体对烯烃的转移反应,可以通过单步构建多达3个手性中心。然而,在生物体内,手性环丙烷是通过S⁃腺苷基蛋氨酸(S⁃adenosyl⁃methionine,SAM)对烯烃的加成或者二甲基烯丙焦磷酸的环化反应而生成的[7]。近年来,人们通过改造细胞色素P450实现了酶催化的金属卡宾对烯烃的环丙烷化反应。考虑到合成生物学将来需要不断地设计催化新反应的酶以及P450催化反应的宽泛性,本文对P450催化反应进展进行综述,以期给相关的研究者提供帮助。
1 催化环丙烷化反应
过渡金属催化的卡宾、氮宾和氧的转移反应是C=C双键以及C—H单键进行官能团化的重要方法,例如铜、钌、铑和金等过渡金属的配位复合物催化的不对称环丙烷化一直是金属有机化学的研究热点[8]。在自然界,生物体内已进化出多种多样的环氧化方法,例如细胞色素P450所催化的单氧化反应。自然界中,并没有进化出酶催化碳卡宾等电子体对烯烃的加成反应这种化学合成中常用的C—C键形成反应。有报道称,铁卟啉可以催化该反应[9],金属卟啉催化的环丙烷化反应被认为是形成金属卡宾中间体对烯烃进行加成(图1(a));而P450酶通过形成4价铁氧活性物种而对烯烃进行加成生成环氧化产物(图1(b))。

图1 铁卟啉介导的金属有机不对称环丙烷化反应(a),细胞色素P450单氧化酶介导的酶催化环氧化反应(b)和细胞色素P450单氧化酶介导的酶催化环丙烷化反应(c)
2 P450催化氧化反应的反应机制
细胞色素P450酶系的催化反应是一种循环作用机制[9](图2)。细胞色素P450酶中铁卟啉是+3价氧化态,当底物与酶结合后,Fe3+由NADPH-细胞色素P450还原酶的电子供体上得到1个电子,从而被还原成Fe2+;Fe2+与分子氧结合后,被另1个电子和1个质子进行加成,脱去1分子H2O后,生成4价铁氧正离子活性物种(图1(c));该活性物种对底物进行自由基的加成,得到羟化产物;产物释放后,游离的P450酶又重复循环。细胞色素P450催化的反应大多数与4价铁氧活性物种有关。在细胞色素P450酶中,存在1个保守的苏氨酸活性残基(如P450BM3中的T268),通过结合水分子对铁氧物种进行质子化,从而起到重要的催化作用。P450酶另外1个保守残基是轴向半胱氨酸残基(如P450BM3中的C400),起到配位铁离子的作用。

图2 细胞色素P450催化氧化反应的反应机制Fig.2 Mechanism of cytochrome P450 catalytic oxidation reaction
3 P450BM3催化环丙烷化
既然铁卟啉可以生成铁-卡宾中间体,可以对烯烃进行加成产生环丙烷化产物,Coelho等[10]尝试天然铁卟啉-血红素的催化性能,发现溶于水中的血红素以及几种血红蛋白,包括P450BM3,可以以较低的产率催化该反应,如图3所示。大多数血红蛋白环丙烷化一般是反式(trans)选择性的,但是几乎没有检测到立体选择性。P450BM3活性比较低,但呈现出可检测到的立体选择性。对它进行突变,特别是对高度保守残基如T268的突变,极大地提高了产率、非对映体过量值(d.e.值)和对映体过量值(e.e.值)。在天然的P450中,该位点保守的活性苏氨酸残基起到质子传递的作用;而在如同环丙烷化反应这样的非天然化学反应中,立体选择性发生很大改变,例如将T268突变为体积较小的丙氨酸缓解了反应的立体排阻作用。将P450BM3及其突变株催化环丙烷化反应的结果总结于表1中。由表1可知:对1株转化率、d.e.值及e.e.值比野生型稍有改善的9-10A-TS-F87V(P450BM3突变株)进行T268A的突变,相比对野生型进行的T268A突变而言,转化率下降了一半,但是其非对映选择性发生了反转,并且e.e.值很不错。由于上述突变株为CIS选择性,因此被称为BM3-CIS。对5个活性位点进行单点饱和突变发现,A328G、T438A、T438S与T438P提高了酶的顺式(cis)产物的e.e.值。A328G反转了酶的非对映选择性,而T438S提高了cis构型的非对映选择性,使得T438S具有最好的非对映及对映选择性(顺反两者比例为92∶ 8,e.e.为-97%),同时其产率也提高了50%[10]。
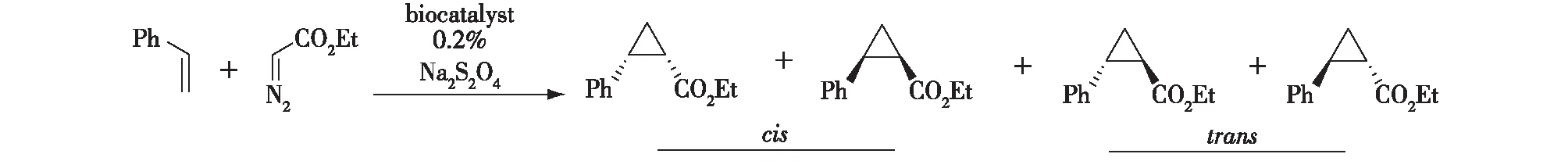
图3 细胞色素P450BM3及其突变株催化的CIS选择性环丙烷化反应Fig.3 Asymmetric cyclopropane by P450BM3 and its mutants
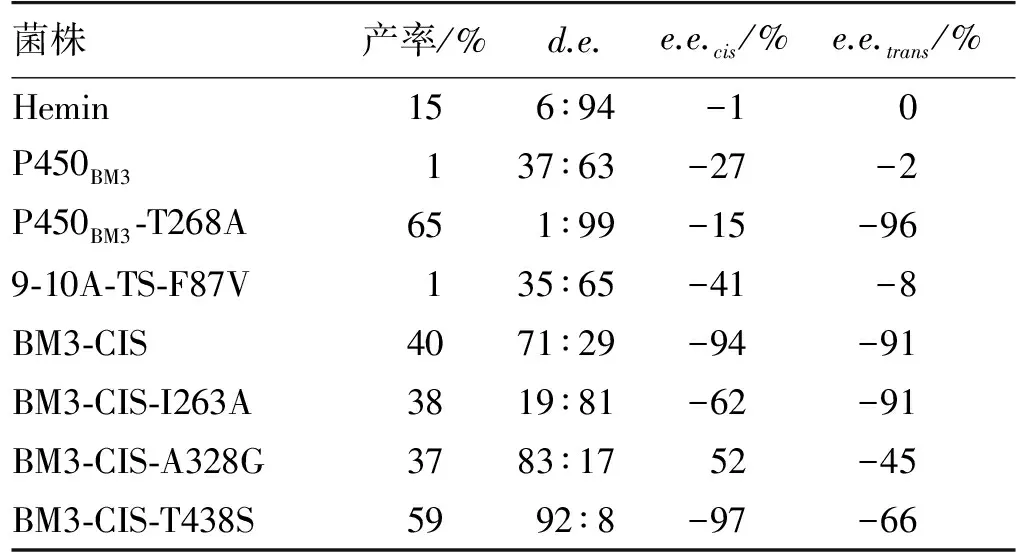
表1 细胞色素P450BM3及其突变株介导的CIS选择性环丙烷化反应结果
与细胞色素P450BM3催化单氧化或环氧化时铁为+3氧化态不同,它催化环丙烷化时铁为+2还原态。为了保持该价态,环丙烷化反应时需要亚化学计量的还原剂并且在无氧条件下进行。
完整的细胞色素P450BM3,包含催化血红素结构域P450BM3-heme以及NADPH依赖的P450还原酶结构域。无论是P450BM3,还是P450BM3-heme,相对于天然的NADPH(EO′=-320 mV),都明显偏好于如连二亚硫酸盐(EO′=-660 mV)这样的强还原试剂。由于作为细胞工厂的活细胞体内的还原剂只能是NADPH,因此有必要对酶进行改造。由于血红素铁的还原潜力与轴向配体有关,如果将P450BM3中轴向半胱氨酸上的硫替换为弱给电子能力的氧,很可能将提高FeIII/II还原潜力,使得酶易被NADPH还原驱动。另外,轴向半胱氨酸环氧化过程中起到活化氧分子以及稳定活性铁氧正离子自由基的作用,哺乳动物P450中,轴向半胱氨酸取代为丝氨酸,丧失环氧化能力[11]。将P450BM3-hemeCIS进行C400S突变后,配位CO后在411 nm处有一个特征吸收峰,因此该突变株被称为P411BM3-heme。相比野生型P450BM3-heme而言,C400S突变的还原电势提高了127 mV,而P450BM3-hemeCIS中13个氨基酸的突变使得还原电势提高了60 mV。而C400S使得P450BM3-hemeCIS的还原电势额外增加了95 mV。这两个C400S突变株的静止态还原电势要高于NAD(P)+变成NAD(P)H的还原电势,使得在没有底物存在的条件下,全长的P411仍可被NAD(P)H还原。P411BM3-CIS的表达量为干质量的2%,而P450BM3-CIS的表达量是6%;但是含P411BM3-CIS的重组表达体催化反应的反应转化数(TTN)为3 700,差不多是P450BM3-CIS的4倍。C400S的单点突变使得P411BM3的环丙烷化活性比野生型提高了两个数量级。在170 mmol/L重氮乙酸乙酯、400 mmol/L的苯乙烯存在下,8.4 g/L的含P411BM3-CIS的重组大肠杆菌可以以72%的得率得到环丙烷化产物,具有较好的非对映选择性(cis:trans为90∶ 10)以及良好的对映选择性[12](e.e.cis为99%),见图4。

图4 P411BM3-CIS催化的CIS选择性环丙烷化反应的克级制备Fig.4 Asymmetric cyclopropane by P411BM3-CIS with gram scale
既然C400S突变会使得细胞色素P450酶的环丙烷化活性增加,因此,Wang等[13]在利于环丙烷化反应的突变株T268A的基础上再次尝试将该位置突变为组氨酸、甲硫氨酸、酪氨酸及丙氨酸,将这些菌株催化环丙烷化反应结果总结于表2。由表2可知:将其突变为组氨酸的突变株,T268A-axH的转化率最高,在45 min时达到61.1%,而T268A转化率仅为1.4%;突变为丝氨酸的突变株,T268A-axS的转化率也只有12.3%。为了证明该突变的有效性,他们尝试用T268A-axH作为催化剂来介导重氮乙酸乙酯对N,N-二乙基-2-苯基-丙烯酰胺的环丙烷化来生产米那普仑中间体。在10 mmol/L的底物浓度下,T268A-axH以81%的得率、6∶ 94的非对映选择性以及42%的e.e.值得到目的产物。为了改善其立体选择性,对影响环丙烷化或环氧化选择性的4个氨基酸残基,F87、I263、L437与T438进行了点饱和突变。前两个位点的突变并没有得到立体选择性改善的突变株,然而后两个位点都是突变为色氨酸,立体选择性提高到68%~69%。但是两者组合所得突变株的产率和e.e.值都有较大的下降。以e.e.值较高的T268A-axH-L437W为母本,对V78与L181这两个位置进行第二轮的点饱和突变,结果显示V78M、L181V及其组合都显示出提高的e.e.值(分别为87%、75%和92%),并且后者(T268A-axH-L437W-V78M-L181V,重新命名为BM3-Hstar)的产率(92%)与非对映选择性(2∶ 98)都有所提高(图5)。
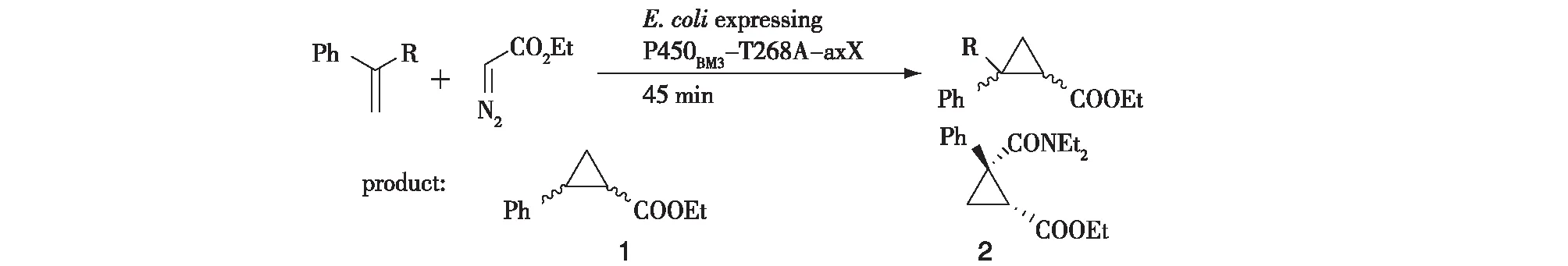
图5 细胞色素P450BM3-T268A的轴向半胱氨酸突变株催化的环丙烷化反应Fig.5 Asymmetric cyclopropane by P450BM3-T268A and its mutants

表2 细胞色素P450BM3-T268A及不同突变株催化环丙烷化反应结果
Renata等[14]研究BM3-Hstar的底物谱发现,丙烯酰胺底物的酰胺部分的取代对环丙烷化反应影响不大,但是较大的取代会引起产率及e.e.值的下降;丙烯酰胺底物的芳基部分容忍性较强,但是产率、非对映选择性及e.e.值都略有降低,具体数据见图6。
由于P450BM3催化环丙烷化取得了很好的效果,Renata等进一步考察了其他几种在大肠杆菌中表达良好的细胞色素P450催化环丙烷化的活性(图7)。将这些酶在大肠杆菌中进行表达,发现这些P450酶都有催化环丙烷化的活性;仿照P450BM3进行C400S突变成为P411BM3增强酶环丙烷化催化性能,将这些P450的轴向半胱氨酸突变为丝氨酸,发现所有这些P450的活性都得到了增强;但是对非对映选择性与e.e.值却没有明显的增强。有趣的是,CYP119以及P450cam的非对映选择性发生了反转[15],具体数据见表3。
之前研究者运用含铁卟啉的蛋白以及游离血红素催化环丙烷化反应时发现辣根过氧化酶、细胞色素C以及肌红蛋白都能催化环丙烷化,但是其d.e.值与e.e.值与游离血红素相差无几[12-14]。最近,Bordeaux等[16]进一步研究了抹香鲸肌红蛋白(myoglobin,Mb)的催化性能,具体见图8。野生型的肌红蛋白催化环丙烷化的转化率和选择性与血红素相差无几;而后对邻近卟啉铁的F43、H64与V68残基进行点饱和突变(图9),发现有几个突变株的催化性能都有不同程度的提高,将其进行组合,得到了MbH64V-V68A突变株,以99.9%的d.e.值、99.9%的e.e.值以及99%的转化率得到1s,2s的对映体,具体数据见表4。图10为MbH64V-V68A突变株催化的环丙烷化反应的底物谱。由图10可知:不同底物得到对应产物的转化率e.e.值有一定差异,这可能是由取代基位置、底物在水中不稳定等原因引起,但该酶具有较好的底物容忍性。
综上所述,人们成功地运用含血红素铁的细胞色素P450BM3以及肌红蛋白实现了重氮乙酸乙酯对苯乙烯的加成产生环丙烷化产物,并通过活性位点饱和突变得到了具有高转化率、高d.e.值及高e.e.值的突变株,具体反应及收率见图11。

图6 BM3-Hstar催化环丙烷化反应的底物谱Fig.6 Substrates of asymmetric cyclopropane by BM3-Hstar

图7 细菌来源的细胞色素P450及其轴向半胱氨酸突变株催化的环丙烷化反应Fig.7 Asymmetric cyclopropane by P450 and its mutant from bacteria
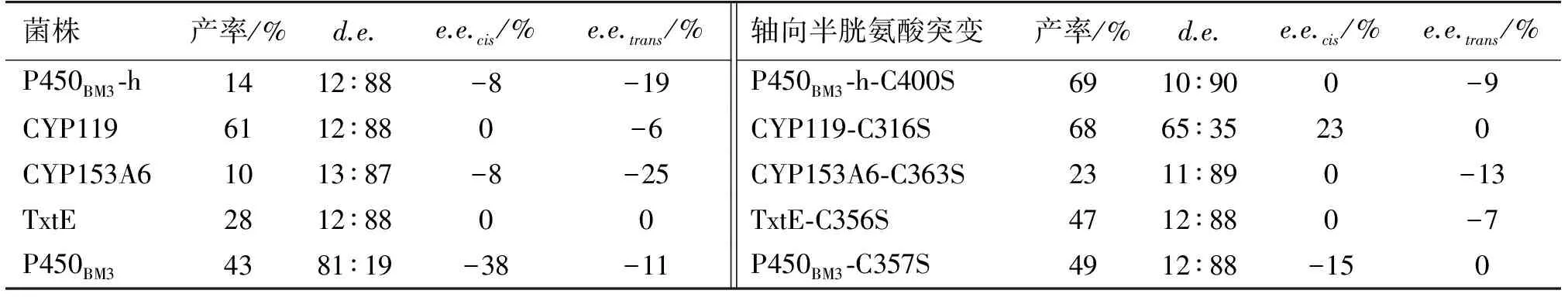
表3 细菌色素P450及其轴向半胱氨酸突变株催化环丙烷化反应结果

图8 抹香鲸肌红蛋白及其突变株催化的环丙烷化反应Fig.8 Asymmetric cyclopropane by sperm whales myoglobin and its mutants

表4 抹香鲸肌红蛋白及其突变株催化环丙烷化反应结果

图9 抹香鲸肌红蛋白活性位点F43、H64和V68[16]Fig.9 F43,H64,V68 active site of sperm hale myoglobin[16]
4 结论与展望
人们成功地运用含血红素铁的细胞色素P450BM3以及肌红蛋白实现不对称催化产环丙烷化产物,并通过活性位点饱和突变等方法得到了具有高转化率、高选择的突变株,从而得到了一个简单、绿色并可持续的催化方法。它不同于传统复杂低效、副产物多的方式,可以高效获得环丙烷这种具有良好活性的结构单元的相关产物,结合工业应用可创造更大价值;另外,结合这种酶的改造设计思路,在未来或许可以应用于其他卡宾中间体的反应中,给医药、化学等行业带来新的希望。

图10 Mb H64V-V68A催化的环丙烷化反应的底物谱Fig.10 Substrate of asymmetric cyclopropane by Mb H64V-V68A

图11 P411BM3-CIS催化环丙烷化生成1R,2S产物(a),Mb H64V-V68A催化环丙烷化生成1S,2S产物(b),BM3Hstar催化环丙烷化生成米那普仑中间体(c)Fig.11 Aymmetric cyclopropane by P411BM3-CIS(a), Mb H64V-V68A(b) and by BM3-Hstar(c)
[1] KEASLING J D,MENDOZA A,BARAN P S.Synthesis:a constructive debate[J].Nature,2012,492:188-189.
[2] TODD H,LIVIA K,THOMAS W,et al.Biotinylated Rh(III) complexes in engineered streptavidin for accelerated asymmetric C-H activation[J].Science,2012,338:500-503.
[3] BLOMBERG R,KRIES H,PINKAS D M,et al.Precision is essential for efficient catalysis in an evolved Kemp eliminase[J].Nature,2013,503:418-421.
[4] SIEGEL J B,ZANGHELLINI A,LOVICK H M,et al.Computational design of an enzyme catalyst for a stereoselective bimolecular Diels-Alder reaction[J].Science,2010,329:309-313.
[5] GUENGERICH F P,MUNRO A W.Unusual cytochrome P450 enzymes and reactions[J].J Biol Chem,2013,288:17065-17073.
[6] PODUST L M,SHERMAN D H.Diversity of P450 enzymes in the biosynthesis of natural products[J].Nat Prod Rep,2012,29:1251-1266.
[7] THIBODEAUX C J,CHANG W C,LIU H W.Enzymatic chemistry of cyclopropane,epoxide,and aziridine biosynthesis[J].Chem Rev,2012,112:1681-1709.
[8] CABALLERO A,PRIETO A,DAZ-REQUEJO M M,et al.Metal-catalyzed olefin cyclopropanation with ethyl diazoacetate:control of the diastereoselectivity[J].Eur J Inorg Chem,2009,9:1137-1144.
[9] COON M J,DING X,PEMECKY S J.Cytochrome P450:progress and predictions[J].FASEB J,1992,6:669-673.
[10] COELHO P S,BRUSTAD E M,KANNAN A,et al.Olefin cyclopropanation via carbene transfer catalyzed by engineered cytochrome P450 enzymes[J].Science,2013,339:307-310.
[11] VATSIS K P,PENG H M,COON M J.Replacement of active-site cysteine-436 by serine converts cytochrome P4502B4 into an NADPH oxidase with negligible monooxygenase activity[J].J Inorg Biochem,2002,91:542-553.
[12] COELHO P S,WANG Z J,ENER M E,et al.A serine-substituted P450 catalyzes highly efficient carbene transfer to olefins in vivo[J].Nat Chem Biol,2013,9:485-487.
[13] WANG Z J,RENATA H,PECK N E,et al.Improved cyclopropanation activity of histidine-ligated cytochrome P450 enables the enantioselective formal synthesis of levomilnacipran[J].Angew Chem Int Ed,2014,53:6810-6813.
[14] RENATA H,WANG Z J,KITTO R Z,et al.P450-catalyzed asymmetric cyclopropanation of electron-deficient olefins under aerobic conditions[J].Catal Sci Technol,2014,10(4):3640-3643.
[15] HEEL T,MCINTOSH J A,DODANI S C,et al.Non-natural olefin cyclopropanation catalyzed by diverse cytochrome P450s and other hemoproteins[J].Chem Bio Chem,2014,15:2556-2562.
[16] BORDEAUX M,TYAGI V,FASAN R.Highly diastereoselective and enantioselective olefin cyclopropanation using engineered myoglobin-based catalysts[J].Angew Chem Int Ed,2015,54:1744-1748.
(责任编辑 荀志金)
中国化工学会生物化工专业委员会青年学者工作委员会启动会在北京召开
2017年1月7日,中国化工学会生物化工专业委员会青年学者工作委员会启动会在北京顺利召开,会议在中国化工学会生物化工专业委员会秘书长伍振毅及青年学者工作委员会主任黄和的领导下,由青年学者工作委员会秘书处、中粮营养健康研究院和南京工业大学《生物加工过程》编辑部共同承办。出席会议的有科技部中国生物技术发展中心工业生物技术处处长付卫平,中国化工学会生物化工专业委员会秘书长伍振毅,青年学者工作委员会副主任委员北京理工大学李春、北京化工大学苏海佳、中粮营养健康研究院林海龙以及来自全国各地近30所高校和科研院所的40多位青年学者,会议由青年学者工作委员会秘书长金明杰主持。
会上,中粮营养健康研究院院长助理林海龙首先对生物化工专业委员会青年学者工作委员会的成立致以诚挚的祝贺;伍振毅秘书长介绍了青年学者工作委员会成立的初衷,对今后青委会的发展提出了诚恳建议;付卫平处长为各位青年学者介绍了中国生物技术发展中心的主要工作职责和近期工作感悟,对在座青年委员提出了殷切期望;李春副主任委员就委员会今后的工作内容以及运作办法做了部署。
生物化工青年工作委员会秘书处还致力于打造青年学者交流平台,值本次会议之机为在场委员奉献了一场学术盛宴。《生物加工过程》期刊编辑部的荀志金编辑结合中国科学引文数据库(CSCD)、《中文核心期刊要目总览》和中国知网的研究为在座青年委员展示了当前热点学科方向,希望期刊能够借助各位青年委员的学术力量共同传播当前热点学科领域的最新研究进展和学术动态;江南大学刘立明教授、清华大学戈钧教授和南京理工大学金明杰教授分别作了题为“微生物代谢途径设计与优化”“无机晶体固定化酶研究”和“木质纤维素乙醇的生物炼制”的精彩的学术报告,并和在座青年学者进行了热烈的互动,碰撞出新的火花。
作为由中国生物化工领域青年工作者组成的学术性群众团体,青年学者工作委员会将在中国化工学会生物化工专业委员会的领导和监督下,搭建青年学者交流的平台,培养青年人才,组建后备研究梯队,进一步发挥青年学者在生物化工领域理论创新、学术研究、技术转化和国际交流等方面的重要作用。《生物加工过程》期刊将进一步加强与青年学者工作委员会的合作,发挥期刊学术传播的优势,强化期刊的服务功能,通过主办、承办或协办各类学术会议,汇聚相关领域专家学者,争取形成一个开放的、有影响力的学术共同体。
(本刊编辑部)
Research progress of cytochrome P450 in asymmetric cyclopropane
WEI Erman,MA Hongmin,QU Xudong,DENG Zixin
(School of Pharmaceutical Sciences,Wuhan University,Wuhan 430071,China)
In the past few decades,chiral metal catalysts for asymmetric cyclopropane have been a hot topic in the field of organic chemistry and gained remarkable achievements. Due to the advantage of environmental sustainability and higher energy efficiency,the exploration of biosynthetic methods becomes a new trend.To remedy the limitations of natural enzyme catalysis,it is so important to joint between the enzyme reaction in vivo with industry synthetic reaction.Compared with the traditional chemical method,the cytochrome P450 asymmetric catalytic synthesis cyclopropane exhibits significant superiority. This review summarized the main achievement of the cytochrome P450 in asymmetric cyclopropane reaction research.
cytochrome P450; asymmetric cyclopropane; biocatalysis; bio-manufacturing
10.3969/j.issn.1672-3678.2017.01.005
2015-04-15
国家自然科学基金(31400052)
魏尔曼(1990—),女,湖北武汉人,研究方向:生物催化;瞿旭东(联系人),教授E-mail:quxd@whu.edu.cn
O643.32
A
1672-3678(2017)01-0028-09
