氧化葡萄糖酸杆菌老黄酶Go的酶学性质鉴定
2017-04-25陈晶晶盛茜茜钱姝文
陈晶晶,盛茜茜,钱姝文,严 明,许 琳
(南京工业大学生物与制药工程学院,江苏南京211800)
氧化葡萄糖酸杆菌老黄酶Go的酶学性质鉴定
陈晶晶,盛茜茜,钱姝文,严 明,许 琳
(南京工业大学生物与制药工程学院,江苏南京211800)
从氧化葡萄糖酸杆菌(Gluconobacteroxydans)H24中克隆出老黄酶Go的基因,通过构建重组表达质粒,在大肠杆菌BL21中诱导表达可溶性的蛋白,使用离子交换柱(HiTrap DEAE FF)对重组酶进行纯化,并对其酶学性质进行表征。结果表明:老黄酶Go的温度和pH耐受性都较好,在40 ℃条件下,12 h后能保持40%的活性;在pH10的条件下,12 h后能保持40%的活性;Go的底物谱十分广泛,对酰亚胺类、α,β-不饱和醛酮、萜类都有一定的活性。老黄酶Go有良好的有机溶剂耐受性,在体积分数20%的乙酸丁酯中可以保持90%左右的活性,但是金属离子对其影响较大,除Mg2+和K+外,所选的其他离子对Go都有着不同程度的抑制作用。最后,在催化性质的实验中发现,Go对柠檬醛的转化率有60%,并且其对映体过量值(e.e.)可以达到99%。
老黄酶;不对称还原碳碳双键;氧化葡萄糖酸杆菌H24;酶学性质

1933年,老黄酶首次从啤酒酵母中分离出来,并且是最早被发现的含有黄素辅酶黄素单核苷酸(FMN)的酶[4-8]。老黄酶在自然界的分布十分广泛,在植物、细菌和低等真菌[4,9-11]中都有发现。到目前为止,已报道的老黄酶微生物来源主要有Saccharomycescarlsbergensis[9-10]、Escherichiacoli[12]、Bacillussubtilis[13-15]、Saccharomycescerevisiae[16-18]、Pseudomonasputida[19-20]、Pseudomonasf ̄l ̄u ̄o ̄r ̄e ̄s ̄cens[21]和Shewanellaoneidensis[22],老黄酶可以催化一系列的活性烯烃,底物谱十分广泛,包括α,β-不饱和醛酮[4,9,23]、羧酸[22]、硝基烯[23-25]及各种衍生物(包括酯、内酯、酰亚胺等)[24-25]。
笔者以已知老黄酶OYE1为模板,在GenBank上进行序列比对搜索,发现一种新来源的老黄酶——存在于氧化葡萄糖酸杆菌H24中的老黄酶Go,并将其构建至大肠杆菌中进行异源表达,进一步对重组酶进行纯化和酶学性质的研究,以期为老黄酶的研究提供新的酶源,为其工业应用奠定基础。
1 材料与方法
1.1 菌株与质粒
氧化葡萄糖酸杆菌(Gluconobacteroxydans)H24购自中国普通微生物菌种保藏管理中心(CGMCC)。载体质粒pET-22b(+)购自Novagen公司。克隆宿主E.coliDH5α以及表达宿主E.coliBL21(DE3)为笔者所在实验室保藏。
1.2 仪器和试剂
各种限制性内切酶、Prime STAR HS DNA聚合酶和T4 DNA 连接酶,宝生物工程(大连)有限公司;细菌基因组试剂盒、质粒小提试剂盒、胶回收试剂盒,天根生化科技(北京)有限公司;PCR引物合成,南京金斯瑞生物科技有限公司。所用底物(马来酰亚胺、马来酸二甲酯、香芹酮、茶香酮、衣康酸、中康酸、柠康酐、2-环戊烯酮、2-环己烯酮、3-甲基-2-环戊烯酮、3-甲基-2-环己烯酮、乙酰环己烯、薄荷酮、α-甲基肉桂醛、2-甲基-2-戊烯醛、反式-2-己烯醛、1-苯基-2-硝基丙烯、硝基苯、柠檬醛等),Aladdin公司;抗生素、考马斯亮蓝、牛血清白蛋白(BSA)及其余试剂,生工生物工程(上海)股份有限公司;PowerWave XS酶标仪,BIO-TEK公司;Centrifuge 5804R型高速冷冻离心机,Eppendorf公司。
1.3 老黄酶Go基因在大肠杆菌中的克隆和表达
根据GluconobacteroxydansH24(GenBank登录号为CP003926.1)设计引物。上游引物:5′-CATGCCATGGATGGAAGTTTCGATCAAGG-3′,下游引物:5′- C ̄G ̄G ̄G ̄A ̄T ̄C ̄C ̄A ̄T ̄G ̄G ̄A ̄A ̄G ̄T ̄T ̄T ̄C ̄G ̄A ̄T ̄C ̄A ̄A ̄G ̄G ̄A ̄G ̄T ̄A ̄C -3′, (上游、下游引物分别引入NcoⅠ及BamHⅠ酶切位点,划线处为酶切位点)。将扩增的DNA片段与pET-22b(+)载体同时进行相同的限制性内切酶酶切,用 T4 DNA 连接酶连接并转化至E.coliDH5α克隆载体,挑取阳性克隆送至南京金斯瑞生物科技有限公司进行测序。将正确测序的Go基因转入表达载体BL21 (DE3)进行表达。挑取重组菌单菌落,接种到含有100 mg/mL氨苄青霉素抗性的5 mL液体培养基中,在37 ℃、200 r/min的恒温摇床中培养12 h。将培养12 h的菌液以体积分数2%的接种量接入含有100 mg/mL氨苄青霉素抗性的100 mL自诱导液体培养基中,在30 ℃、200 r/min的摇床中诱导培养15 h。诱导结束后,用高速冷冻离心机收集菌体。用磷酸缓冲(pH 8.0)清洗菌体1次,最后用5 mL磷酸悬浮菌体。在冰上用超声细胞粉碎机破碎细胞,破碎后的细胞在4 ℃、10 000 r/min条件下离心15 min。将收集得到的上清液过膜后置于4 ℃冰箱待用。
1.4 老黄酶Go的分离纯化
将粗酶液使用AKTA蛋白纯化仪和阴离子交换柱(Hi Trap DEAE FF)进行纯化。用20 mmol/L、pH 8.0的磷酸缓冲平衡柱子,用1 mol/L NaCl和20 mmol/L、pH 8.0的磷酸缓冲的混合液进行梯度洗脱。收集到的目的蛋白使用SDS-PAGE进行检测。
1.5 Go蛋白浓度测定
利用常规Bradford法测定蛋白浓度[29]。
标准蛋白溶液:取10 mg牛血清蛋白,用蒸馏水定容至100 mL,配制成100 μg/mL的标准蛋白液。
考马斯亮蓝G-250溶液:取50 mg考马斯亮蓝G-250,加入25 mL 90%的乙醇溶液及85%磷酸溶液50 mL,定容至500 mL。
将标准蛋白液稀释成10、20、40、60、80和100 μg/mL的蛋白质量浓度梯度溶液,分别取1 mL放入10 mL试管中,每管加入5 mL考马斯亮蓝试剂,混匀,静置5 min,于595 nm处测定其吸光值A595。以标准蛋白质量(mg)为横坐标、吸光值A595为纵坐标作图,即得到一条标准曲线。由此标准曲线和未知样品的A595可以计算样品的蛋白浓度。
1.6 老黄酶Go酶活的测定
用Molecular Devices 公司的多功能酶标仪SpectraMax M2进行酶活力测定。酶反应体系包括1 mmol/L NADPH、10 mmol/L 底物、100 mmol/L磷酸缓冲液(pH 8.0)中进行测定。在30 ℃、波长340 nm处检测吸光值变化。每分钟催化氧化1 μmol NADPH所需的酶量为1个活力单位(U)。设置两组对照:相同的反应体系不加酶进行测定,和相同的反应体系不加底物进行测定。
1.7 老黄酶Go酶学性质研究
1.7.1 Go的最适温度和温度稳定性
最适温度的研究:将磷酸缓冲分别放在20~70 ℃的水浴锅保温30 min后,迅速取出进行最适温度的测定。
温度稳定性的研究:将酶液放置在30~60 ℃条件下保温12 h,检测 12 h后的残余酶活。以酶活最高为100%,其余酶活与之相比,计算其相对酶活。每组设置3个重复实验。检测最适温度和温度稳定性时以马来酰亚胺为底物。
1.7.2 Go的最适pH和pH稳定性
最适pH的研究:配制pH分别为4、5、6、7、8、9和10的缓冲液,在不同的pH缓冲液条件下检测酶的活性,确定最适pH。
pH稳定性的研究:将酶液按测酶活的体系加入到不同pH的缓冲溶液中,检测12 h后的残余酶活。以酶活最高为100%,其余酶活与之相比,计算其相对酶活。每组设置3个重复实验。检测最适pH和pH稳定性,以马来酰亚胺为底物。
1.7.3 Go的底物谱
选取19种底物进行底物谱的研究,包括马来酰亚胺、马来酸二甲酯、香芹酮、茶香酮、衣康酸、中康酸、柠康酐、2-环戊烯酮、2-环己烯酮、3-甲基-2-环戊烯酮、3-甲基-2-环己烯酮、乙酰环己烯、薄荷酮、α-甲基肉桂醛、2-甲基-2-戊烯醛、反式-2-己烯醛、1-苯基-2-硝基丙烯、硝基苯和柠檬醛。
将以上底物分别配制成100 mmol/L的母液,并在超声清洗器中超声15 min来均匀混合底物。测定底物谱时,加入1 mmol/L的NADPH、10 mmol/L的底物、适量的酶液,再用缓冲补足到200 μL,最后加入到96孔板中,并在酶标仪上检测。每个样品至少做3个平行样。
1.7.4 Go的动力学参数
采用双倒数法检测米氏常数Km值和最大反应速率rmax。转换数kcat是指每摩尔酶活性中心每秒转换底物的摩尔数,其计算方法如下:kcat=rmax/cE0,这里cE0表示总的酶浓度。Go蛋白的相对分子质量为4.5×104。测定辅酶的动力学常数时,底物(马来酰亚胺)的浓度为10 mmol/L,辅酶的底物浓度范围为0.1~3 mmol/L。
根据底物谱测定的结果,一共选取了8种底物进行动力学常数的测定:马来酰亚胺、马来酸二甲酯、香芹酮、茶香酮、α-甲基肉桂醛、柠檬醛、2-甲基-2-戊烯醛以及2-环戊烯酮。测定底物的动力学常数时,辅酶的浓度为1 mmol/L,底物的浓度为0.1~32 mmol/L。
1.7.5 金属离子及EDTA对Go活性影响
本研究以马来酰亚胺为底物,以不加金属离子为对照,检测体系中加入了5 mmol/L的Mg2+、Ca2+、Zn2+、Li+、Na+、K+、Cu2+、Ba2+和EDTA后的酶活力。
1.7.6 有机溶剂耐受性
本研究以马来酰亚胺为底物,选取了11种有机溶剂进行了研究,包括:乙醇、甲醇、乙酸丁酯、乙酸乙酯、异丙醇、正己醇、正戊醇、正丁醇、二甲基亚砜(DMSO)、三氯甲烷和正己烷等。并以不加有机溶剂为对照,分别检测了老黄酶Go在5%、10%和20%(体积分数)的有机溶剂条件下的酶活力。
1.8 Go催化性质

2 结果与讨论
2.1 老黄酶Go基因的克隆和重组质粒的构建
根据Go的基因序列设计引物,将PCR产物经0.8%的琼脂糖凝胶电泳鉴定,电泳结果见图1。由图1可知:在近1 100 bp处有特异性扩增条带,其大小与预期符合(目的产物约为1 101 bp)。酶切鉴定后的阳性克隆送南京金斯瑞生物科技有限公司测序,测序结果与GenBank中目的序列完全一致。重组大肠杆菌细胞蛋白的SDS-PAGE电泳见图2。由图2可知,表达的重组蛋白大约为4.0×104,与预测的酶蛋白相对分子质量大小一致。

M为标准DNA;1—PCR结果图1 Go基因的PCR结果Fig.1 PCR analysis of Go gene

M为标准蛋白;Go为老黄酶Go在BL21(DE3)中表达结果;BL21为对照图2 Go蛋白的诱导表达结果Fig.2 SDS-PAGE analysis of Go protein
将不同来源的老黄酶氨基酸序列进行BLASTp比对发现,老黄酶Go与来源于Rhizobiumsp. UR51a的NerA序列相似性最高为42%[12],与来源于Bacillussubtili的YqjM氨基酸序列相似性为31%[15],与来源于Saccharomycescerevisiae的OYE1氨基酸序列相似性为34%[9],与来源于Gluconobacteroxydans621H的Gox氨基酸序列相似性最低仅有19%[9]。
2.2 老黄酶Go的纯化
蛋白纯化使用的是AKTA蛋白纯化仪和阴离子交换柱(Hi Trap DEAE FF)。纯化后蛋白电泳图见图3。纯化后的老黄酶浓度使用Bradford蛋白定量检测法进行测定,得到这4种老黄酶最终的蛋白浓度为10 mg/mL。

M为标准蛋白;1为纯化前样品;2为纯化后的Go蛋白图3 Go蛋白纯化后的电泳图Fig.3 SDS-PAGE analysis of purified Go protein
2.3 最适温度和温度稳定性研究结果

图4 温度对Go活性和稳定性的影响Fig.4 Effects of temperature on activity and stability of Go protein
老黄酶Go的最适温度和温度稳定性见图4。由图4可知:该酶的最适温度在45 ℃左右,在25~50 ℃时酶活能达到60%以上,与Xu等[13]得到的老黄酶相比,Go在50 ℃下的酶活更高。在35 ℃以下保温12 h后能保持70%以上的活性。综上,该酶有着广泛的温度范围和较高的温度耐受性,这在生物催化中有着一定的优势。
2.4 最适pH和pH稳定性研究结果
老黄酶Go的最适pH和pH稳定性见图5。由图5可知:该酶的最适pH在8.0左右,在pH 7~10时,酶活能达到80%以上,与Xu等[13]和Zhang等[14]得到的老黄酶相比,Go在碱性条件下的酶活更高。12 h后pH稳定性的结果显示出,在pH 6~9时,12 h后残余酶活能维持在60%以上。综上,该酶的适用温度范围偏碱性,并且碱性条件下的pH耐受性更好。
2.5 底物谱研究
考察老黄酶Go的底物适应性,结果见表1。从表1可以看出:Go对环内双键的醛酮活力相对较高,例如马来酰亚胺、茶香酮、香芹酮和2-环己烯酮等;对开环的醛酮活力相对较低,例如柠檬醛、香芹酮、2-甲基-2-戊烯醛和α-甲基肉桂醛等;对硝基烯类和羧酸类基本没有活性。同Fu等[18]得到的老黄酶相比,底物谱要更加广泛,活性也相对较高。

图5 pH对Go酶活力和稳定性的影响Fig.5 Effects of pH on activity and stability of Go protein
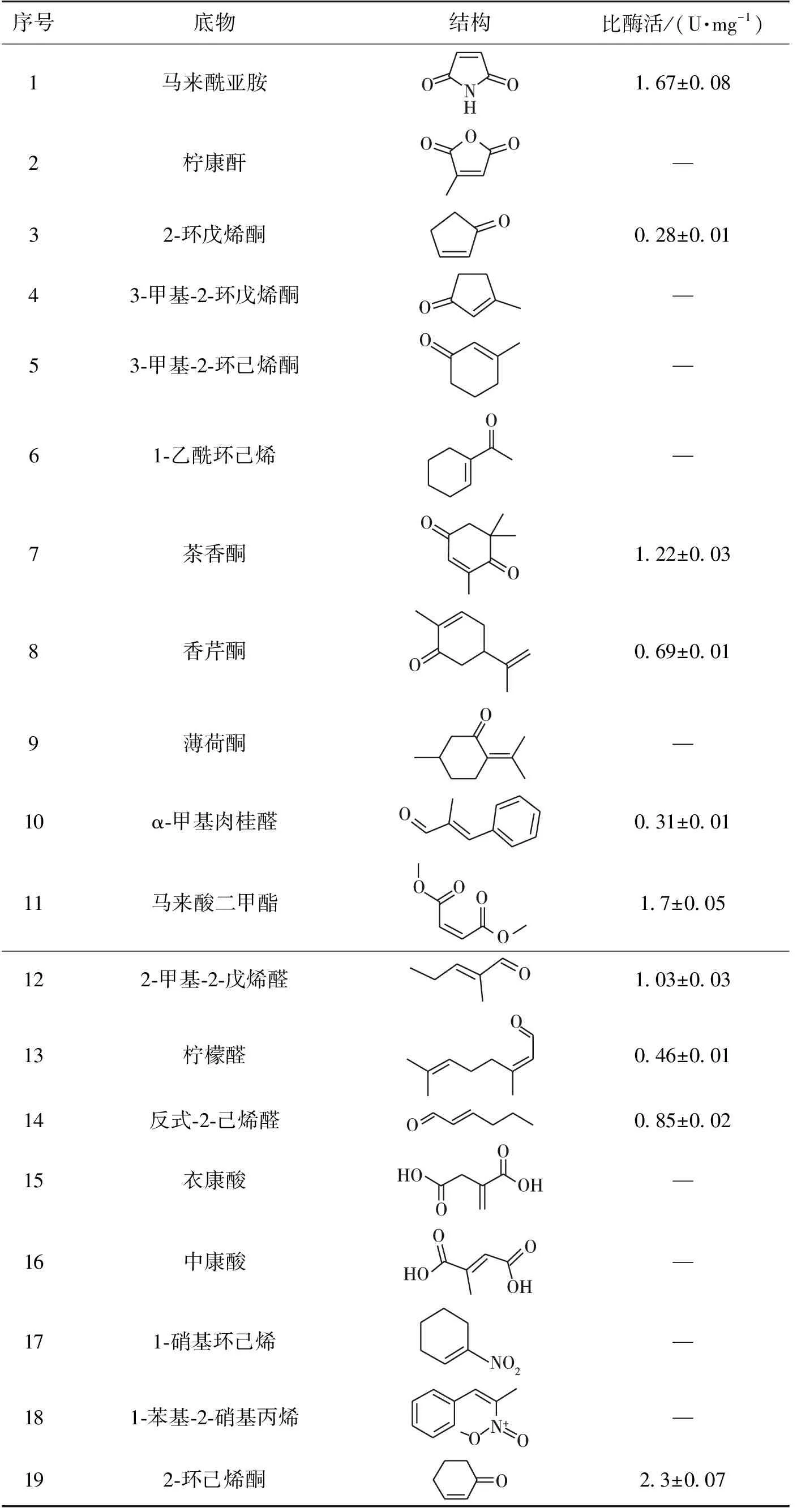
表1 Go的底物谱鉴定
2.6 动力学参数研究
根据底物谱的研究结果挑选了9种底物和辅酶进行了动力学参数的研究,结果见表2。

表2 Go的动力学参数测定
从表2中可看出,Go对NADPH的亲和力要远大于对NADH的亲和力。因此,本实验中选用NADPH作为辅酶。从kcat/Km的数据可看出,马来酰亚胺的kcat/Km为219 L/(s·mmol),要远远高于其他的底物,因此马来酰亚胺可坐为Go的天然底物。Go对马来酸二甲酯、茶香酮、2-环己烯酮、柠檬醛也有着较高的催化能力。并且对2-环己烯酮的kcat/Km值为21.8 L/(s·mmol)要高于之前发现的老黄酶YqjM 15 L/(s·mmol)、MR 0.19 L/(s·mmol)和TOYE 0.5 L/(s·mmol)。
2.7 金属离子和EDTA对Go酶活力的影响研究结果
考察金属离子和EDTA对Go的影响,结果见图6。由图6可知:Cu2+和Ca2+对Go有很强的抑制作用,5 mmol/L的Cu2+使Go完全失去了活性;Na+、Li+、Ba2+、Zn2+和EDTA对Go也有不同程度的抑制作用;Mg2+和K+对Go没有明显的作用。

图6 金属离子对Go酶活的影响Fig.6 Effects of metal ions on activity of Go protein
2.8 有机溶剂耐受性研究结果
考察有机溶剂对Go的影响,结果见图7。由图7可知:Go的有机溶剂耐受性较好,在20%的乙酸丁酯中能保持80%以上的活力,在20%的异丙醇、正丁醇、乙酸乙酯、正己烷、甲醇和DMSO中能保持60%的活力,在20%的乙醇中能保持40%的活力,这对后续老黄酶Go的进一步的生物催化反应有很大的作用。

图7 有机溶剂对Go酶活的影响Fig.7 Effects of organic solvents on activity of Go protein
2.9 催化性质的研究结果
一共选取了5种底物进行了催化转化率和对映体过量值(e.e.)的研究,结果见表3。

表3 Go的转化率和e.e.值测定
从表3中可看出:所选的5种底物中,老黄酶Go对马来酰亚胺的转化率最高,可以达到99%;对α-甲基肉桂醛的转化率最低仅有17%。柠檬醛可以被还原成香茅醛,香茅醛是一种重要的香料,而Go对柠檬醛的转化率有60%,但是其e.e.值可以达到99%。同时,茶香酮可以被还原成(R)-左旋二酮,(R)-左旋二酮是生产类胡萝卜素中的重要手性中间体,Go对茶香酮的转化率仅有54%,但是e.e.值可以达到83%。
3 结论
笔者成功克隆了氧化葡萄糖酸杆菌H24中的老黄酶基因Go,并成功构建了重组菌BL21-pET22b(+)-Go。将老黄酶Go纯化后进行了酶学性质的鉴定,包括最适温度和温度的稳定性、最适pH和pH稳定性、底物谱、动力学参数、金属离子的影响、有机溶剂的影响以及催化性质的鉴定。结果发现Go的底物谱十分广泛,温度和pH的耐受性都较好,并且有着良好的有机溶剂耐受性,在20%的乙酸丁酯中可以保持90%左右的活性,但是金属离子对其影响较大,除了Mg2+和K+,所选的其他离子对Go都有着不同程度的抑制作用。最后,在催化性质的实验中发现,Go对柠檬醛的转化率有60%,并且其e.e.值可以达到99%。以上这些研究为老黄酶家族的研究提供了一个新的酶源,并且为以后的工业化研究提供了充足的数据基础。
[1] TURNER N J.Directed evolution of enzymes for applied biocatalysis[J].Trends Biotechnol,2003,21(11):474-478.
[2] TOOGOOD H S,GARDINER J M,SCRUTTON N S.Biocatalytic reductions and chemical versatility of the old yellow enzyme family of flavoprotein oxidoreductases[J].Chem Cat Chem,2010,8(2):892-914.
[3] TUTTLE J B,OUELLET S G,MACMILLAN D W C.Organocatalytic transfer hydrogenation of cyclic enones[J].J Am Chem Soc, 2006,128(39):12662-12663.
[4] CHAPARRO-RIGGERS J F,ROGERS T A,VAZQUEZ-FIGUEROA E,et al.Comparison of three enoate reductases and their potential use for biotransformations[J].Adv Synth Catal,2007,349(8/9):1521-1531.
[5] FRYSZKOWSKA A,TOOGOOD H,SAKUMA M,et al.Asymmetric reduction of activated alkenes by pentaerythritol tetranitrate reductase:specificity and control of stereochemical outcome by reaction optimisation[J].Adv Synth Catal,2009,351(17):2976-2990.
[6] HALL M,STUECKLER C,EHAMMER H,et al.Asymmetric Bioreduction of C=C bonds using enoate reductases OPR1,OPR3 and YqjM: enzyme-based stereocontrol[J].Adv Synth Catal,2008,350(3) : 411-418.
[7] STUERMER R,HAUER B,HALL M,et al.Asymmetric bioreduction of activated C=C bonds using enoate reductases from the old yellow enzyme family[J].Curr Opin Chem Biol,2007,11(2):203-213.
[8] ADALBJORNSSON B V,TOOGOOD H S,FRYSZKOWSKA A,et al.Biocatalysis with thermostable enzymes:structure and properties of a thermophilic ′ene′-reductase related to old yellow enzyme[J].Chem Bio Chem,2010,11(2):197-207.
[9] RICHTER N,GROGER H,HUMMEL W.Asymmetric reduction of activated alkenes using an enoate reductase fromGluconobacteroxydans[J].Appl Microbiol Biotechnol,2011,89(1):79-89.
[10] KATAOKA M,KOTAKA A,THIWTHONG R,et al.Cloning and overexpression of the old yellow enzyme gene ofCandidamacedoniensis,and its application to the production of a chiral compound[J].J Biotechnol,2004,114(1/2):1-9.
[11] STRASSNER J,FURHOLZ A,MACHEROUX P,et al.A homolog of old yellow enzyme in tomato:spectral properties and substrate specificity of the recombinant protein[J].J Biol Chem,1999,274(49):35067-35073.
[12] RIEDEL A,MEHNERT M,PAUL C E,et al.Functional characterization and stability improvement of a ′thermophilic-like′ ene-reductase fromRhodococcusopacus1CP[J].Frontiers Microbiol,2015,6:1073.
[13] XU M Y,PEI X Q,WU Z L.Identification and characterization of a novel ′thermophilic-like′ old yellow enzyme from the genome ofChryseobacteriumsp.CA49[J].J Mol Catal B:Enzymatic,2014,108:64-71.
[14] ZHANG H,GAO X,RRN J,et al.Enzymatic hydrogenation of diverse activated alkenes:identification of twoBacillusold yellow enzymes with broad substrate profiles[J].J Mol Catal B:Enzymatic,2014,105:118-125.
[15] FITZPATRICK T B,AMRHEIN N,MACHEROUX P.Characterization of YqjM,an old yellow enzyme homolog fromBacillussubtilisinvolved in the oxidative stress response[J].J Biol Chem,2003,278(22):19891-19897.
[16] WANG H B,PEI X Q,WU Z L.An enoate reductase Achr-OYE4 from Achromobacter sp.JA81: characterization and application in asymmetric bioreduction of C=C bonds[J]. Appl Microbiol Biotechnol,2014,98(2):705-715.
[17] GAO X,RRN J,WU Q,et al. Biochemical characterization and substrate profiling of a new NADH-dependent enoate reductase from Lactobacillus casei[J]. Enzyme Microb Technol,2012,51 (1) : 26-34.
[18] FU Y,HOELSCH K,WEUSTER-BOTZ D.A novel ene-reductase from Synechococcus sp. PCC 7942 for the asymmetric reduction of alkenes[J].Process Biochem,2012,47(12):1988-1997.
[19] YANTO Y,YU H H,HALL M,et al.Characterization of xenobiotic reductase A (XenA):study of active site residues,substrate spectrum and stability[J].Chem Commun,2010,46(46):8809-8811.
[20] OPPERMAN D J,PIATER L A,VAN HEERDEN E.A novel chromate reductase from Thermus scotoductus SA-01 related to old yellow enzyme[J].J Bacteriol,2008,190(8) : 3076-3082.
[21] BLEHERT D S,FOX B G,CHAMBLISS G H.Cloning and sequence analysis of two Pseudomonas flavoprotein xenobiotic reductases[J].J Bacteriol,1999,181(20):6254-6263.
[22] AHMED N K,FELSTED R L,BACHUR N R.Comparison and characterization of mammalian xenobiotic ketone reductases[J]J Pharmacol Experim Therap,1979,209(1):12-19.
[23] KHAN H,HARRIS R J,BARNA T,et al.Kinetic and structural basis of reactivity of pentaerythritol tetranitrate reductase with NADPH,2-cyclohexenone, nitroesters, and nitroaromatic explosives[J].J Biol Chem,2002,277(24):21906-21912.
[24] SWIDERSKA M A,STEWART J D.Stereoselective enone reductions by Saccharomyces carlsbergensis old yellow enzyme[J].J Mol Catal B:Enzymatic,2006,42(1/2):52-54.
[25] WILLIAMS R E,RATHBONE D A,SCRUTTON N S,et al.Biotransformation of explosives by the old yellow enzyme family of flavoproteins[J].Appl Environ Microb,2004,70(6):3566-3574.
[26] MULLER A,HAUER B,ROSCHE B.Enzymatic reduction of the alpha,beta-unsaturated carbon bond in citral[J].J Mol Catal B:Enzymatic,2006; 38: 126-130.
[27] MULLER A,HAUER B,ROSCHE B.Asymmetric alkene reduction by yeast old yellow enzymes and by a novel Zymomonas mobilis reductase[J].Biotechnol Bioeng,2007,98(1) : 22-29.
[28] CRAIG D H,MOODY P C E,BRUCE N C,et al.Reductive and oxidative half-reactions of morphinone reductase from Pseudomonas putida M10: a kinetic and thermodynamic analysis[J].Biochemistry,1998,37(20):7598-7607.
[29] BRADFORD M M,MCRORIE R A,WILLIAMS W L.A role for esterases in the fertilization process[J].J Exp Zool,1976,197(2) : 297-301.
(责任编辑 荀志金)
Characterization of an old yellow enzyme fromGluconobacteroxydansH24
CHEN Jingjing,SHENG Xiqian,QIAN Shuwen,YAN Ming,XU Lin
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
Go,a novel old yellow enzyme fromGluconobacteroxydansH24,was successfully cloned and overexpressed in BL21(DE3). Then the recombinant protein was identified and characterized after purified with HiTrap DEAE FF column. Go can reduce various activated alkenes imides,α,β-unsaturated ketones, and terpene and exhibits high temperature (retaining 40% catalytic activity, 40 ℃ for 12 h) and pH stability (retaining 40% activiy, pH 10 for 12 h),indicating that it has a great potential for biocatalysis. Also,it shows high tolerance toward organic solvents and maintain 90% activity in 20% ethyl acetate. However,Go has low tolerance towards metal ions. Tested metal ions all existed inhibitions toward Go except Mg2+and K+.Besides,Go can catalyze citral to (S)-citronellal with 60% conversion and but high enantiomeric excess value (e.e.>99%).
10.3969/j.issn.1672-3678.2017.01.004
2016-04-22
国家重点基础研究计划(973计划)(2011CBA00804)
陈晶晶(1990—),女,湖北红安人,研究方向:基因工程与生物信息学;严 明(联系人),副教授,E-mail:yanming@njtech.edu.cn
Q554
A
1672-3678(2017)01-0020-08
