TACE联合阿帕替尼治疗中晚期肝细胞癌
2017-04-24金鑫荔
金鑫荔,卢 伟
(1.南方医科大学第三临床医学院,广东 广州 510515;2.南方医科大学附属海军总医院介入医学科,北京 100048)
TACE联合阿帕替尼治疗中晚期肝细胞癌
金鑫荔1,卢 伟2*
(1.南方医科大学第三临床医学院,广东 广州 510515;2.南方医科大学附属海军总医院介入医学科,北京 100048)
目的 比较TACE联合阿帕替尼与单纯TACE治疗中晚期肝细胞癌的临床疗效和安全性。方法 将44例肝细胞癌患者随机平均分为A、B组,对A组行单纯TACE治疗,B组行TACE联合阿帕替尼治疗。比较两组治疗后3个月时甲胎蛋白(AFP)指标变化,及3、6、9、12个月时客观缓解率(ORR)。同时比较两组患者疾病无进展生存期(PFS)和不良反应的发生情况。结果 治疗后3个月,A、B组AFP水平均显著下降,较治疗前差异均有统计学意义(Z=-2.289、-2.953,P均<0.05),治疗后两组间比较差异无统计学意义(Z=-0.126,P=0.90)。3、6个月时两组ORR差异无统计学意义(P均>0.05),9、12个月时差异有统计学意义(P均<0.05)。两组PFS差异有统计学意义(2=6.576,P=0.01)。B组阿帕替尼相关并发症(包括高血压、手足综合征、蛋白尿)发生率高于A组,差异均有统计学意义(P均<0.05)。不良反应经对症处理后均缓解。结论 对于中晚期肝细胞癌患者,TACE联合阿帕替尼的中远期疗效优于单纯TACE治疗,且具有一定的安全性。
癌,肝细胞;阿帕替尼;化学栓塞,治疗性;疗效;不良反应
原发性肝癌是最常见的恶性肿瘤之一,占全球癌症相关死亡原因的第2位[1]。根据巴塞罗那(Barcelona clinic liver cancer, BCLC)肝癌临床分期,BCLC B期和BCLC C期标准治疗方式分别为TACE和口服索拉非尼治疗[2]。索拉非尼是第一个获批用于治疗肝癌的靶向药,然而其治疗效果仍存在一定局限性,且耐药后无其他可替代治疗。血管内皮生长因子受体-2 (vascular endothelial growth factor receptor-2, VEGFR-2)与肝癌的发生有密切关系,甲磺酸阿帕替尼是最新高选择性的VEGFR-2抑制剂,可阻断血管内皮细胞的迁移和增殖,减少肿瘤微血管密度,抑制肿瘤生长[3]。同时,阿帕替尼还具有抑制多个ATP结合位点流出道以逆转多耐药性及提高传统化疗药物疗效的作用[4-5]。研究[6-7]证实,肝癌经TACE后残余的组织细胞中表达VEGF阳性细胞数量较前明显增多,且术后进展迅速的患者中VEGF表达的水平明显升高。因此,基于阿帕替尼的选择性抑制VEGFR-2的特点,可抑制TACE术后肿瘤组织新生血管生成,联合使用可能增加抗肿瘤的疗效。
目前,阿帕替尼治疗肝癌的Ⅱ期临床研究证实了阿帕替尼对于肝癌的疗效[8],Ⅲ期临床试验也在进行。本研究通过对中晚期肝癌患者TACE联合阿帕替尼与单纯TACE治疗的临床疗效、疾病无进展生存期(progression free survival, PFS)和不良反应的发生情况进行比较,以期为中晚期肝癌患者的TACE联合阿帕替尼治疗提供更多的临床依据。
1 资料与方法
1.1一般资料 收集2015年3月—2015年8月南方医科大学附属海军总医院收治的肝癌患者44例,所有患者均经穿刺病理诊断为肝细胞肝癌(hepatocellular carcinoma, HCC)。纳入标准:①无化疗禁忌证,主要器官功能无明显障碍;②BCLC肝癌分期B期或C期;③肝功能Child分级A级或B级;KPS评分>60分;④无法接受或拒绝外科手术切除者,且术前未接受其他治疗。排除标准:①有化疗禁忌证者;②严重凝血功能障碍者;③心、肺等重要脏器功能障碍者;④停服药物超过1个月;⑤存在肝动脉-门静脉或肝静脉瘘或门静脉主干或左、右主干癌栓;⑥大量腹腔积液或顽固性腹腔积液;⑦伴有远处转移者。将44例HCC患者随机分为A组(n=22),年龄39~75岁,行单纯TACE治疗,B组(n=22),年龄34~79岁,行TACE联合阿帕替尼治疗。所有患者均签署知情同意书。
1.2仪器与方法 TACE:经股动脉穿刺插管成功后,采用Philips Allura Xper FD20 DSA仪,行腹腔干、肠系膜动脉及其分支造影,通过肠系膜动脉或脾动脉行间接门静脉造影。行肝动脉造影,明确肿瘤位置、分布及其滋养动脉情况(图1A),然后使用微导管分别超选择插管至病灶的各滋养动脉,经导管注入表柔比星 30 mg+奥沙利铂50 mg+碘化油10~20 ml混合乳化剂,并用embosphere颗粒(300~500 μm,Merit Medical)栓塞供血动脉(图1B、1C)。栓塞终点为供血动脉血流停滞(图1D)。术后常规给予止吐、抑酸保护胃黏膜等对症治疗及保肝治疗。术后45天复查,患者有TACE指征,Child分级A级或B级,且无TACE治疗禁忌证,则再次行TACE治疗。
阿帕替尼服用方法:TACE首次治疗后4天开始口服阿帕替尼,起始剂量每天500 mg,1~2周后视患者耐受情况调整药物剂量。若耐受良好或出现轻度不良反应则维持原剂量;出现明显不良反应,可减量至每天250 mg继续观察或暂时停药观察。当不良反应降级或消失时可逐渐恢复原剂量继续观察。停药时间不超过1个月。下一周期TACE前4天停止服用,TACE术后4天继续服用。
1.3肿瘤疗效的评价方法 所有患者于治疗后3、6、9、12个月行增强CT或MR检查并复查血清甲胎蛋白(alpha fetoprotein, AFP),然后依据mRECIST标准对肿瘤的控制情况进行疗效评价:完全缓解(complete response, CR),所有靶病灶均无动脉期增强;部分缓解(partial response, PR),靶病灶增强扫描动脉期的直径总和缩小不低于30%;疾病进展(progressive disease, PD),动脉增强期,目标病灶显影的直径比原始水平至少增大20%,或有新的肿瘤灶出现;疾病稳定(stable disease, SD),靶病灶的缩小直径既未达到PR标准,增大程度亦未达到PD[9]。客观缓解率(objective response rate, ORR)=(CR+PR)/总病例数×100%。PFS定义为患者自治疗开始至明确为PD或死亡的时间。观察起点为第一次治疗时间,截止时间为患者PD或末次随访时间。当患者明确为PD时则根据其病情需要进行其他治疗(如放疗或消融治疗等)。

2 结果
两组患者的一般资料差异均无统计学意义(P>0.05,表1)。两组患者随访时间为12~18个月,随访截止日期为2016年8月15日。B组共2例未纳入疗效评价,1例因肝硬化、食管胃底静脉曲张、上消化道出血死亡,1例因无法耐受阿帕替尼不良反应停药超过1个月。
2.1临床疗效评价 治疗后3个月,A、B组AFP水平均显著下降,中位数分别为200(5~2 240)μg/L和235(13~3 567)μg/L,较治疗前A组AFP 759(6~6 130)μg/L和B组653(8~6 432)μg/L差异有统计学意义(Z=-2.289、-2.953,P均<0.05),治疗后两组间比较差异无统计学意义(Z=-0.126,P=0.90)。A组原AFP升高的19例患者中5例降至正常,B组原AFP升高的16例患者中6例降至正常。
治疗后3个月复查肝脏增强CT,A组12例、B组15例患者瘤灶动脉期强化范围较前减小。随访12个月,A组5例、B组12例患者瘤灶体积较前未见明显增大,B组1例患者动脉期未见明显强化。治疗3、6个月时两组ORR差异无统计学意义(χ2=2.346、2.295,P=0.126、0.130),治疗9、12个月时差异有统计学意义(χ2=5.050、4.177,P=0.025、0.041),见表2。
2.2无进展生存期 A组中位PFS为6.0个月,B组中位PFS为12.5个月,两组差异有统计学意义(2=6.576,P=0.01,图2)。
2.3不良反应 B组1例患者因严重腹泻停药超过1个月出组,余患者均耐受良好。B组中1例(1/20,5.00%)患者出现重度手足综合征(3级),停药并经对症处理后反应降级,2周后恢复用药。两组栓塞后综合征,如发热、腹痛、恶心呕吐等不良反应发生率差异均无统计学意义(P>0.05)。B组阿帕替尼相关不良反应(包括高血压、手足综合征、蛋白尿)发生率高于A组,差异有统计学意义(P<0.05),见表3。两组不良反应经对症处理后均缓解。
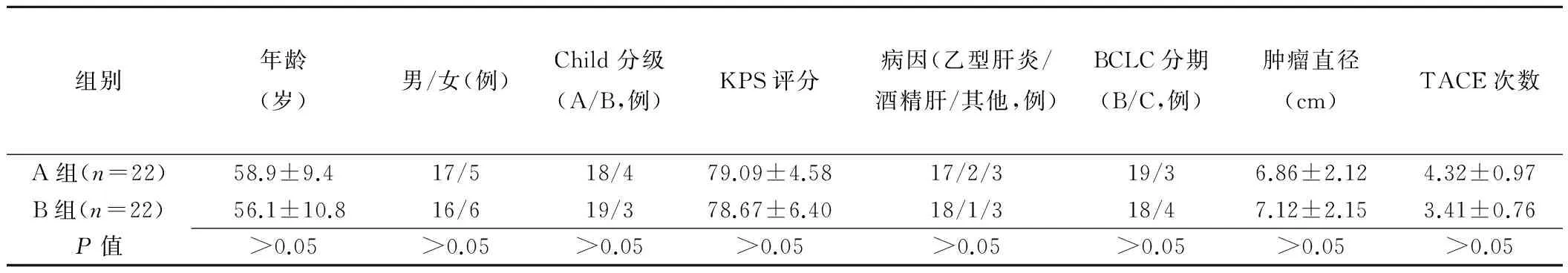
表1 两组患者的一般资料的比较

表2 随访3、6、9、12个月时两组患者的ORR
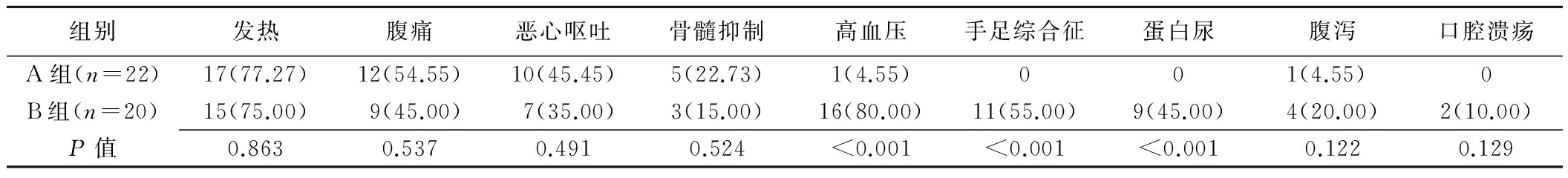
表3 两组不良反应比较[例(%)]
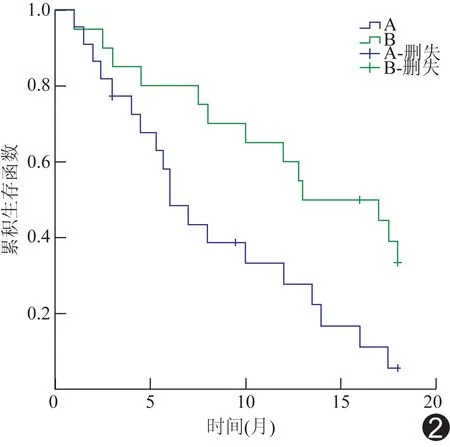
图2 两组患者PFS生存曲线
3 讨论
我国是世界肝癌高发国家之一,大部分患者就诊时已属晚期,TACE疗效确切,可作为非手术治疗患者的首选[10]。TACE是原发性肝癌尤其是中晚期原发性肝癌安全、有效的姑息治疗方法,配合多元化的综合治疗有助于获得更好的疗效[11]。肝癌的发生及转移均依赖于新生血管形成,其中VEGF为肝癌患者体内作用最强的血管生成因子[12]。TACE常不能彻底杀灭肿瘤细胞,且术后造成肿瘤局部缺氧,残存周边肿瘤组织的VEGF表达更高,其侵袭性及转移活性更强[13-14]。因此,针对TACE术后肿瘤细胞VEGF表达增高的特点进行相应处理,有望提高TACE疗效。
索拉非尼是一种多激酶抑制剂,可发挥抗血管生成作用[15]。Llovet等[16]进行了SHARP临床试验,结果显示索拉非尼可以将晚期肝癌患者的中位PFS延长3个月。然而其在肝癌的反应率很低,且联合TACE的治疗效果存在一定局限性[17-19]。阿帕替尼是一种小分子VEGFR酪氨酸激酶抑制剂,是PTK787的衍生物。主要作用靶点为VEGFR-2/KDR,阿帕替尼抑制VEGF介导的VEGFR-2磷酸化及下游分子活化,显著抑制肿瘤血管内皮细胞的增殖、迁徙和管腔形成,从而发挥其抗肿瘤作用。阿帕替尼在低浓度下即可抑制VEGFR-2,在高浓度下甚至能抑制PDGFR、c-Kit及c-Src等激酶[20-21]。阿帕替尼治疗肝癌的Ⅱ期临床研究表明,肿瘤进展时间较SHARP试验中更长[8,16]。因此,将阿帕替尼与TACE联合使用,从而进一步发挥抗癌作用,有望为中晚期肝癌患者提供更多选择。
本研究表明,中晚期肝癌患者采用TACE联合阿帕替尼与单纯TACE治疗比较,可有效延长患者无进展生存期,且中远期疾病ORR更高。近期疾病ORR无明显差异,分析原因:①可能是由于入组的病例数较少,尚不能显示统计学差异;②可能是TACE术后VEGF水平升高后再被阿帕替尼抑制,疗效需要更长时间的观察。另外,两种治疗方案均可有效降低AFP水平,控制肿瘤生长。
B组中1例患者出现严重腹泻停药超过1个月出组,停药及对症治疗后症状逐渐缓解。余患者不良反应均可耐受,且经对症治疗后均可缓解。两组患者栓塞后综合征不良反应发生率无明显差异。阿帕替尼相关不良反应较单纯TACE组明显,以高血压、手足综合征、蛋白尿多见。
综上所述,对于中晚期肝癌患者,TACE联合阿帕替尼治疗的中远期疗效较单纯TACE治疗更具优势,且显著延长患者疾病无进展生存期。多数不良反应较轻微,经对症处理后不会导致治疗中断,阿帕替尼联合使用的安全性得以证实,可考虑推广应用于临床。但其疗效仍有待于进一步的大样本随机对照多中心研究结果证实。
[1] Mittal S, El-Seraq HB. Epidemiology of hepatocellular carcinoma: Consider the population. J Clin Gastroenterol, 2013,47(Suppl):S2-S6.
[2] European Association For The Study Of The Liver, European Organisation For Research And Treatment Of Cancer. EASL-EORTC clinical practice guidelines: Management of hepatocellular carcinoma. J Hepatol, 2012,56(4):908-943.
[3] Peng S, Zhang Y, Peng H, et al. Intracellular autocrine VEGF signaling promotes EBDC cell proliferation, which can be inhibited by Apatinib. Cancer Lett, 2016,373(2):193-202.
[4] Mi YJ, Liang YJ, Huang HB, et al. Apatinib (YN968D1) reverses multidrug resistance by inhibiting the efflux function of multiple ATP-binding cassette transporters. Cancer Res, 2010,70(20):7981-7991.
[5] Tong XZ, Wang F, Liang S, et al. Apatinib (YN968D1) enhances the efficacy of conventional chemotherapeutical drugs in side population cells and ABCB1-overexpressing leukemia cells. Biochem Pharmacol, 2012,83(5):586-597.
[6] Wang B, Xu H, Gao ZQ, et al. Increased expression of vascular endothelial growth factor in hepatocellular carcinoma after transcatheter arterial chemoembolization. Acta Radiol, 2008,49(5):523-529.
[7] Hsieh MY, Lin ZY, Chuang WL. Serial serum VEGFR-A, angiopoietin-2, and endostatin measurements in cirrhotic patients with hepatocellular carcinoma treated by transcatheter arterial chemoembolization. Kaohsiung J Med Sci, 2011,27(8):314-322.
[8] Qing SK, Ouyang XN, Bai YX, et al. Multicenter phase Ⅱ study of apatinib, a novel inhibitor of VEGFR, in patients with advanced hepatocellular carcinoma. ASCO annual meeting 2014. [Abstract] ID:4019.
[9] Lencioni R, Llovet JR. Assessment for hepatocellular carcinoma. Semin Liver Dis, 2010,30(1):52-60.
[10] Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology, 2003,37(2):429-442.
[11] 吕嘉玲,杜端明,刘鹏程,等.TACE治疗原发性肝癌的远期疗效分析.中国介入影像与治疗学,2012,9(2):114-117.
[12] 陈杰,侯恩存.VEGF及其受体与肝细胞癌血管生成和抗血管治疗研究进展.现代肿瘤医学,2016,24(3):498-502.
[13] Sasaki A, Iwashita Y, Shibata K, et al. Preoperative transcatheter arterial chemoembolization reduces long-term survival rate after hepatic resection for resectable hepatocellular carcinoma. Eur J Surg Oncol, 2006,32(7):773-779.
[14] Kim YB, Berek JS, Martinez-Maza O, et al. Vascular endothelial growth factor expression is not regulated by estradiol or medroxyprogesterone acetate in endometrial carcinoma. Gynecol Oncol, 1996,61(1):97-100.
[15] Wilhelm SM, Carter C, Tang L, et al, BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved intumor progression and angiogenesis. Cancer Res, 2004,64(19):7099-7109.
[16] Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med, 2008,359(4):378-390.
[17] Chen KF, Chen HL, Tai WT, et al. Activation of phosphatidylinositol 3-Kinase/Akt signaling pathway mediates acquired resistance to sorafenib in hepatocellular carcinoma cells. J Pharmacol Exp Ther, 2011,337(1):155-161.
[18] Kudo M, Imanaka K, Chida N, et al. Phase Ⅲ study of sorafenib after transarterial chemoembolisation in Japanese and Korean patients with unresectable hepatocellular carcinoma. Eur J Cancer, 2011,47(14):2117-2127.
[19] 丁文金,李飞平,龚光文,等.TACE联合索拉菲尼与TACE治疗巴塞罗那B期肝癌的临床对比研究.肿瘤药学,2015,3(3):230-234.
[20] 张力,史美祺,黄诚,等.甲磺酸阿帕替尼治疗晚期非鳞非小细胞肺癌随机、双盲、安慰剂对照、多中心Ⅱ期临床研究.//第十五届全国临床肿瘤学大会暨2012年CSCO学术年会论文集.北京:中国抗癌协会,2013:24.
[21] 林岩.榄香烯注射液联合甲磺酸阿帕替尼抗肝癌的实验研究.南京:南京中医药大学,2014:49-53.
TACE combined with Apatinib in treatment of advanced hepatocellular carcinoma
JINXinli1,LUWei2*
(1.ThirdClinicalMedicalCollege,SouthernMedicalUniversity,Guangzhou510515,China;2.DepartmentofInterventionalMedicine,PLANavyGeneralHospitalofSouthernMedicalUniversity,Beijing100048,China)
Objective To evaluate the efficacy and safety of TACE combined with Apatinib versus TACE monotherapy in the treatment of advanced hepatocellular carcinoma (HCC). Methods A total of 44 patients with advanced HCC were enrolled and divided randomly into group A (n=22) and group B (n=22). The patients in group A were treated with TACE monotherapy while group B were treated with TACE combined with Apatinib. The serum alpha fetoprotein (AFP) levels were compared between the two groups three months after treatment. The objective response rate (ORR) after 3, 6, 9 and 12 months, the progression-free survival (PFS) and incidence of adverse reactions were also compared. Results The serum AFP levels decreased apparently in two groups three months after treatment, and statistic differences were observed in each group (Z=-2.289, -2.953, bothP<0.05), while no statistic differences was obtained between the two groups after treatment (Z=-0.126,P>0.05). No statistic differences were found in ORR between the two groups 3 and 6 months after treatment (bothP>0.05), while statistic differences were manifested after 9 and 12 months (bothP<0.05). The medium PFS in group A significantly lower than that in group B (2=6.576,P=0.01). The apatinib-related adverse reactions including hypertension, hand-foot syndrome and proteinuria in group B were higher than those in group A, and statistically significant difference were obtained (allP<0.05). The adverse reactions were relieved after symptomatic treatment. Conclusion TACE combined with apatinib may improve the mid-long term efficacy in patients with advanced HCC. And the relatively safety of TACE combined with apatinib is confirmed.
Carcinoama, hepatocellular; Apatinib; Chemoembolization, therapeutic; Efficacy; Adverse reactions
中国人民解放军海军总医院人才引进专项基金(RCYJZX-009)。
金鑫荔(1992—),女,江西吉安人,在读硕士。研究方向:介入医学。E-mail: 954524925@qq.com
卢伟,南方医科大学附属海军总医院介入医学科,100048。E-mail: luwei6702@126.com
2016-10-11
2017-01-14
R816; R735.7
A
1672-8475(2017)04-0200-05
10.13929/j.1672-8475.201610005
